
评价二乙基二硫代氨基甲酸钠(sodium diethyldithiocarbamate, DTC)、左旋咪唑(levamisole, LMS)、咪喹莫特(imiquimod, Imi)3个小分子化合物对铜绿假单胞菌疫苗候选抗原PA0833免疫原性和保护效果的影响,并进一步对其机制进行初步研究。
抗原PA0833分别与上述3种小分子以及铝佐剂配伍制备疫苗,通过肌肉注射的方式于0、14、21 d分别免疫BALB/c小鼠。收集3次免疫后血清,ELISA测定PA0833特异性IgG抗体水平。采用铜绿假单胞菌PAO1感染免疫后的小鼠,通过生存率、体重变化、临床评分、炎症因子检测和肺组织病理学改变等评价疫苗的保护效果。在此基础上,对小鼠连续7 d肌肉注射DTC,取肺脏组织进行转录组测序分析,并通过流式细胞术检测其对抗原提呈细胞活化的影响。
联用小分子免疫组能够有效提高PA0833特异性IgG抗体效价,降低细菌感染后肺组织中细菌负荷和TNF-α、IL-6、IL-1β炎症因子水平,显著提高细菌感染后的生存率,其中DTC效果最好。转录组测序结果表明,相比于PBS对照组,DTC处理组样本有121个基因表达上调、18个基因下调;差异表达基因主要富集在免疫信号通路,IL-17信号通路活化明显。流式细胞术结果表明DTC能促进脾细胞中Th17细胞分化,且能促进抗原提呈细胞活化。
本研究中的3种小分子都能够有效地增强抗原的免疫原性,其中DTC效果最优,可用于新型疫苗佐剂的研发。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
免疫原性是抗原的基本属性之一,获得具有良好免疫原性抗原是疫苗研发成功的关键。佐剂是一种非特异性免疫增强剂,用于添加到疫苗中以增强抗原的免疫原性,从而增强机体对抗原的免疫应答或者改变免疫应答的类型[1]。目前,已经批准临床使用的佐剂包括铝佐剂、MF59、AS03和AS04等。其中,铝佐剂已经有100余年的历史,是目前人用疫苗中使用的一种主要佐剂[2]。铝佐剂之所以得到广泛使用,是因为价格低廉、易于获得、广为人知并被监管机构普遍接受,它发挥佐剂活性的机制包括:与可溶性抗原结合成颗粒形式促进抗原提呈细胞吞噬;局部"储存库"效应促进抗原缓慢释放,延长免疫应答时间;活化抗原提呈细胞免疫应答信号通路等。但铝佐剂的局限性是只能诱导相对较强的体液免疫应答,不能支持强大的细胞免疫应答[3],对某些胞内病原体无法提供有效保护[4],因此目前有许多增强其佐剂性能的尝试。
研究发现很多小分子也具有免疫调节作用。二乙基二硫代氨基甲酸钠(sodium diethyldithiocarbamate, DTC)是一种具有类似胸腺活性的硫代衍生物,能够促进体液免疫应答并引起淋巴细胞增殖,但其机制尚不明确。在体外,DTC对肿瘤的发生和转移也具有抑制作用[5]。左旋咪唑(levamisole, LMS)是一种合成噻唑类化合物的衍生物,具有免疫调节特性[6],可以增强机体产生抗体的水平,促进免疫细胞的增殖和成熟,增强巨噬细胞功能,激活和提高补体活性等[7]。咪喹莫特(imiquimod, Imi)及其类似物是人工合成的小分子药物中唯一的干扰素诱导免疫调节剂,通过激活参与病原体识别的Toll样受体7(TLR7)来刺激固有免疫应答[8],并且可以增强B淋巴细胞的抗原特异性反应等。
佐剂可在调节疫苗诱导的免疫应答方面发挥关键作用[9]。然而,随着新型疫苗的发展,单一功能的佐剂对于难以清除的病原体非常低效,两种或两种以上不同成分佐剂之间产生的协同作用能够激活多种免疫应答,有可能发挥更强的免疫保护作用。那么,这些具有免疫调节作用的小分子是否可与氢氧化铝一起联用作为双模佐剂,提高抗原的免疫原性和保护效果呢?
PA0833是国家免疫生物制品工程技术研究中心前期通过反向疫苗学技术筛选出的铜绿假单胞菌疫苗候选抗原,它在小鼠中表现出很强的免疫原性,并且能够在急性肺部感染模型中保护小鼠免受铜绿假单胞菌攻击[10]。因此,PA0833可被视为一种新型铜绿假单胞菌候选疫苗。本研究拟采用该抗原作为模式抗原,在小鼠模型中评价上述3种小分子与氢氧化铝联用的佐剂活性,为新型双模佐剂的研发提供支撑。
6~8周龄雌性SPF级BALB/c小鼠,体重16~20 g,购于北京维通利华生物科技有限公司,所有小鼠均饲养在SPF级动物房。本研究动物实验经中国人民解放军陆军军医大学实验动物福利伦理委员会审批通过(编号:AMUWEC20230412),实验动物许可证号:SCXK(渝)2022-0018。铜绿假单胞菌菌株PAO1购自ATCC,-80℃冻存。工程菌pGEX-6p-1-PA0833/BL21(DE3)由国家免疫生物制品工程技术研究中心前期构建并冻存。
DTC(麦克林,中国);LMS(Dr. Ehrenstorfer,德国);Imi(索莱宝,中国);氢氧化铝佐剂(InvivoGen,美国);生理盐水(Bio sharp,中国);GST 4B亲和填料(博格隆,中国);PreScissionProtease酶;山羊抗小鼠IgG Fc HRP、TMB显色液、佛波酯、离子霉素、蛋白质转运抑制剂(碧云天,中国);抗鼠live/dead-AF700、抗鼠CD3-FITC抗鼠CD4-Pacific Blue抗鼠IL17A-PE抗鼠CD11c-FITC抗鼠CD80-BV421抗鼠CD40-APC抗鼠CD86-PerCP(BioLegend,美国);高速离心机(卢湘仪,中国);高速低温离心机(Beckman,美国);96孔微孔板洗板机和多功能酶标仪(Bio Tek,美国);光学显微镜(永科光学,中国)。
吸取100 μl PA0833菌液至10 ml氨苄西林(100 μg/ml)抗性液体LB中,37℃、150 r/min摇床中培养过夜;将10 ml菌液加入2 L氨苄西林(150 μg/ml)抗性液体LB培养基中,37℃、220 r/min培养4 h。加入IPTG至终浓度为0.2 mmol/L,16℃、150 r/min过夜培养。4℃、4 000×g离心20 min后收集菌体,重悬后超声破碎。4℃、21 000×g离心20 min,取上清液与谷胱甘肽-琼脂糖凝胶4℃结合3 h,清洗未结合的蛋白质3次,加入适量PreScission蛋白酶4℃酶切过夜,收集目的蛋白并通过12% SDS-PAGE分析蛋白质制备结果。
实验小鼠随机分为6组,每组10只,分组如下:PA0833组、PA0833+氢氧化铝组、DTC+PA0833+氢氧化铝组、LMS+PA0833+氢氧化铝组、Imi+PA0833+氢氧化铝组、组氨酸缓冲液组。疫苗样品制备:每剂含30 μg PA0833、30 μg氢氧化铝、小分子佐剂10 μg(统一用剂量)。以等体积组氨酸缓冲液作为阴性对照。各组小鼠分别在0、14、21 d肌肉免疫3次。于13、20、27 d取小鼠尾静脉血,常温下1 500×g离心10 min,收集血清保存在-80℃冰箱中待用。
小鼠尾静脉取血分离血清,ELISA测定免疫小鼠血清中抗PA0833 IgG滴度。酶标板每孔加入0.5 μg的抗原PA0833,4℃过夜。PBST洗涤3次。每孔加入200 μl 2% BSA封闭液,于37℃封闭2 h,PBST洗涤3次。将待检血清从1∶1 000开始用抗体稀释液梯度稀释后以100 μl/孔加入酶标板中,37℃孵育1 h。PBST洗涤3次,将HRP标记的山羊抗鼠IgG(1∶5 000)稀释后以100 μl/孔加入酶标板中,37℃孵育1 h。PBST洗涤3次,控干后每孔加入100 μl TMB底物显色液,避光孵育15 min后每孔加入100 μl终止液终止反应。在450 nm处读取吸光度值,以待测样品孔A450/阴性对照孔A450≥2.1的最高稀释倍数为待测血清的阳性结果标准。
通过12% SDS-PAGE进行蛋白质电泳,按滤纸-凝胶-PVDF膜-滤纸的顺序进行转膜,转膜结束后于5%脱脂奶粉中持续摇匀并常温封闭1 h。TBST清洗3次,将PA0833+氢氧化铝组3次免疫后血清以1∶1 000稀释于抗体稀释液中,加入PVDF膜,4℃孵育过夜,次日TBST清洗3次。将山羊抗小鼠IgG 1∶1 000稀释于含3% BSA,0.05%吐温-20的PBST中,常温孵育1 h。TBST清洗3次并吸去多余液体后加入1∶1配制的Super ECL Detection Reagent ECL化学发光超敏显色液,于显色仪上自动曝光。
小鼠末次免疫后7 d,采取腹腔注射1%异戊巴比妥麻醉,用铜绿假单胞菌PAO1菌株(1.1×107 CFU/只)进行气管插管感染。连续7 d观察并记录生存情况、体重变化及临床评分。
采用亚致死剂量(3.0×106 CFU/只)的PAO1菌株感染免疫后的小鼠。感染48 h后,通过吸入二氧化碳的方式处死小鼠。取小鼠肺组织,将其加入到含1 ml无菌PBS的研磨管中,于冰上研磨充分。将匀浆连续梯度稀释,吸取5 μl均匀涂布于固体LB培养基上,37℃倒置培养过夜。16~17 h后对培养基上细菌单克隆计数。取肺脏匀浆,4℃、2 000×g离心10 min。取上清,ELISA检测TNF-α、IL-1β、IL-6水平。
肺组织HE染色切片制作:将小鼠肺置于4%多聚甲醛溶液中,室温固定24 h,交由重庆闻达生物科技有限公司制作HE染色切片,于光学显微镜下观察病理变化。
为了探究DTC增强免疫应答的具体机制,以BALB/c小鼠为对象,分为1个对照组和1个实验组,每组3只,连续7 d肌肉注射DTC(10 μg)或PBS,取小鼠肺组织,液氮中冻存,利用mRNA-Seq技术对小鼠肺脏进行转录组测序与分析。以对照组基因组为参考,筛选出差异表达基因并进行GO功能富集分析和KEGG信号通路分析以探究DTC发挥效应的机制。
Th17细胞应答:肌肉注射DTC(10 μg)48 h后,取小鼠脾细胞,经红细胞裂解液处理后,在完全RPMI 1640培养基中加入100 μg/ml佛波酯和1 μg/ml离子霉素刺激4.5 h,蛋白质转运抑制剂阻断细胞约1 h后,用染色缓冲液(含2%胎牛血清的PBS)洗涤细胞。对样本进行表面分子(CD3、CD4)标记染色30 min,避光固定破膜通透30 min,再进行细胞内因子染色(IL-17A)。洗涤细胞后PBS重悬,BD流式细胞仪检测样本,用FlowJo对检测结果进行分析。
肌肉注射DTC(10 μg)48 h后,取小鼠脾细胞,红细胞裂解液处理后,用染色缓冲液(含2%胎牛血清的PBS)洗涤细胞。对样本进行表面分子(live/dead、CD11c、CD80、CD40、CD86)标记染色30 min,洗涤细胞后PBS重悬,BD流式细胞仪检测样本,用FlowJo对检测结果进行分析。
采用Graph Pad Prism 9.5软件分析数据,连续变量以 ±s表示,组间差异采用Student′s t检验,多组独立样本间比较使用单因素方差分析,P<0.05为差异有统计学意义。
±s表示,组间差异采用Student′s t检验,多组独立样本间比较使用单因素方差分析,P<0.05为差异有统计学意义。
PA0833在大肠埃希菌中以可溶的形式高效表达。通过纯化可得到高纯度的抗原PA0833,PA0833抗原理论相对分子质量(Mr)为17×103,SDS-PAGE和考马斯亮蓝染色结果显示电泳条带位置与理论值相符且纯度较高(图1A),Western blot结果显示PA0833免疫小鼠血清与PA0833在Mr为17×103处存在特异性结合(图1B),证实此蛋白质为PA0833。采用纯化的抗原分别加入氢氧化铝和3种小分子佐剂联合制备疫苗,免疫小鼠后采集血清并对其中的PA0833特异性IgG抗体进行检测。结果显示:第1次免疫后各实验组IgG水平差异无统计学意义(图1C);第2次加强免疫后,与组氨酸缓冲液组相比,单独抗原PA0833组抗体上升不明显,PA0833+氢氧化铝组抗体滴度明显上升,LMS+PA0833+氢氧化铝组抗体滴度低于PA0833+氢氧化铝组(P<0.01),DTC+PA0833+氢氧化铝组的抗体滴度高于PA0833+氢氧化铝组(P<0.05),而Imi+PA0833+氢氧化铝组的抗体滴度与PA0833+氢氧化铝组差异无统计学意义(图1D);第3次免疫后DTC+PA0833+氢氧化铝组与PA0833组、PA0833+氢氧化铝组之间的差异有统计学意义(P<0.001和P<0.05),DTC+PA0833+氢氧化铝组与LMS+PA0833+氢氧化铝组、Imi+PA0833+氢氧化铝组比较差异也有统计学意义(P均<0.05),而PA0833+氢氧化铝与LMS+PA0833+氢氧化铝组、Imi+PA0833+氢氧化铝组比较差异均无统计学意义(图1E)。结果提示DTC能够有效提高PA0833免疫小鼠后的体液免疫应答。
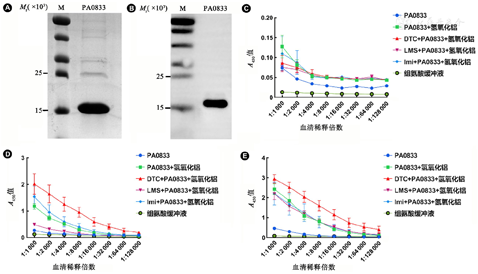

注:A和B:PA0833的SDS-PAGE分析和Western blot验证,M:蛋白质marker;C~E:第1、2、3次免疫后血清抗PA0833 IgG效价测定。DTC:二乙基二硫代氨基甲酸钠;LMS:左旋咪唑;Imi:咪喹莫特
为了评价不同小分子对PA0833所诱导的免疫保护效果差异,本研究使用铜绿假单胞菌标准株PAO1建立小鼠急性感染肺炎模型,免疫后的BALB/c小鼠用致死剂量的PAO1菌株感染,记录7 d内生存率、体重及临床评分的变化。感染后2 d小鼠开始死亡,观察期结束时组氨酸缓冲液组小鼠全部死亡,PA0833+氢氧化铝组(40%)和PA0833组(30%)有一定保护效果但与组氨酸缓冲液组比较差异无统计学意义(P均>0.05);DTC+PA0833+氢氧化铝组、LMS+PA0833+氢氧化铝组和Imi+PA0833+氢氧化铝组的生存率分别为100%、90%和80%,显著高于组氨酸缓冲液组(P<0.000 1或P<0.001);DTC+PA0833+氢氧化铝组、LMS+PA0833+氢氧化铝组的生存率也显著高于PA0833+氢氧化铝组(P<0.01和P<0.05),但Imi+PA0833+氢氧化铝组的生存率与PA0833+氢氧化铝组比较差异无统计学意义(图2A,P>0.05)。上述结果提示小分子组免疫小鼠能够进一步提高PA0833抗原抵抗铜绿假单胞菌感染能力。体重变化及小鼠临床状态评分中也可看出,添加小分子化合物佐剂组DTC+PA0833+氢氧化铝组、LMS+PA0833+氢氧化铝组和Imi+PA0833+氢氧化铝组小鼠在感染初期体重下降,临床评分降低,但从感染后4 d,小鼠状态开始逐步恢复正常,说明小分子能够有效提高抗原的保护效果(图2B和图2C)。从抗体及生存率中可以看出,3个小分子佐剂中以DTC的效果最为显著,后续实验将优势佐剂DTC作为主要研究方向。
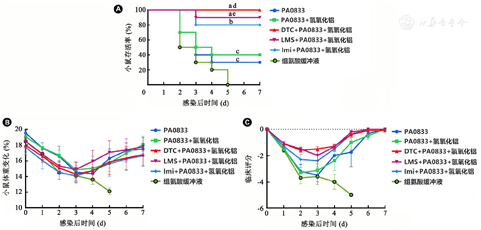

注:A~C:各免疫组小鼠感染PAO1后生存率、体重变化及临床状态观察。DTC:二乙基二硫代氨基甲酸钠;LMS:左旋咪唑;Imi:咪喹莫特。与组氨酸缓冲液组比较,aP<0.000 1, bP<0.001, cP>0.05;与PA0833+氢氧化铝组比较,dP<0.01, eP<0.05
为研究不同免疫组保护效果差异的原因,本研究首先通过菌落计数检测各免疫组感染PAO1后小鼠的肺部细菌负荷量。与组氨酸缓冲液组比较,DTC+PA0833+氢氧化铝免疫组细菌负荷量显著下降(P<0.000 1),并且显著低于PA0833+氢氧化铝组(P<0.01,图3A),说明DTC能够显著降低铜绿假单胞菌肺部感染时的细菌负载量。
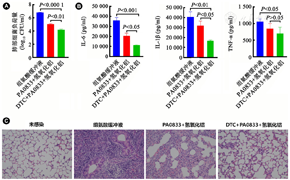

注:A~C:各免疫组小鼠感染PAO1后肺组织中细菌负荷量、炎性因子水平及肺组织病理检测(HE染色,×200)。DTC:二乙基二硫代氨基甲酸钠
同时,通过ELISA检测小鼠肺组织中的炎性因子IL-6、TNF-α、IL-1β水平。结果表明DTC+PA0833+氢氧化铝免疫组3种炎性因子的水平均显著低于组氨酸缓冲液组(P<0.001、P<0.01、P<0.05),IL-6和IL-1β水平显著低于PA0833+氢氧化铝组(P均<0.05,图3B)。以上结果说明添加DTC后更能够有效地降低细菌感染后肺部的炎症水平。
此外,通过HE染色检测肺组织病理损伤的情况。未感染细菌的正常对照组肺泡结构清晰,肺泡壁薄,无炎性细胞浸润;组氨酸缓冲液组的肺泡壁增粗,炎性细胞浸润严重,实质化严重,并伴有明显出血;PA0833+氢氧化铝组较组氨酸缓冲液组有一定程度的减轻;DTC+PA0833+氢氧化铝组肺部组织结构更为完整,肺泡组织接近正常,少肺泡壁增厚的变化(图3C)。该结果进一步证实抗原添加DTC后能更有效地减少铜绿假单胞菌造成的肺损伤。
mRNA-seq结果表明,DTC组与PBS组相比,二者共诱导了16 909个差异表达基因,其中包含121个上调基因和18个下调基因(图4A)。KEGG信号通路富集分析显示,许多上调的差异表达基因富集在几个炎症反应的信号通路中,尤其在cAMP(P<0.01)和IL-17(P<0.01)信号通路方面显著富集(图4B)。提示IL-17信号通路可能是DTC在疫苗中增强保护作用的关键。
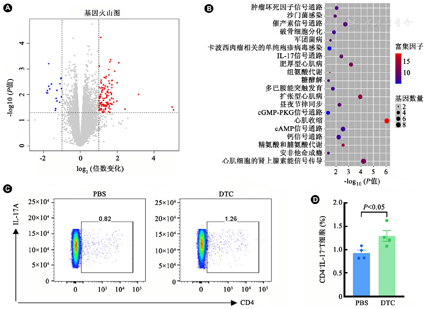

注:A:差异表达基因火山图,灰色点代表未发生差异表达的基因,蓝色点代表差异下调的基因,红色点代表差异上调的基因;B:差异表达基因的KEGG信号通路富集分析,以P<0.05作为筛选标准;C:末次免疫后48 h,流式细胞术检测小鼠脾脏CD4+IL17+T细胞中IL-17表达水平;D:不同组小鼠脾细胞CD4+IL-17+T细胞比例统计直方图(n=3)。DTC:二乙基二硫代氨基甲酸钠
为了验证转录组测序的结果,小鼠经DTC肌肉注射后,流式细胞术检测小鼠脾脏细胞的Th17应答水平。结果表明DTC组CD3+CD4+IL-17A+T细胞比例显著高于PBS对照组(P<0.05,图4C和图4D),提示DTC能促进Th17细胞分化,与转录组测序结果相符。
DCs是识别和提呈抗原的关键,为了验证DTC是否能够促进DCs分化成熟,采用DTC处理小鼠脾细胞,检测共刺激因子CD40、CD80和CD86的表达情况。结果表明:DTC处理后,小鼠脾细胞CD40、CD86的表达量显著上升(P<0.01和P<0.05,图5),提示DTC具有促进DCs成熟的作用。
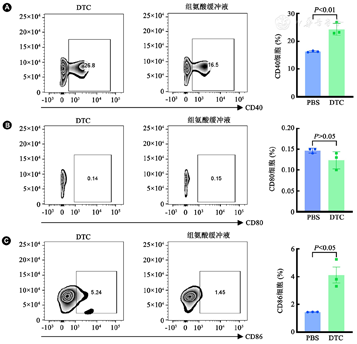

注:A~C:二乙基二硫代氨基甲酸钠(DTC)诱导后,小鼠脾细胞共刺激分子CD40、CD80和CD86的表达情况
佐剂可以增强抗原的免疫原性和保护效果,并通过多种机制的组合发挥作用,包括招募免疫细胞,增强抗原的摄取和提呈,诱导细胞因子和趋化因子的产生,以及促进抗原和抗原提呈细胞运输到引流淋巴结[11]。本研究以PA0833作为抗原,比较了DTC、LMS和Imi小分子对氢氧化铝佐剂效应的影响。PA0833抗原被认为是一种潜在的候选疫苗,用于制备疫苗预防铜绿假单胞菌感染。前期研究结果证实,作为一种OmpA家族蛋白,PA0833能够诱导强烈的免疫应答,降低铜绿假单胞菌感染后的细菌负荷、炎性细胞因子表达和炎性细胞浸润,减轻病理变化[10]。我们推测PA0833可能与宿主细胞上的受体(如肺泡上皮细胞和巨噬细胞)相互作用,以激活实质性的信号通路发挥其生物学效应,但具体免疫机制仍不明确。另外,PA0833单独抗原的免疫效果需要继续提高。本实验结果表明,上述3种小分子佐剂均能够增强抗原的免疫原性,有效减降低死亡率,增强PA0833抗原的保护效果,其中以DTC最具有优势,提示其具有一定的佐剂效应。
有研究表明,LMS能够降低人T细胞的活化和增殖,经过LMS治疗后,T细胞活化相关的细胞因子如IL-2、TNF-α和IFN-γ减少而IL-4和IL-23增加,促进Th2向Th1细胞转变[12]。Imi能够诱导产生多种细胞因子,如IFN-α、IFN-γ、TNF-α、IL-1、IL-6和IL-8,它通过与TLR7结合和激活NF-κB来激活固有和适应性免疫应答,从而释放细胞因子,并将浆细胞前体细胞招募到用药部位,随后引起Th1细胞应答[13]。目前,有关DTC的免疫调控研究较少,本研究通过流式细胞术检测发现小鼠注射DTC后脾细胞内Th17细胞水平增加。Th17细胞可以增强抗菌黏膜防御,并可能介导疫苗诱导的保护性反应[14]。有大量的研究表明,感染和炎症性疾病会引起肺组织中Th17细胞的募集[15]。IL-17是宿主防御病原体感染的关键因子[16],Th17细胞来源的IL-17在小鼠肺部铜绿假单胞菌急性感染中发挥关键保护作用[17]。这些结果提示DTC可能通过促进Th17细胞分化来发挥保护作用。
DCs作为免疫系统的抗原提呈细胞[18],由多个表型和功能异质的亚群组成,不同DCs亚群能够调控不同的CD4+T辅助(Th)细胞分化[19]。本研究发现DTC能够促进DCs的成熟和活化,进而促进Th17细胞的分化,这些调控作用可能是DTC有效增强氢氧化铝佐剂效应的关键。后续我们将通过细胞和动物实验从体内外多个层面对DTC发挥免疫调控作用的机制进行深入研究,为基于DTC的佐剂研发提供参考。
孙恬峻,张晓丽,夏真萍,等.小分子化合物与铝佐剂联用对铜绿假单胞菌疫苗候选抗原PA0833保护效果的影响及机制初步研究[J].中华微生物学和免疫学杂志,2024, 44(3): 189-197. DOI: 10.3760/cma.j.cn112309-20231129-00157.
所有作者声明无利益冲突



























