
阵发性睡眠性血红蛋白尿症(paroxysmal nocturnal hemoglobinuria,PNH)是一种罕见的造血干细胞异常克隆性疾病,以血管内溶血性贫血、血栓形成和外周血细胞减少为主要表现,呈慢性进展性病程,严重者可危及生命。补体抑制剂是治疗PNH溶血相关症状的一线推荐药物。随着补体抑制剂领域的快速发展,加强对PNH的筛查、快速诊断,判断需要用补体抑制剂治疗的患者,在补体抑制剂治疗过程中监测突破性溶血、血管外溶血等,对患者的生存、生活质量改善有着重要意义。为促进PNH临床诊疗的规范,本共识参考国内外最新指南和文献,荟萃国内外最新研究成果,并结合专家团队经验,聚焦PNH筛查原则、PNH克隆检测意义、末端C5补体抑制剂治疗后监测等问题,旨在为PNH的筛查、诊断和补体抑制剂时代的治疗监测提供参考意见。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
阵发性睡眠性血红蛋白尿症(PNH)是一种获得性、发生于多能造血干细胞层面的糖化磷脂酰肌醇A类(PIGA)基因体细胞突变引起的罕见疾病。PIGA编码糖基磷脂酰肌醇(GPI)生物合成第一步所需的酶,PIGA突变导致患者造血干细胞及向下分化的血细胞表面缺乏GPI锚定蛋白,其中,两种必需的补体调节蛋白CD55和CD59的缺乏使PNH红细胞易发生补体介导的溶血[1]。PNH主要表现为反复发作的血管内溶血(IVH)、血栓形成倾向和不同程度的骨髓衰竭,国际PNH工作组(I-PIG)将PNH分为三类[1,2]:①经典型PNH:有典型的溶血和血栓形成表现;②合并其他骨髓衰竭性疾病(BMF)的PNH:如再生障碍性贫血(AA)或骨髓增生异常肿瘤(MDS);③亚临床型PNH:患者有少量PNH克隆,但没有溶血和血栓的临床和实验室证据。
PNH虽然是一种良性疾病,但在传统的治疗手段下,患者10年总生存(OS)率仅70.7%~77.6%,生存率及生活质量亟待提高。PNH患者因慢性溶血可引起疲劳、血栓、肾功能不全、疼痛、意识障碍、呼吸困难等多种临床表现,首诊科室往往并非血液科,易被误诊、漏诊,导致随病程推移出现器官功能障碍[3,4]。此外,在BMF中,如何理解PNH克隆存在的意义、如何进行合理监测和随访也需规范。
靶向末端补体C5的抑制剂依库珠单抗,是首个被美国食品药物管理局(FDA)和欧洲药品管理局批准用于治疗溶血性PNH的补体抑制剂,目前已成为溶血性PNH的首选治疗药物[3],2022年底在中国获批上市。尽管以依库珠单抗为代表的第一代补体抑制剂取得了很好的疗效,但如何及时判断补体抑制剂效果不佳的可能原因,监测突破性溶血(BTH)和血管外溶血(EVH)[5,6,7]等尚无相关的共识或指南。中华医学会血液学分会红细胞疾病(贫血)学组组织相关专家,结合PNH筛查、诊断、随访和补体抑制剂使用管理的最新文献,形成本共识,为临床提供参考。
PNH误诊率极高,首次诊断即确诊的患者仅7%,起病一年内确诊者仅35.5%[4]。确诊AA、MDS和不明原因贫血的患者,如进行PNH筛查,均有一定比例确诊为PNH[8,9,10,11]。对于出现血小板减少、不明原因腹痛(平滑肌张力障碍)、IVH或血栓形成的患者也应怀疑PNH,应及早进行外周血PNH克隆流式检测筛查,以免延误治疗。此外,PNH患者出现血液科以外的其他相关症状,首诊于其他科室,可能造成诊断延迟[9,10,11,12],消化内科、神经内科、皮肤科、心内科、呼吸科、急诊科、血管外科、基本外科等,都可能成为患者的首诊科室,应加强多学科协作,提升相关科室对该病的认识(表1)。

应进行阵发性睡眠性血红蛋白尿症( PNH)筛查的适宜人群
应进行阵发性睡眠性血红蛋白尿症( PNH)筛查的适宜人群
| 临床特征 | 适宜人群及建议 |
|---|---|
| 血细胞减少症 | 原因不明的血细胞减少症,尤其是全血细胞减少、考虑进行骨髓检查的患者 |
| 骨髓衰竭性疾病 | 怀疑AA/h-MDS或伴有溶血证据的患者,建议在诊断时进行PNH筛查,并至少每6个月筛查1次 |
| 血栓形成 | 不明原因血栓形成,伴有/不伴有未知原因的溶血患者;腹腔内/颅内/真皮层等特殊部位的动静脉血栓形成的患者;伴有全血细胞减少的易栓症患者;抗凝效果不佳的年轻患者 |
| 不明原因的溶血性贫血 | Coombs阴性溶血性贫血的患者;血红蛋白尿/尿含铁血黄素阳性的患者;伴肾功能不全的溶血性贫血的患者 |
| 缺铁性贫血 | 补铁治疗效果不佳,LDH水平升高,间接胆红素升高或血红蛋白尿的患者 |
注 AA:再生障碍性贫血;h-MDS:低增生骨髓增生异常肿瘤
在大多数健康个体中可以检测到0.001%~0.005%的微小PNH克隆,约1%健康个体中可能出现0.02%~0.03%的稍大PNH克隆,然而,在没有免疫攻击的背景下,PNH细胞一般不会发生扩增。在免疫介导的骨髓衰竭,如AA、低增生MDS(h-MDS)患者中,PNH克隆常常存在。
具有全血细胞减少、骨髓增生低下等BMF表现特征的疾病可由不同的病因引起,AA的诊断需要排除其他类似表现的疾病,对儿童和年轻患者特别要排除遗传性BMF(IBMF)。由于PNH细胞的克隆扩增与免疫机制介导的骨髓衰竭关系密切,PNH克隆的检出可为AA患者的免疫介导机制提供重要的诊断线索[9]。
既往研究指出,在BMF中检出PNH克隆对诊断免疫介导的AA更有帮助,也有助于排除如范可尼贫血、先天性角化不良等IBMF,因为PNH克隆极少在IBMF中出现[2]。无论克隆大小,PNH粒细胞克隆的出现,对免疫介导的AA阳性预测值约为100%;而在130多例IBMF患者中,却没有发现PNH克隆或PIGA突变。免疫介导的AA与IBMF相比,发现PNH克隆的概率高25倍。因此,PNH克隆的出现,为诊断免疫介导AA提供了特异性的额外支持。值得注意的是,PNH阴性并不能排除免疫介导的AA诊断,不应通过未检出PNH克隆来排除AA。
PNH克隆的出现,还与BMF的预后相关。在大多数关于AA预后的研究中,PNH克隆(无论克隆大小)与免疫抑制治疗反应的改善和总体预后的改善相关。存在PNH克隆患者免疫抑制反应疗效好的原因尚不完全清楚,但部分原因可能是PNH克隆的存在,使免疫介导的AA诊断更准确,从而可能对免疫抑制剂疗效更佳[13]。PNH克隆还与AA患者较低的MDS进展率相关。PNH克隆也可出现在h-MDS患者中,但较AA罕见,同样提示可能是免疫介导机制和对免疫抑制剂疗效较好。PNH克隆在其他恶性程度更高的髓系肿瘤(如骨髓增殖性肿瘤、急性髓系白血病等)中极为罕见。
在PNH患者中,PNH克隆的大小与临床表现也有一定关联。通过流式细胞术检测,发现在PNH患者中,PNH克隆呈现"双峰"分布,即有较小PNH克隆和较高PNH克隆的患者较多,而存在中等大小PNH克隆的患者较少。较小PNH克隆,往往在亚临床型或以骨髓衰竭为主要表现的患者中出现。而那些以经典PNH表现为主者,PNH克隆往往较大,平均大小超过70%[9]。值得注意的是,由于不同的PNH亚型之间可以相互转换,造成临床特征不典型[14,15,16]。临床上,不能简单将PNH克隆大小直接对应临床表现。
PNH患者启动补体抑制剂治疗取决于多个因素,包括PNH克隆大小、溶血症状和疾病负担。以骨髓衰竭为主要临床表现的患者平均PNH克隆较小,较少出现PNH相关典型症状,很少能从补体抑制剂治疗中获益。因此,在有骨髓衰竭表现的PNH患者中,启动补体抑制剂治疗时,应仔细评估患者贫血的病因,包括了解网织红细胞、白细胞及血小板计数[2]。
经典型PNH往往有较大的PNH克隆(通常>50%),常呈现较高的疾病负担表现,如腹痛、疲劳、呼吸困难、食管痉挛、勃起功能障碍、神经功能障碍、肾功能不全、胆石症及各种血栓栓塞表现,包括不寻常部位血栓[3,4]。PNH患者血栓形成的危险因素包括粒细胞PNH克隆大小超过50%,LDH≥1.5倍正常上限(ULN),PNH症状负担重以及既往的血栓事件等。红细胞PNH克隆和粒细胞PNH克隆超过一定数值,可在一定程度上预测LDH升高;此外,粒细胞PNH克隆大小每增加10%,血栓形成约增加1.6%。尽管如此,PNH克隆大小、溶血和血栓风险之间的关系并不完全是线性的[16]。
PNH克隆也可能在AA或h-MDS病程的后期出现,定期通过流式细胞术监测PNH克隆,有助于早期发现PNH克隆演变;同时,在病程后期发现的PNH克隆,将支持在诊断时不易明确的BMF患者中的免疫介导因素。对BMF患者出现血栓形成或溶血等临床表现者,如果初始检测未显示PNH克隆,后续也应进行随访检测。诊断时已发现小克隆的AA或MDS患者,连续监测也很重要,因为患者可能从伴有小PNH克隆的AA或MDS,进展为溶血性PNH,及时发现,可以迅速加用针对性治疗[14]。
即使是诊断为PNH的患者,也需要对PNH克隆进行定期监测。其中一些患者的PNH克隆在病程中继续扩增,少数患者的PNH克隆可能随时间的推移而变小。极少数患者PNH克隆甚至消失。因此,建议对所有PNH患者的克隆进行定期监测,若病情稳定,可每年监测1次;出现任何临床或血液学参数变化时应缩短监测间隔。亚临床的PNH应每6~12个月进行PNH克隆监测[17,20]。
所有的补体抑制剂都需要长期甚至终身使用,其监测过程漫长而复杂。依库珠单抗是第一代末端补体C5抑制剂,2007年上市,是目前应用最为广泛、随访时间最长的补体抑制剂,欧美国家的临床应用经验丰富。C5补体抑制剂使用后,除监测临床表现的变化外,还需监测实验室指标、PNH克隆变化、补体活性等[21]。
血清LDH水平降低通常与IVH减少相关,但与PNH无关的其他因素如感染、细胞坏死、心力衰竭等也会影响LDH水平的变化。在开始依库珠单抗治疗时,需监测LDH,LDH下降提示补体的末端活性被抑制。补体抑制剂使用后LDH明显下降,但后期发现LDH再次明显上升,且能除外其他因素,需考虑BTH的可能[3,21]。少数情况下,补体抑制剂治疗前LDH并没有升高(如没有溶血时的血栓形成),可通过50%溶血补体检测(CH50)评估疗效。
网织红细胞是成熟红细胞的前体,在溶血加重时也会代偿性增加。应监测补体抑制剂治疗期间PNH患者绝对网织红细胞计数的变化,这有助于评估治疗反应和监测溶血事件的恢复情况[5,6]。
另外,在C5补体抑制剂使用前,患者由于长期的IVH,常合并铁缺乏或缺铁性贫血,在长期使用依库珠单抗后,EVH得到控制,可能出现铁过载,需要监测血清铁蛋白,必要时启动去铁治疗[21,22]。
C5补体抑制剂使用后,通过流式细胞术定期监测PNH克隆大小非常重要,建议在前2年至少每6个月检测PNH克隆;此后疾病稳定且接受稳定治疗时,可延长到每年1次[17]。
一般情况下,使用C5补体抑制剂后,由于受到保护,PNH患者的红细胞PNH克隆增加。粒细胞和单核细胞的PNH克隆在治疗前往往较高,治疗后也会缓慢增加[14]。但在长期随访中,有些患者长期使用依库珠单抗后出现克隆自发减少,尽管如此,很少患者能够停止治疗,除非持续监测显示患者克隆明显减少,且没有明显的溶血证据(目标通常是至少2次连续的流式评估,确认PNH粒细胞和单核细胞的比例<10%)[21]。在此种情况下,停药后仍需动态监测PNH克隆,若出现PNH克隆细胞比例增加,可能需要重新开始治疗。在极少数情况下,PNH克隆变化可能预示着病态造血或白血病转化,此时需要通过全面的骨髓检查来进行评估。
血浆中的游离C5也可用作末端补体活性的生物标志物,其水平预计会因末端补体抑制而降低。游离C5水平可以帮助确定个体BTH事件是否与不完全的补体抑制相关。长期使用C5抑制剂,还可能出现EVH,EVH仅在使用C5抑制剂后出现。通过流式细胞仪测量细胞表面C3沉积,可帮助判断。PNH红细胞膜上的C3片段沉积,是C5抑制后反映上游补体活性的重要标志物,可作为EVH的检测指标。同时,使用Coombs试验评估红细胞上的C3沉积也可以作为一种替代方法[23,24,25,26]。
应用依库珠单抗治疗6周后,如果LDH依然无明显改变,需检测C5补体多态性。值得注意的是,只有出现C5多态性时,才是真正意义上对依库珠单抗的"无反应"或"反应不佳"[7]。而在实际工作中,许多有残存贫血者被定义为"无反应者"或"反应不佳者",这是误解。另外,20%的患者在使用依库珠单抗时需要调整剂量。
6周的常规治疗后,如果LDH<1.5 ULN,说明IVH得到控制,可按原剂量继续治疗。如果LDH≥1.5 ULN,但CH50显示补体被完全阻断,也可以继续治疗。此时,需要除外其他原因导致的LDH升高,尤其是LDH从非红细胞的其他组织(如肝、骨骼和心肌等)释放的原因,可以检测LDH同工酶加以鉴别。如果LDH≥1.5 ULN,且CH50显示补体没有被阻断,则考虑补体抑制剂剂量不足,可以提高剂量或转换为其他补体抑制剂。近年来,新型补体抑制剂不断获批上市,尤其是近年来开展临床试验的近端补体抑制剂,有望解决依库珠单抗疗效不佳的问题[23,24,25,26,27,28]。
主要表现为IVH和经典PNH症状的再次出现[24]。BTH是补体抑制剂效果不佳或失去疗效的表现,对有良好治疗反应(LDH<1.5 ULN、补体活性被完全抑制)者,有时可观察到间断的突破性IVH(血红蛋白下降、LDH升高、PNH症状再次发作),应考虑是否存在一些因素(如感染、药物等)激活或放大了补体的活性。此时不建议终止补体抑制剂治疗,因为一旦停药,会出现一系列溶血相关的并发症。BTH的病因具体鉴别方式见表2。可以通过控制诱发因素、继续补体抑制剂但增加剂量来改善,并密切监测患者的情况[27,28,29,30]。此外,出现BTH,如当前使用C5抑制剂,可以转化为近端补体抑制剂。或在提高C5抑制剂剂量仍无效时,转为近端补体抑制剂[28]。
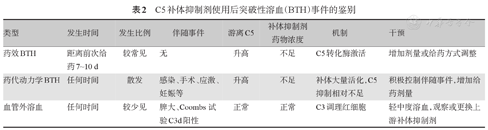
C5补体抑制剂使用后突破性溶血(BTH)事件的鉴别
C5补体抑制剂使用后突破性溶血(BTH)事件的鉴别
| 类型 | 发生时间 | 发生比例 | 伴随事件 | 游离C5 | 补体抑制剂药物浓度 | 机制 | 干预 |
|---|---|---|---|---|---|---|---|
| 药效BTH | 距离前次给药7~10 d | 较常见 | 无 | 升高 | 不足 | C5转化酶激活 | 增加剂量或给药方式调整 |
| 药代动力学BTH | 任何时间 | 散发 | 感染、手术、应激、妊娠等 | 升高 | 不足 | 补体大量活化,C5抑制相对不足 | 积极控制伴随事件,增加给药剂量 |
| 血管外溶血 | 任何时间 | 较少见 | 脾大、Coombs试验C3d阳性 | 正常 | 正常 | C3调理红细胞 | 轻中度溶血,观察或更换上游补体抑制剂 |
未经治疗的PNH主要以IVH为特征,所有PNH患者都有不同程度的IVH。EVH通常发生在接受C5抑制剂治疗的患者中。患者接受C5抑制剂治疗后,红细胞不再被补体攻击,C3片段沉积在细胞膜上,从而导致红细胞在脾脏被破坏,发生EVH。使用C5抑制剂后,IVH被控制,但仍然发生持续贫血、黄疸加重、网织红细胞计数明显升高、脾大等表现的患者,应警惕EVH,可以检测C3沉积、抗人球蛋白试验、免疫指标等。部分C5抑制剂治疗的患者会出现直接抗球蛋白试验(抗C3d)阳性,可使用糖皮质激素、免疫抑制剂等,脾切除术在部分患者有效。目前,已经获批或正在开展临床试验的近端补体抑制剂,不仅能避免EVH的出现,还能对C5抑制剂使用后出现的EVH实现良好的控制[21,28,29,30]。
在C5补体抑制剂使用期间,部分患者血红蛋白并不能恢复正常。贫血的原因,除了IVH控制不满意、EVH以外,还有多种因素,应进行鉴别[29]。如在使用补体抑制剂时,网织红细胞计数较低或正常,考虑合并骨髓衰竭,则应在使用补体抑制剂同时,对伴随的骨髓衰竭进行诊断和治疗。叶酸缺乏症,是导致持续贫血的另一个常见原因,可通过补充叶酸来纠正。对伴有肾功能不全、与贫血程度不匹配的促红细胞生成素(EPO)降低患者,以及"低危"MDS,且EPO<500 U/L患者,可能需要外源性EPO。门静脉血栓导致的门脉高压、脾功能亢进(尤其是布加综合征后),可导致贫血和血小板减少,消化道出血会进一步加重贫血,可对症处理。既往反复输血导致的同种异体抗体导致的溶血性贫血、潜在MDS导致的无效红细胞生成等,都可能是贫血的原因[5,6,27,31]。
中国PNH的治疗即将步入补体抑制剂时代,谨慎地甄别各种临床情况,并给予恰当的治疗至关重要。当然,未来尚需累积更多的诊治经验对患者进行更精准的管理。
(执笔:杨辰、李莉娟)
参与共识制定和讨论的专家(按姓氏汉语拼音排序):常春康(上海市第六人民医院);常红(四川大学华西医院);陈彤(复旦大学附属华山医院);戴敏(南方医科大学南方医院);董宝侠(上海市第一人民医院);付蓉(天津医科大学总医院);高素君(吉林大学第一医院);高晓宁(解放军总医院);韩冰(北京协和医院);何川(四川大学华西医院);何广胜(江苏省人民医院);洪梅(华中科技大学同济医学院附属协和医院);黄健(浙江大学附属第一医院);贾劲松(北京大学人民医院);姜中兴(郑州大学附属第一医院);赖永榕(广西医科大学第一附属医院);雷美清(海口市人民医院);李德鹏(徐州医科大学附属医院);李静(西安交通大学第一附属医院);李莉娟(兰州大学第二医院);李文倩(青海省人民医院);李燕(新疆维吾尔自治区人民医院);林丽娥(海南省人民医院);林圣云(浙江省中医院);刘红(南通大学附属医院);刘辉(北京医院);刘立民(苏州大学第一附属医院);刘容容(广西医科大学第一附属医院);马艳萍(山西医科大学附属第二医院);孟凡凯(华中科技大学同济医学院附属同济医院);苗瞄(苏州大学附属第一医院);任金海(河北医科大学第二附属医院);施均(中国医学科学院血液病医院);宋强(山东大学齐鲁医院);田发青(深圳市龙岗区人民医院);佟红艳(浙江大学附属第一医院);王荷花(中山大学附属第一医院);王化泉(天津医科大学总医院);王顺清(广州市第一人民医院);文钦(陆军军医大学第二附属医院);徐雅靖(中南大学湘雅医院);杨辰(北京协和医院);杨岩(吉林大学第一医院);曾云(昆明医科大学第一附属医院);张敏(华中科技大学同济医学院附属协和医院);张连生(兰州大学第二医院);张凤奎(中国医学科学院血液病医院);赵明峰(天津市第一中心医院);郑波(宁夏医科大学总医院);郑以州(中国医学科学院血液病医院);祝亮方(福建医科大学附属协和医院)



























