
探讨老龄雄性C57BL/6J小鼠剖腹探查术后认知功能障碍与肠道菌群及其代谢物失调改变的关系。
采用随机数字表法将48只老龄(16~17月龄)无特定病原体(SPF)雄性C57BL/6J小鼠分为对照组(n=24)和手术组(n=24)。手术组采用1.4%异氟醚诱导麻醉15 min后,继续用1.4%异氟醚+100%氧气维持麻醉行剖腹探查术,手术时间持续10 min,术后继续麻醉2 h;对照组不予手术及麻醉,置于含100%氧气的透明箱中2 h。术后48 h同时采集两组小鼠的粪便和外周血。采用16S rDNA基因测序检测肠道菌群的丰度、多样性和差异性,采用液相色谱-串联质谱(LC/MS)代谢组技术检测粪便代谢谱的改变,并分析差异代谢物功能,采用ELISA检测血清白细胞介素(IL)-6、IL-1β和肿瘤坏死因子-α(TNF-α)含量。在术后3 d行Morris水迷宫实验,检测小鼠认知功能。
对照组与手术组小鼠术后逃避潜伏期分别为(22.0±4.9)、(35.0±5.1)s,目标象限停留时间分别为(26.0±3.7)、(16.0±2.9)s;与对照组比较,手术组小鼠术后逃避潜伏期延长(P=0.035),目标象限停留时间减少(P=0.006)。两组小鼠肠道菌群差异变化具有可比性,手术组大肠埃希菌、志贺菌和梭杆菌的菌群表达水平上调,瘤胃菌和丁酸菌的菌群表达水平下调。LC/MS获得对照组和手术组小鼠粪便代谢谱,在正、负离子模式分别筛选出14种和21种差异代谢物,正离子模式差异代谢物为谷氨酸、2-吲哚甲酸、犬尿酸、甘油醛等,负离子模式差异代谢物为甲硫氨酸、天冬氨酸、L-苏氨酸、酪氨酰-苏氨酸、5-羟基吲哚-3-乙酸等。鉴定出的差异代谢物的路径主要涉及氨基酸、脂肪酸和色氨酸代谢以及核苷酸合成。两组小鼠血清IL-1β、IL-6和TNF-α表达水平差异均无统计学意义(均P>0.05)。
肠道菌群及其代谢物失调与老龄雄性C57BL/6J小鼠术后认知功能障碍的发生相关。麻醉手术不仅改变了小鼠肠道微生物菌群的组成,而且改变了代谢稳态和粪便代谢表型。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
术后认知功能障碍(postoperative cognitive dysfunction,POCD)是老年患者术后常见的中枢神经系统并发症,主要表现为精神错乱、记忆力减退、人格改变、社交障碍等症状,具体发病机制仍不明确。目前基于肠-脑轴的临床前研究证明了肠道菌群与神经退行性疾病和免疫介导的神经系统疾病之间存在相互作用,这种肠道菌群与大脑的双向交流作用即是“微生物-肠-脑”(microbiota-gut-brain,MGB)轴[1]。肠道菌群通过MGB轴与循环炎症标志物、激素、传入和传出神经系统等发生相互作用,从而影响大脑的神经、免疫、内分泌和代谢,进一步改变宿主行为,促进疾病发展,加重当前症状,或加快治疗和恢复。已有研究证实肠道菌群的缺失或失调会导致宿主记忆受损、学习能力下降、心理障碍等[2, 3]。此外,最新研究提出肠道菌群失调与POCD之间可能存在潜在关系[4],而肠道菌群失调对老年小鼠POCD的影响尚未见报道。因此,本研究旨在探究老龄小鼠术后肠道菌群及其代谢物的失调改变与POCD的关系。
本研究已获得国家癌症中心实验动物伦理委员会批准(NCC2019A193)。无特定病原体(specific pathogen free,SPF)老龄雄性C57BL/6J小鼠48只,16~17月龄,体质量28~35 g,购自至善北京健康医学研究院有限公司。采用随机数字表法将其分为对照组(n=24)和手术组(n=24)。小鼠饲养于无特殊病原菌环境中,室内温度(22±2)℃,12 h昼夜交替,自由摄食水和食物。两组分别在不同的笼子中饲养,防止肠道菌群的混合。
1.手术组处理方法:根据既往研究方法[5],小鼠采用1.4%异氟醚诱导麻醉15 min,待翻正反射消失后固定于实验台,用1.4%异氟醚+100%氧气维持麻醉并实行剖腹探查术,术后将小鼠放回透明麻醉箱,继续麻醉2 h。
2.对照组处理方法:小鼠不做手术及麻醉处理,置于含100%氧气的透明箱中2 h。
3.Morris水迷宫实验:水迷宫系统为直径120 cm、高40 cm的圆形水池,池内水深35 cm[水温(22±1)℃],在第四象限内放1个直径为10 cm的平台,低于水面1 cm。水池中加入镁白粉拌匀,训练期间平台位置和水池周围参照物保持不变。所有小鼠术后3 d开始Morris水迷宫训练测试,于每天下午同一时间,进行连续5 d的4个象限定位航行实验。直到训练完成后的第8天,撤走水下平台,进行空间探索实验:从第二象限将小鼠头部面向池壁放入水中,记录其在目标象限内(第四象限)所用的时间。
4.粪便采集:术后48 h从手术组和对照组小鼠肛门收集新鲜粪便装入2.0 ml离心管,并立即放进-80 ℃冰箱低温保存[6]。
5.生物信息学分析:小鼠粪便使用DNeasy®PowerSoil® Kit(100)试剂盒(生产批号:163049267,杭州联川生物有限公司)进行微生物DNA提取。通过引物341F(5′-CCTACGGGNGGCWGCAG-3′)和805R(5′-GACTACHVGGGTATCTAATCC-3′)对细菌16S rDNA基因序列(V3~V4区)进行PCR扩增。PCR产物由AMPure XT beads(生产批号:17219479,杭州联川生物有限公司)纯化和荧光定量仪Qubit(美国Invitrogen公司)定量后,进行Illumina NovaSeq 6000(美国Illumina公司)平台测序。使用FLASH软件对16S rDNA数据原始双端序列进行拼接,并根据fqtrim(v0.94)对拼接后数据进行质量过滤,Vsearch软件进行嵌合序列过滤,以获得高质量的有效数据。利用DADA2软件进行后续分析,得到特征表和特征序列。最后与SILVA(release 132)数据库进行比对得到注释信息。为评估菌群之间的差异性,使用基于UniFrac的主坐标分析(principal co-ordinates analysis,PCoA)方法计算β多样性值,分析肠道菌群在不同环境下的相似性和差异性。
6.液相色谱-串联质谱(liquid chromatography-mass spectrometry,LC/MS)代谢检测:(1)代谢物的提取:称取100 mg粪便样品进行液氮研磨;向样品加入120 μl、50%甲醇充分混匀,常温静置10 min;加入提取液,放入-20 ℃冰箱过夜,沉淀样品中的蛋白质;4 000 ×g离心20 min,转移上清液代谢物提取液到96孔板;每份样品等量取出10 μl 稀释液混合成质控样品,最后进行质谱分析。(2)色谱与质谱条件:用超高压液相色谱仪(ExionLC,美国SCIEX 公司)进行样品色谱分离。设置柱温为35 ℃,流速为0.4 ml/min。采用的流动相为A相:水(1%甲酸);B 相:乙腈(1%甲酸)。样本采集所用的高分辨率质谱仪购自美国SCIEX公司。每份样本分别进行1次正、负离子模式采集。离子源的遮蔽气压设置为30 PSI(磅每平方英寸),气体1(辅气)和气体2(鞘气)压力均为60 PSI。源温度650 ℃。正离子模式时电压为正5 000 V,负离子模式时电压为-4 500 V。信息依赖性采集模式采集数据,每个采集循环中,一级采集范围为60~1 200道尔顿,一级采集时间为150 ms,从一级图谱中挑选带1个正电荷(负离子模式下为带1个负电荷),并且每秒信号积累强度超过100的前12个信号离子进行二级碎裂扫描。整个采集循环耗时0.56 s。每次扫描的粒子信号以质谱仪检测器的4个通道分别记录共4次后合并转化成数据。(3)潜在的差异代谢物鉴定及代谢通路富集分析:利用R语言软件包XCMS进行峰提取并进行质控,对提取到的物质利用CAMERA软件进行加和离子注释;利用MetaX软件进行代谢物鉴定(一级质谱信息进行数据库匹配鉴定,二级质谱信息与in-house标准品数据库进行匹配鉴定);候选鉴定物质利用京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)数据库进行代谢物注释,解释代谢物的物理化学性质、生物功能;利用MetaX软件对代谢物进行定量、筛选显著差异代谢物。用SIMCA-P(v14.1)软件模式识别,进行多变量统计偏最小二乘法判别分析(partial least squares-discriminant analysis,PLS-DA)。
7. 炎症因子水平检测:小鼠眼球取血,室温静置2 h,1 000 ×g离心20 min,取上清液血清,根据ELISA试剂盒(20200215-20188A、20200215-20174A、20200215-20852A,上海酶联科技有限公司)操作说明检测小鼠血清白细胞介素(interleukin,IL)-6、IL-1β和肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)含量。
采用SPSS 25.0和GraphPad Prism 8软件进行数据分析和制图。正态分布的计量资料采用表示,两组间比较采用独立样本t检验。非正态分布的肠道菌群门、属水平的相对丰度比较采用 Wilcoxon 秩和检验,根据Bonferroni法校正P值。采用t检验进行代谢物单变量分析,主要计算代谢物强度在两表型间的比值,对检验结果作多重检验分析,经过Benjamini-Hochberg矫正,得到Q值;利用PLS-DA对代谢物进行多变量分析,得到每个代谢物的变量重要性(variable importance in projection,VIP);取>2倍差异、Q<0.05、VIP≥1 为筛选条件得到显著差异代谢物。双侧检验,检验水准α=0.05。
与对照组比较,手术组小鼠的术后逃避潜伏期延长,目标象限所用时间减少(P<0.05);两组小鼠的平均运动速度比较差异无统计学意义(P>0.05),结果见表1。
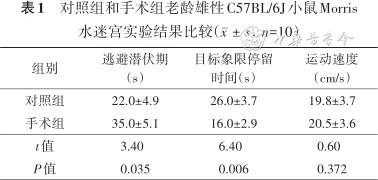
对照组和手术组老龄雄性C57BL/6J小鼠Morris水迷宫实验结果比较(,n=10)
对照组和手术组老龄雄性C57BL/6J小鼠Morris水迷宫实验结果比较(,n=10)
| 组别 | 逃避潜伏期(s) | 目标象限停留时间(s) | 运动速度(cm/s) |
|---|---|---|---|
| 对照组 | 22.0±4.9 | 26.0±3.7 | 19.8±3.7 |
| 手术组 | 35.0±5.1 | 16.0±2.9 | 20.5±3.6 |
| t值 | 3.40 | 6.40 | 0.60 |
| P值 | 0.035 | 0.006 | 0.372 |
根据97%的序列相似性聚类,划分出对照组2 035个分类操作单元(operational taxonomic units,OTU),手术组1 273个OTU,其中807个OTU为两组所共有。两组小鼠肠道菌群差异变化具有可比性,手术组的大肠埃希菌、志贺菌和梭杆菌的菌群表达水平上调,瘤胃菌和丁酸菌的菌群表达水平下调。
利用LC/MS获得对照组和手术组小鼠粪便代谢谱,PLS-DA模型显示两组之间代谢谱存在差异。在正、负离子模式中分别筛选出14种和21种差异代谢物(图1),正离子模式差异代谢物为谷氨酸、2-吲哚甲酸、犬尿酸、甘油醛等,负离子模式差异代谢物为甲硫氨酸、天冬氨酸、L-苏氨酸、酪氨酰-苏氨酸、5-羟基吲哚-3-乙酸等。这些代谢物的上调和下调变化趋势见图1。利用差异代谢物进行KEGG通路富集并进行富集显著性分析,鉴定出的差异代谢物的路径主要涉及氨基酸、脂肪酸和色氨酸代谢,核苷酸合成等(图2)。
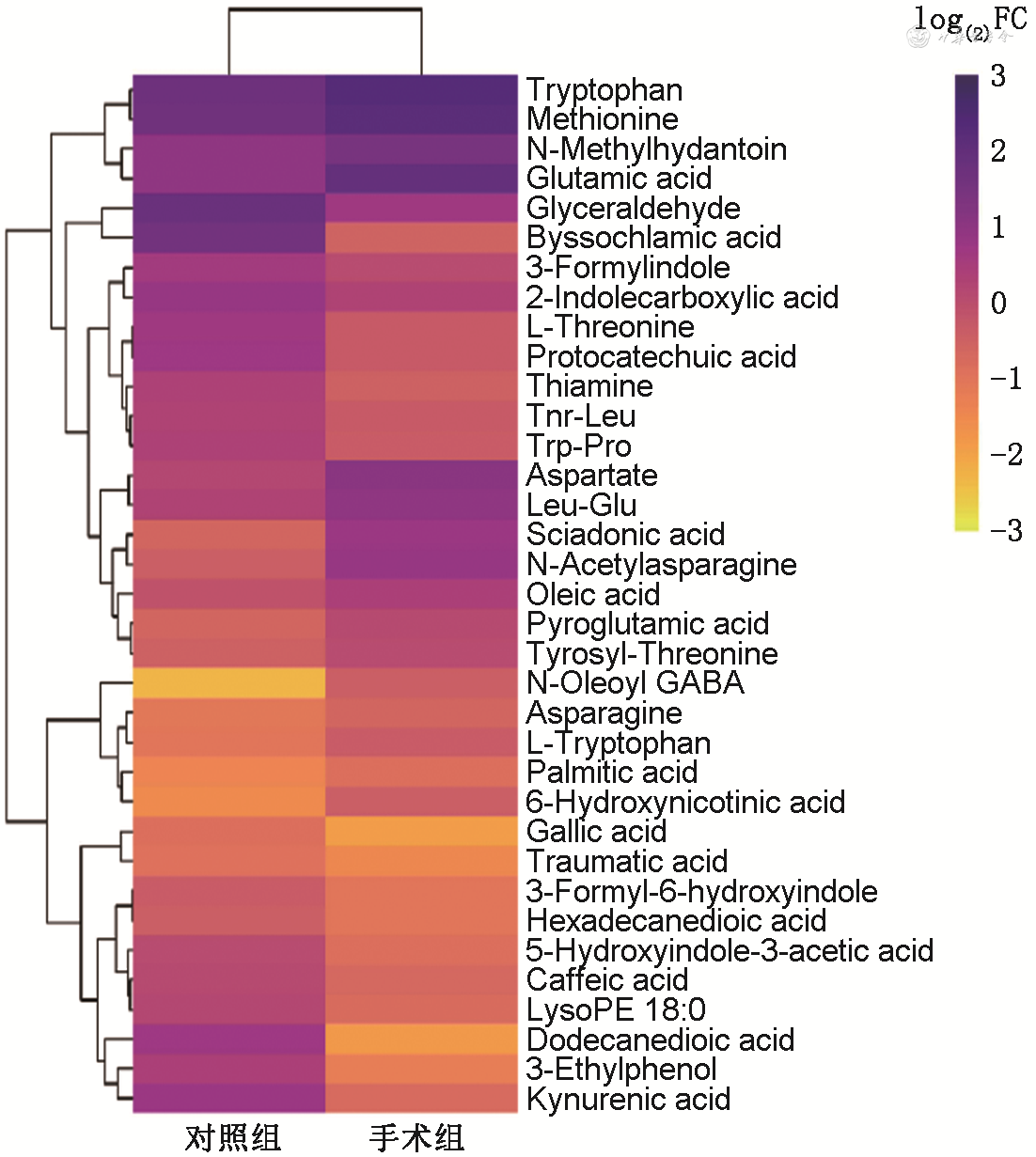

注:FC为倍数变化,表示对照组代谢物的丰度定量平均值相对于手术组的变化倍数;深紫色代表浓度较高的代谢物,浅黄色代表浓度较低的代谢物;Tryptophan为色氨酸;Methionine为甲硫氨酸;N-Methylhydantoin为N-甲基乙内酰脲;Glutamic acid为谷氨酸;Glyceraldehyde为甘油醛;Byssochlamic acid为丝衣霉酸;3-Formylindole为3-吲哚甲醛;2-Indolecarboxylic acid为2-吲哚甲酸;L-Threonine为L-苏氨酸;Protocatechuic acid为苯酚羧酸;Thiamine为硫胺素;Thr-Leu为苏氨酸-亮氨酸;Trp-Pro为色氨酸-脯氨酸;Aspartate为天冬氨酸;Leu-Glu为亮氨酸-谷氨酸;Sciadonic acid为金松酸;N-Acetylasparagine为N-乙酰-L-蛋氨酸;Oleic acid为油酸;Pyroglutamic acid为吡咯谷氨酸;Tyrosyl-Threonine为酪氨酸-苏氨酸;N-Oleoyl GABA为N-油酰基-γ-氨基丁酸;Asparagine为天冬酰胺;L-Tryptophan为左旋色氨酸;Palmitic acid为棕榈酸;6-Hydroxynicotinic acid为6-羟基烟酸;Gallic acid为没食子酸;Traumatic acid为氨甲环酸;3-Formyl-6-hydroxyindole为3-甲酰基-6-羟基吲哚;Hexadecanedioic acid为十六烷基二酸;5-Hydroxyindole-3-acetic acid为5-羟基吲哚-3-乙酸;Caffeic acid为咖啡酸;LysoPE 18∶0为硬脂酰溶血磷脂酰乙醇胺;Dodecanedioic acid为十二烷二酸;3-Ethylphenol为3-乙基苯酚;Kynurenic acid为犬尿酸
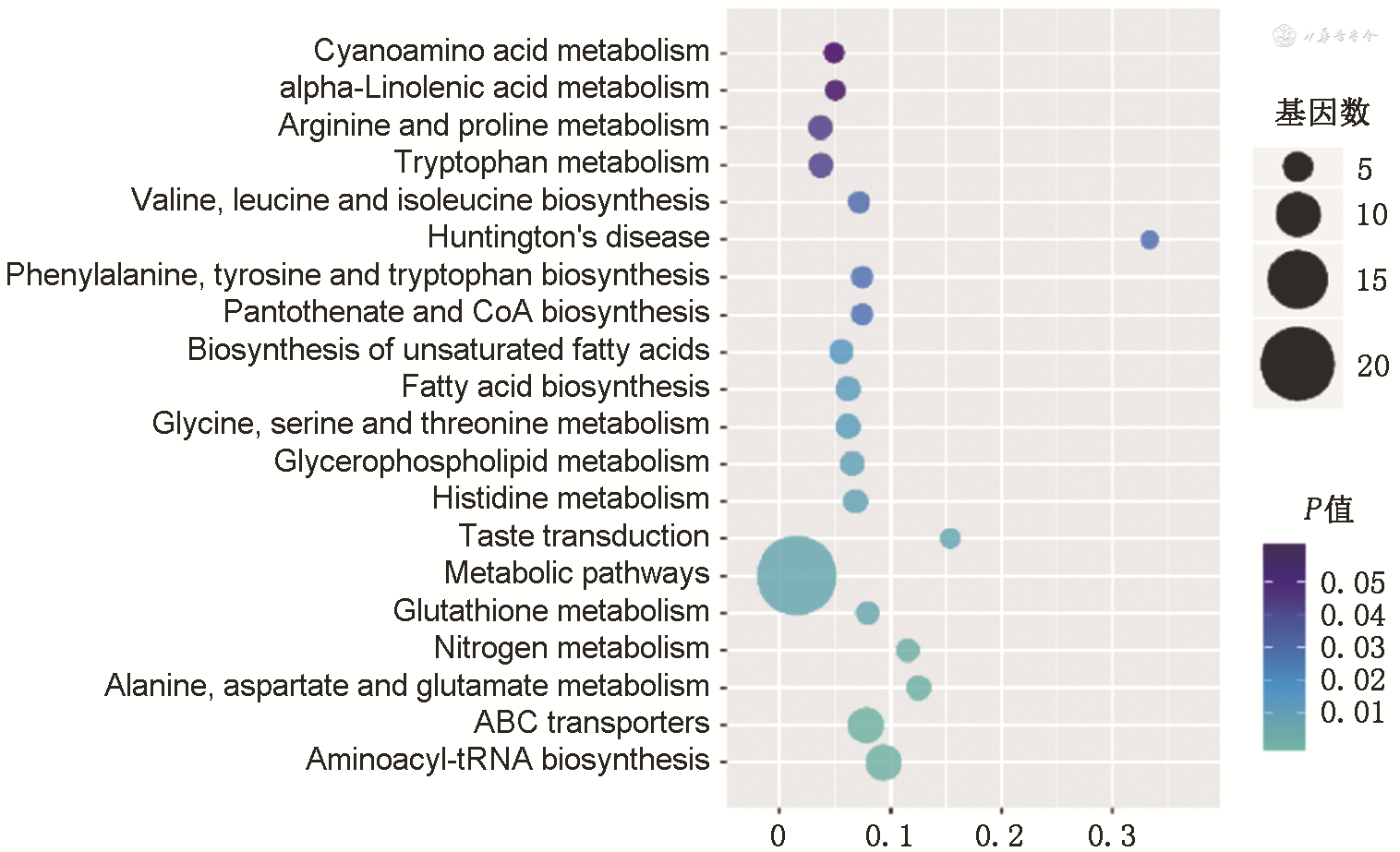

注:Cyanoamino acid metabolism为氰胺酸代谢;alpha-Linolenic acid metabolism为α-亚麻酸代谢;Arginine and proline metabolism为精氨酸和脯氨酸代谢;Tryptophan metabolism为色氨酸代谢;Valine,leucine and isoleucine biosynthesis为缬氨酸、亮氨酸和异亮氨酸的生物合成;Huntington′s disease 为亨廷顿舞蹈症;Phenylalanine,tyrosine and tryptophan biosynthesis为苯丙氨酸、酪氨酸和色氨酸的生物合成;Pantothenate and CoA biosynthesis为泛酸和辅酶A的生物合成;Biosynthesis of unsaturated fatty acids为不饱和脂肪的生物合成;Fatty acid biosynthesis为脂肪酸代谢;Glycine,serine and threonine metabolism为甘氨酸、丝氨酸和苏氨酸的代谢;Glycerophospholipid metabolism为甘油磷脂代谢;Histidine metabolism为组氨酸代谢;Taste transduction为味觉传导通路;Metabolic pathways为代谢途径;Glutathione metabolism为谷胱甘肽代谢;Nitrogen metabolism为氮代谢;Alanine,aspartate and glutamate metabolism为丙氨酸、天冬氨酸和谷氨酸代谢;ABC transporters为ATP结合盒转运蛋白/ABC转运器;Aminoacyl-tRNA biosynthesis为氨酰基转运PNA的生物合成
粪便显著变化的差异代谢物和丰度差异显著的属水平菌群物种的相关性热图见图3。
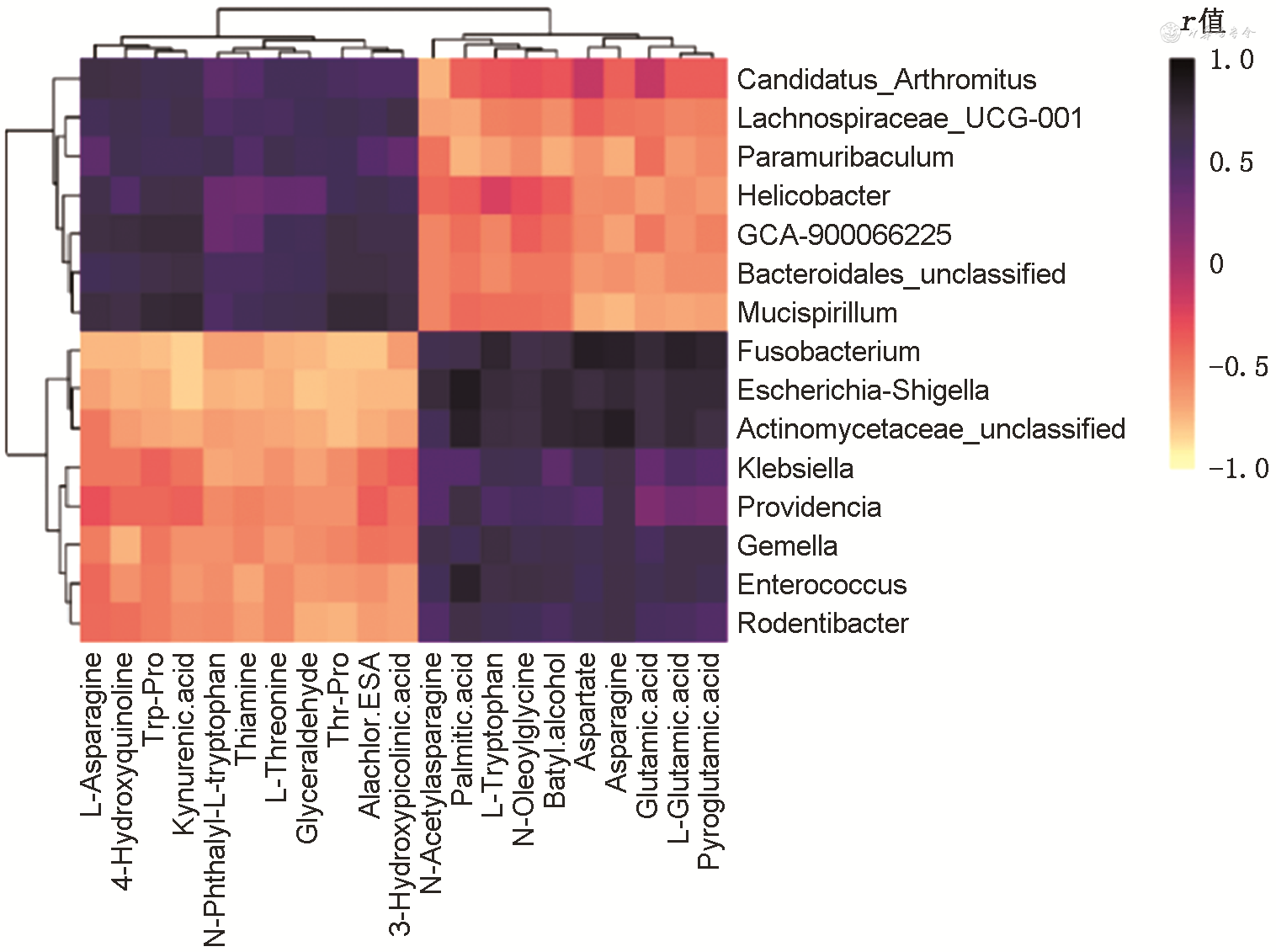

注:Candidatus_Arthromitus为昆虫肠道菌属;Lachnospiraceae_UCG-001为毛螺菌科UCG-001;Paramuribaculum为副鼠杆状菌属;Helicobacter为螺杆菌属;GCA-900066225为瘤胃球菌科;Bacteroidales_unclassified为拟杆菌目未分类;Mucispirillum为小螺菌属;Fusobacterium为梭菌属;Escherichia-Shigella为大肠杆菌属-志贺菌属;Actinomycetaceae_unclassified为放线菌科未分类;Klebsiella为克雷伯杆菌属;Providencia为普罗维登斯菌属;Gemella为孪生球菌属;Enterococcus为肠球菌属;Rodentibacter为啮齿杆菌属;Pyroglutamic acid为吡咯谷氨酸;Glutamic acid为谷氨酸;Asparagine为天冬酰胺;Aspartate为天冬氨酸;Batyl alcohol为鲨肝醇;N-Oleoylglycine为油酰甘氨酸;L-Tryptophan为色氨酸;Palmitic acid为棕榈酸;N-Acetylasparagine为N-乙酰-L-蛋氨酸;3-Hydroxypicolinic acid为3-羟基吡啶甲酸;Alachlor ESA为甲草胺;Thr-Pro为苏氨酸-脯氨酸;Glyceraldehyde为甘油醛;L-Threonine为苏氨酸;Thiamine为硫胺素;N-Phthalyl-L-tryptophan为N-酞酰-L-色氨酸;Kynurenic acid为犬尿酸;Trp-Pro为色氨酸-脯氨酸;4-Hydroxyquinoline为4-羟基喹啉;L-Asparagine为L-天冬氨酸
两组小鼠血清IL-1β、IL-6和TNF-α表达水平差异均无统计学意义(均P>0.05),结果见表2。
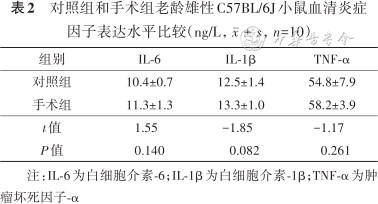
对照组和手术组老龄雄性C57BL/6J小鼠血清炎症因子表达水平比较(ng/L,,n=10)
对照组和手术组老龄雄性C57BL/6J小鼠血清炎症因子表达水平比较(ng/L,,n=10)
| 组别 | IL-6 | IL-1β | TNF-α |
|---|---|---|---|
| 对照组 | 10.4±0.7 | 12.5±1.4 | 54.8±7.9 |
| 手术组 | 11.3±1.3 | 13.3±1.0 | 58.2±3.9 |
| t值 | 1.55 | -1.85 | -1.17 |
| P值 | 0.140 | 0.082 | 0.261 |
注:IL-6为白细胞介素-6;IL-1β为白细胞介素-1β;TNF-α为肿瘤坏死因子-α
本研究结果显示,手术组小鼠术后逃避潜伏期延长,空间探索实验的目标象限所用时间减少,提示老龄小鼠POCD模型构建成功。
肠道菌群在大脑发育和脑功能中发挥着重要作用,可作为宿主个体认知和功能行为学异常的驱动力[7, 8]。本研究中手术组小鼠术后肠道菌群门(6种)和属(15种)水平发生了显著的改变。在肠道菌群门水平上,手术组的柔壁菌门、厚壁菌门的相对丰度比例减少,与先前的老年小鼠胫骨骨折手术POCD模型的研究结果相似[9]。手术组的变形菌门比例增加,据相关研究报道,变形菌门与免疫失调和炎症反应有关,是疾病状态下肠道菌群失调的微生物特征[10]。在肠道菌群属水平上,手术组的埃希菌-志贺杆菌属、梭杆菌属相对丰度比例增加。外科手术不仅能增加外周血炎症因子水平,也能诱发中枢神经系统的炎症反应[7];志贺杆菌与促炎状态相关,该菌群利用人肠道α-防御素5提升自身的黏附能力,以促进对宿主的感染[11]。此外,具有黏附性/侵袭性的埃希菌对宿主的持续感染可导致宿主出现慢性和持续的周围炎症状态[12]。埃希菌可通过NLRP3炎症小体依赖机制,诱导促炎细胞因子的产生与释放[13]。与淀粉样蛋白阴性的认知能力完好者相比,淀粉样蛋白阳性的认知障碍者的粪便样本中,大肠杆菌和志贺菌类群有所增加。与健康对照者比较,介导炎症相关微生物的埃希菌和志贺菌在阿尔茨海默病患者的粪便样本中有所增加,与认知障碍和脑淀粉样变患者的外周炎症状态有关,这表明肠道菌群的失调与全身性炎症之间存在紧密的联系,引发或加剧阿尔茨海默病患者脑神经的退化[14]。曲霉菌属作为肠道真菌,其低丰度与中性粒细胞增多、淋巴细胞减少密切相关[15],而淋巴细胞降低通常被认为与认知功能障碍有关[16];另有文献报道,低淋巴细胞计数与老年人帕金森病发病率和死亡率增加有关[17]。根据上述研究结果发现,手术对肠道菌群的属水平改变具有选择性的影响,某些条件性致病菌的增多或缺失可能是POCD的发病机制,具有重要的临床诊断和治疗参考意义。
微生物可以在动物和人类的肠道中局部合成神经递质[18]。本研究鉴定出36种差异表达的代谢物,这些代谢物主要参与核苷酸、脂肪酸和氨基酸的代谢,部分参与神经递质的代谢。最近1项研究在Aβ淀粉样蛋白转基因小鼠模型中证明,在阿尔兹海默病的发生、发展中,肠道微生物失调会导致外周血中苯丙氨酸和异亮氨酸的含量异常增多,可诱导辅助T细胞1(T helper cell 1,Th1)的分化和增殖,并促进其向小鼠脑内浸润,浸润入脑的Th1细胞和脑内固有的M1型小胶质细胞共同激活,进而导致阿尔茨海默病相关神经炎症的发生和加重[19]。色氨酸在哺乳动物中发挥抗炎作用[20],而肠道微生物组成可以调节血浆中色氨酸及其代谢物的浓度[21]。在精神病谱系中,色氨酸分解增加,且色氨酸分解指数与病程之间有相关性;同时,患者死亡后脑组织额叶皮质的犬尿氨酸升高[22]。然而,所涉及的确切代谢性分子信号转导途径尚未明确,未来需要进一步临床前研究和临床试验去探索相关的分子机制。
MGB交流的最重要和研究最深入的特征是细菌响应和直接产生多种神经化学物质的能力,这些神经化学信号可以通过肠-脑轴的生化和结构途径传播到大脑[23]。肠道菌群与下丘脑-垂体-肾上腺轴(hypothalamic-pituitary-adrenal,HPA)紧密相连,HPA也是肠道菌群影响大脑发育和认知记忆功能的主要神经内分泌系统。通过控制饮食、感染、压力和运动对肠道菌群的作用,宿主HPA激活机体系统释放改变胃肠道功能的多种神经内分泌激素,如去甲肾上腺素和多巴胺,引起肠道菌群组成的改变,导致肠道通透性、运动性和黏液生成增加;相反,各种细菌成份的易位和相互作用诱导神经炎症反应过程,通过释放促炎细胞因子和前列腺素等强激活因子导致HPA轴的激活,增加了肠道菌群与大脑的免疫-神经内分泌相互作用的复杂性[24, 25]。此外,肠道菌群的衍生代谢物包括短链脂肪酸、三甲胺、氨基酸衍生物和维生素,具有基本的代谢调节和信号转导功能,可以调节宿主体内包括血脑屏障的完整性和大脑功能的平衡[26]。
本研究局限性:(1)粪便采集时间是在术后48 h进行;(2)研究对象是术前基线状况健康的老年小鼠,术后48 h小鼠的外周血炎症因子变化不大或者恢复较快。仅仅监测血液中炎性因子浓度,还很难较好揭示肠道菌群紊乱与术后神经认知障碍的关联性;(3)本研究尚未进行抗生素处理或者粪菌移植实验的相关验证。总的来说,肠道菌群虽然在POCD的发病机制中具有潜在的作用,但未来鉴别和筛选关键条件致病菌,挖掘菌群代谢活性物质的功能特征和潜在价值仍是至关重要的。
承耀中, 练新荣, 李慧娴, 等. 老龄雄性C57BL/6J小鼠剖腹探查术后肠道菌群及其代谢物失调与认知功能障碍的关系[J]. 中华医学杂志, 2024, 104(15): 1316-1322. DOI: 10.3760/cma.j.cn112137-20230810-00199.
所有作者声明不存在利益冲突



























