
探讨3D打印匹配式人工椎体临床应用有效性及短期安全性评价。
回顾性分析2021年9月至2022年7月于空军军医大学西京医院和北京大学人民医院于肿瘤切除后采用3D打印匹配式人工椎体重建脊柱稳定性的脊柱肿瘤患者12例,男7例、女5例,年龄为(42.17±14.56)岁(范围18~65岁)。所有患者均接受椎体整块切除(total en bloc spondylectomy,TES),以3D打印匹配式人工椎体重建脊柱。术后3、6个月采用Brantigan-Steffee的影像学融合标准评价融合效果,术后3、6个月采用日本骨科协会(Japanese Orthopaedic Association,JOA)功能评分,术后3个月采用视觉模拟评分法(visual analogue scale,VAS),术后3、6个月采用椎体间高度变化,分别与术前比较进行疗效评价,记录不良事件并进行安全性评价。
12例均顺利完成手术,手术部位分别为胸椎6例、胸腰段3例、腰椎3例。所有患者均获得随访,随访时间为(23.92±3.23)个月(范围19~29个月),所有患者期间均未出现肿瘤复发转移。术后6个月时12例Brantigan-Steffee的影像学融合标准均为全部融合。术后6个月JOA评分优10例、良1例、差1例。术前及术后3个月的VAS分别为(4.08±2.47)、(1.83±1.59)分,差异有统计学意义(t=2.635,P=0.023)。术前、术后第15天、术后3个月及术后6个月椎体间高度分别为32.75(25.94,68.20)、41.09(30.55,70.20)、40.70(30.23,67.83)和40.74(30.23,67.08)mm,差异无统计学意义(χ2=0.768,P=0.857)。术后未发生内植物相关不良事件。
采用3D打印匹配式人工椎体可用于脊柱肿瘤切除后脊柱稳定性重建,具有满意的短期疗效和安全性。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
对累及椎体的脊柱原发恶性、良性侵袭性和寡转移灶等肿瘤的外科治疗,目前大多采用的手术方案是全脊椎切除术(total en-bloc spondylectomy,TES)[1,2]。与病变刮除和分块切除相比,TES可实现对椎体病损的边缘或广泛切除,外科边界更加安全、肿瘤局部控制率更高,患者总生存获益[3]。然而,通过单一后路或者前后联合入路的TES会造成脊柱前、中、后柱的360°缺损,导致脊柱连续性遭到严重破坏,影响脊柱发挥支撑保护的基本功能[4]。此外,TES还会造成脊柱后方结构缺损,以致难以获得满意的后方植骨融合条件。因此,对TES导致的脊柱缺损,前方椎体的支撑重建尤为重要[5,6,7]。
不同类型的椎体替代物联合后路上、下至少两个节段椎弓根螺钉固定,是临床上常用的脊柱重建方式[8]。既往常用的椎体替代物包括自体移植骨、同种异体移植骨、钛笼和标准化人工椎体等。一直以来,自体骨移植因其良好的骨整合效果,可获得长期生物稳定,被认为是脊柱重建的金标准[9]。但术中自体骨的获取需要额外的手术操作,延长了手术时间,并导致供区出血和术后疼痛。当涉及多节段脊柱重建时,可采集自体骨体量的有限性也会限制其使用。异体骨的应用虽然也可获得长期生物稳定,但可能会出现排异反应及骨愈合不良,且异体骨的来源稀少。钛网因具有良好的生物相容性、可自由修剪、中空结构可填充自体骨等特点,得到了外科医生的普遍接受和广泛使用。但由于钛网与上、下终板植骨面是点接触模式,容易发生应力分布不均匀而出现终板切割,从而导致钛网下沉,造成椎体间高度短缩和椎间孔缩小,甚至出现脊髓和神经根受压[10]。同时,钛网沉陷致脊柱不稳定时,脊柱内固定相关并发症如椎弓根螺钉松动及连接棒断裂的发生率明显升高,可能需行翻修手术,为患者带来再次手术创伤[11,12]。可调式人工椎体可根据术中脊柱缺损情况灵活调节,椎体终板支撑面积增大,但仍不能满足长节段或特殊部位重建生理曲度和解剖形态的要求,难以形成稳定的骨整合。
3D打印匹配式人工椎体是根据患者椎体肿瘤切除后骨缺损个性化定制的人工椎体,可提供更好的力学支撑,界面匹配和可供骨长入的内部多孔结构,患者在获得即刻机械稳定的基础上也能获得长久的生物稳定,因此被认为是一种更优的人工椎体选择方案[13]。然而其临床应用的推广仍需长期大量的临床研究。
本研究采用激光选区熔融技术和人工椎体结构分析优化,设计制备出匹配式人工椎体,用于脊柱肿瘤TES后重建脊柱稳定性,通过临床研究观察其临床应用的安全性及有效性。研究目的:(1)探讨3D打印匹配式人工椎体的设计、制备、手术植入和随访评价全流程实施过程的合理性与有效性;(2)探讨3D打印匹配式人工椎体植入后6个月的融合稳定性及功能改善情况;(3)观察记录3D打印匹配式人工椎体相关不良事件,评价人工椎体术后早期安全性。
纳入标准:(1)脊柱肿瘤或病变切除后需行脊柱稳定性重建者;(2)脊柱重建部位为胸椎1~3个节段、胸腰段、或腰椎1~2个节段者;(3)预期生存期>6个月者;(4)3个月内未参加过其他临床试验者。
排除标准:(1)精神上无能力或不能理解参与研究要求的患者;(2)任何不愿遵守术后须知或医嘱者;(3)可能阻碍脊柱植入物手术获益的任何疾病患者;(4)有严重的心、肝、肺、肾等重要脏器疾病患者;(5)手术部位无足够软组织覆盖者;(6)有涉及手术部位的感染或有局部炎症表现(脊柱结核除外)者;(7)病理性肥胖者[体质指数(body mass index,BMI)≥40 kg/m2];(8)妊娠、哺乳期女性;(9)精神疾病、药物滥用或酗酒等影响手术及术后康复者;(10)急进性关节病、骨软化、骨质吸收和严重骨质疏松(T值<-3.5)者;(11)疑似或经证实对异物(金属材料)过敏或不耐受者;(12)待治疗的椎间节段既往实施过融合术者;(13)长期服用影响骨、软组织愈合的药物(如化疗药物、皮质类固醇激素等)且无法配合停药1周以上者;(14)年龄<18岁或>80岁;(15)其他研究者认为不适合入选者。
回顾性分析2021年9月至2022年7月于空军军医大学第一附属医院(以下称西京医院)或北京大学人民医院收治,脊柱病变经TES切除后采用增材制造(3D打印)匹配式人工椎体[维度(西安)生物医疗科技有限公司,中国]重建脊柱稳定性的患者12例。西京医院8例,疾病诊断分别为:T4椎体肉瘤1例、L4椎体Ewing肉瘤1例、T10~T12结核术后钛网移位并不全瘫1例、T11椎体及附件骨巨细胞瘤1例、T12椎体血管瘤1例、T6肿瘤伴不全瘫1例、L2浆细胞瘤1例、T12~L1脊椎体恶性肿瘤伴不全瘫1例;北京大学人民医院4例,疾病诊断为:T8椎体软骨肉瘤1例、L3浆细胞瘤1例、T7~T9恶性肿瘤1例、T3~T4椎体恶性肿瘤1例(表1)。12例全部为汉族,男7例(58%)、女5例(42%),年龄为(42.17±14.56)岁(范围18~65岁),身高为(165.33±5.45)cm,体重为(61.73±8.76)kg。
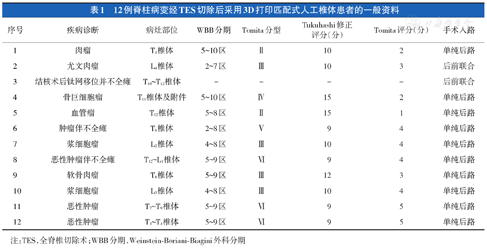
12例脊柱病变经TES切除后采用3D打印匹配式人工椎体患者的一般资料
12例脊柱病变经TES切除后采用3D打印匹配式人工椎体患者的一般资料
| 序号 | 疾病诊断 | 病灶部位 | WBB分期 | Tomita分型 | Tukuhashi修正评分(分) | Tomita评分(分) | 手术入路 |
|---|---|---|---|---|---|---|---|
| 1 | 肉瘤 | T4椎体 | 5~10区 | Ⅱ | 10 | 2 | 单纯后路 |
| 2 | 尤文肉瘤 | L4椎体 | 2~7区 | Ⅲ | 10 | 3 | 后前联合 |
| 3 | 结核术后钛网移位并不全瘫 | T10~T12椎体 | - | - | - | - | 后前联合 |
| 4 | 骨巨细胞瘤 | T11椎体及附件 | 5~10区 | Ⅳ | 15 | 2 | 单纯后路 |
| 5 | 血管瘤 | T12椎体 | 5~8区 | Ⅱ | 15 | 1 | 单纯后路 |
| 6 | 肿瘤伴不全瘫 | T6椎体 | 2~8区 | Ⅴ | 9 | 4 | 单纯后路 |
| 7 | 浆细胞瘤 | L2椎体 | 4~8区 | Ⅲ | 10 | 4 | 单纯后路 |
| 8 | 恶性肿瘤伴不全瘫 | T12~L1椎体 | 5~9区 | Ⅵ | 9 | 4 | 单纯后路 |
| 9 | 软骨肉瘤 | T8椎体 | 5~9区 | Ⅲ | 12 | 3 | 单纯后路 |
| 10 | 浆细胞瘤 | L3椎体 | 4~8区 | Ⅲ | 10 | 4 | 单纯后路 |
| 11 | 恶性肿瘤 | T7~T9椎体 | 5~9区 | Ⅵ | 9 | 5 | 单纯后路 |
| 12 | 恶性肿瘤 | T3~T4椎体 | 5~9区 | Ⅵ | 9 | 5 | 单纯后路 |
注:TES,全脊椎切除术;WBB分期,Weinstein-Boriani-Biagini外科分期
本研究获得了西京医院伦理委员会(QX20211 025-1)及北京大学人民医院伦理委员会(2021PHC023-001)批准通过。所有纳入的患者均签署相关知情同意书。
脊柱肿瘤术后需行匹配式人工椎体重建的治疗路径包括患者评估,影像数据采集,术前模拟规划,人工椎体设计制备,手术实施和术后康复等步骤进行实施。治疗环节均经过术前医工企讨论、资深骨肿瘤外科医生实施和术后按期的随访观察。
通过影像学检查和穿刺活检结果,并根据Weinstein-Boriani-Biagini(WBB)外科分期、Tomita外科分型,Tokuhashi修正评分及Tomita评分把握手术适应证和禁忌证。从病理特征来讲,TES适用于原发性脊柱恶性肿瘤(Ⅰ、Ⅱ期)、侵袭性生长的良性脊柱肿瘤以及有较长生存预期(>6个月)的孤立性脊柱转移瘤。从肿瘤侵犯角度,TES适用于Tomita分型Ⅲ~Ⅴ型,Ⅰ、Ⅱ、Ⅵ型为相对适应证,不适用于Ⅶ型。本组12例中Tomita分型Ⅱ型2例、Ⅲ型4例、Ⅳ型1例、Ⅴ型1例、Ⅵ型3例,均适合TES。
通过对CT和MRI检查图像数据进行3D重建和融合,获得脊柱肿瘤的3D模型数据集。辨识肿瘤,获得肿瘤大小、位置、性质以及与周围正常组织和异常增生血管的毗邻关系等信息。利用3D打印技术制备模型,获得对病灶区空间关系更清晰直观的认识。
根据肿瘤位置和Tomita外科分型确定手术入路。单纯后路适合L4节段以上不涉及重要血管的大多数Tomita分型Ⅰ~Ⅳ型和部分Ⅴ、Ⅵ型;前后联合入路适合涉及重要血管和节段性动脉Tomita分型Ⅴ、Ⅵ型以及L5水平的肿瘤(因髂骨翼和腰骶神经丛的存在)。本组对1例L4椎体Ewing肉瘤患者和1例T10~T12结核术后钛网移位并不全瘫患者采用前后联合入路,其他病例采用单纯后路手术入路。
确定术中执行肿瘤切除和假体重建所采用的辅助技术手段。西京医院实施手术8例患者均采用计算机辅助导航术中辅助识别肿瘤切除范围。
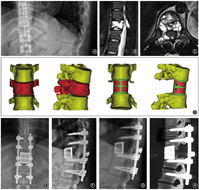
根据不同病变节段和病椎形态进行个性化设计,上下终板前后径、左右径和上下终板角度均与患者椎体缺损形成个体化匹配。人工椎体采用多孔结构和实心桁架相结合的结构提升人工椎体的力学强度。椎体中央设计植骨孔道,椎体背面为光滑结构避免与硬膜粘连,椎体两侧设计有可供夹持和术中调整的夹持孔(图1)。采用激光选区熔融的工艺进行加工,加工后进行后处理、清洗和灭菌消毒,备术中使用。


根据影像学检查和3D打印模型对主要血管和节段动脉进行选择性栓塞以减少术中出血。依术前规划的入路方式和拟切除范围,在术中导航或3D打印个性化导板的帮助下,逐步进行肿瘤切除、一期个性化人工椎体安装以及后方椎弓根螺钉固定。
术后卧床2周,之后佩戴个性化支具下地活动。根据肿瘤病理类型对3例肉瘤患者行化学药物治疗,对1例骨巨细胞瘤患者行地舒单抗靶向治疗。
患者于术后第15天、3个月、6个月进行住院或门诊随访,评估融合效果,以研究期间发生的不良事件发生率来评价器械使用的安全性。由2名副高级以上临床医生评估融合效果,以研究期间发生的不良事件发生率来评价器械使用的安全性。
以术后6个月影像学终点为主要评价指标,观察融合有效率。分析术后6个月融合有效率,并与预设目标值比较。计算主要评价指标(术后6个月融合有效率及95%CI),如95%CI的下限大于预先设定的目标值,则认为产品的有效性满足临床要求。设定目标值为P0=70%,预估产品有效率为99%。术后6个月融合有效率=融合成功病例数/总病例数。直至随访时间终点,即术后6个月,所治疗的病患节段的内固定系统仍未取出时,符合Brantigan-Steffee的影像学融合标准中4级或5级,视为融合有效。
次要评价指标包括:(1)日本骨科协会(Japanese Orthopaedic Association,JOA)功能评分改善率,本研究JOA功能评分采用胸腰椎JOA评分,JOA评分改善率=(术后分-术前分)/(总分-术前分)×100%。分析比较JOA评分术后3、6个月较术前的变化,同时分析各访视JOA改善率的变化,参考JOA评分改善率分级[28](改善率≥75%为优、50%≤改善率<75%为良、25%≤改善率≤50%为可、改善率<25%为差)。(2)疼痛评价,采用视觉模拟评分法(visual analogue scale,VAS),分析比较术后3个月VAS较术前的变化。(3)椎体间高度,以病椎相邻椎体终板矢状位前缘距离、中线距离和后缘距离的平均值为椎体间高度,分别测量记录术前、术后第15天、术后3个月和术后6个月的CT片中椎体间高度,观察是否有高度丢失。
安全性评价以不良事件发生率为安全性评价指标。分析术中及术后不良事件及严重不良事件的发生率,记录术中及术后发生的不良事件及严重不良事件。
采用统计软件SPSS 26.0(IBM公司,美国)进行统计分析。服从正态分布的计量资料(VAS、随访时间)采用 ±s的形式表示,不同时间点的比较采用配对样本t检验;不服从正态分布的计量资料(JOA评分、椎体间高度)采用M(Q1,Q3)的形式表示,不同时间点的比较采用非参数秩和检验;计数资料(JOA评分改善率、不良事件发生率)采用频数(例,%)的形式表示。检验水准α值取双侧0.05。
±s的形式表示,不同时间点的比较采用配对样本t检验;不服从正态分布的计量资料(JOA评分、椎体间高度)采用M(Q1,Q3)的形式表示,不同时间点的比较采用非参数秩和检验;计数资料(JOA评分改善率、不良事件发生率)采用频数(例,%)的形式表示。检验水准α值取双侧0.05。
对术后6个月人工椎体融合有效率的95%CI采用Clopper-Pearson可信区间计算法,在公开统计学网页计算获得(http://vassarstats.net/index.html)。
术后随访6个月按Brantigan-Steffee的影像学融合标准判定为全部融合(图2),融合有效率为100%[95%CI(75.6%,100%)],95%CI下限大于预设目标值70%,人工椎体产品的有效性满足临床要求。
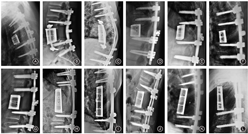

所有患者均获得随访,随访时间为(23.92±3.23)个月(范围19~29个月),所有患者期间均未出现肿瘤复发转移。
术前JOA评分为25.00(14.75,27.50)分、术后3个月为26.00(22.50,28.00)分、术后6个月为28.0(28.00,28.00)分,差异有统计学意义(χ2=6.488,P=0.039)。其中,术后3个月与术前比较差异无统计学意义(Z=-0.932,P=0.351),术后6个月与术前比较,差异有统计学意义(Z=-2.311,P=0.021)。
JOA评分术后3个月改善率为优5例、良2例、可3例、差2例,优良率58%;JOA评分术后6个月改善率为优10例、良1例,差1例。
术前VAS为(4.08±2.47)分,术后3个月降至(1.83±1.59)分,差异有统计学意义(t=2.635,P=0.023)。
术前、术后第15天、术后3个月及术后6个月椎体间高度分别为32.75(25.94,68.20)、41.09(30.55,70.20)、40.70(30.23,67.83)和40.74(30.23,67.08) mm,差异无统计学意义(χ2=0.768,P=0.857,图3)。

12例中9例共发生30次不良事件,发生率为75%(9/12),无严重不良事件发生,无导致脱落的不良事件。不良事件主要为血液及淋巴系统疾病6例(50%),呼吸系统、胸及纵膈疾病5例(42%),各类检查4例(33%),全身性疾病及给药部位各种反应4例(33%),感染及侵染类疾病1例(8%),肝胆系统疾病1例(8%),皮肤及皮下组织类疾病1例(8%),各类神经系统疾病1例(8%)。对不良事件严重程度进行分析,轻度17例次(57%)、中度13例次(43%)、无重度,不良事件均与使用器械无关。
既往用于椎体修复重建的替代物有自体骨、同种异体骨、钛笼和组配式人工椎体等[14]。自体骨和异体骨来源受限,组配式人工椎体价格昂贵,而钛笼人工椎体因术中操作便利和良好的临床可获得性得到广泛应用。但钛网与相邻椎体的上、下终板均为点接触,应力集中容易切割终板引起钛网下沉。已有大量文献报道钛网椎体早期快速下沉是导致人工椎体重建失败的独立危险因素,可引起椎体间高度降低,甚至出现脊髓和神经根受压[15]。
本研究采用3D打印匹配式人工椎体[维度(西安)生物医疗科技有限公司]重建椎体缺损,其目的是为缺损相邻椎体提供稳定支撑,并通过界面多孔结构与上下终板形成骨性融合。该产品采用激光选区熔融的加工工艺,属于个性化植入物,是患者匹配式医疗器械,按照验证确认的工艺设计和制造,用于指定患者的个性化人工椎体。
3D打印匹配式人工椎体的优势在于:(1)与上下椎体终板解剖形态更加匹配,适配的端面接触可以提高人工椎体的即刻稳定性[16];(2)界面应力分散减少切割,防止人工椎体沉陷[17];(3)多孔结构及预留的植骨腔有利于骨长入,从而加速骨融合,获得更加持久的生物稳定性[18];(4)可较好地恢复脊柱生理曲度[19];(5)不需要术中修剪即可满足精确重建的要求。理论上,3D打印匹配式人工椎体是理想的人工椎体,较传统钛网或人工椎体有明显的优势[20]。此外,相较于已上市的标准化3D打印人工椎体,3D打印匹配式人工椎体由于采用了个性化设计,可以制备出匹配患者病损部位的人工椎体,不论从外形尺寸、重建曲度、上下界面的贴合程度等均更具优势,更好地发挥了3D打印技术的优势[21]。
3D打印人工椎体的术中精准安装是确保3D打印匹配式人工椎体疗效的前提。个性化人工椎体按照术前设计精准安放,也是该类植入物术中操作的难点所在。人工椎体安装前需对上下终板接触面进行处理,清除椎间盘组织和软骨终板,尽量避免损伤骨性终板。人工椎体后路放置时采用配套工具夹持,从椎旁间隙放入,放置过程注意避免损伤神经根和硬膜,放置后通过直视和透视进行前后、左右和旋转位置调整。理想的位置是人工椎体正、侧位透视位置居中,且上下表面与相邻椎体终板紧密贴合。其中,与相邻终板的紧密贴合往往是人工椎体术中位置调整的难点,尤其是在胸腰段和腰椎节段。后路TES时,患者俯卧且腹部悬空会导致一定程度的腰椎前凸角度增加,术中后方软组织剥离和后方附件切除会使前凸进一步增大,给人工椎体的放置与调整增加步骤与难度。此外,当病变椎体压缩需要进行脊柱矢状位矫形时,也可能遇到人工椎体调整困难。如何确保人工椎体术中正确安放,目前尚没有标准的解决方案。合理的人工椎体设计、充分的术前准备、脊柱终板间角度测量和脊柱固定棒预弯等一系列措施,可以辅助术者实现人工椎体的精准安装。未来全程可视化智能外科技术的发展,也会对术中精准操作提供指引。
本研究尽管初步验证了该患者匹配式人工椎体的有效性和安全性,但仍存在局限性:(1)由于脊柱原发肿瘤发病率低,本研究样本小,未设对照组,可能影响结果的可靠性;(2)本研究仅为6个月的短期随访,人工椎体在体是否长期安全稳定仍需进一步随访观察。
治疗性研究Ⅳ级
所有作者声明无利益冲突



























