
胃癌的手术治疗经过30余年的规范化探索,已经从早期的切除,经扩大化切除发展到现今更精确的个体化手术3.0阶段。该过程中不但有业界学者精益求精的科研精神与使命感,更得益于腹腔镜、机器人、生物工程、电子显示等技术的发展,同时提出了“微解剖”“膜解剖”“全系膜”“层面手术”等理念。上述理念也得到国内外学者的逐渐认可与重视,但不可避免在基础概念、实际操作中产生较多概念模糊、标准不统一、操作难规范等问题。笔者基于团队前期研究,联合山西医科大学基础医学院对胃癌的发生与解剖层面进行相关概念的规范探索并提出“系膜化”切除与6条系膜、8条血管筋膜缘的理念以供探讨。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
胃癌在全世界的发病率和病死率均居高不下,手术仍然是其治疗的重要方法[1, 2]。胃癌根治术经过日本临床肿瘤研究组(Japan Clinical Oncology Group,JCOG)1001、0110和9501等一系列高质量RCT论证,对于No.10、13、14v和No.16淋巴结的清扫已日趋统一[3, 4, 5, 6]。但进展期胃癌患者行D2根治术后的5年总生存率仍不尽如人意,仅为30%~45%[7]。目前关于淋巴结清扫的标准和范围仍然是业界争议的话题,D2根治术的规范化操作、针对不同人群个体化治疗的分层推荐、手术切除范围的界定、手术质量的把控等目前尚缺乏统一标准。进入21世纪以来,全世界学者针对规范化、彻底性根治胃癌开展解剖学探索,提出“膜解剖”“网膜囊切除”“全系膜切除”等概念[8, 9, 10, 11]。这些概念的提出反映前辈们孜孜不倦的追求精神,但也说明在一些细节方面的模糊。临床上任何盲目的扩大或缩小切除范围均有悖于医学的“无伤害”原则,当前业界已普遍对上述理念引起重视,因此,应对相关概念予以明确与规范。笔者基于团队前期研究,联合山西医科大学基础医学院对胃癌的发生与解剖层面进行相关概念的规范探索并提出“系膜化”切除与6条系膜、8条血管筋膜缘的理念以供探讨。
对于No.10(JCOG0110研究)、13、14v、16(JCOG 9501研究)淋巴结清扫和术中胃网膜囊保留与否(JCOG1001研究)的探索,以及关于D1和D2根治术的研究,究其根源是边界范围和适应证的选择并提出“扩大”理念,所得出的一致性结论为不建议患者均普遍行扩大淋巴结清扫,但仍有部分患者会在上述淋巴结区域发生肿瘤转移,且部分患者能通过相应区域的淋巴结清扫获益[12, 13, 14, 15]。在行业标准方面,虽然已有研究报道进展期远端胃癌No.13、14v淋巴结转移率为12%~25%,但不同版本日本《胃癌处理规约》对于是否将上述淋巴结纳入D2淋巴结清扫术仍未统一,且日本《胃癌处理规约》与《胃癌治疗指南》意见也不一致,目前暂定为D2+No.13或No.14淋巴结清扫术[16, 17, 18, 19, 20]。这说明现有的研究并未完全阐明胃淋巴结系统的分布及规律,而D1、D2、D3和“扩大”等理念也说明在探寻合理淋巴结清扫范围的道路上仅是方向越来越细,而并未从解剖学范畴这一根本理念上着手,这回答了目前临床研究的不确定性和临床操作的欠规范性。回顾JCOG系列研究不难发现不论是胃网膜囊保留与否的探索,还是淋巴结清扫范围的探讨,均是单一因素的考量且没有统一标准。因为淋巴结分站、分组是人为设定,而实际中淋巴结是成系统延续,单一清扫某一组淋巴结很难得到阳性差异,且易发生出血、肿瘤扩散、清扫不彻底等问题。该问题逐渐得到国内外学者的认识与重视,均认为除淋巴结转移外,胃周软组织微转移也是进展期胃癌的高发事件(发生率32.6%),只有保证筋膜完整前提下才能在淋巴结彻底清扫时,确保软组织微转移灶不暴露、不外泄,并逐步提出“膜解剖”“网膜囊切除”“全系膜切除”等概念[21, 22]。
基于对胃癌转移途径的新认识,目前认为肿瘤细胞可能浸润或种植在网膜囊,从而导致肿瘤转移。已有研究证实网膜囊切除可使病理学分期为pT3~4期的患者生存获益,而对于侵犯浆膜层的进展期胃癌,切除包括横结肠系膜前叶、胰前筋膜在内的整个网膜囊被认为是胃癌根治术中的关键步骤,在日本已作为常规处理施行了数十年[23]。对于未发生浆膜侵犯的胃癌患者,由于网膜囊切除可能增加胰腺损伤风险且对患者无显著获益而不被JCOG1001研究推荐[3]。我国学者也陆续提出并重视手术层面走行在固有筋膜间隙,并强调系膜的完整切除为清扫终点,而非淋巴结清扫的观点[24, 25]。该理念的提出与广泛认可是对胃癌根治术认识的又一个飞跃,但同时也发现以下概念的混淆与模糊:“全系膜”切除与“网膜囊”切除、“膜”切除等概念的关系,这些本意是促使操作更规范的概念容易引起歧义与争议。针对上述概念,笔者进行以下解剖学探索。
“膜切除”等概念的提出与临床规范化操作需建立在胚胎学和解剖学的科学基础上。从根本上理解胃与周围组织、脏器的延续、关联机制才能确保临床操作的规范化与科学性。首先需明确膜、筋膜、系膜的概念。膜是筋膜的简称,筋膜是由间质细胞、纤维细胞所组成并包裹在组织表面,由毛细血管滋养并与相邻筋膜进行连接或物质交换。而系膜指由筋膜及其包裹的脉管、神经、脂肪组织所组成的整体。
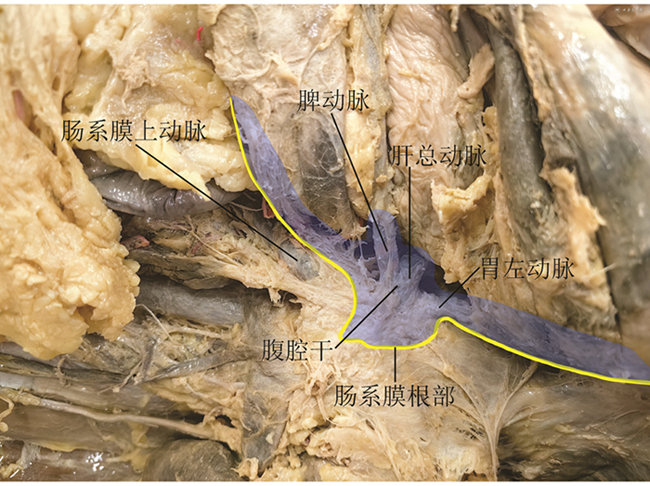
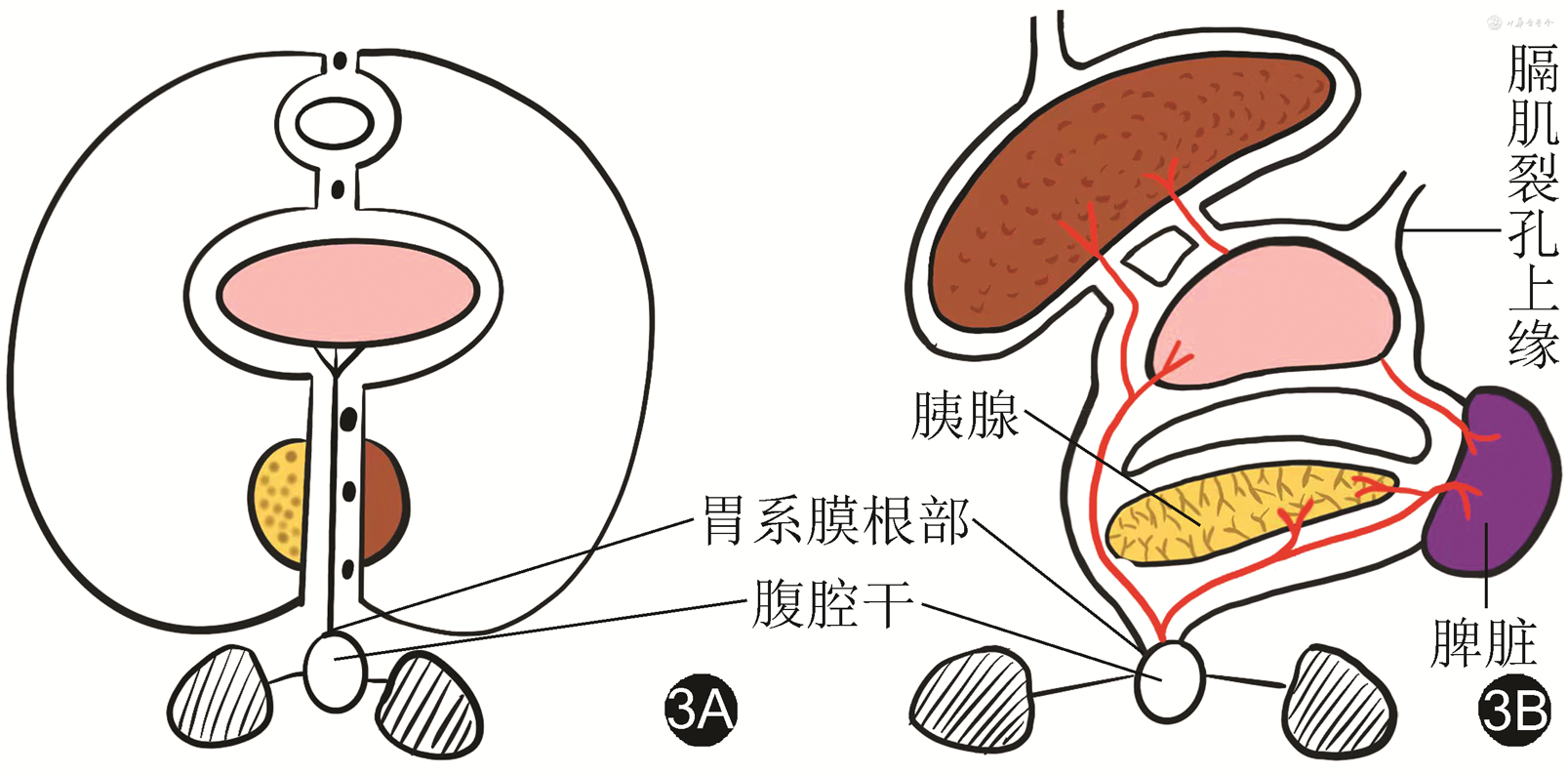
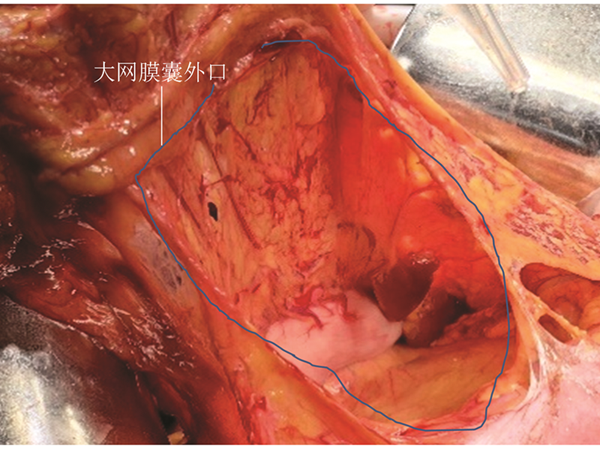
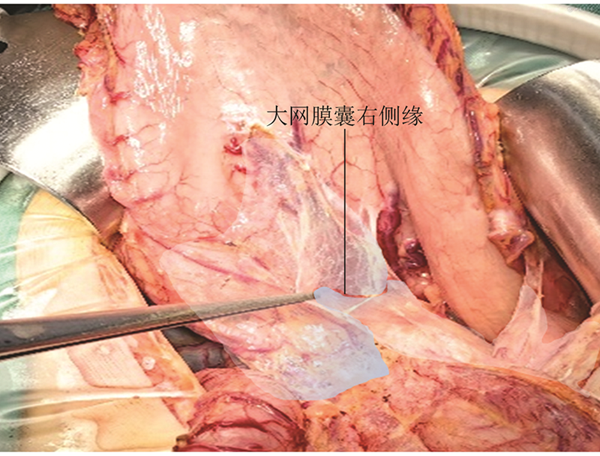
前期研究普遍将胃系膜分为腹侧系膜和背侧系膜[26, 27]。前期研究提出的理念容易引起理解的混乱甚至误解。胃的胚胎发育过程并不复杂,其系膜发生于腹腔干,上界于膈肌裂孔上缘与食管相延续、下界终止于肠系膜上动脉上缘与小肠相延续,胰腺与脾脏均位于胃系膜内[28]。见图1,2。严格意义上胃的“全系膜”切除应包括胰腺和脾脏在内的以上范围,因此,“全系膜”切除用于胃癌根治术的表述应慎重。见图3。胃系膜通过肝胃韧带和供应胰头部分血供的肠系膜上动脉相通,基于此角度将胃系膜描述为发自腹腔干并由右侧筋膜和左侧筋膜包裹的结构更确切。随着胚胎发育,胃的形态和位置发生旋转并通过脉管系统穿过筋膜与周围脏器连接。见图4。胃系膜的右侧筋膜附着于右侧膈肌角,并随肝总动脉和十二指肠向右侧旋转延续至胰腺后方,终止于腹主动脉右侧缘,肝脏的脉管穿过系膜形成肝十二指肠系膜(韧带)与胃胰相通,胃小弯侧通过副肝动脉形成肝胃系膜与肝脏相通,这就形成胃系膜右侧缘覆盖以及包裹的肝胃双管道组成的小网膜囊。胃系膜的左侧筋膜附着于左侧膈肌角,并在后腹膜前、胰腺后沿腹主动脉下行终止于肠系膜上动脉上缘,此处有胰后动脉穿出系膜使胰腺与后腹膜相通,胃系膜下极沿脾动脉包绕胰尾终止于脾脏。胃系膜的左侧筋膜在胃底侧通过胃脾脉管通路与脾脏相通。胃系膜的左侧筋膜向胃大弯侧延伸形成大网膜并黏附于横结肠系膜前筋膜,形成由腹腔干左侧缘起源,沿左膈肌脚上行至食管裂孔,向左沿脾动脉并覆盖于胰腺表面折叠成胰胃皱襞终止于脾门、向下黏附于横结肠系膜前筋膜,向右与幽门、胰头部筋膜延续所形成的大网膜囊。见图5,6。
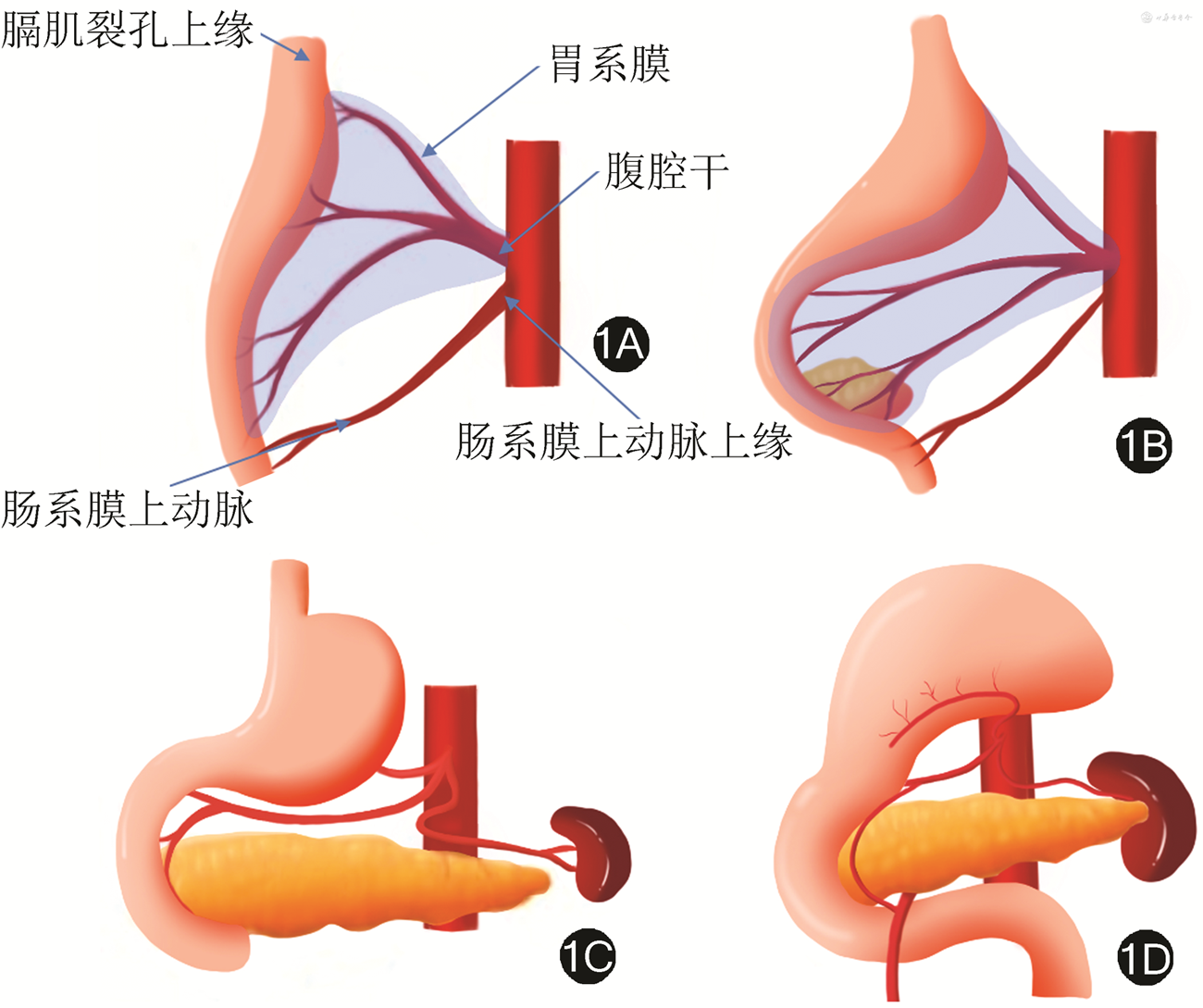



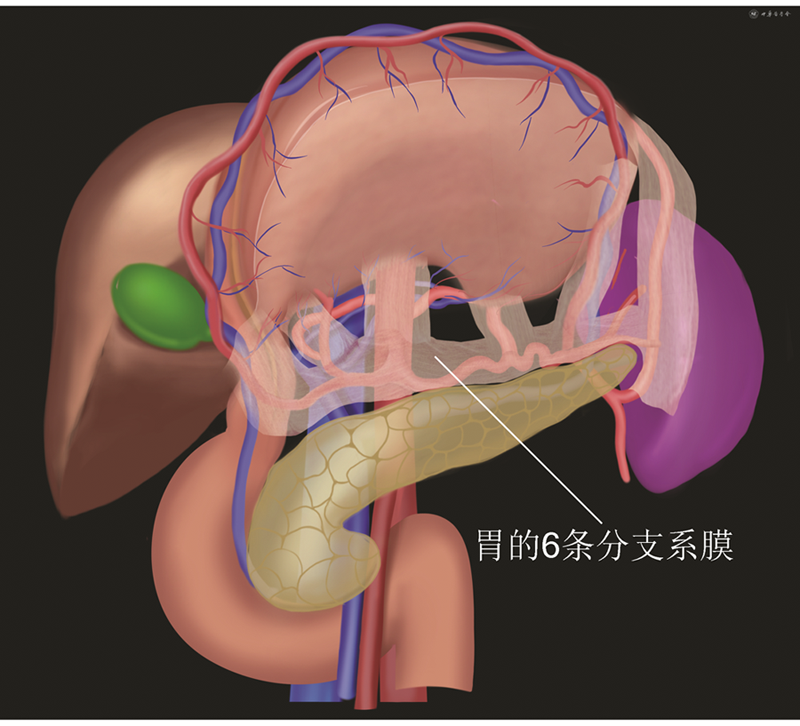



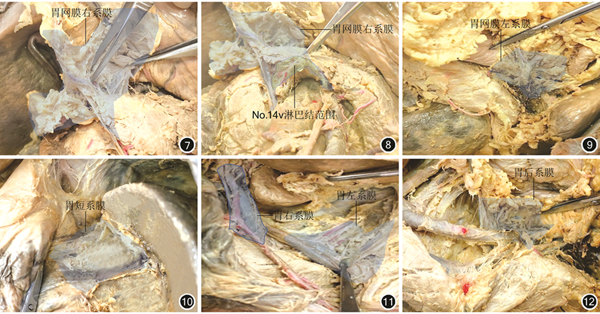
基于上述组织胚胎学基础,胃系膜由左右侧筋膜向外延伸、旋转,从“树干”呈放射状形成6条分支系膜通道与周围组织进行连接与物质交换。见图1,3,4。这包括:(1)胃网膜右系膜(No.14v淋巴结只是其中淋巴结分支网络的1支)。见图7,8。(2)胃网膜左系膜(No.4b、10淋巴结是其膜包裹的边界范围)。见图9。(3)胃短系膜。见图10。(4)肝胃系膜,包括胃右系膜。见图11。(5)胃左系膜。见图11。(6)胃后系膜。见图12。

上述6条系膜分别包绕形成小网膜囊和大网膜囊2个囊腔,至此,围绕根治胃癌的一系列淋巴结清扫分组研究(包括No.10、13、14v、16淋巴结)的成败机理就能够解释清楚了。胃淋巴结系统沿胃系膜各分支分布,而上述存在争议的淋巴结只是胃淋巴结树状分布系统的末端“枝叶”,因此,单独摘除某一个“枝叶”不但不会改善患者预后,还有可能导致系膜的整体被破坏而引起出血、肿瘤扩散等风险,这也是为何越来越多的学者重视膜层次的临床操作。“系膜化”切除就是根据切除范围的需要,沿各系膜的外侧筋膜缘剥离筋膜间隙。这不但能完整清除胃淋巴结系统,还能更清晰、容易地显露走行于筋膜间隙的脉管通路,从而进行游离、切断,由此既能提高手术的根治率,又能降低副损伤和并发症发生率。
目前临床上针对胃癌根治术中争议较大的问题主要集中于3个方面:(1)对于需行胃癌根治术的较早期胃癌患者,区段或局部切除是否可行。(2)切除范围如何确定。(3)如何清扫淋巴结。上述JCOG9501研究虽未能证实常规行No.16淋巴结的必要性,但却得出分期较早的胃癌可以通过行扩大淋巴结清扫术获益,这也在日本的早期临床研究中得以证实[29]。Naffouje和Salti[30]对美国国家癌症数据库4万多例胃癌患者的临床资料分析发现:现行的标准为术中清扫15枚淋巴结,这仅有助于判断肿瘤分期,而对于清扫>25枚淋巴结的胃癌患者,其长期生存显著获益。因此,即使对于分期较早的胃癌,行“系膜化”切除仍然有必要。鉴于此,日本胃癌学会和AJCC均将No.1~12和No.14v淋巴结定义为区域淋巴结[31, 32]。明确胃系膜的组织胚胎学和解剖学理论以及研究基础后,在实际操作中也只有保证筋膜的完整,从而行“系膜化”切除才能确保淋巴结清扫数目的最大化。因此,上述存在争议的3个问题就合并为1个问题:各分支系膜范围的确定与手术标志的统一。
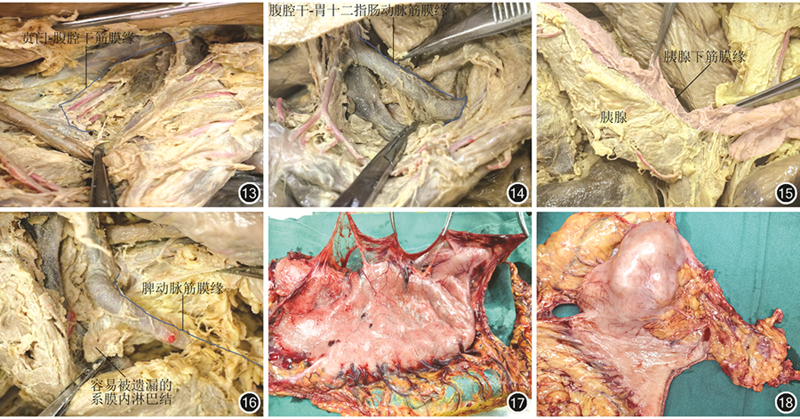
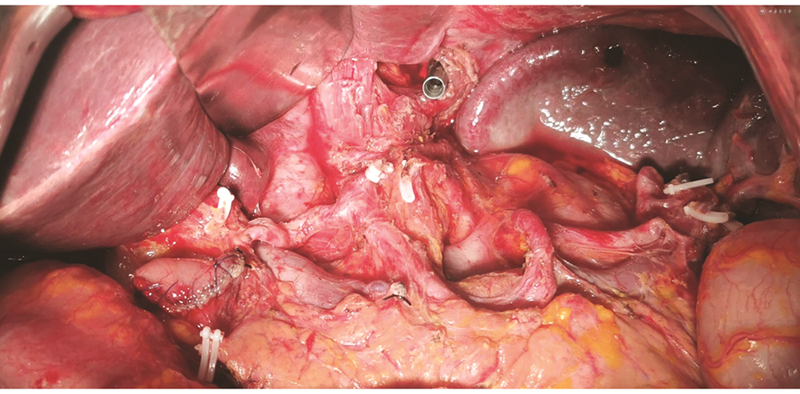
为提高辨识度,笔者针对6条分支系膜的“系膜化”切除引入8条血管筋膜缘,其分别为覆盖8条主要血管并发生转折的筋膜标志线。脉管、脂肪、淋巴结等组织沿这些筋膜线附着、包绕与生长。通过对这8条血管筋膜缘的剥离、清扫,就像从“树枝主干”的根部进行离断,这有助于“系膜化”切除的彻底和手术操作的统一规范。8条血管筋膜缘从右到左分别为:(1)贲门-腹腔干右侧基底筋膜缘。见图13。腹腔干基底部仍有脉管系统沿此缘回流至门静脉,这也是临床操作中经常忽略的部位,因此,大部分的手术操作平面仅限于胃左动脉根部是不够的。(2)腹腔干-胃十二指肠动脉筋膜缘。此缘沿肝总动脉分布。见图14。此筋膜“枝叶”中的淋巴结时常穿插分布于门静脉与肝总动脉间或门静脉后方(No.8p淋巴结),与胆总管后方淋巴结(No.12b、13淋巴结)相延续。对于位于胃角、幽门管处分期偏晚的肿瘤,建议“系膜化”清扫这些区域淋巴结并结合Kocher手法将十二指肠左侧掀起显露胰后Treitz筋膜,这有利于完整行“系膜化切除”,且沿此间隙操作安全、可行。(3)肝脏-十二指肠动脉筋膜缘。见图14。临床操作中,常规的淋巴结清扫范围为沿肝固有动脉的前侧与左侧,常忽略门静脉前、后的淋巴结(No.12p淋巴结)。基于“系膜化”理论,这部分的淋巴结和软组织均存在肿瘤转移可能性。因此,对于位于胃角、幽门管处分期偏晚的肿瘤,建议清扫这部分淋巴结。(4)胃十二指肠动脉筋膜缘。术中显露胃十二指肠动脉已成为远端胃癌切除术的标准,但沿胰腺下缘完整剥离网膜囊右缘才能从根部显露胃网膜右动脉根部以及该筋膜所附带的脉管、淋巴结及软组织。(5)胰腺下筋膜缘。见图15。胰腺下缘常有交通支血管走行,沿该筋膜缘剥离胃系膜不仅有助于右侧No.6、14v淋巴结和左侧胃网膜左血管根部的显露,还能沿此间隙完整显露No.8a、9和No.11淋巴结。虽然剥离胰前筋膜并不会改善患者预后,但其作为网膜囊的一部分,完整剥离的意义在于对以上淋巴结的清扫[5]。(6)脾门筋膜缘。见图10。这是胃系膜的远侧终点,沿此筋膜缘可轻松、完整清除No.4和No.10淋巴结,也能完美解释国内学者的操作经验。除非肿瘤直接侵犯胰腺、脾脏,或侵犯胃脾韧带而脾脏存在肿瘤侵犯可疑等情况,则不应将联合胰腺切除作为常规处理[33, 34]。(7)脾动脉筋膜缘。见图16。沿此筋膜缘可轻松、完整游离和清扫目前常规分组中容易被忽视的淋巴结。整体筋膜切除后见图12。(8)贲门-腹腔干左侧筋膜缘。此筋膜向左、向下覆盖于Toldt筋膜上,于胰腺后终止于肠系膜上动脉上缘腹主动脉处。该范围也是经常与No.16淋巴结相混淆,临床中对于腹腔干范围内肿大的淋巴结不应归于No.16淋巴结而置之不理[35, 36]。采用以上方法行“系膜化”胃癌根治术后标本(图17,18)及手术视野(图19)。


陶凯, 张卫国, 翟刚, 等. “系膜化”切除和“膜解剖”理念在胃癌根治术中的解剖学探索[J]. 中华消化外科杂志, 2024, 23(3): 360-366. DOI: 10.3760/cma.j.cn115610-20240103-00005.
所有作者均声明不存在利益冲突



























