
原发性高草酸尿症(primary hyperoxaluria,PH)是一种罕见的常染色体隐性遗传病,部分患者就诊时已进入肾衰竭期,需接受肾脏替代治疗。该文报告1例以重度贫血、顽固性低白蛋白血症和高凝状态为临床特征的PH并维持性血液透析病例。经增加血液透析次数、加强超滤、纠正贫血、补铁、抗凝、补充白蛋白和纠正钙磷代谢紊乱等强化对症支持治疗联合硫代硫酸钠治疗后,PH患者病情显著好转。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
患者女性,50岁,因“反复肾结石24年,维持性血液透析4年,双手疼痛麻木1年”于2022年8月10日入院。患者24年前体检发现双肾结石,并分别于1998年、2008年和2018年3次接受“双肾结石摘除术”治疗。4年前查血肌酐进行性升高至700 μmol/L,基因测序分析示“AGXT基因突变[NM-000030;exon8;c.815-816insG(p.S275Rfs*38);纯合突变]”,诊断为“原发性高草酸尿症(primary hyperoxaluria,PH)1型”。后建立左前臂动静脉内瘘,接受每周3次规律血液透析治疗。1年前出现双手疼痛麻木,以双食指为主,伴有双足跟疼痛。近6个月来因反复血栓形成动静脉内瘘功能不良,血清白蛋白波动在25~27 g/L,D-二聚体波动在17 130~21 250 μg/L(正常参考值< 500 μg/L)。低分子量肝素钠(依诺肝素钠)6 000 IU(透析日)或4 000 IU(非透析日)静脉滴注;利伐沙班片10 mg每周3次口服;人血白蛋白10 g,每周3次静脉滴注;骨化三醇软胶囊0.25 μg,每天1次口服;罗沙司他120 mg,每周3次口服治疗。患者1年来体重下降5 kg,无尿。既往有血脂异常病史10年;胆囊结石病史1年;房间隔缺损病史,未治疗;否认糖尿病、高血压、脑梗死等慢性疾病史;否认肝炎、结核等传染病病史;1998年及2008年接受肾结石开放取石术,2018年接受微创肾结石取石术,结石成分分析结果示草酸盐结石。父母非近亲婚配,否认遗传病家族史。
入院查体:体温36.2 ℃,脉搏100次/min,呼吸20次/min,血压83/54 mmHg,体重指数18.9 kg/m2。神志清,精神萎靡,贫血貌,消瘦,查体合作。左腕部可见一长约6 cm陈旧性手术疤痕,愈合良好。左肘部可见一长约6 cm陈旧性手术疤痕,可闻及血管杂音,可触及震颤。浅表淋巴结未触及,颜面无水肿。心肺腹查体未见明显异常,双下肢轻度凹陷性水肿。四肢关节活动受限,双手食指压痛,双下肢肌力、肌张力正常,病理反射未引出。
实验室检查:血红蛋白65 g/L,血白细胞5.5×109/L,血小板129×109/L;粪隐血阴性;纤维蛋白(原)降解产物24.10 mg/L,D-二聚体7 394 μg/L;血钙2.08 mmol/L,血磷1.62 mmol/L,总蛋白42.6 g/L,前白蛋白208.2 mg/L,血清白蛋白25.6 g/L,乳酸脱氢酶285 U/L,尿素氮31 mmol/L,肌酐713 μmol/L,尿酸367 μmol/L,三酰甘油3.79 mmol/L,总胆固醇3.43 mmol/L;心肌损伤指标:肌钙蛋白I 0.163 μg/L,B型钠尿肽524 ng/L;甲状旁腺素197.21 ng/L;贫血筛查:铁蛋白29.68 μg/L,铁5.1 μmol/L,不饱和铁51.5 μmol/L,转铁蛋白饱和度9.0%;25羟维生素D 6.27 μg/L;体液免疫特定蛋白检测:IgG 4.27 g/L,补体C3 0.7 g/L;12项细胞因子检查:白细胞介素6 18.74 ng/L,白细胞介素8 51.04 ng/L;病毒8项、女性肿瘤标志物筛查均未见明显异常;透析充分性指标:尿素清除指数1.5,尿素清除率72.6%。
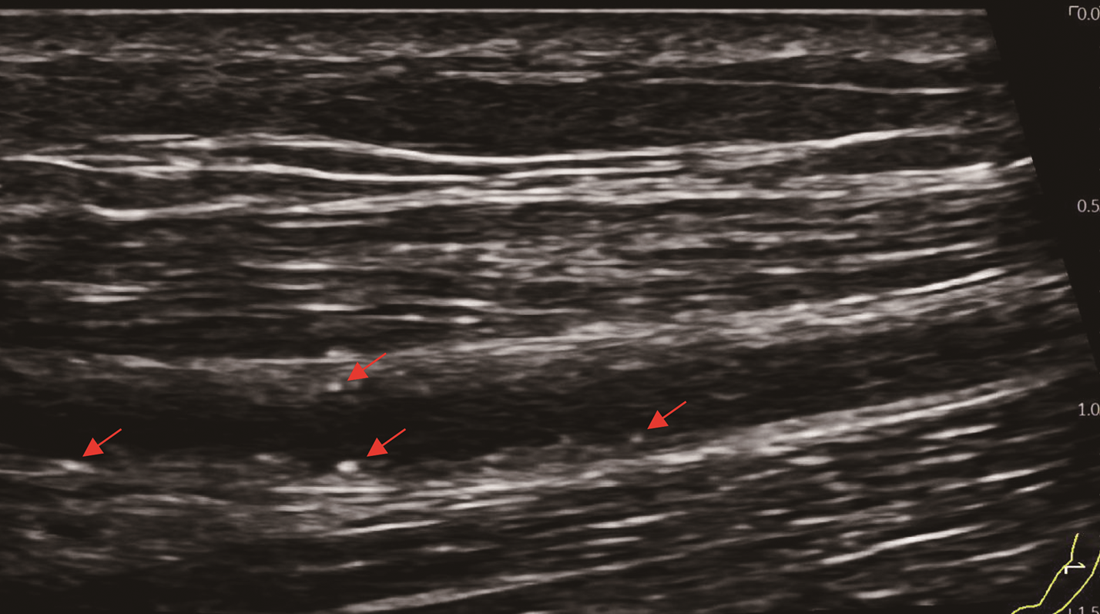
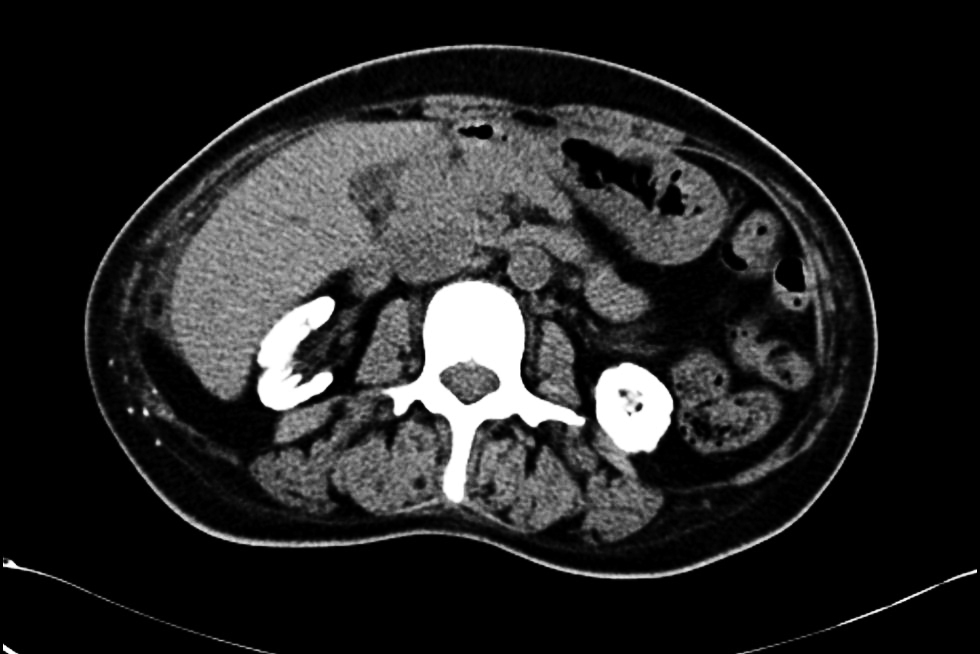
辅助检查:心电图检查示窦性心律,室性早搏。血管彩超见右上肢动脉中内膜点状钙化斑形成,左上肢动静脉内瘘血管中内膜点状钙化斑形成(图1)。双下肢和双手X线检查:双手诸骨骨质密度不均匀增高,部分远节指骨骨质吸收(图2),右手指骨周围见血管钙化影和结节状高密度影,诸小关节在位,关节间隙尚可,周围软组织未见明显肿胀;双髋关节在位,髋关节间隙变窄,双侧股骨骨质密度增高。双膝、双踝关节,双足诸小关节在位,关节间隙尚可,双膝、双踝、双足关节面下骨质密度不均匀增高(图2)。心脏彩超检查:双心房扩大,二尖瓣环钙化,二尖瓣轻度反流,三尖瓣轻-中度反流和卵圆孔未闭(房水平左向右分流)。胸腹部计算机体层成像(CT)平扫:(1)双肾萎缩钙化;(2)全身广泛骨质密度增高;(3)脾脏饱满,动脉粥样硬化。与2021年5月21日胸部X线片比较,胸廓诸骨骨质密度增高稍有进展(图3)。骨髓涂片检查:骨髓细胞增生减低,中性粒细胞系占68.0%,以分叶核细胞为主,嗜酸细胞可见;红细胞系占1.2%,成熟红细胞大小不均,部分细胞中心淡染区扩大;淋巴细胞比例增高;未见巨核细胞,血小板散在。骨髓病理检查结果:骨髓部分组织破碎,伴纤维组织增生,增生程度无法明确判断,骨髓小梁结构紊乱伴髓腔变形,部分小梁硬化,髓腔内见多量结晶样物沉积,有少量偏成熟粒细胞散在分布,未见红系和巨核系(图4A),偏振光镜下可见特征性双折射(图4B)。

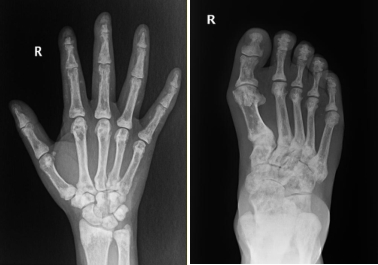

注:患者双手和双足骨质密度不均匀增高,双手部分远节指骨骨质吸收

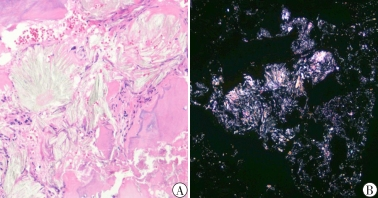

注:A:骨髓部分组织伴纤维组织增生,骨髓小梁结构紊乱伴髓腔变形,部分小梁硬化,髓腔内见多量结晶样物沉积(PAS染色 ×200);B:偏振光镜下可见大量双折光晶体物质沉积(×200)
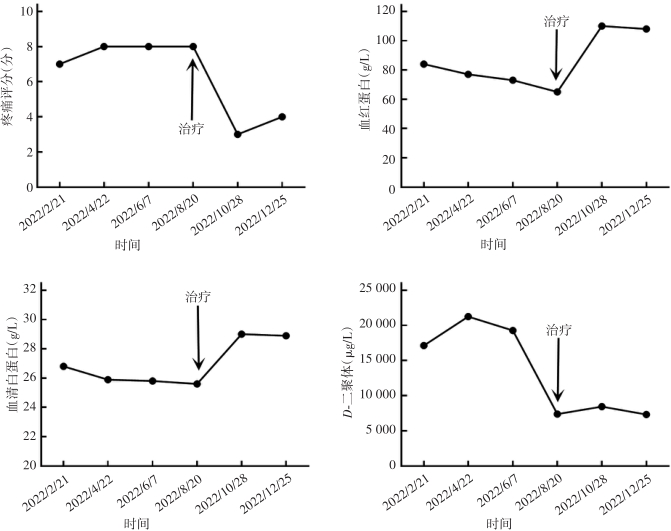
治疗上予以增加血液透析次数,由3次/周增至4次/周;加强超滤;纠正贫血、补铁;抗凝;补充白蛋白;纠正钙磷代谢紊乱,以及予3个疗程的硫代硫酸钠治疗(分别为2022/8/15至2022/8/22、2022/9/14至2022/9/26、2022/10/16至2022/10/26,3.2 g/d,静脉滴注)。治疗后患者双手疼痛麻木症状较前好转,乏力、精神萎靡和贫血貌较前明显改善,2022年10月28日复查结果:血红蛋白110 g/L,血清白蛋白29.0 g/L,D-二聚体8 454 μg/L,铁蛋白715.7 μg/L(图5)。

PH是一种罕见的常染色体隐性遗传病,因乙醛酸盐和草酸盐代谢缺陷草酸盐生成过多而致病,主要临床表现是反复发生的泌尿系结石、进行性加重的肾钙质沉积症及系统性草酸累积症[1, 2]。PH早期受累器官主要是肾脏,表现为反复发生的泌尿系结石和肾钙质沉积症,引起肾功能进行性降低。当肾小球滤过率降至40 ml·min-1·(1.73 m2)-1左右时,由于肾脏不能排除过多的草酸,血草酸盐浓度过饱和导致草酸盐在泌尿系统外组织沉积,从而引起一系统性临床表现,包括骨骼系统和骨髓(骨痛、骨钙化、骨关节畸形,累及骨髓时导致贫血)、心脏(心肌病和传导阻滞)、血管(弥漫/闭塞性血管病灶和内瘘栓塞)、神经系统(周围神经病变、单神经炎和多神经炎)以及眼睛(视网膜病变)等受累[3, 4]。
本例PH患者接受维持性血液透析治疗4年,除肾脏受累外,还伴有多系统病变,总结如下。(1)重度顽固性贫血:患者乏力明显,精神萎靡,贫血貌,在外院反复接受输血治疗,且在使用较大剂量罗沙司他情况下,血红蛋白仍波动在65 g/L左右。患者粪便潜血阴性,可排除消化道出血,结合病史、骨髓活检以及硫代硫酸钠经验性治疗效果,证实草酸盐结晶骨髓沉积是骨髓造血受损的主要病因。既往也有文献报道重度顽固性贫血是PH患者特征性表现之一。需要注意的是,本例患者以贫血为主要表现,白细胞和血小板计数正常,这与既往报道的全血细胞减少存在差异[5, 6]。经文献检索发现,本例患者骨髓组织草酸盐结晶的病理表现是目前已报道病例中最具有特征性改变的病例。(2)骨痛、骨关节畸形和骨质密度增高:患者主诉双手疼痛麻木,伴有双足跟疼痛,四肢关节活动受限。结合其胸腹部CT表现为全身广泛骨质密度增高,以及X线检查示双手诸骨骨质密度不均匀增高,部分远节指骨骨质吸收;髋关节间隙变窄;双侧股骨骨质密度增高;双膝、双踝、双足关节面下骨质密度不均匀增高,提示草酸盐沉积于骨导致骨钙化,而非一般性肾性骨病,后者常以骨质疏松、骨软化、纤维囊性骨炎及病理性骨折为特征。由于PH的罕见性和缺乏大样本的系统研究,PH骨损害的流行病学特征目前仍不清楚。值得注意的是,即使在未出现临床症状时,部分患者已出现明显骨损害影像学改变[7]。我们既往报告的1例PH 1型患者也是以骨质密度增高、骨组织破坏、骨结构紊乱,草酸钙沉积骨及骨周组织改变为临床特征[3],与本例相似。因此,早期的骨骼系统筛查可能对PH诊疗有着重要价值。(3)心脏病变:虽然目前尚无草酸盐沉积于心脏的直接证据,但本例患者血压较前显著降低,波动在80~83/54~50 mmHg,肌钙蛋白I升高;心脏彩超检查示双心房扩大、二尖瓣环钙化。心脏病变受到多种因素的影响,本例患者除考虑贫血外,还可能与草酸盐沉积于心脏组织有关。既往也有草酸盐沉积于心脏组织的文献报道[8]。(4)血管钙化:草酸盐沉积于血管是PH患者发生血管钙化的重要发病机制[9]。本例患者血管彩超结果示左右上肢动脉中内膜点状钙化斑形成;胸腹部CT亦可见较广泛血管钙化;X线检查示右手指骨周围见血管钙化影。目前,草酸盐沉积于血管的选择性仍不明确。研究显示,皮肤微血管功能障碍可作为PH 1型患者心血管损害的早期标志物[10],提示草酸盐较易沉积于微小血管。(5)低白蛋白血症:本例患者体重指数、血脂正常,透析充分性良好,自诉饮食合理,每次透析使用人血白蛋白10 g,但仍表现为顽固性低白蛋白血症,这与既往文献报道并不完全一致[11, 12],且与PH分型无关[13]。目前,PH患者发生低白蛋白血症的病因不清楚,考虑到PH是以肝脏特异性基因突变导致草酸盐产生过多为临床特征,肝脏基因突变间接引起的肝脏白蛋白合成异常可能是顽固性低白蛋白血症的原因。(6)高凝状态:本例患者平素使用大剂量抗凝药物。即使在高强度抗凝情况下,透析器中仍可见血栓形成。同时,近6个月来反复因动静脉内瘘血栓形成而导致动静脉内瘘功能不良,血D-二聚体多次较正常值升高10多倍,纤维蛋白(原)降解产物升高数倍,表明本例患者存在高凝状态和纤溶亢进。经文献检索发现,本例为PH合并高凝状态的首次报道,其发生机制仍不清楚,推测可能与转氨酶相关基因突变导致凝血因子和纤溶蛋白合成异常及草酸盐沉积引起内皮损伤有关[14]。既往有个案报道显示,肝移植能够治愈合并血栓形成倾向的PH 1型患者[15]。
在治疗措施上,除予以增加血液透析次数、加强超滤、纠正贫血、补铁、抗凝、补充白蛋白和纠正钙磷代谢紊乱等常规治疗措施外,经过医院药事委员会和伦理委员会批准,我们还予硫代硫酸钠超说明书用药治疗。治疗方案是我们通过对国内外诊治经验加以系统调研及总结,根据种族差异适当进行了药物减量,由此确定的“中大方案”[16],即从小剂量开始用药,通常以3.2 g/d为起始剂量,逐渐增加剂量(≤6.4 g/d),当出现轻微不良反应时即撤退至前1天最高耐受剂量,用100~250 ml生理氯化钠溶液溶解后静脉滴注,每天1次,2周为1个疗程,推荐每1~2个月进行一疗程治疗。硫代硫酸钠能够与钙离子结合,形成具有高溶解度的硫代硫酸钙,因此可以减轻血管钙化。最新的Meta分析研究亦显示,硫代硫酸钠治疗可延缓维持性血液透析患者血管钙化,包括冠状动脉和髂动脉[17]。我们既往在硫代硫酸钠治疗钙化防御或转移性钙化的临床研究中发现,该药具有显著的抗血管和组织钙化作用,其作用机制与抗氧化应激、抑制炎性反应、舒张血管、保护内皮细胞、抗炎镇痛和上调钙化抑制因子等作用有关[18, 19]。此外,考虑到硫代硫酸钠的药理学作用,尽管缺少直接的证据,我们推测其亦有一定程度改善高凝状态的作用。
总之,PH临床罕见,临床表现差异性大,常累及除肾脏以外的其他重要脏器或系统。临床医师应加强对PH的认识,早诊断,早治疗。我们报道和总结了1例以重度贫血、顽固性低白蛋白血症和高凝状态为临床特征的PH患者,为理解该疾病提供了新的临床经验。
李作林, 王彬, 杨艳, 等. 以重度贫血、顽固性低白蛋白血症和高凝状态为临床特征的原发性高草酸尿症1例[J]. 中华肾脏病杂志, 2024, 40(4): 305-309. DOI: 10.3760/cma.j.cn441217-20230629-00650.
所有作者声明不存在利益冲突



























