
肺癌仍然是全球癌症的主要死因之一,造成了严重的疾病负担。烟草暴露是肺癌主要的危险因素,20世纪60年代以来,全球逐步对烟草暴露采取控制措施,人群中烟草暴露水平也随之降低,全球肺癌的流行特征可能也随之发生变化。本研究通过全球肿瘤登记数据和相关研究报道的数据资料,分年龄、性别、地区、诊断分期、生存情况5个方面,对全球肺癌流行数据进行描述,以阐明目前全球肺癌的流行特征,为肺癌防控提供相应的科学依据,并通过癌症三级预防策略为肺癌防控提供相应的措施和建议。分析结果显示,肺癌在老年人群(≥65岁)中发病和死亡负担远高于劳动力人群(15~64岁);男性肺癌年龄标化发病率高于女性,但总体上男性肺癌年龄标化发病率呈下降趋势,而女性肺癌年龄标化发病率呈上升趋势;在人类发展指数(HDI)高和非常高的地区肺癌发病和死亡负担远高于HDI低和非常低的地区;肺癌Ⅰ期诊断率最高的国家为日本(38.6%),其相应的标化5年净生存率也最高(32.9%),中国、日本等国肺癌的生存状况有所改善,但整体肺癌的生存状况仍然不容乐观。鉴于目前肺癌的流行特征,进一步加强烟草控制措施,降低女性肺癌特异性危险因素的暴露是肺癌一级预防的主要目标。推动高危人群行低剂量计算机断层扫描筛查,降低肺癌筛查的假阳性率及推动医疗制度改革和规范化诊疗分别为肺癌二级和三级预防的主要措施。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
肺癌是癌症相关死亡的主要原因之一[1, 2],造成了严重的疾病负担[3]。据GLOBOCAN 2020估计,全球范围内肺癌新发病例约221万例,年龄标化发病率为22.4/10万;全球肺癌死亡病例约180万例,年龄标化死亡率为18.0/10万。烟草暴露是肺癌的主要危险因素,吸烟者发生肺癌的风险约为未吸烟者的10~40倍[4]。随着越来越多的科学证据证明烟草与肺癌的关系,各国陆续采取多种控烟政策以控制吸烟率的上升,自2005年《烟草控制框架公约》正式实施至今已有183个国家签署该公约[5, 6]。随着全球大部分国家逐步采取控烟政策,人群中烟草暴露情况也随之发生变化,相应的全球肺癌流行特征可能也随之发生变化。本研究通过全球肿瘤登记数据和相关研究报道的数据资料,分年龄、性别、地区、诊断分期、生存情况5个方面,对肺癌发病和死亡趋势进行描述,以阐明目前全球肺癌的流行特征,为肺癌防控提供相应的科学依据,并通过癌症三级预防策略为肺癌防控提供相应的措施和建议。
(1)年龄特征:在老年人群中肺癌疾病负担较重。据GLOBOCAN 2020估计,全球劳动力人群(15~64岁)肺癌粗发病率为16.5/10万,而全球老年人群(≥65岁)肺癌粗发病率为188.1/10万,老年人群肺癌粗发病率约为劳动力人群的11倍[7]。全球疾病负担数据(GBD)显示2019年各年龄组中肺癌发病人数呈近似正态分布,65~69岁年龄组人群肺癌新发病例数最多(约38万例),老年人群新发病例约140万例,占全部新发病例的63.7%;全球老年人群肺癌粗死亡率为162.0/10万,约为劳动力人群肺癌粗死亡率(12.1/10万)的13倍。各年龄组肺癌死亡人数也呈近似正态分布,其中70~74岁年龄组人群肺癌死亡人数最多(34万例),老年人群死亡人数为137万例,占全部肺癌死亡病例的67.0%。这些结果均表明,肺癌在老年人群中的发病和死亡负担较重。因此,随着全球人口的增长和人口老龄化持续加重,肺癌发病人数和死亡人数也将会持续增加[8, 9, 10],老年人群肺癌的发病和死亡负担将会进一步加重。不同年龄和不同性别人群肺癌发病和死亡情况见图1。
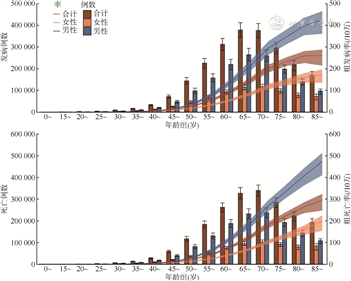

(2)性别特征:肺癌的发病和死亡具有非常明显的性别差异。2020年全球男性肺癌年龄标化发病率为31.5/10万,约为女性年龄标化发病率(14.6/10万)的2.2倍,男性肺癌年龄标化死亡率为25.9/10万,约为女性年龄标化死亡率(11.2/10万)的2.3倍[2]。不同地区男女性肺癌年龄标化发病率比(IRR)差异较大,北美地区最低(1.2),北非地区最高(5.6),男女性肺癌IRR≥3.0的地区有北非、西亚、中东欧、非洲南部地区;IRR在2.0~3.0之间的国家或地区包括中南亚、东南亚、南欧、波利尼西亚、东亚、密克罗尼西亚;IRR在1.0~2.0之间的国家或地区包括美拉尼西亚、中非、加勒比、南美、中美、西欧、西非、东非、北欧、澳大利亚和新西兰、北美地区。这提示在去除年龄结构的影响后,全球各地区依然呈现男性肺癌发病风险高于女性的现象。男女性之间肺癌发病率的差异一部分原因是吸烟率不同引起的,吸烟对男女性患肺癌的影响是相似的,一项Meta分析结果表明,从轻度吸烟、中度吸烟到重度吸烟,女性与男性发生肺癌的RR值之比分别为0.99(95%CI:0.65~1.52)、1.11(95%CI:0.75~1.64)、0.94(95%CI:0.69~1.30)[11],然而男性吸烟率远高于女性,因此男性肺癌发病率远高于女性。然而,自2010年以来,全球男性肺癌年龄标化发病率下降了7.4%,而女性肺癌年龄标化发病率却增加了0.9%[12]。随着男性肺癌发病率的快速下降,女性肺癌发病率的增加,肺癌在性别之间的发病率差异将逐步缩小。
(3)地区特征:全球各地区肺癌发病和死亡差异十分明显,这种地区间的差异很大程度上反映了吸烟模式的差异,而吸烟模式的差异又因性别和经济发展趋势而不同[4]。肺癌发病率随着人类发展指数(HDI)的升高而增加,从低水平HDI到非常高水平HDI,男性和女性肺癌年龄标化发病率分别由4.5/10万上升至41.1/10万和2.6/10万上升至20.6/10万;2020年90.0%(2 023 372/2 206 771)的肺癌新发病例和77.1%(1 630 291/1 796 144)的肺癌相关死亡病例发生在HDI高和非常高的国家[4,13]。HDI高和非常高的国家如美国、加拿大、日本、韩国、中国,其对应的肺癌年龄标化发病率分别为33.1/10万、28.9/10万、32.1/10万、25.5/10万、34.8/10万,年龄标化死亡率分别为18.9/10万、22.5/10万、14.7/10万、16.5/10万、30.2/10万;而巴西作为HDI中等国家其肺癌年龄标化发病率和年龄标化死亡率分别为14.3/10万和12.3/10万,均低于HDI高和非常高的国家。肺癌在HDI评分高和非常高的国家具有更高的年龄标化发病率和年龄标化死亡率,这可能与其吸烟率高和预期寿命长、医疗资源丰富等有关,较高的吸烟率表明肺癌高危人群较多,较长的预期寿命为肺癌发生发展提供了可能,丰富的医疗资源使得肺癌筛查和诊断率较高,因此肺癌发病率在HDI评分高和非常高的国家中较高。肺癌在HDI评分低和非常低的国家中,其年龄标化发病率和年龄标化死亡率普遍较低。这可能是因为其吸烟率较低、预期寿命较短或其他疾病的竞争风险较高、医疗保健服务的获得性较差等造成大量肺癌高危人群因肺癌以外的原因过早死亡,从而使得肺癌的发病率较低[4]。
(4)诊断分期:不同国家肺癌诊断阶段的分布存在较大差异。日本肺癌Ⅰ期诊断率最高(38.6%)[14],韩国肺癌Ⅰ期诊断率为29.8%[15],加拿大肺癌Ⅰ期诊断率为20.7%[16],美国肺癌Ⅰ期诊断率为25.3%[17],中国肺癌Ⅰ期诊断率为17.3%[17],而巴西肺癌Ⅰ期诊断率仅为8.0%[18],随着Ⅰ期诊断率的下降与之对应的各国标化5年净生存率呈下降趋势,其中日本生存率最高[32.9%(95%CI:32.3%~33.4%)],韩国为25.1%(95%CI:24.8%~25.4%),加拿大为20.6%(95%CI:20.2%~20.9%),美国为21.2%(95%CI:21.1%~21.3%),中国为19.8%(95%CI:19.4%~20.2%),而巴西仅为8.5%(95%CI:5.3%~11.6%),因此早发现、早诊断对改善肺癌的预后具有重要意义。各国肺癌早期诊断率的差异可能与各国肺癌筛查率有关,2019年日本符合肺癌筛查标准的男性筛查率为53.4%,女性为45.6%[14],而在美国符合筛查条件的761万例吸烟者中筛查率仅为2.0%[19],故较高的筛查率可能是日本肺癌早期诊断率较高的原因之一。各国筛查率的差异又与各国筛查政策、社会经济发展水平、文化程度、医疗保险的覆盖范围等有关[20, 21, 22, 23],这些因素会影响个体获取肺癌筛查或诊断的意愿和机会。如日本肺癌筛查接受率较高可能与其实施全民健康保险制度(>40岁者均可通过“公共援助”进行胸部X线检查、高危者进行痰液细胞学检查进行肺癌筛查)有关[14]。
(5)生存差异:随着肺癌诊断和治疗技术的提高使得肺癌生存率得到一定程度的改善[24],但肺癌整体生存率依然不容乐观。第三轮全球癌症生存分析CONCORD-3项目报告了2010-2014年全球60个国家或地区肺癌年龄标化5年净生存率的数据,其中,日本肺癌年龄标化5年净生存率最高(32.9%),年龄标化5年净生存率在20.0%~30.0%的国家共14个(包括美国、加拿大、韩国、中国、瑞典、瑞士等);年龄标化5年净生存率在10.0%~19.0%之间的国家共38个(包括澳大利亚、新西兰、德国、法国、新加坡等);8个国家(包括泰国、巴西、保加利亚和印度等)的年龄标化5年净生存率低于10.0%[25]。相比于1995-1999年,2000-2014年肺癌总体生存率趋势基本持平,但加拿大、美国等21个国家肺癌生存率提高了5.0%~10.0%,中国、韩国和日本的生存率提高了10.0%以上[25]。肺癌治疗手段的发展,特别是靶向治疗和免疫疗法的发展是肺癌生存率提高的主要原因。研究表明靶向治疗和免疫疗法的应用改善了转移性非小细胞肺癌患者的生存状况,美国男性非小细胞肺癌患者2年生存率从2001年的26.0%,提高到了2014年的35.0%,女性非小细胞肺癌的生存率也有相应的改善[26, 27, 28]。
目前全球范围内肺癌的早期诊断率不高,5年生存率虽然得到改善,但仍然处于较低水平,因此肺癌的控制仍应以预防为主,根据肺癌三级预防策略制定相应的措施或可应对不断增长的肺癌疾病负担。
加强烟草控制是肺癌一级预防的主要措施。英、美等国家自20世纪60年代就开始针对烟草消费采取各种控制措施,包括禁止烟草广告宣传、提高烟草税率,禁止公共场所吸烟等。相应的,自2006-2007年以来,美国男性肺癌发病率以每年2.6%、女性以每年1.1%的速度下降,因此烟草控制仍然是肺癌一级预防的主要措施[29]。此外还需警惕电子烟的流行,研究表明电子烟可能与癌症、呼吸系统、心血管系统疾病等有关[30],目前电子烟在中国的流行率相对较低,但在18~29岁人群中其流行率有增加趋势[31],建议相关部门加强对电子烟的管理和控制,制定相应的预防和控制计划。
筛查是肺癌二级预防的主要措施。现行的肺癌筛查方法主要是通过低剂量计算机断层扫描(LDCT)进行。美国和荷兰的研究结果显示,LDCT筛查可降低肺癌死亡率[32]。中国的一项研究也发现,一次性LDCT筛查可降低31%的肺癌死亡率和32%的全因死亡率[33]。因此,逐步推动LDCT筛查范围的扩大是降低肺癌死亡率的主要手段之一。但目前通过LDCT进行肺癌筛查尚存在许多问题,如筛查的依从性较差、辐射暴露过量、假阳性结果造成的侵入性损伤和对生活质量的影响、过度诊断以及筛查并发症等问题。2021年美国预防服务工作组扩大筛查资格,LDCT筛查将会产生更多的假阳性病例以及筛查并发症、过度诊断、辐射暴露增加等问题[34]。合理的筛查资格可能是解决这些问题的有效途径,因此构建和验证基于多变量的数学模型确定肺癌筛查资格进行筛查是十分有必要的。
肺癌三级预防的主要目标提高肺癌患者生存率,提高生存质量。目前随着肺癌治疗方法的发展,特别是靶向治疗和免疫治疗的发展使美国等国家肺癌生存率有所提高[28,35]。积极推进肺癌规范化诊疗,提高整体肺癌诊疗水平,对提高整体肺癌生存率有重要的推动作用。虽然肺癌诊断和治疗技术有所发展,但肺癌的总体生存情况仍然不容乐观,特别是晚期肺癌患者。因此除治疗方式以外,还需要加强对肺癌患者的人文关怀,提高肺癌患者的生活质量。
总之,随着社会发展、全球老龄化的加重和人口增加,肺癌的发病和死亡负担将会进一步加重;推动全面开展肺癌的三级预防是应对肺癌流行趋势的重要措施之一。
蔡林, 朱称心, 张兴龙, 等. 全球肺癌流行数据解读[J]. 中华流行病学杂志, 2024, 45(4): 585-590. DOI: 10.3760/cma.j.cn112338-20230920-00172.
Cai L, Zhu CX, Zhang XL, et al. Interpretation of global lung cancer statistics[J]. Chin J Epidemiol, 2024, 45(4):585-590. DOI: 10.3760/cma.j.cn112338-20230920-00172.
所有作者声明无利益冲突



























