
骨质疏松性骨折是骨质疏松最严重的并发症,是骨骼在骨质疏松病变的基础上发生的一种特殊类型的病理性骨折,具有愈合困难、再骨折风险高、致残致死率高、治疗难度大、治疗时间长的特点,且再骨折具有“级联效应”。各国指南建议,骨质疏松性骨折患者和极高危骨折风险患者应首先考虑促成骨治疗。特立帕肽是中国目前唯一已被批准应用于临床的促成骨类药物,在治疗骨质疏松性骨折时具有促进骨折愈合、降低再骨折风险、改善骨微结构等临床疗效。针对目前特立帕肽临床使用标准与规范的不足,由中国康复技术转化与发展促进会骨质疏松性骨折加速康复专业委员会、中华医学会骨质疏松和骨矿盐疾病委员会骨与关节学组以及中国医师协会骨科医师分会骨质疏松工作委员会联合组织相关学科专家起草制订本共识。本共识制订遵循改良Delphi法,形成8条循证医学推荐意见,旨在提出科学规范应用特立帕肽的方法和注意事项,强调特立帕肽应用对于骨质疏松性骨折患者治疗的重要性。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
骨质疏松症(osteoporosis)是一种以骨量丢失和骨组织微结构损坏而导致骨脆性增加、易发生骨折为特征的全身性骨骼疾病[1]。骨质疏松性骨折(osteoporotic fracture)是骨质疏松最严重的并发症,是骨骼在骨质疏松病变的基础上,受到低能量外力或日常活动时发生的骨折,是老年人群致残和致死的主要原因之一[2]。骨质疏松性骨折具有“级联效应(cascade effect)”,即首次骨折发生后,易再次或多次发生新的骨折,对患者的危害极大[3]。骨质疏松性骨折不同于普通创伤性骨折,临床治疗难度大、预后差,主要包括:(1)病理性骨折,多为粉碎性骨折,复位及固定困难;(2)骨折修复能力差,愈合时间长;(3)手术内植物稳定性不佳,易松动或移位;(4)再骨折的“级联效应”[2]。
骨质疏松性骨折治疗有其特殊性和重要性,当骨折发生后首先选用促骨形成类药物治疗,即“成骨先行”,是近年来多国骨质疏松诊疗指南中提出的新观念。特立帕肽(teriparatide)是通过基因重组技术获得的人内源性甲状旁腺激素的活性片段[rhPTH(1-34)],是中国目前唯一已应用于临床的促骨形成类药物[4, 5, 6]。特立帕肽可诱导成骨细胞活性,增加新骨形成[7],在治疗骨质疏松性骨折时,具有降低再骨折风险、促进骨折愈合、减少术后并发症、缓解疼痛、改善骨微结构等作用。尤其适用于抗破骨细胞类药物治疗无效或出现不良反应的患者。
合理应用特立帕肽对于骨质疏松性骨折患者的治疗有重要的促进作用。为进一步规范骨质疏松性骨折后特立帕肽的临床应用,中国康复技术转化与发展促进会骨质疏松性骨折加速康复专业委员会,联合中华医学会骨质疏松和骨矿盐疾病委员会骨与关节学组、中国医师协会骨科医师分会骨质疏松工作委员会,针对特立帕肽在骨质疏松性骨折治疗中的作用,结合国内外最新临床研究进展,遵循科学性和实用性的原则,共同讨论制订本共识。本共识仅针对已发生骨质疏松性骨折的患者。
本共识由中国康复技术转化与发展促进会骨质疏松性骨折加速康复专业委员会,中华医学会骨质疏松和骨矿盐疾病委员会骨与关节学组,中国医师协会骨科医师分会骨质疏松工作委员会组织国内各位专家共同制订。
本共识的制订遵循改良Delphi法,共识形成过程主要包括:拟定咨询条目及提纲、确定专家组成员、多次函询及条目修订。本共识工作组通过临床问题的第一轮开放性调查共收集专家组共计14个临床问题,形成共识初稿,专家团队围绕共识初稿进行面对面第一轮讨论,提出修改意见,工作组根据意见修改形成第二稿,得到10个临床问题。接下来针对此10个问题进行第二轮讨论,即对问题相对于临床的重要性进行评估,形成第三稿。编审专家再围绕重要临床问题及推荐意见删减和综合,最终确定了纳入本共识的8个临床问题推荐。本共识已在国际实践指南注册与透明化平台(www.guidelines-registry.cn,PREPARE-2024CN266)注册。
证据检索则由共识起草小组针对纳入的临床问题,收集、评估相关的循证医学证据。英文检索平台为 PubMed、Web of Science以及Cochrane Library;中文检索数据库包括:中国知网、万方数据库、中国科技期刊数据库。中英文数据库均检索自建库到2023年6月30日发表的文献。主要检索词包括“osteoporosis”“osteoporotic fracture”“osteoblast”“anabolic”“bone healing”“teriparatide”“parathyroid hormone”以及“特立帕肽”“骨质疏松”“骨质疏松性骨折”“再骨折”“骨折愈合”等。纳入的参考文献类型包括临床实践指南、专家共识、综述、荟萃分析、临床研究以及病例报道。最终纳入文献68篇,对文献进行精读,依据循证医学PICOS原则(P为研究对象,I为干预措施,C为对照措施,O为结局,S为研究类型)提取信息。共识证据等级及推荐等级如表1。
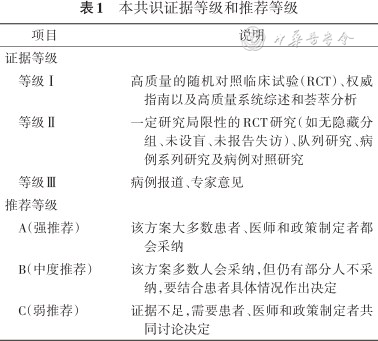
本共识证据等级和推荐等级
本共识证据等级和推荐等级
| 项目 | 说明 |
|---|---|
| 证据等级 | |
| 等级Ⅰ | 高质量的随机对照临床试验(RCT)、权威指南以及高质量系统综述和荟萃分析 |
| 等级Ⅱ | 一定研究局限性的RCT研究(如无隐藏分组、未设盲、未报告失访)、队列研究、病例系列研究及病例对照研究 |
| 等级Ⅲ | 病例报道、专家意见 |
| 推荐等级 | |
| A(强推荐) | 该方案大多数患者、医师和政策制定者都会采纳 |
| B(中度推荐) | 该方案多数人会采纳,但仍有部分人不采纳,要结合患者具体情况作出决定 |
| C(弱推荐) | 证据不足,需要患者、医师和政策制定者共同讨论决定 |
推荐意见1:对于新近(24个月内)发生脆性骨折、骨质疏松多发性骨折、抗骨质疏松治疗期间仍发生骨折、骨密度(BMD)极低的骨质疏松性骨折(T值<-3.0)等极高骨折风险患者;老年低骨转换型骨质疏松性骨折患者,初始治疗推荐应用特立帕肽治疗。(强推荐,证据等级Ⅰ级)
证据概述:2017年,Imminent Risk of Fracture after Fracture临床研究发布[8],揭示了首次脆性骨折后2年内存在“迫在眉睫的骨折风险(imminent risk)”,并强调此时期是抗骨质疏松治疗的关键时期。2019年欧洲骨质疏松骨折风险管理共识提出“按照骨折风险分层选择抗骨质疏松治疗药物”治疗理念受到临床的广泛认可[9]。2020年夏维波教授也将相关观念引入国内,并建议:在治疗极高骨折风险患者时,与抗骨吸收治疗相比,应优先选用骨形成促进药物,因为其降低骨折的风险作用更强,起效更快[10]。
2020年美国《AACE/ACE绝经后骨质疏松症诊断和治疗指南-2020更新》[11]、2022年中华医学会骨科学分会《骨质疏松性骨折诊疗指南》[12]、2022年中华医学会骨质疏松和骨矿盐疾病分会《原发性骨质疏松症诊疗指南(2022)》[13]、2023年美国医师学会(ACP)《原发性骨质疏松症与低骨量人群药物治疗临床指南》[14]等骨质疏松领域各大权威指南均推荐特立帕肽为极高骨折风险患者的一线治疗药物。
2018年《骨质疏松性椎体压缩性骨折患者抗骨质疏松规范治疗专家共识》指出特立帕肽临床主要用于低骨转换型及绝经后严重骨质疏松症的治疗[15]。
特立帕肽的关键性研究(FPT研究)纳入了1 637例绝经后女性(平均年龄69.5岁)[16],90%的患者在基线时有一处或多处椎体骨折,平均椎体BMD的T值为-2.6。所有患者每天补充钙剂1 000 mg,补充维生素D 400 IU。结果显示特立帕肽每天20 μg治疗18个月可显著降低椎体和非椎体骨折风险(该研究使用特立帕肽最长24个月,中位期19个月)。与安慰剂组相比,特立帕肽有效降低新发椎体骨折风险65%,降低中重度椎体骨折风险90%,降低非椎体骨折风险53%。经过19个月(中位期)的治疗,腰椎和全髋处BMD与安慰组相比分别升高9%和4%(P<0.001)。
一项荟萃分析纳入了69项试验(超过8万例绝经后患者),该研究结果显示:对于临床骨折而言,与安慰剂相比,主流药物均有保护作用;但与特立帕肽相比,双膦酸盐减少临床骨折的效果较差;与特立帕肽和罗莫佐单抗相比,地舒单抗减少临床骨折的效果较差[17]。
ACP的一项荟萃分析[18],纳入34项RCT研究和36项观察性研究,分析结果显示:对于极高骨折风险的绝经后女性,特立帕肽降低脆性骨折风险的疗效也优于双膦酸盐。一项多中心、随机、双盲研究(FPT研究)结果显示,特立帕肽每天20 μg治疗18个月可显著降低椎体和非椎体骨折风险,增加腰椎和全髋BMD[19]。一项多中心、随机、双盲研究(VERO研究)[20]对比了特立帕肽与利塞膦酸降低极高骨折风险患者脆性骨折的疗效,结果显示:在12和24个月时,特立帕肽组对比利塞膦酸组能显著降低新发椎体骨折。
在髋部骨折中,早期特立帕肽治疗的研究数据相对不足。主要原因在于髋部骨折相对其他部位骨折发生率相对较低,而早年特立帕肽使用有24个月时长限制,故在2年的前瞻性研究中难以观察到显著差异;考虑这个因素,FPT试验并未设置以髋部骨折为终点的研究目标,而代之以非椎体骨折分组。但随着特立帕肽应用时间增加,2021年的一篇文献综述发现,特立帕肽不仅增加了股骨近端BMD,而且降低了髋部骨折的风险[21]。
推荐意见2:骨质疏松性骨折患者在围手术期可考虑尽早应用特立帕肽治疗。(强推荐,证据等级Ⅰ级)
证据概述:骨质疏松性骨折的特点之一即为骨重建异常、骨折愈合过程缓慢、恢复时间长、易发生骨折延迟愈合甚至不愈合。这表明骨质疏松症患者本身的骨折愈合速度就可能低于非骨质疏松症患者[12],对骨质疏松性骨折患者尽早进行抗骨质疏松治疗是缩短其恢复时间的重要手段[22]。
中华医学会骨科学分会骨质疏松性骨折诊疗指南(2022年版)建议:骨质疏松性骨折发生前已使用抗骨质疏松药物者,应重新评估骨质疏松状况,不建议盲目停药;未使用抗骨质疏松药物者,应在骨折处理后,患者全身情况稳定时,尽早使用抗骨质疏松药物治疗[12]。早期基础研究和动物实验结果提示:骨折后即刻应用特立帕肽可促进断端骨形成,改善骨痂机械强度[23, 24]。
一项荟萃分析纳入了16篇关于甲状旁腺激素及其类似物[绝大多数为特立帕肽[25],部分为PTH(1-84)]用于人体骨折愈合的文献,其中有2例患者是在急性期(即骨折后2周内)给予治疗以促进骨折愈合,有14例是因骨折延迟愈合或不愈合而开始治疗,这些病例在1~3个月时间内出现了骨痂形成、骨折间隙减少影像数据;在5~21个月后临床疼痛消失并最终骨折愈合。
在其他的临床研究中,无论是骨折术后1、2 d还是10 d内对患者应用特立帕肽,均观察到相较于对照组更好的临床结局。这些结局包括愈合时间的缩短和骨形成标志物的快速提升[26, 27, 28]。
推荐意见3:骨质疏松性骨折患者,早期使用特立帕肽治疗,可有效缓解疼痛,提高骨折后患者活动能力。(强推荐,证据等级Ⅱ级)
证据概述:骨质疏松性骨折患者骨折治疗后因疼痛、制动等情况会导致局部或全身活动减少,而活动减少又会导致急性骨量丢失、废用性肌萎缩和关节强直等运动系统不良后果[29],这些不良后果可直接导致生活质量降低[30],甚至影响到患者心理健康状况[13]。一项多中心、观察性研究(EFOS研究)[31]采用100 mm疼痛视觉模拟评分(VAS评分)和问卷形式,对1 581例患者进行背痛评估,结果显示,在接受特立帕肽治疗的18个月期间,VAS评分显著下降,停药后的18个月依然持续下降;随访36个月后,校正的VAS评分显著低于基线值。此外,另一项ExFOS研究[32]显示,接受特立帕肽治疗者在用药3个月时背痛VAS评分显著下降,在用药24个月持续下降,在停药后18个月期间保持下降趋势。同时,该研究对患者的健康状况进行了调查,患者在每次就诊时使用欧洲生命质量五维度量表(EQ-5D)问卷进行自评,结果显示,从用药第3个月开始,患者健康状况评分已显著提升,整个用药期间健康状况评分持续提升(与基线相比,P<0.000 1),且在停药的18个月内保持上升趋势。上述研究显示,特立帕肽不但有效缓解骨质疏松相关疼痛,对患者行动能力、健康状况也有显著疗效。
推荐意见4:特立帕肽对骨微结构的改善优于抗骨吸收药物,骨质疏松性骨折患者应用特立帕肽进行治疗,可在提高BMD、降低骨折风险的同时改善患者骨微结构,提高骨质量。(强推荐,证据等级Ⅱ级)
证据概述:动物实验已证实特立帕肽能够有效促进骨折修复,显著增强骨折后骨痂力学特性,改善骨植入物稳定性和加速骨折愈合[33, 34, 35, 36]。目前已有多项研究证实特立帕肽在改善骨微结构及骨质量方面具有一定的作用;与抗骨吸收药物不同,特立帕肽可通过刺激骨重建及一定程度骨塑建促使骨代谢正平衡,从而增加骨小梁体积和数目,改善骨小梁形态结构,增加骨皮质厚度,增加骨骼弯曲强度,改善骨微结构,提高骨质量[37, 38]。一项观察性研究(SHOTz研究)分别对接受特立帕肽和唑来膦酸治疗的患者进行骨组织形态学测定[39],用四环素标记的髂嵴活检结果显示,使用特立帕肽治疗6个月可观察到皮质骨和松质骨表面有大量类骨质形成,而唑来膦酸组没有观察到明显变化。另一项观察性研究[40],通过髂骨活检观察特立帕肽对骨微结构的影响,从免疫组化染色结果发现特立帕肽组患者的小梁骨Ⅰ型胶原较安慰剂组明显增加。
推荐意见5:新发骨质疏松性骨折患者,应用特立帕肽治疗,可以有效促进骨折愈合。(强推荐,证据等级Ⅱ级)
证据概述:由于骨质疏松性骨折的特点,相较于愈合率而言,更应该考虑愈合时间。在大多数特立帕肽的研究中,和对照组相比,愈合率并无显著性差异,但特立帕肽治疗组在愈合时间上通常更短。从细胞分子水平来看,特立帕肽可改变间充质干细胞原本的分化方向,促进其向成骨细胞定向分化,抑制其向骨髓脂肪细胞分化[41],同时促进静止的骨衬细胞向成熟成骨细胞转换,以增加体内成骨细胞总数[42]。另外,特立帕肽可通过Wnt/β-连环蛋白(Wnt/β-catenin)信号传导,增强骨膜祖细胞的增殖和分化,骨膜祖细胞通过软骨分化促进骨折骨痂的形成,也为修复过程的后期提供成骨细胞,因此最终结果同样是加速骨折修复[43]。另外,由于软骨和成骨前体细胞似乎都是PTH信号传导的靶点,而这两种细胞在骨折愈合中发挥着重要作用,因此PTH本身很可能在骨折愈合中发挥着直接作用[44]。
大量动物研究也探索了甲状旁腺激素及其类似物[绝大多数为特立帕肽,部分为PTH(1-84)]促进骨折愈合的作用和具体表现。除正常骨模型外,多项实验探索了该类药物应用于以骨折愈合受损为特征的各类动物模型,包括骨质疏松性骨折、应力性骨折和骨不连[45, 46, 47, 48]。在这些研究中观察到损伤组织矿化增加、机械强度增加,截骨间隙的早期桥接,以及萎缩性骨不连的减少。在各类动物模型中,特立帕肽对于骨折愈合的改善趋势是较为一致的,为其在促进骨折愈合中的临床作用提供了有力的支持。
2022年的一篇系统综述,回顾了截止至2022年的所有骨质疏松性椎体压缩性骨折(OVCF)相关研究,指出在OVCF群体中,对于双膦酸盐而言,目前还缺乏对骨折愈合影响的临床研究。但间歇性采用特立帕肽可显著改善脊柱融合和骨折愈合,同时降低死亡风险[49]。
一项回顾性研究,共纳入98例最近发生OVCF,且行非手术治疗的患者,分别给予特立帕肽20 μg/d治疗和阿仑膦酸70 mg/周治疗。研究显示:相较于双膦酸盐,特立帕肽可促进OVCF患者的骨折愈合,提高骨结合率[50]。
一项RCT显示,对于桡骨远端骨折的患者,特立帕肽20 μg/d治疗组愈合时间相比安慰剂组更短,但特立帕肽20 μg/d治疗与40 μg/d治疗无显著差异[28]。相应的研究结果提示了常规剂量的特立帕肽(20 μg/d)即可缩短骨折愈合时间。多项特立帕肽治疗股骨颈骨折或粗隆间骨折的研究显示,特立帕肽能够缩短骨折愈合时间,降低疼痛评分,有效改善功能性恢复,但对愈合率无影响[51]。另外一项基于RCT和观察性研究的荟萃分析提示:若仅考虑骨质疏松患者群体,特立帕肽治疗可以缩短髋部骨折愈合时间,但对愈合率无影响[52]。
一项回顾性研究,共纳入189例粗隆间骨折且行手术治疗的骨质疏松性骨折患者,研究显示特立帕肽治疗组的骨愈合时间明显较短。在生命质量量表SF-12生理总评分方面,特立帕肽治疗组在3个月时明显更好[53]。在比较3和6个月的疼痛评分、在家里走动的能力、走出家门的能力和购物的能力时,也发现了特立帕肽治疗组具有更好的临床结局。特立帕肽治疗组的并发症和死亡率也明显降低。故研究者认为术后使用特立帕肽6个月似乎是治疗骨质疏松性粗隆间骨折的有效辅助疗法。
骨折愈合是复杂的综合过程,多项风险因素会导致愈合延迟或不愈合,包括年老、骨质疏松、营养不良以及绝经,特立帕肽能够促进骨重建和骨痂成熟,进而促进骨折愈合。其独特的促进骨形成的机制,使其在骨折愈合、骨不连、应力性骨折、改善植入体固定等方面显示出作用潜力。但在特立帕肽用于临床的十余年中,也确有越来越多的证据表明,其可以作为促进骨折愈合的辅助手段,或作为治疗骨不连的一种选择,但仍需要进一步的高质量、大样本前瞻性试验验证[54]。
推荐意见6:骨质疏松性椎体骨折后行椎弓根内固定术的患者,选用特立帕肽治疗,可提高椎体骨量、改善骨质量、增加“骨/螺钉”界面把持力、降低椎弓根螺钉松动发生率。(中度推荐,证据等级Ⅱ级)
证据概述:一项回顾性研究纳入了29例65~82岁(平均72.2岁)的绝经后骨质疏松症女性[55],患者均行胸椎和(或)腰椎融合手术。根据手术前是否接受特立帕肽治疗,将患者分为2组,在特立帕肽治疗组中,患者术前接受特立帕肽日制剂或周制剂进行治疗(治疗时间平均61.4 d,最少31 d)。在手术中,测量了从T7至L5插入的212个螺钉的插入扭矩,并在2组之间进行了比较,还调查了插入扭矩与术前特立帕肽治疗时间的相关性。最终显示特立帕肽组的平均插入扭矩值明显高于对照组,但每日和每周特立帕肽组在平均插入扭矩值方面无明显差异。另一项回顾性研究纳入了84例骨质疏松症和退行性腰椎病患者[56],均接受经椎间融合术和椎弓根螺钉固定术,术后接受了特立帕肽或双膦酸盐。术后6和12个月时,用简单的放射检查来评估螺钉松动情况。该研究表明,与应用双膦酸盐相比,腰椎融合手术后立即开始应用特立帕肽治疗可以减少螺钉松动。
推荐意见7:骨质疏松性粗隆间骨折手术患者,使用特立帕肽治疗,在提高BMD、降低再次骨折风险的同时,可减少术后并发症,加速患者的康复,缩短患者在院时间。(中度推荐,证据等级Ⅱ级)
证据概述:骨质疏松患者因骨量低、骨质量差,严重影响手术效果,除术中复位、固定困难外,还有以下诸多问题:术后螺钉松动、骨折愈合缓慢、再发骨折风险高,死亡率高等[12],所以如何降低骨质疏松性骨折术后并发症是亟需解决的难题。临床回顾性研究报道,髓内钉内固定术后接受特立帕肽治疗,患者术后螺钉移位、内翻塌陷伴螺钉滑动、伤口感染、骨愈合畸形等并发症明显低于单纯手术组(P=0.028)[57]。粗隆间骨折术后使用特立帕肽,患者术后活动能力明显提高,术后并发症(伤口感染、肺炎、尿路感染、延迟愈合、不愈合等)和死亡率显著下降[53]。
推荐意见8:双膦酸盐或地舒单抗治疗骨质疏松症的患者,若发生了非典型性骨折,在治疗骨折的同时可选用特立帕肽辅助治疗。(中度推荐,证据等级Ⅱ级)
证据概述:一项观察性研究(Fix-IT)对已发生非典型股骨骨折(AFF)的妇女患者随机进行了即刻与延迟(AFF 6个月后)特立帕肽治疗;随访1年的结果表明,与延迟治疗组相比,即刻使用特立帕肽的治疗组骨折愈合情况较好,BMD下降较少;不良反应两组间无差异[58]。一项荟萃分析,回顾了67篇文献,包括31个病例报告,9项回顾性研究和3项前瞻性研究(无可纳入的RCT),结果认为尽管观察数据表明,特立帕肽可能导致手术治疗的AFF更快地愈合,但对于AFF患者来说,并无证据支持将这种治疗列为特立帕肽的适应证[59]。美国骨矿盐研究学会建议,虽然有回顾性、前瞻性的研究及个案报道证实特立帕肽可促进AFF愈合,但仍缺乏大型RCT证据。故目前仅能基于有限证据给出推荐:对于AFF保守治疗失败的患者,可以考虑使用特立帕肽治疗[60, 61]。
特立帕肽被中国国家药品监督管理局(NMPA)批准用于治疗骨折高风险的绝经后骨质疏松症,国外还批准用于治疗骨折高风险的男性骨质疏松症以及糖皮质激素性骨质疏松症(GIOP)。根据《原发性骨质疏松症诊疗指南(2022)》[13],骨质疏松症患者合并以下任意一条危险因素,均属于极高骨折风险者。危险因素包括:(1)近期发生脆性骨折(特别是24个月内发生的脆性骨折);(2)接受抗骨质疏松症药物治疗期间仍发生骨折;(3)多发性脆性骨折(包括椎体、髋部、肱骨近端或桡骨远端等);(4)正在使用可导致骨骼损害的药物如高剂量糖皮质激素(≥75 mg/d泼尼松龙超过3个月)等;(5)双能X线吸收法(DXA)测量BMD T值<-3.0;(6)高跌倒风险或伴有慢性疾病导致跌倒史;(7)骨折风险评估工具FRAX®计算未来10年主要骨质疏松骨折风险>30%或髋部骨折风险>4.5%。
对于极高骨折风险患者,指南推荐特立帕肽可作为初始治疗药物之一[13]。而骨质疏松骨折患者均应被视作极高骨折风险患者,在无禁忌证情况下,可将特立帕肽作为初始治疗,按照“成骨先行”的治疗理念,降低患者再次骨折风险。
在特立帕肽说明书中,明确了在老年患者人群中,无需根据年龄调整剂量。一项观察性研究纳入了628例接受特立帕肽20 μg/d治疗24个月的骨质疏松症患者[62]。将患者分为不同年龄亚组(老年亚组≥80 岁、较年轻亚组<80岁),以比较BMD和骨转换标志物。结果显示在各亚组之间,腰椎和股骨颈BMD增加的百分比和绝对值以及Ⅰ型前胶原N端前肽和尿Ⅰ型胶原N末端肽的变化相似。说明了特立帕肽在不同年龄患者之间疗效的相似性。
特立帕肽的禁忌证包括畸形性骨炎、骨骼疾病放射治疗史、肿瘤骨转移及合并高钙血症;严重肾功能不全;18岁以下的青少年和骨骺未闭合的青少年;对本品过敏者。
2020年11月,美国食品药品监督管理局(FDA)取消终身累计不超过24个月的治疗限制与警告[63]。国内说明书中,特立帕肽终身累计使用时间仍不能超过24个月。
对于极高危骨折风险患者,强调在评估治疗成本和临床获益的前提下,特立帕肽可考虑与唑来膦酸或地舒单抗联合治疗。唑来膦酸与特立帕肽联合治疗一年,较单药治疗显著增加腰椎和髋部BMD[64];地舒单抗与特立帕肽联合治疗一年,可增加腰椎和髋部BMD,尤其是髋部BMD[65]。但两种方案均无骨折风险降低数据,可作为短期BMD提升的酌情方案。
无论是否到达最大疗程,特立帕肽停药后应序贯治疗,序贯双膦酸盐类药物或地舒单抗治疗,均可有效增加BMD,且降低骨折风险[66, 67, 68]。
综上,骨质疏松性骨折是一种特殊类型的病理性骨折,治疗的难度大,专业性强,对于那些极高危骨折风险的骨质疏松性骨折患者,强调在常规骨折治疗的基础上,促成骨类药物的早期应用。特立帕肽的合理使用可迅速提高骨量,促进骨折愈合,防止内置物松动,预防再骨折发生,对骨质疏松性骨折的治疗有重要作用[69]。本专家共识在现有文献证据和专家经验的基础上制订,仅供医学专业人士参阅,不具有任何法律效力,本共识会根据后续相关研究的深入及证据的积累而不断更新。
本共识制订专家委员会名单
组长:林华(南京大学医学院附属鼓楼医院骨科);徐又佳(苏州大学附属第二医院骨科);刘强(山西白求恩医院骨科)
执笔专家:林华(南京大学医学院附属鼓楼医院骨科);徐又佳(苏州大学附属第二医院骨科);吕厚辰(解放军总医院骨科医学部);朱秀芬(南京大学医学院附属鼓楼医院骨科)
编审专家组成员(按姓氏汉语拼音排序):陈柏龄(中山大学附属第一医院骨科);陈剑明(宁波市第六医院骨科);陈允震(山东大学齐鲁医院骨科);纪方(第二军医大学长海医院骨科);刘宏建(郑州大学第一附属医院骨科);吕厚辰(解放军总医院骨科);刘强(山西白求恩医院骨科);沈彬(四川大学华西医院骨科);施鸿飞(南京大学医学院附属鼓楼医院骨科);司海朋(山东大学齐鲁医院骨科);宋纯理(北京大学第三医院骨科);苏佳灿(上海新华医院骨科);孙强(南京医科大学附属南京第一医院骨科);曾玉红(西安市红会医院骨质疏松科)
编写专家组成员(按姓氏汉语拼音排序):陈群(江苏省人民医院骨科);陈涛(云南省中医院骨科);陈勇(昆山市中医院骨科);陈云丰(上海第六人民医院骨科);邓雄伟(江阴市人民医院骨科);丁悦(中山大学孙逸仙纪念医院骨科);方跃(四川大学华西医院骨科);冯卫(吉林大学白求恩第一医院骨科);郭晓东(华中科技大学附属协和医院骨科);郝杰(重庆医科大学附属第一医院骨科);洪盾(浙江大学台州医院骨科);蒋伟宇(宁波第六人民医院骨科);李峰(湖北省中医院光谷院区骨科);李宁(北京积水潭医院骨科);李旭(安徽省立医院骨科);李毅中(福建医科大学附属第二医院骨科);梁伟(空军军医大学西京医院骨科);吕世桥(烟台山医院骨科);马锋(宁夏回族自治区人民医院骨科);米明珊(青海大学附属医院骨科);聂茂(重庆医科大学附属第二医院骨科);钱列(上海交通大学医学院附属仁济医院骨科);曲志伟(上海市静安区中心医院骨科);芮云峰(南京中大医院骨科);申才良(安徽医科大学第一附属医院骨科);施慧鹏(上海第六人民医院骨科);斯海波(四川大学华西医院骨科);宋滇文(上海市第一人民医院骨科);孙旭(南京大学医学院附属鼓楼医院骨科);万雷(广州中医药大学附属第三医院骨科);王鹏程(河北医科大学附属第三医院骨科);文良元(北京医院骨科);吴斗(山西省白求恩医院骨科);谢垒(绍兴第二医院骨科);徐宝山(天津医院骨科);徐三中(浙江大学附属第一医院骨科);徐新华(湖北民族学院附属民大医院骨科);杨东(南昌大学医学院附属第一医院骨科);杨茂伟(中国医科大学附属第一医院骨科);臧晓方(中南大学湘雅第三医院骨科);张嘉(北京协和医院骨科);张权(复旦大学附属华山医院骨科);周辰鹤(浙江大学医学院附属第二医院骨科);周方(北京大学第三医院骨科);朱仕文(北京积水潭医院骨科)
中国康复技术转化与发展促进会骨质疏松性骨折加速康复专业委员会, 中华医学会骨质疏松和骨矿盐疾病委员会骨与关节学组, 中国医师协会骨科医师分会骨质疏松工作委员会. 特立帕肽治疗骨质疏松性骨折中国专家共识2024版)[J]. 中华医学杂志, 2024, 104(17: 1456-1465. DOI: 10.3760/cma.j.cn112137-20231101-00964.
所有作者声明不存在利益冲突


























