
分析IL-18、IL-18结合蛋白(IL-18BP)在骨髓增生异常综合征(MDS)患者骨髓液中的表达水平及临床意义。
纳入2020年7月至2021年2月天津医科大学总医院血液科收治的初诊MDS患者43例,对照组包括急性髓系白血病(AML)患者14例、缺铁性贫血(IDA)患者25例,检测骨髓上清中IL-18和IL-18BP水平,分析其与MDS的严重程度、CD8+ T细胞及NK细胞功能的相关性。
MDS患者骨髓上清中IL-18、IL-18BP和游离IL-18(fIL-18)的水平均高于IDA组,fIL-18的水平与MDS-IPSS评分呈线性负相关。MDS患者CD8+ T细胞表面IL-18受体(IL-18Rα)表达低于IDA组,fIL-18及IL-18Rα水平均与MDS患者CD8+ T细胞功能呈正相关。
IL-18在MDS患者骨髓微环境中表达增加,但由于IL-18BP的存在导致fIL-18相对减少,与MDS疾病严重程度和CD8+ T细胞功能减低有关。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
骨髓增生异常综合征(MDS)是髓系克隆造血导致的血液系统恶性疾病,表现为血细胞减少、骨髓病态或无效造血,高风险向急性髓系白血病(AML)转化[1]。免疫机制在MDS的发病中发挥重要作用[2]。IL-18是一种多效性促炎细胞因子,参与先天性和适应性免疫反应的调节[3]。在IL-12和(或)IL-15存在的情况下,IL-18诱导巨噬细胞、NK细胞、T细胞和B细胞产生干扰素γ(IFN-γ);IL-18与IL-23结合可促进Th17细胞的生长[4,5]。在IL-18的刺激下NK细胞及T细胞抗肿瘤作用均增强[6]。研究显示IL-18在包括MDS在内的多种肿瘤患者中表达增高[7],但给予IL-18治疗未能发挥预期抑制肿瘤生长的理想疗效[8]。IL-18结合蛋白(IL-18BP)是一种天然的游离免疫检查点蛋白,可竞争性抑制IL-18与其受体(IL-18Rɑ)结合,且与IL-18的亲和力远高于IL-18Rɑ。目前已发现IL-18BP在多种肿瘤[9,10,11]和自身免疫性疾病[12,13]中高表达,但在MDS患者中的作用尚不清楚。本研究检测了MDS患者骨髓上清中IL-18和IL-18BP的表达水平,探讨在MDS患者中检测的临床意义。
回顾性分析2020年7月至2021年2月在天津医科大学总医院血液科确诊的43例初治MDS患者及对照病例[AML患者14例、缺铁性贫血(IDA)患者25例]。所有患者均完成骨髓穿刺、骨髓病理、染色体核型、组织化学分析等相关检查,排除感染、实体肿瘤及其他血液系统疾病。MDS患者符合2016年WHO诊断分型标准,AML患者符合2017年WHO诊断分型标准。该研究经天津医科大学总医院伦理委员会批准(批件号:IRB2019-210-01)。收集所有患者外周血及骨髓液3 ml到EDTA抗凝管中,室温下1 000×g离心15 min,吸取500 μl上清至1.5 ml无酶EP管中,密封在-80 ℃冰箱中保存,备后期检测IL-18和IL-18BP的表达水平。
本研究使用的人IL-18 ELISA试剂盒(最小检测限为20 pg/ml)、人IL-18BP试剂盒(最小检测限为47 pg/ml)均购自北京博奥森生物技术有限公司。使用酶标仪Elx800(美国Bio Tek公司产品)按照试剂盒说明进行检测操作。在测量每个样品IL-18和IL-18BP的浓度后,采用质量作用法[14]计算游离IL-18(fIL-18)的水平(即没有与其抑制剂IL-18BP结合的细胞因子的部分)。已知IL-18的相对分子质量为18.4×103,IL-18BP的相对分子质量为17.6×103,IL-18和IL-18BP按1∶1结合,其相互作用的Kd值为0.4 nmol/L。
CD3-PerCP、CD8-APC-CY7、IL-18Rα-PE、PD-1-PE-CY7、TIM-3-BV421、IFN-γ-FITC、Perforin-APC、Granzyme B-BV421用于检测CD8+T细胞的数量及功能;CD3-PerCP、CD56-FITC、IL-18Rα-PE、PD-1-PE-CY7和TIM-3-BV421、IFN-γ-FITC、Perforin-APC、Granzyme B-PE-CY7用于检测NK细胞的数量及功能。运用流式细胞仪CytoFLE进行检测,利用CytExpert进行数据分析。
采用SPSS 25.0统计软件和GraphPad Prism 5.01统计软件进行数据分析和图形处理。连续变量的正态性判定采用Shapiro-Wilk检验,若为正态分布则用 ±s表示,两组间比较采用独立样本t检验,多组间的比较采用单因素方差分析。若为非正态分布则用M(IQR)表示,两组间比较采用Mann-Whitney U检验,多组间比较采用Kruskal-Wallis H秩和检验,进一步采用Dunn法进行多重比较。两个变量的相关性分析采用Pearson或Spearman法。双侧P<0.05为差异有统计学意义。
±s表示,两组间比较采用独立样本t检验,多组间的比较采用单因素方差分析。若为非正态分布则用M(IQR)表示,两组间比较采用Mann-Whitney U检验,多组间比较采用Kruskal-Wallis H秩和检验,进一步采用Dunn法进行多重比较。两个变量的相关性分析采用Pearson或Spearman法。双侧P<0.05为差异有统计学意义。
MDS患者和AML患者骨髓上清中IL-18表达水平分别为(211.30±157.20)ng/L和(202.90±102.40)ng/L,均明显高于IDA组的(84.97±64.78)ng/L(P值分别为<0.001、0.004)。MDS患者和AML患者的IL-18BP表达水平分别为(33 149±12 134)ng/L和(40 221±14 259)ng/L,均明显高于IDA组的(21 796±7 858)ng/L(P值分别为0.004、<0.001)。MDS患者和AML患者的fIL-18表达水平分别为(38.40±25.88)ng/L和(31.15±14.34)ng/L,MDS患者的fIL-18水平显著高于IDA组的(22.84±18.66)ng/L(P=0.039)(图1),较AML组表达水平差异无统计学意义(P=1.000)。
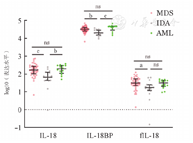

注 MDS:骨髓增生异常综合征;AML:急性髓系白血病;IDA:缺铁性贫血;IL-18BP:IL-18结合蛋白;nsP>0.05、aP<0.05、bP<0.01、cP<0.001
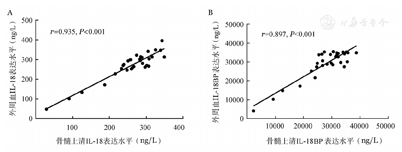
为探究IL-18BP对IL-18的拮抗作用是否仅局限于骨髓原位,我们对31例MDS患者骨髓及外周血同时采样,分别检测IL-18、IL-18BP水平并进行Pearson相关性分析。结果显示MDS患者外周血与骨髓的IL-18(r=0.935,P<0.001)、IL-18BP(r=0.897,P<0.001)均呈正相关,提示二者具有很好的一致性(图2)。

根据修订版MDS国际预后评分系统(IPSS-R),将43例初治MDS患者分为相对高危组(>3.5分)和相对低危组(≤3.5分)。分析发现,相对低危组患者IL-18BP的表达水平与相对高危组比较差异无统计学意义[(32 351±12 178)ng/L对(33 723±12 321)ng/L,P=0.932]。相对低危组患者的fIL-18的表达水平明显高于相对高危组[(50.26±30.15)ng/L对(29.85±18.61)ng/L,P=0.016](图3)。
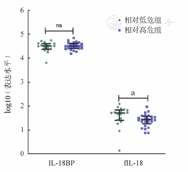

注 IPSS-R:修订版MDS国际预后评分系统;IL-18BP:IL-18结合蛋白;fIL-18:游离IL-18;nsP>0.05、aP<0.05
骨髓上清中fIL-18与骨髓原始细胞比例(r=-0.36,P=0.03)、国际预后积分系统(IPSS)评分(r=-0.35,P=0.02)、IPSS-R评分(r=-0.38,P=0.01)和WHO分型预后积分系统(WPSS)评分(r=-0.31,P=0.04)均呈负相关。
在与突变基因相关性的研究结果显示:DTA(DNMT3A、TET2、ASXL1)基因突变与IL-18BP水平呈正相关(r=0.412,P=0.008),但与IL-18水平(r=0.18,P=0.25)、fIL-18(r=-0.07,P=0.65)无明显线性相关性。剪切子相关基因突变(SF3B1、U2AF1、SRSF2和ZRSR2)与IL-18(r=0.15,P=0.34)、IL18BP(r=0.09,P=0.60)、fIL-18(r=0.16,P=0.33)均水平无明显线性相关性。
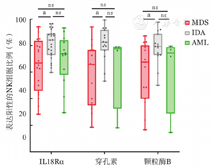
MDS患者和AML患者CD8+ T细胞分泌穿孔素水平分别为(12.35±9.71)%和(7.80±4.10)%,均显著低于IDA组的(22.25±13.66)%(P值分别为0.040、0.001)。MDS与AML患者骨髓CD8+ T细胞分泌的穿孔素水平差异无统计学意义(P=0.622)。MDS患者和AML患者骨髓CD8+ T细胞分泌的IFN-γ水平分别为(16.65±15.11)%和(11.13±9.31)%,明显低于IDA组的(29.17±17.11)%(P值分别为0.027、0.002)(图4)。MDS、AML和IDA组患者骨髓CD8+ T细胞分泌的颗粒酶B水平分别为(38.46±15.40)%、(39.81±14.31)%和(43.94±18.97)%,组间差异无统计学意义(P=1.000)。


注 MDS:骨髓增生异常综合征;AML:急性髓系白血病;IDA:缺铁性贫血;IL-18Rα:IL-18受体;nsP>0.05,aP<0.05,bP<0.01,cP<0.001
MDS及AML患者PD-1+CD8+/CD8+细胞比例分别为(43.44±16.17)%和(40.73±23.30)%,均显著高于IDA组的(22.63±11.91)%(P值分别为<0.001、0.020)。MDS和AML患者TIM-3+CD8+/CD8+ T细胞比例分别为(42.12±19.51)%和(38.16±19.45)%,均显著高于IDA组的(20.77±12.70)%(P值分别为<0.001、0.031)。MDS和AML患者的PD-1+TIM-3+CD8+/CD8+ T细胞比例分别为(17.55±11.57)%和(16.21±15.75)%,均显著高于IDA组的(6.78±4.90)%(P值分别为<0.001、0.013),提示MDS和AML患者CD8+ T细胞存在免疫耗竭状态(图5)。


MDS患者和AML患者CD8+ T细胞上IL-18Rα的表达水平分别为(57.44±15.37)%和(55.94±13.32)%,均显著低于IDA组的(69.32±14.98)%(P值分别为0.036、0.048),MDS和AML患者之间差异无统计学意义(P=1.000)(图4)。
MDS患者骨髓上清中fIL-18表达水平与CD8+ T细胞分泌的穿孔素(r=0.54,P=0.04)和IFN-γ(r=0.64,P=0.01)呈正相关,与颗粒酶B无明显线性相关性(r=0.29,P=0.30);CD8+ T细胞表面的IL-18Rα与穿孔素、颗粒酶B及IFN-γ表达水平均呈正相关(r值分别为0.60、0.53、0.52,P值分别为0.02、0.04、0.03)。但MDS患者骨髓上清中的IL-18BP水平与穿孔素、颗粒酶B及IFN-γ表达水平均无明显线性相关性(r值分别为0.01、0.09、-0.29,P值分别为0.96、0.74、0.29)。本研究并未发现MDS患者骨髓上清中IL-18BP、fIL-18及IL-18Rα与PD-1+TIM-3+CD8+ T细胞比例的线性相关性,提示IL-18或fIL-18水平可能与CD8+ T细胞耗竭无显著关联。
MDS患者骨髓NK细胞分泌的穿孔素水平显著低于IDA组[(57.36±23.81)%对(78.21±12.36)%,P=0.042],颗粒酶B水平明显低于IDA组[(57.44±15.37)%对(69.32±14.98)%,P=0.034],骨髓NK细胞上IL-18Rα的表达水平显著低于IDA组[(63.61±20.40)%对(81.30±11.10)%,P=0.040](图6)。

MDS患者骨髓上清中的fIL-18(r=0.07,P=0.83)、IL-18BP(r=0.08,P=0.80)、IL-18Rα(r=0.07,P=0.82)表达水平与骨髓NK细胞分泌的穿孔素无明显线性相关性;fIL-18(r=0.14,P=0.66)、IL-18BP(r=0.16,P=0.61)、IL-18Rα(r=-0.21,P=0.50)表达水平与骨髓NK细胞分泌的颗粒酶B无明显线性相关性。
MDS是造血干细胞的一种恶性克隆性疾病,以无效和病态造血为特征,可转变为AML。MDS的发病机制涉及许多因素,包括细胞遗传学变化和分子异常,如基因突变和表观遗传学变化,以及细胞免疫和免疫微环境的紊乱等。
IL-18是一种促炎症和免疫调节因子。在一些临床前模型中已经发现IL-18具有抗肿瘤活性[15,16]。重组IL-18(rIL-18)通过激活CD4+、CD8+ T细胞和(或)NK细胞介导的反应,可消除小鼠黑色素瘤或肉瘤[17];在小鼠模型中,rIL-18与免疫检查点抑制剂(ICI)和嵌合抗原受体T细胞(CAR-T细胞)具有协同作用[18]。尽管在动物实验中显示出显著疗效,但IL-18在临床应用上却未见明显有效性[19],这引起广泛研究者的困惑。这种困惑持续到人们发现了IL-18BP。很多研究表明,肿瘤微环境中不同因素介导了IL-18BP的表达,IL-18BP限制了IL-18与其受体的结合,从而降低IL-18的生物活性。这一发现揭示了肿瘤通过IL-18BP表达来逃避免疫反应的潜在机制,对肿瘤治疗研究具有重要意义。
本研究发现,MDS患者骨髓上清中IL-18表达水平明显升高,这说明MDS体内存在抗肿瘤的炎症反应,但我们同样发现IL-18BP表达水平也同步升高,这就抑制了IL-18抗肿瘤作用。根据质量作用定律[14]和骨髓上清中IL-18和IL-18BP的表达水平,我们计算了MDS患者骨髓fIL-18的表达水平,发现MDS患者fIL-18的表达水平仍高于IDA组,并且fIL-18在MDS中高于AML,说明在MDS阶段,机体的有效炎症反应强于AML。本研究还发现不同分期的MDS患者骨髓fIL-18的表达水平也不相同,相对低危组MDS患者fIL-18的表达水平高于相对高危组。
肿瘤患者的CD8+ T细胞及NK细胞不仅发挥免疫监视作用,而且是机体杀灭肿瘤细胞最主要的武器。本研究再次验证了MDS患者CD8+ T细胞及NK细胞分泌功能分子(如穿孔蛋白、颗粒酶、IFN-γ)的能力减低。且由于CD8+ T细胞及NK细胞表面IL-18Rα表达减少,导致fIL-18促进CD8+ T及NK细胞活化能力减弱。MDS患者骨髓CD8+ T细胞存在耗竭状态,MDS患者的PD-1+TIM-3+CD8+ T细胞比例增高,但本研究并未发现IL-18BP、fIL-18以及IL-18Rα与骨髓CD8+ T细胞表面PD-1和TIM-3的表达水平的相关性,说明IL-18通过调节IL-18Rα调控T细胞的功能,可能并未参与CD8+ T细胞耗竭的过程。
近期,Zhou等[8]创造了一种诱饵受体DR-18,可以有效地防止IL-18被IL-18BP中和,但不影响IL-18与IL-18受体结合,介导下游的信号转导。该药物目前正在进行临床开发,未来有望用于多种肿瘤性疾病的治疗。本实验证实MDS患者骨髓上清中IL-18的表达水平虽然不低,但由于IL-18BP的存在导致fIL-18表达水平相对不足,加之MDS患者CD8+ T和NK细胞表面IL-18Rα的下调,导致CD8+ T和NK细胞炎症反应能力不足,抗肿瘤功能受抑。因此,IL-18BP拮抗剂和(或)促进IL-18受体上调的药物,有望成为治疗MDS的新选择。
所有作者声明不存在利益冲突



























