
流行性脑脊髓膜炎(流脑)是由脑膜炎球菌感染引起的急性中枢神经系统性疾病,具有发病不确定性、起病急、进展快、致死和致残率均较高等特点,疾病负担重。脑膜炎球菌常定植在人的鼻咽部,国际上通常将脑膜炎球菌引起的一系列疾病,如败血症、关节炎、脑膜炎、肺炎和心包炎等疾病统称为脑膜炎球菌病(meningococcal diseases)。至今接种疫苗是控制和预防该病最经济有效的措施之一。脑膜炎球菌分为12种血清群,目前全球均面临多菌群流行和变迁的威胁,为给人群提供更广更全的保护,多联多价脑膜炎球菌疫苗已成为研发和使用主力军。脑膜炎球菌疫苗的研发先后经历从单价到多价,从多糖到多糖结合疫苗的过程。脑膜炎球菌多糖结合疫苗在提升免疫原性、诱导免疫记忆和降低带菌率等方面具有明显优势。国际上首款四价和五价脑膜炎球菌多糖结合疫苗分别于2005年和2023年上市,我国首款四价脑膜炎球菌多糖结合疫苗于2021年底获批上市。本综述将系统梳理脑膜炎球菌多糖结合疫苗的研究进展,以期为我国脑膜炎球菌多糖结合疫苗的应用、脑膜炎球菌病的防控策略制定提供参考。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
流行性脑脊髓膜炎(流脑)是由脑膜炎奈瑟菌(Neisseria meningitidis,Nm)或称脑膜炎球菌引起的急性化脓性中枢神经系统感染,具有发病不确定性、起病急、进展快等特点。全球范围内病死率超过10%,有10%~20%的幸存者会出现长期严重后遗症,造成严重疾病负担[1]。国际上通常将脑膜炎球菌引起的一系列疾病,如败血症、关节炎、脑膜炎、肺炎和心包炎等疾病统称为脑膜炎球菌病(meningococcal diseases)。脑膜炎球菌病在全年龄段人群均有发病,以婴幼儿发病率最高,其次是青少年和老年人[2]。根据荚膜多糖结构,脑膜炎球菌分为12个血清群,其中6个血清群(A、B、C、W、X和Y)导致全球大多数侵袭性脑膜炎球菌性疾病(invasive meningococcal disease,IMD)病例[3]。目前,全球不同国家和地区均经历了明显的菌群变迁而呈现多菌群流行的趋势,脑膜炎球菌疫苗研发、免疫策略制定和更新也主要依据脑膜炎球菌流行的血清群特点。多联多价疫苗是全球疫苗研发的趋势和方向,脑膜炎球菌疫苗也逐渐由单一价次的疫苗(A群、C群、B群)逐步发展为多价次疫苗(AC群、ACYW群、ABCYW群和ACYWX群)。由于脑膜炎球菌多糖疫苗(meningococcal polysaccharide vaccine,MPSV)的免疫原性、安全性、免疫记忆和无法产生群体性免疫等局限性,不适合2岁以下婴幼儿接种,脑膜炎球菌多糖结合疫苗(meningococcal polysaccharide conjugate vaccine,MPCV)有效克服了多糖疫苗的不足,逐渐成为国际上接种的主流脑膜炎球菌疫苗[4]。2021年我国首款ACYW群脑膜炎球菌多糖结合疫苗(group A, C, Y and W meningococcal polysaccharide conjugate vaccine,MPCV-ACYW)获批上市,为我国脑膜炎球菌疫苗提供了一种新的选择。本文拟对全球脑膜炎球菌多糖结合疫苗研究进展及MPCV-ACYW的安全性、免疫原性和免疫持久性等进行综述,以期为我国MPCV-ACYW疫苗使用和免疫策略制定提供参考依据。
脑膜炎球菌病为全球流行性疾病,各大洲均有病例报道,欧洲、北美洲和大洋洲等流脑报告发病率较低;几乎所有非洲国家流脑发病率均高于10/10万,其中非洲撒哈拉以南的"脑膜炎带"为高发病率的国家和地区[5]。目前全球IMD发病率降至较低水平,但局部暴发时有发生。IMD发病率及相关血清群分布具有明显的地域性和年龄组特征。过去20年里,通过脑膜炎球菌疫苗的使用,世界大多数国家和地区的IMD发病率持续下降。因疫苗使用及菌株自身变化等多重因素影响,不同国家和地区经历了明显的血清群变迁。目前,B群、W群和Y群在欧洲、北美、非洲、大洋洲和亚太地区等国家/地区成为常见菌群,而南美洲和中美洲脑膜炎球菌病病例则以B群、C群和W群为主[2,6,7,8]。
以往A群脑膜炎球菌流行主要发生在发展中国家,尤其是"非洲脑膜炎带"地区,自2010年引入A群脑膜炎球菌结合疫苗(MenAfriVac)后,发病率下降99%以上,且2017年后再无确诊A群病例出现,但B、C、W、Y群等血清群病例比例却逐年升高[9]。1999年,由于CC11 C群脑膜炎球菌(meningococcal serogroup C,MenC)发病率增加,英国在全球率先将C群脑膜炎球菌多糖结合疫苗(group C meningococcal polysaccharide conjugate vaccine,MPCV-C)纳入国家免疫规划,之后高风险人群及未免疫人群的C群发病率均显著下降。该疫苗的使用在英国获得群体免疫的显著成效,随后很多欧美发达国家逐渐将MPCV疫苗纳入本国的免疫规划,为人群提供有针对性的更佳保护[10]。2001年因麦加朝圣导致W群疫情在全球暴发,波及多个大洲众多国家,2005年为应对包括W群在内的脑膜炎球菌多菌群流行威胁,美国在全球率先使用MPCV-ACYW疫苗,随后多个国家相继引入该疫苗[11]。2015年为应对W群及其他菌群的暴发流行,英国也将MPCV-ACYW纳入免疫规划以替代13~14岁青少年接种的单价MPCV-C,以应对W群及其他菌群的暴发流行[12]。2017年阿根廷为应对邻国W群的高发,将MPCV-ACYW纳入免疫规划,为9月龄~5岁儿童接种该疫苗[13]。
全球众多国家逐渐由多糖疫苗向多糖结合疫苗转换。沙特阿拉伯为应对2011年W群疫情暴发,对麦加和麦地那主要朝圣地及周边地区的所有公民和非公民等人群强制接种四价脑膜炎球菌多糖疫苗(group A, C,Y and W meningococcal polysaccharide vaccine,MPSV-ACYW);2010年对于参与朝圣的沙特阿拉伯公民和非公民采用MPCV-ACYW疫苗取代多糖疫苗,并于2013年在扩大免疫规划下将MPCV-ACYW用至所有婴儿[14]。科威特于1994年国家免疫规划引入MPSV-ACYW疫苗,而2019年国家免疫规划的脑膜炎球菌多糖疫苗被MPCV-ACYW疫苗取代[15]。2023年3月WHO更新的关于常规免疫接种的建议中推荐接种脑膜炎球菌多糖结合疫苗[16]。少数国家目前仍在使用多糖疫苗,比如埃及为应对早年的A群疫情,1992年实施了学校MPSV-AC疫苗接种计划,目前仍在实施,同时其还建议前往危险地区的旅行者需接种四价脑膜炎球菌疫苗[17]。WHO数据显示,全球有40个国家将该疫苗纳入本国免疫规划,更多国家可自费选择该类疫苗,MPCV-ACYW已成为全球防控脑膜炎球菌病领域使用最广泛的疫苗[18,19]。
历史上我国也经历多次A群流脑暴发,发生过数次全国性大流行。在疫苗广泛应用前,我国是流脑高发国家,8~10年出现一次较大流行,发病率可达100/10万~500/10万[5]。自1980年代接种A群多糖疫苗后,A群发病率显著下降。2003年安徽省开始出现C群脑膜炎球菌流行,A群病例逐渐减少,C群成为主要流行菌株[20]。AC群脑膜炎球菌多糖疫苗开始被广泛使用,2005年我国流脑发病率降至0.20/10万以下,2007年我国将A群多糖疫苗和AC群多糖疫苗纳入国家免疫规划,2008年开始对适龄儿童开展接种[5],C群流脑发病得到有效控制,发病率逐年下降。2006—2014年报告流脑实验室确诊病例中C群占比最高(44.81%)。2015—2019年B群成为占比最高的菌群(36.15%),其次是C群、W群及不可分群病例呈上升趋势,并出现X群和Y群病例,菌群呈现多元化[21,22]。我国2018—2021年流脑报告发病率为0.0036/10万~0.0079/10万[23,24,25,26]。
目前,我国脑膜炎球菌疫苗分为免疫规划疫苗和非免疫规划疫苗两类。《国家免疫规划疫苗儿童免疫程序及说明(2021版)》脑膜炎球菌疫苗接种程序为6月龄、9月龄各接种1剂次A群多糖疫苗,3岁和6岁各接种1剂次AC多糖疫苗。根据我国《国家免疫规划疫苗儿童免疫程序及说明(2021版)》和《非免疫规划疫苗使用指导原则(2020年版)》要求,对于小于24月龄儿童,如已按流脑结合疫苗说明书接种了规定的剂次,可视为完成A群多糖疫苗接种剂次;儿童3周岁和6周岁时已接种含A群和C群流脑疫苗成分的疫苗,可视为完成相应剂次的AC多糖疫苗接种。我国目前上市的脑膜炎球菌疫苗包括A群多糖疫苗、AC多糖疫苗、ACYW多糖疫苗和ACYW多糖结合疫苗4种,期待有更多的多价多糖结合疫苗及未来的B群疫苗能发挥相应的补充作用,给国内的儿童提供更全面和有效的保护。
WHO提出"2030年战胜脑膜炎路线图计划",脑膜炎球菌疫苗接种作为预防脑膜炎球菌病最有效的措施。根据抗原成分的不同,脑膜炎球菌疫苗分为两类:一类是基于脑膜炎球菌荚膜多糖成分的疫苗,可覆盖A、C、W和Y等血清群;另一类是蛋白质成分疫苗,主要为B群脑膜炎球菌疫苗,包括重组蛋白疫苗和外膜囊泡疫苗。B群脑膜炎球菌荚膜多糖结构与人神经细胞N-乙酰神经氨酸结构相似,作为疫苗抗原,不仅其免疫原性较弱,且其所诱导产生的抗体可能会与神经细胞相互作用,造成机体自身免疫性损伤,因此B群脑膜炎球菌疫苗采用蛋白疫苗技术路线[27]。
1960年全球首款脑膜炎球菌多糖疫苗开始研发,1971年首款AC群脑膜炎球菌多糖疫苗在美国上市,随后多价脑膜炎球菌多糖疫苗相继上市。由于脑膜炎球菌多糖抗原是胸腺非依赖性抗原(thymus-independent antigen,TI-Ag),刺激B细胞产生抗体不需要T细胞辅助,导致免疫持久性较短暂[28],除MPSV-A外,对2岁以下儿童免疫效果不理想。研究发现,脑膜炎球菌荚膜多糖通过化学偶联到蛋白质载体上,TI-Ag转换为T细胞依赖性抗原(thymus-dependent antigen,TD-Ag),诱导T细胞依赖性免疫应答,在2岁以下婴幼儿中免疫原性及安全性表现良好,并可产生免疫记忆,从而提供长期保护。除直接保护外,脑膜炎球菌多糖结合疫苗还可减少鼻咽携带与传播,发挥群体免疫作用,在保护被接种人群的同时也为未接种疫苗的人群提供间接保护[29]。因此,脑膜炎球菌多糖结合疫苗在全球得到了广泛使用。
多糖结合疫苗的载体是蛋白质,相比于多糖抗原,蛋白质抗原可同时激发体液免疫和细胞免疫,产生持久免疫记忆。目前主要的载体有白喉类毒素(diphtheria toxoid,DT)、破伤风类毒素(tetanus toxoid,TT)和白喉毒素无毒突变体(diphtheria protein cross-reactive material 197,CRM197),不同载体蛋白具有不同的生物学特性。DT和TT是国内多糖结合疫苗中常用的载体蛋白,但制备过程中均需甲醛等脱毒处理,甲醛与伯胺基(-NH2)反应易形成衍生物,可能会封闭DT和TT的氨基酸残基,降低结合效率。CRM197是DT的无毒突变体,结构与DT基本一致,仅第52位甘氨酸(Gly)突变为谷氨酸(Glu),使其失去细胞毒性,保留抗原性和免疫原性,并保持T细胞表位[30],在多价多糖结合疫苗领域有着批间一致性好,安全性优等优势。
1999年,英国首次引入以CRM197为载体的C群脑膜炎球菌多糖结合疫苗(MenC-CRM197),作为2、3和4月龄婴儿常规疫苗接种,并在1~18岁儿童单剂量加强,在C群脑膜炎球菌病防控方面效果显著[10]。2005年,全球首款MPCV-ACYW在美国成功上市,随后在2010年和2012年另外两款MPCV-ACYW相继上市,我国在2021年底上市国内首款可用于6月龄以内的MPCV-ACYW,为婴幼儿提供更全面有效的保护。
1999年英国首次将MenC-CRM197多糖结合疫苗纳入国家免疫规划。截至目前,全球共有4个厂家生产的5款MPCV-ACYW获批上市,分别是2005年赛诺菲巴斯德成功研发第一款以DT为载体的MenACYW疫苗(Menactra®),可从9月龄开始接种;2010年诺华研发的以CRM197为载体的Men-ACYW-CRM197疫苗(Menveo®),可从2月龄婴幼儿开始接种,2015年,该疫苗被葛兰素史克收购;2012年,葛兰素史克研发的以TT为载体的MPCV-ACYW疫苗(Nimenrix®),可从6周龄开始接种,2015年辉瑞与葛兰素史克置换了该疫苗;2020年赛诺菲巴斯德研发的以TT为载体的MenACYW-TT疫苗(MenQudafi®)上市,适用于2岁以上人群;2021年底,康希诺研发的以CRM197为载体的MenACYW-CRM197(Menhycia®)在我国获批上市,可从3月龄开始接种。2023年辉瑞以TT为载体蛋白的五价疫苗MenABCYW(Penbraya™)获批,成为首个针对10~25岁青少年和年轻人的五价脑膜炎球菌疫苗(表1)。
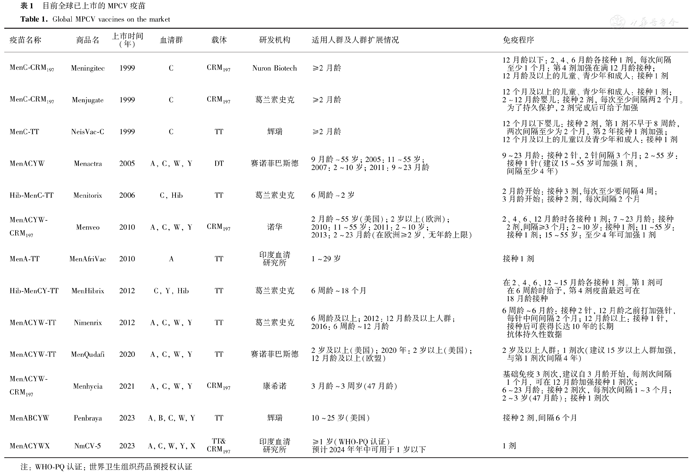
目前全球已上市的MPCV疫苗
Global MPCV vaccines on the market
目前全球已上市的MPCV疫苗
Global MPCV vaccines on the market
| 疫苗名称 | 商品名 | 上市时间(年) | 血清群 | 载体 | 研发机构 | 适用人群及人群扩展情况 | 免疫程序 |
|---|---|---|---|---|---|---|---|
| MenC-CRM197 | Meningitec | 1999 | C | CRM197 | Nuron Biotech | ≥2月龄 | 12月龄以下:2、4、6月龄各接种1剂,每次间隔至少1个月;第4剂加强在满12月龄接种;12月龄及以上的儿童、青少年和成人:接种1剂 |
| MenC-CRM197 | Menjugate | 1999 | C | CRM197 | 葛兰素史克 | ≥2月龄 | 12个月及以上的儿童、青少年和成人:接种1剂;2~12月龄婴儿:接种2剂,每次至少间隔两2个月。为了持久保护,2剂完成后可给予加强 |
| MenC-TT | NeisVac-C | 1999 | C | TT | 辉瑞 | ≥2月龄 | 12个月以下婴儿:接种2剂,第1剂不早于8周龄,两次间隔至少为2个月,第2年接种1剂加强;12个月及以上的儿童以及青少年和成人:接种1剂 |
| MenACYW | Menactra | 2005 | A, C, W, Y | DT | 赛诺菲巴斯德 | 9月龄~55岁;2005: 11~55岁;2007: 2~10岁;2011: 9~23月龄 | 9~23月龄:接种2针,2针间隔3个月;2~55岁:接种1针(建议15~55岁可加强1剂,间隔至少4年) |
| Hib-MenC-TT | Menitorix | 2006 | C, Hib | TT | 葛兰素史克 | 6周龄~2岁 | 2月龄开始:接种3剂,每次至少要间隔4周;3月龄开始:接种2剂,每次间隔2个月 |
| MenACYW-CRM197 | Menveo | 2010 | A, C, W, Y | CRM197 | 诺华 | 2月龄~55岁(美国); 2岁以上(欧洲);2010: 11~55岁;2011: 2~10岁;2013: 2~23月龄(在欧洲≥2岁,无年龄上限) | 2、4、6、12月龄时各接种1剂;7~23月龄:接种2剂,间隔≥3个月;2~10岁:接种1剂;11~55岁:接种1剂;15~55岁:至少4年可加强1剂 |
| MenA-TT | MenAfriVac | 2010 | A | TT | 印度血清研究所 | 1~29岁 | 接种1剂 |
| Hib-MenCY-TT | MenHibrix | 2012 | C, Y, Hib | TT | 葛兰素史克 | 6周龄~18个月 | 在2、4、6、12~15月龄各接种1剂。第1剂可在6周龄时给予,第4剂疫苗最迟可在18月龄接种 |
| MenACYW-TT | Nimenrix | 2012 | A, C, W, Y | TT | 葛兰素史克 | 6周龄及以上;2012: 12月龄及以上人群;2016: 6周龄~12月龄 | 6周龄~6月龄:接种2针,12月龄之前打加强针,每针中间间隔2个月;12月龄以上:接种1针,接种后可获得长达10年的长期抗体持久性数据 |
| MenACYW-TT | MenQudafi | 2020 | A, C, W, Y | TT | 赛诺菲巴斯德 | 2岁及以上(美国); 2020年:2岁以上(美国);12月龄及以上(欧盟) | 2岁及以上人群:1剂次(建议15岁以上人群加强,与第1剂次间隔4年) |
| MenACYW-CRM197 | Menhycia | 2021 | A, C, W, Y | CRM197 | 康希诺 | 3月龄~3周岁(47月龄) | 基础免疫3剂次,建议自3月龄开始,每剂次间隔1个月,可在12月龄加强接种1剂次;6~23月龄:接种2剂次,每剂次间隔1~3个月;2~3岁(47月龄):接种1剂次 |
| MenABCYW | Penbraya | 2023 | A, B, C, W, Y | TT | 辉瑞 | 10~25岁(美国) | 接种2剂,间隔6个月 |
| MenACYWX | NmCV-5 | 2023 | A, C, W, Y, X | TT&CRM197 | 印度血清研究所 | ≥1岁(WHO-PQ认证)预计2024年年中可用于1岁以下 | 1剂 |
注:WHO-PQ认证:世界卫生组织药品预授权认证
脑膜炎球菌疫苗上市许可以血清杀菌活性(serum bactericidal activity,SBA)作为衡量保护效应的免疫学指标。目前国内外研究显示,MPCV-ACYW疫苗在不同年龄和不同人群中均具有良好的免疫原性,且加强剂的接种能够刺激机体产生强烈的免疫记忆,维持较高水平反应(表2)。
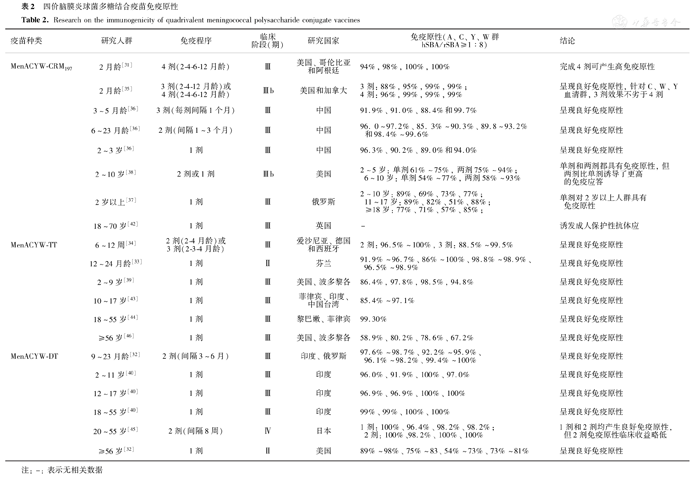
四价脑膜炎球菌多糖结合疫苗免疫原性
Research on the immunogenicity of quadrivalent meningococcal polysaccharide conjugate vaccines
四价脑膜炎球菌多糖结合疫苗免疫原性
Research on the immunogenicity of quadrivalent meningococcal polysaccharide conjugate vaccines
| 疫苗种类 | 研究人群 | 免疫程序 | 临床阶段(期) | 研究国家 | 免疫原性(A、C、Y、W群hSBA/rSBA≥1∶8) | 结论 |
|---|---|---|---|---|---|---|
| MenACYW-CRM197 | 2月龄[31] | 4剂(2-4-6-12月龄) | Ⅲ | 美国、哥伦比亚和阿根廷 | 94%, 98%, 100%, 100% | 完成4剂可产生高免疫原性 |
| 2月龄[35] | 3剂(2-4-12月龄)或4剂(2-4-6-12月龄) | Ⅲb | 美国和加拿大 | 3剂:88%, 95%, 99%, 99%;4剂:96%, 99%, 99%, 99% | 呈现良好免疫原性,针对C、W、Y血清群,3剂效果不劣于4剂 | |
| 3~5月龄[36] | 3剂(每剂间隔1个月) | Ⅲ | 中国 | 91.9%、91.0%、88.4%和99.7% | 呈现良好免疫原性 | |
| 6~23月龄[36] | 2剂(间隔1~3个月) | Ⅲ | 中国 | 96. 0~97.2%、85. 3%~90.3%、89.8~93.2%和98.4%~99.6% | 呈现良好免疫原性 | |
| 2~3岁[36] | 1剂 | Ⅲ | 中国 | 96.3%、90.2%、89.0%和94.0% | 呈现良好免疫原性 | |
| 2~10岁[38] | 2剂或1剂 | Ⅲb | 美国 | 2~5岁:单剂61%~75%,两剂75%~94%;6~10岁:单剂54%~77%,两剂58%~93% | 单剂和两剂都具有免疫原性,但两剂比单剂诱导了更高的免疫应答 | |
| 2岁以上[37] | 1剂 | Ⅲ | 俄罗斯 | 2~10岁:89%、69%、73%、77%; 11~17岁:89%、82%、51%、88%; ≥18岁:77%、71%、57%、85%; | 单剂对2岁以上人群具有免疫原性 | |
| 18~70岁[42] | 1剂 | Ⅲ | 英国 | - | 诱发成人保护性抗体应 | |
| MenACYW-TT | 6~12周[34] | 2剂(2-4月龄)或3剂(2-3-4月龄) | Ⅲ | 爱沙尼亚、德国和西班牙 | 2剂:96.5%~100%, 3剂:88.5%~99.5% | 呈现良好免疫原性 |
| 12~24月龄[33] | 1剂 | Ⅱ | 芬兰 | 91.9%~96.7%、86%~100%、98.8%~98.9%、96.5%~98.9% | 呈现良好免疫原性 | |
| 2~9岁[39] | 1剂 | Ⅲ | 美国、波多黎各 | 86.4%, 97.8%, 98.5%, 94.8% | 呈现良好免疫原性 | |
| 10~17岁[43] | 1剂 | Ⅲ | 菲律宾、印度、中国台湾 | 85.4%~97.1% | 呈现良好免疫原性 | |
| 18~55岁[44] | 1剂 | Ⅲ | 黎巴嫩、菲律宾 | 99.30% | 呈现良好免疫原性 | |
| ≥56岁[46] | 1剂 | Ⅲ | 美国、波多黎各 | 58.9%、80.2%、78.6%、67.2% | 呈现良好免疫原性 | |
| MenACYW-DT | 9~23月龄[32] | 2剂(间隔3~6月) | Ⅲ | 印度、俄罗斯 | 97.6%~98.7%、92.2%~95.9%、96.1%~98.2%、99.4%~100% | 呈现良好免疫原性 |
| 2~11岁[40] | 1剂 | Ⅲ | 印度 | 96.0%、91.9%、100%、97.0% | 呈现良好免疫原性 | |
| 12~17岁[40] | 1剂 | Ⅲ | 印度 | 96.9%、96.9%、100%、100% | 呈现良好免疫原性 | |
| 18~55岁[40] | 1剂 | Ⅲ | 印度 | 99%、99%、100%、100% | 呈现良好免疫原性 | |
| 20~55岁[45] | 2剂(间隔8周) | Ⅳ | 日本 | 1剂:100%、96.4%、98.2%、98.2%; 2剂:100%、98.2%、100%、100% | 1剂和2剂均产生良好免疫原性,但2剂免疫原性临床收益略低 | |
| ≥56岁[32] | 1剂 | Ⅱ | 美国 | 89%~98%、75%~83、54%~73%、73%~81% | 呈现良好免疫原性 |
注:-:表示无相关数据
婴幼儿是脑膜炎球菌感染的高危人群,脑膜炎球菌疫苗的临床试验证实婴幼儿需要接种多剂次的疫苗,以产生足够的免疫力。国外临床研究表明[31,32,33,34,35],婴幼儿接种2~4剂MPCV-ACYW疫苗后,血清群人血清杀菌试验(human serum bactericidal assay,hSBA)或兔血清杀菌试验(rabbit serum bactericidal assay,rSBA)滴度≥1∶8在86%~100%,对A、C、Y、W血清群产生良好的免疫原性。国内研究显示[36],3~5月龄、6~23月龄婴幼儿接种3剂或2剂后,血清群rSBA≥1∶8为85%~100%,同样表现出良好的免疫原性,提示接种MPCV-ACYW疫苗可有效预防A、C、Y、W血清群脑膜炎球菌的感染。
国外多项研究显示,在不同国家、人群和临床试验中接种不同载体的MPCV-ACYW疫苗,婴幼儿接种2~4剂或青少年和成人接种1剂后,免疫持久性维持3~10年,加强接种1剂后,均可起到加强效果,产生量多质优的抗体[47,48,49,50,51,52,53,54,55,56,57](表3)。国内研究显示,3~5月龄接种3剂后,12月龄加强接种1剂后,加强效果良好,持久性更佳;6~23月龄接种2剂MPCV-ACYW-CRM197,免后6个月和12个月机体免疫水平依然较高[36,50]。因此,婴幼儿、儿童、青少年或成人在完成疫苗基础免疫后,均可产生良好免疫原性。基础免疫后6~12个月、3~5年及以上再次加强免疫,可刺激产生较好的免疫记忆反应,产生数量更多亲和力更高的抗体,从而保护机体免受脑膜炎球菌侵袭,具有良好的免疫持久性。
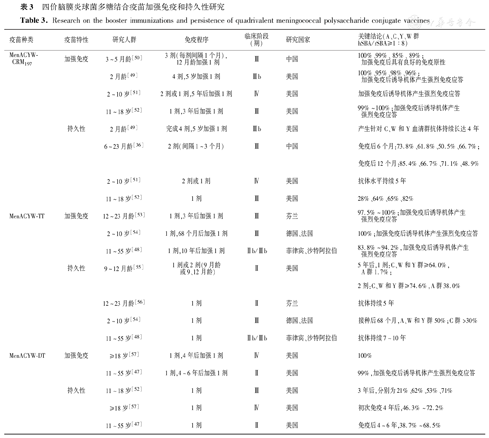
四价脑膜炎球菌多糖结合疫苗加强免疫和持久性研究
Research on the booster immunizations and persistence of quadrivalent meningococcal polysaccharide conjugate vaccines
四价脑膜炎球菌多糖结合疫苗加强免疫和持久性研究
Research on the booster immunizations and persistence of quadrivalent meningococcal polysaccharide conjugate vaccines
| 疫苗种类 | 疫苗特性 | 研究人群 | 免疫程序 | 临床阶段(期) | 研究国家 | 关键结论(A、C、Y、W群hSBA/rSBA≥1∶8) |
|---|---|---|---|---|---|---|
| MenACYW-CRM197 | 加强免疫 | 3~5月龄[50] | 3剂(每剂间隔1个月),12月龄加强1剂 | Ⅲ | 中国 | 100%、99%、85%、89%;加强免疫后具有良好的免疫原性 |
| 2月龄[49] | 4剂,5岁加强1剂 | Ⅲb | 美国 | 100%、95%、98%、96%;加强免疫后诱导机体产生强烈免疫应答 | ||
| 2~10岁[51] | 2剂或1剂,5年后加强1剂 | Ⅳ | 美国 | 加强免疫后诱导机体产生强烈免疫应答 | ||
| 11~18岁[52] | 1剂,3年后加强1剂 | Ⅲ | 美国 | 99%~100%;加强免疫后诱导机体产生强烈免疫应答 | ||
| 持久性 | 2月龄[49] | 完成4剂,5岁加强1剂 | Ⅲb | 美国 | 产生针对C、W和Y血清群抗体持续长达4年 | |
| 6~23月龄[36] | 2剂(间隔1~3个月) | Ⅲ | 中国 | 免疫后6个月:73.8%、61.8%、50.5%、66.7%; | ||
| 免疫后12个月:85.4%、66.7%、71.1%、48.9% | ||||||
| 2~10岁[51] | 2剂或1剂 | Ⅳ | 美国 | 抗体水平持续5年 | ||
| 11~18岁[52] | 1剂 | Ⅲ | 美国 | 28%、64%、65%、82% | ||
| MenACYW-TT | 加强免疫 | 12~23月龄[53] | 1剂,3年后加强1剂 | Ⅲ | 芬兰 | 97.5%~100%;加强免疫后诱导机体产生强烈免疫应答 |
| 2~10岁[54] | 1剂,68个月后加强1剂 | Ⅲ | 德国、法国 | 100%;加强免疫后诱导机体产生强烈免疫应答 | ||
| 11~55岁[48] | 1剂,10年后加强1剂 | Ⅱb/Ⅲb | 菲律宾、沙特阿拉伯 | 83.8%~94.2%,加强免疫后诱导机体产生强烈免疫应答 | ||
| 持久性 | 9~12月龄[55] | 1剂或2剂(9月龄或9、12月龄) | Ⅱ | 美国 | 5年后,1剂:C、W和Y群≥64.0%,A群1.7%; | |
| 2剂:C、W和Y群≥74.6%,A群38.0% | ||||||
| 12~23月龄[56] | 1剂 | Ⅱ | 芬兰 | 抗体持续5年 | ||
| 2~10岁[54] | 1剂 | Ⅲ | 德国、法国 | 接种后68个月,A、W和Y群50%;C群>30% | ||
| 11~55岁[48] | 1剂 | Ⅱb/Ⅲb | 菲律宾、沙特阿拉伯 | 抗体持续7~10年 | ||
| MenACYW-DT | 加强免疫 | ≥18岁[57] | 1剂,4年后加强1剂 | Ⅳ | 美国 | 100% |
| 11~55岁[47] | 1剂,4~6年后加强1剂 | Ⅱ | 美国 | 99%,加强免疫后诱导机体产生强烈免疫应答 | ||
| 持久性 | 11~18岁[52] | 1剂 | Ⅲ | 美国 | 3年后,分别为21%、62%、53%、71% | |
| ≥18岁[57] | 1剂 | Ⅳ | 美国 | 初次免疫4年后,46.3%~72.2% | ||
| 11~55岁[47] | 1剂 | Ⅱ | 美国 | 免疫后4~6年,38.7%~68.5% |
自2005年全球首款MPCV-ACYW疫苗应用以来,多项研究已证明MPCV-ACYW疫苗在真实世界使用安全可靠,不同年龄人群,无论单独接种或是与其他疫苗同时接种,不良反应以轻度为主,且一般于2~3日内可自行缓解。
接种MPCV-ACYW疫苗的婴幼儿中[31,35,36,58],常见的局部反应是注射部位疼痛(0.4%~36.0%)和红斑(3.5%~17.0%);常见的全身不良事件是易激惹(1.3%~52.0%)、嗜睡(0.6%~48.0%)和食欲减退或饮食习惯改变(15%~26%)、发热(4%~50%)。我国一项3~5月龄婴儿接种MPCV-ACYW疫苗的Ⅲ期临床试验[36],接种后不良反应均以轻度为主,未发生与疫苗有关的严重不良事件,具有良好的安全性,其中全身不良反应以发热、哭闹和腹泻为主,局部不良反应以触痛、红和肿为主,发生率均低于对照组(对照为国内已上市多糖结合脑膜炎球菌疫苗),差异具有统计学意义。上市后安全性研究显示,2~23月龄接种MPCV-ACYW疫苗后报告0.46%的非疫苗相关的严重不良反应事件,无死亡病例报告,与疫苗临床研究试验结果一致,未发现新的安全性问题[59]。
研究显示,2~10岁儿童中接种MPCV-ACYW疫苗,常见的局部反应是注射部位疼痛、红斑和硬结;常见全身不良反应为易激惹、嗜睡、全身不适和头痛等,具有良好的安全性[36,60,61]。青少年和成年人中接种MPCV-ACYW疫苗,常见的局部反应与儿童基本相似,为注射部位疼痛、红斑、肿胀或硬结;常见的全身不良事件与儿童有所不同,为头痛、肌痛、乏力和发热等,但也表现出良好安全性[37,62,63,64]。
综上所述,无论婴幼儿、儿童、青少年和成人接种MPCV-ACYW疫苗后,常见的局部反应为接种部位疼痛、红肿等,常见的全身反应为发热等,大多数表现较轻,可自行缓解,上市后研究与疫苗临床研究结果一致,具有良好的安全性。
WHO表明,同时接种多种疫苗不会产生负面影响,联合接种能减少接种次数,降低受种者不适感。美国免疫实践咨询委员会(ACIP)中对没有特定禁忌证的儿童,也建议所有符合年龄条件、适当剂量的疫苗进行联合接种,几种灭活疫苗之间、一种灭活疫苗与一种减毒活疫苗可无时间间隔同时接种。澳大利亚卫生部发布的《预防接种手册》明确规定同一部位间隔2.5 cm可接种两种疫苗[65]。
为证实MPCV-ACYW疫苗与其他疫苗同时接种,对疫苗的安全性和免疫原性不会产生负面影响。MPCV-ACYW-CRM197疫苗上市后,开展了相关研究。结果显示,在不同国家和人群中与甲型肝炎病毒疫苗、乙型肝炎病毒疫苗、B型流感嗜血杆菌疫苗、脊髓灰质炎灭活疫苗、百白破疫苗、7价肺炎链球菌结合疫苗、13价肺炎链球菌多糖结合疫苗、轮状病毒疫苗、麻腮风疫苗、水痘疫苗、麻腮风-水痘疫苗、人乳头瘤病毒疫苗、B群脑膜炎球菌疫苗、黄热病疫苗、狂犬病疫苗、伤寒疫苗、乙脑疫苗等联合接种,未观察到临床相互作用[66,67],证实四价脑膜炎球菌多糖结合疫苗与常规疫苗、旅行者疫苗等联合接种,具有一定的安全性和可靠性。另外,疫苗接种部位多元化,有助于联合接种。目前,全球已上市的5款MPCV-ACYW疫苗均可在上臂三角肌肌肉接种,其中两款(包含国产疫苗)推荐1岁以内的婴儿可在大腿前外侧肌肉接种,为联合接种提供便利的同时也有效降低了不良反应发生率。
全球脑膜炎球菌不断变迁,不同地区、不同国家脑膜炎球菌病致病菌群和发病情况各有不同。众多国家根据本国疾病监测的结果适时调整免疫策略,将MPCV-ACYW疫苗纳入使用范围,脑膜炎球菌病防控取得显著效果。
2005年ACIP建议11~12岁青少年常规接种MPCV-ACYW疫苗,2010年推荐为16岁青少年加强接种[68],结果显示2006—2010年基础免疫后11~15岁由C、W、Y群引起的脑膜炎球菌病病例下降了67%,加强接种后(2011—2017年)发病率由0.61例/10万下降到0.15例/10万,表明MPCV-ACYW疫苗应用后,显著降低青少年脑膜炎球菌病的发病,尤其是脑膜炎球菌C、W、Y群引起的病例。
智利2006年起W群引起的脑膜炎球菌病呈增加趋势,2012年W群病例显著性上升且暴发事件增多,智利2012年开始在9月龄~4岁人群中开展大规模MPCV-ACYW应急接种,并于2014年纳入国家常规免疫规划,W群的发病率由2012年的1.3例/10万下降至2016年的0.1例/10万,病死率也由2012年的23%下降至2016年的0,结果显示MPCV-ACYW在该国脑膜炎球菌病防控中发挥了重要作用[69]。
2015年英国ST-11型菌株引起全国性W群脑膜炎球菌病暴发事件,英国立即实施青少年接种MPCV-ACYW疫苗免疫策略[70],W群病例在12个月内趋于稳定后显著下降,对C、Y、W群脑膜炎球菌病的总体有效率为94%,进一步证明MPCV-ACYW对脑膜炎球菌病防控的有效性。
脑膜炎球菌病的传染源是患者和无症状带菌者,其中无症状带菌者是主要的传染源。接种结合疫苗可有效降低发病和带菌,建立免疫屏障,起到群体免疫效果。结合疫苗可降低带菌是由于接种后T细胞的CD4+ Th1和Th17亚家族被激活,释放的细胞因子激活,召集巨噬细胞和中性粒细胞迁移到黏膜表面,与循环中渗出的抗体共同清除细菌,减少传播的风险[71]。英国在一项Ⅲ期临床试验中观察18~24岁的英国大学生中接种1剂MenACYW-CRM197疫苗对脑膜炎球菌携带的影响,结果发现在接种疫苗后的12个月内,使用MenACYW-CRM197导致C、W和Y群脑膜炎球菌的携带率显著下降了36.2%[72]。
2013年波兰士兵接种MenACYW-CRM197疫苗,脑膜炎球菌携带率为1.2%[73],显著低于未接种疫苗的士兵(9.6%),提示MenACYW-CRM197疫苗可有效降低带菌率。2015年英国将MPCV-ACYW纳入疫苗接种计划,15~19岁人群C、W和Y群合并携带率从2.03%下降到0.71%(P<0.001),并维持C群的低携带率[74],脑膜炎球菌病的病例数和发病率均呈下降趋势。为应对W群暴发,荷兰于2018年引入MPCV-ACYW替代国家免疫规划中C群多糖结合疫苗,接种4年后,发现疫苗相关血清群携带率下降3.8倍,而疫苗未包含的E群携带率升高9倍(P<0.001)[75]。以上研究均表明MPCV-ACYW疫苗应用可以降低脑膜炎球菌的携带率,从而间接产生群体保护作用,减少脑膜炎球菌病发病。
多价多糖结合疫苗广泛应用在控制脑膜炎球菌病流行和降低疾病负担方面发挥了重要作用,针对我国目前流行病学和疫苗应用现状,仍存在多个需解决的问题:
国际上大多数国家的疫苗接种已完成从多糖疫苗到多糖结合疫苗的过渡,且将多价多糖结合疫苗纳入国家免疫规划。我国扩大免疫规划中仍以多糖疫苗为主,多糖结合疫苗尚未纳入。为克服多糖疫苗局限性,国内疫苗企业也研发上市多款多糖结合疫苗,为2岁以下婴幼儿提供保护,但仅覆盖A群和C群,2岁以下婴幼儿仍缺乏W群和Y群的保护。2021年,我国首款MPCV-ACYW疫苗上市,以期为国内婴幼儿提供更广泛的菌群保护。因此,相关部门或机构可从流行病学、疫苗免疫效果和疫苗的经济学效益等多方面进行论证,开展有针对性的调查研究,解决MPSV和MPCV之间的序贯接种和替代接种问题,为国家免疫策略的适时调整提供科学可行的依据。
国内多个疫苗公司可自主研发和生产多糖结合疫苗,但各公司疫苗的起始接种年龄、免疫接种剂次和免疫程序各有不同,给基层使用造成极大困扰。因此,建议国内各部门及不同疫苗生产企业加强协作研究,对已上市脑膜炎球菌结合疫苗免疫程序进行规范,对未上市的多糖结合疫苗,在审批时就进行免疫程序的统一,切实解决当前基层卫生机构开展脑膜炎球菌疫苗接种时遇到的问题。
全球大多数国家在强大高效的监测体系和持续对上市后疫苗临床研究数据收集与评估双重作用下,根据各国脑膜炎球菌病流行病学和疫苗临床研究等方面的数据,制定和适时调整免疫策略。在我国疫苗研发与免疫策略制定时,也需持续开展流行病学调查与疫苗上市后研究,不断完善婴幼儿、儿童、青少年和成人的临床研究数据与疫苗免疫持久性等方面的证据,为我国人群的脑膜炎球菌病的免疫程序和策略制定提供科学的数据支持。
SBA是WHO推荐的评价脑膜炎球菌疫苗免疫原性和保护力的金标准,目前采用流脑血清群hSBA效价≥1∶4或rSBA≥1∶8作为疫苗上市获得许可的标准。SBA检测是在体外模拟抗原抗体复合物在补体介导下的抗体杀菌试验,存在程序不易标准化、人源补体不易获得、应用兔源补体与人源补体抗体滴度间关系不确定、补体来源不同导致结果差异大等问题,而且SBA滴度与各型疫苗的保护力相关性尚需进一步的证实[76]。因此,需要实验室不断优化脑膜炎球菌疫苗免疫效果评价指标。
B群已成为我国和全球脑膜炎球菌主要流行菌群。目前欧洲、美国、加拿大等地区已批准多款B群脑膜炎球菌疫苗上市,但我国尚无B群脑膜炎球菌疫苗。同时多联多价疫苗已成为全球疫苗研发的趋势。2023年10月20日,辉瑞研发的Penbraya™获得美国FDA的批准,用于10~25岁青少年和年轻人,成为全球首个获批可覆盖A、B、C、Y和W群脑膜炎球菌疫苗的五价疫苗[77]。而葛兰素史克的五价疫苗MenABCWY和印度血清研究所MenACWXY[78,79](NmCV-5)Ⅲ期临床研究均显示具有良好的安全性和免疫原性。因此,我国应加强引导和重点支持我国B群脑膜炎球菌疫苗和多价多糖结合疫苗研发工作,以有效应对我国流脑菌群多元化的威胁。
随着脑膜炎球菌疫苗广泛使用,我国流脑发病率已显著下降。但为应对脑膜炎球菌菌群持续变化与多元化的流行趋势,仍需不断提高脑膜炎球菌病的监测能力。多联多价的联合疫苗是未来疫苗发展的趋势和优先考虑推荐接种的疫苗,具有覆盖面广、减少接种剂次、不良反应发生率低等优势。持续对上市的多价多糖结合疫苗开展临床研究数据收集与评估,可为完善脑膜炎球菌疫苗免疫策略提供科学的数据支撑。同时,应重点支持B群及多价脑膜炎球菌疫苗的研发,实现脑膜炎球菌的有效防控。
徐娟,严冬山,徐丽,等.全球脑膜炎球菌多糖结合疫苗研究进展[J].中华微生物学和免疫学杂志,2024,44(4):304-316. DOI: 10.3760/cma.j.cn112309-20231229-00198.
所有作者声明无利益冲突



























