
硬脑膜病变是以硬脑膜增厚与异常强化为特征的一类疾病,肿瘤、自身免疫等病因均可累及硬脑膜。MRI具有无创、多参数及软组织分辨率高等优点,在识别硬脑膜病变影像学特征中有很重要的作用。该文旨在综述各类病因下硬脑膜病变的临床特点及MRI表现,为广大影像医师提供诊断及鉴别诊断硬脑膜病变要点,以求进一步提高对硬脑膜病变的认识,辅助临床诊断与治疗。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
经全国继续医学教育委员会批准,本刊开设继教专栏,每年从第1期至第10期共刊发10篇继教文章,文后附5道单选题,读者阅读后可扫描标签二维码答题,每篇可免费获得Ⅱ类继教学分0.5分,全年最多可获5分。
硬脑膜可因肿瘤、自身免疫等多种病因而受累,主要表现为硬脑膜异常增厚与强化。不同病因的硬脑膜病变特征不尽相同,且与预后密切相关,早期识别硬脑膜异常改变十分重要。MRI具有无创、多参数及软组织分辨率高等优点,在硬脑膜疾病早期诊断及预后判断方面具有重要有价值。
脑膜由覆盖在中枢神经系统表面的三层结构组成,由外向内依次为硬脑膜、蛛网膜和软脑膜[1]。硬脑膜是由结缔组织构成的厚实且坚硬的膜,分内、外两层,外层为富含血管和神经的骨内膜层,内层为脑膜层,可延伸形成大脑镰、小脑幕及鞍膈等结构。由于骨内膜层的血管内皮细胞间缺乏紧密连接,硬脑膜无血脑屏障,约50%正常人在MRI增强扫描中可见硬脑膜不连续、薄线样强化。蛛网膜是一层较薄且疏松的紧贴于硬脑膜的结构,而软脑膜紧贴脑表面,可深入脑沟、脑池。由于软脑膜含有丰富的小血管及毛细血管,且内皮细胞间紧密连接,软脑膜存在血脑屏障。目前影像学检查难以区分蛛网膜及软脑膜,一般将其合称为柔脑膜,正常情况下柔脑膜不强化。
因此脑膜具有两种异常强化模式[2]:(1)硬脑膜强化,为大脑表面连续、增粗的粗线样或结节状强化,可累及大脑镰及小脑幕等结构,不伸入脑沟及脑池(图1);(2)柔脑膜强化,为大脑表面粗线样或结节状强化(图2),特点在于可伸入脑沟及脑池[1]。

MRI具有无辐射、多序列及多参数的特点,且较其他影像学检查软组织分辨率高,在临床工作中作为评估脑膜病变的首选影像学检查方法。MRI平扫可对硬脑膜病变进行解剖定位,但诊断能力较差,临床中常用T1WI、T2WI及液体衰减反转恢复序列(fluid attenuated inversion recovery,FLAIR),增强MRI图像可显示硬脑膜病变强化分布及特点,优于对比增强CT及MRI平扫。此外,多模态MRI还可用于评估硬脑膜病变水分子扩散及代谢等特点。DWI结合ADC可评估占位性病变扩散受限情况。磁共振灌注成像(perfusion weighted imaging,PWI)可获得相对脑血流量(relative cerebral blood flow,rCBF)及相对脑血容量等参数,可用于定量评估脑实质及硬脑膜病灶灌注信息。MRS可评估硬脑膜病灶的代谢及生化情况。
1.脑膜瘤:脑膜瘤是最常见的原发性中枢神经系统肿瘤之一,约占颅内肿瘤37.6%[3],好发于老年人,女性发病率多于男性。大多数脑膜瘤侵袭性低,常在MRI检查中偶然发现。脑膜瘤为脑外肿瘤,起源于蛛网膜帽细胞,其病灶部位与蛛网膜颗粒细胞分布的部位一致,约89%脑膜瘤位于幕上,主要好发于大脑凸面、矢状窦旁及大脑镰旁等部位。
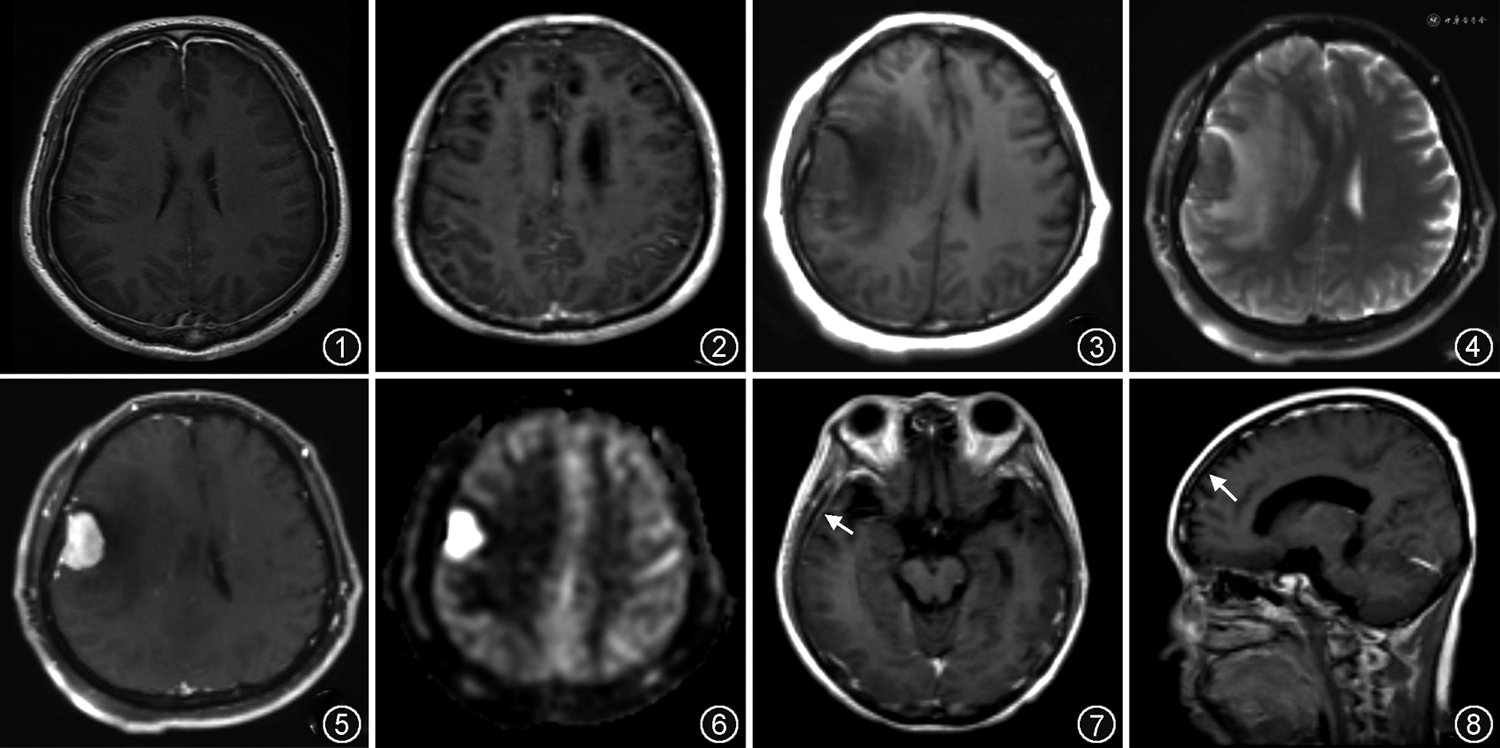
脑膜瘤大多为球形或分叶形,边界清晰,以广基底与硬脑膜相连,少数可沿硬脑膜呈浸润性生长,表现为扁平状或盘状。大部分脑膜瘤T1WI呈等或稍低信号,T2WI呈等或稍高信号,增强后一般为均匀强化,约60%病灶伴有硬膜尾征(图3~6),即邻近肿瘤的硬脑膜增厚,增强扫描呈窄带状强化,随着远离肿瘤而逐渐变细呈鼠尾状或线状,但硬膜尾征并非脑膜瘤的特异性表现,也可见于淋巴瘤、胶质瘤等肿瘤[4]。裂隙征也是脑膜瘤的表现之一,指肿瘤与周围脑组织之间存在薄层脑脊液,T2WI呈高信号,代表脑膜瘤无脑实质受累。此外,瘤周水肿、囊变、出血、钙化及瘤内血管征等其他表现也可见于脑膜瘤。PWI被推荐用于区分脑膜瘤、硬脑膜转移瘤及高级别胶质瘤。研究证实肺癌、乳腺癌等肿瘤的硬脑膜转移瘤的rCBF显著低于脑膜瘤。在MRS中,脑膜瘤属于脑外肿瘤,因而不含N-乙酰基天冬氨酸(N-acetyl aspartate,NAA),但胆碱(Choline-containing compounds,Cho)可显著增加,脑膜瘤还可表现为特征性丙氨酸峰增高,而脑转移瘤或高级别胶质瘤中未见显示[4, 5]。
2.淋巴瘤:中枢神经系统淋巴瘤按来源可分为原发性与继发性淋巴瘤。硬脑膜淋巴瘤是一种罕见的原发于硬脑膜的中枢神经系统淋巴瘤,占比小于1%,通常为低度恶性的B细胞边缘区淋巴瘤[3,6, 7, 8],好发于大脑凸面、大脑镰、小脑幕及鞍区等部位。
硬脑膜淋巴瘤为脑外肿瘤,多发较单发常见,边界清晰,具有广泛的硬脑膜附着,可伴硬膜尾征,有时硬脑膜淋巴瘤也可表现为块状增厚。硬脑膜淋巴瘤在T1WI上呈等或稍低信号,在T2WI上表现为低信号(图7,8)。由于硬脑膜淋巴瘤为致密细胞性肿瘤,DWI呈均匀较高信号,ADC呈较低信号,表现为明显扩散受限,类似于其他原发性中枢神经系统淋巴瘤[9, 10]。增强后肿瘤明显强化伴硬膜尾征。大多数硬脑膜淋巴瘤病灶可挤压皮质向内移位,并导致邻近的脑实质血管源性水肿,表现为T2WI及FLAIR高信号。其他表现还包括脑实质浸润、骨质破坏及增生等[8],但脑实质坏死、脑积水和软脑膜强化十分少见[9]。硬脑膜淋巴瘤累及颅骨骨质时其表现可类似于脑膜瘤,但多模态MRI可进一步提示鉴别征象。与脑膜瘤相比,硬脑膜淋巴瘤在DWI及ADC中扩散受限更加明显,且有更大范围的溶骨性破坏及邻近血管源性水肿,在PWI中硬脑膜淋巴瘤rCBF更低[11],以及在MRS中出现特征性脂质峰,伴有NAA峰降低,Cho峰增高[10]。
3.组织细胞肿瘤:组织细胞肿瘤是以组织细胞在各组织器官中积累为特征的一类罕见疾病,既往被认为与炎性改变相关,近年来研究发现部分病变具有激活MAPK通路突变等恶性肿瘤的特征,在《2021年WHO中枢神经系统肿瘤分类》中被归为肿瘤性病变。主要包含朗格汉斯细胞组织细胞增生症(langerhans cell histiocytosis,LCH)、Erdheim-Chester病(Erdheim-Chester disease,ECD)及Rosai-Dorfman病(Rosai Dorfman disease,RDD)等疾病。RDD又称为窦组织细胞增生伴巨淋巴结病,可累及淋巴结及结外组织,结内病变常好发于儿童及青年,表现为双侧颈部淋巴结肿大,结外病变好发于中年男性,可累及皮肤、上呼吸道及骨等部位,其中中枢神经系统受累少见,约占所有病例的5%。ECD又称为多骨硬化性组织细胞增生症,绝大多数患者为中老年男性,常表现为骨肌受累,但40%~50%的患者还伴中枢神经系统受累,以硬脑膜与脑实质最为常见[12]。研究证实组织细胞肿瘤中枢神经受累可增加患者残疾率和死亡率[13, 14],因此早期诊断有重要意义。
RDD和ECD患者硬脑膜受累较为多见且病变类似,常表现为单发或多发的硬脑膜肿块,边界清晰,少数可表现为弥漫性硬脑膜增厚。二者病变类似于脑膜瘤易被混淆,一般来说,当病灶表现为多发时倾向于考虑RDD或ECD而非脑膜瘤,且ECD多发较RDD常见[15]。此外,二者影像学特点及其他颅内表现也可提供鉴别诊断思路。
RDD累及硬脑膜时常好发于大脑凸面、海绵窦、鞍上和岩斜区等部位[11,16],少部分可表现为柔脑膜、鞍区及脑实质等部位受累[17]。病灶在T1WI呈等信号,在T2WI、DWI均呈低信号(图9~12),伴病灶周围脑实质明显水肿[16,18, 19],增强后表现为均匀强化伴硬膜尾征,少数病灶边缘可出现沿脑沟向脑实质内延伸的“伪足样”改变,提示柔脑膜受累[17]。RDD还可累及全身骨骼表现为多中心溶骨性骨质破坏[20]。
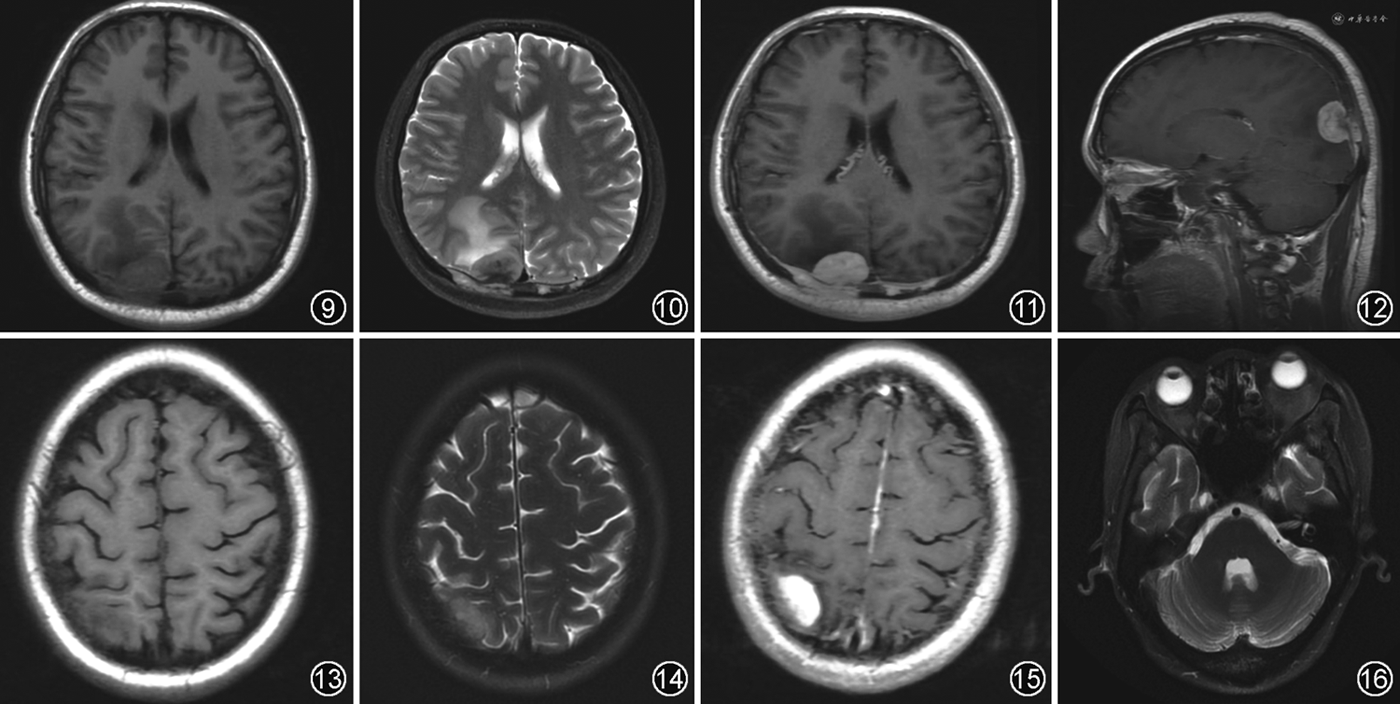

ECD常累及大脑镰、小脑幕及蝶鞍等硬脑膜。在T1WI呈等信号,T2WI呈等或低信号,增强后明显均匀强化[12,21, 22](图13~15)。ECD还可累及脑实质引起小脑综合征和锥体综合征等症状,有时还因肿块压迫导致梗阻性脑积水[23]。脑实质受累常见于幕下脑组织(如小脑齿状核及脑桥),一般表现为结节或肿块,呈双侧对称性T1WI低信号、T2WI高信号,增强后强化程度不一,大部分病灶可见强化,且病灶周围常无水肿。当累及下丘脑-垂体轴时,可出现中枢性尿崩症等症状。此外,ECD可累及颅面部骨骼或眼眶而表现为窦壁骨质增生硬化或眶内肿块[7,12,22](图16),而RDD一般为溶骨性破坏,且无眶内受累。
4.硬脑膜转移瘤:根据脑膜解剖分层,肿瘤的脑膜转移可分为硬脑膜转移及柔脑膜转移,多见于实体瘤及血液系统肿瘤患者[24, 25, 26]。其中硬脑膜转移是指硬脑膜被肿瘤细胞浸润,约61%为颅骨直接延伸,包括硬膜外转移及硬膜下转移[22],伴有颅骨骨质破坏。发生硬脑膜转移的非中枢神经系统性肿瘤主要有乳腺癌、前列腺癌、肺癌及恶性黑色素瘤等[27]。MRI平扫中硬脑膜病变信号可与原发肿瘤相似[28],增厚的硬脑膜在T1WI上常表现为等或低信号,但在T2WI上表现不一,可为高信号或低信号(图17~20);增强后表现为颅骨内板连续、增粗的弧形强化,且不深入脑沟及脑池,约50%的病例中存在硬膜尾征,当肿瘤细胞聚集时可形成大小不等的异常强化结节。硬脑膜转移瘤特点多样而不易鉴别,需结合原发肿瘤影像学特征综合判断。在PWI中,大多数硬脑膜转移瘤的rCBF减低,但某些转移瘤如肾癌、黑色素瘤等肿瘤因血供丰富表现为灌注明显增加。此外,某些肿瘤特征性信号也有一定提示作用,如黑色素瘤中的黑色素为顺磁性,在MRI上表现为特征性的T1WI高信号、T2WI低信号[29]。
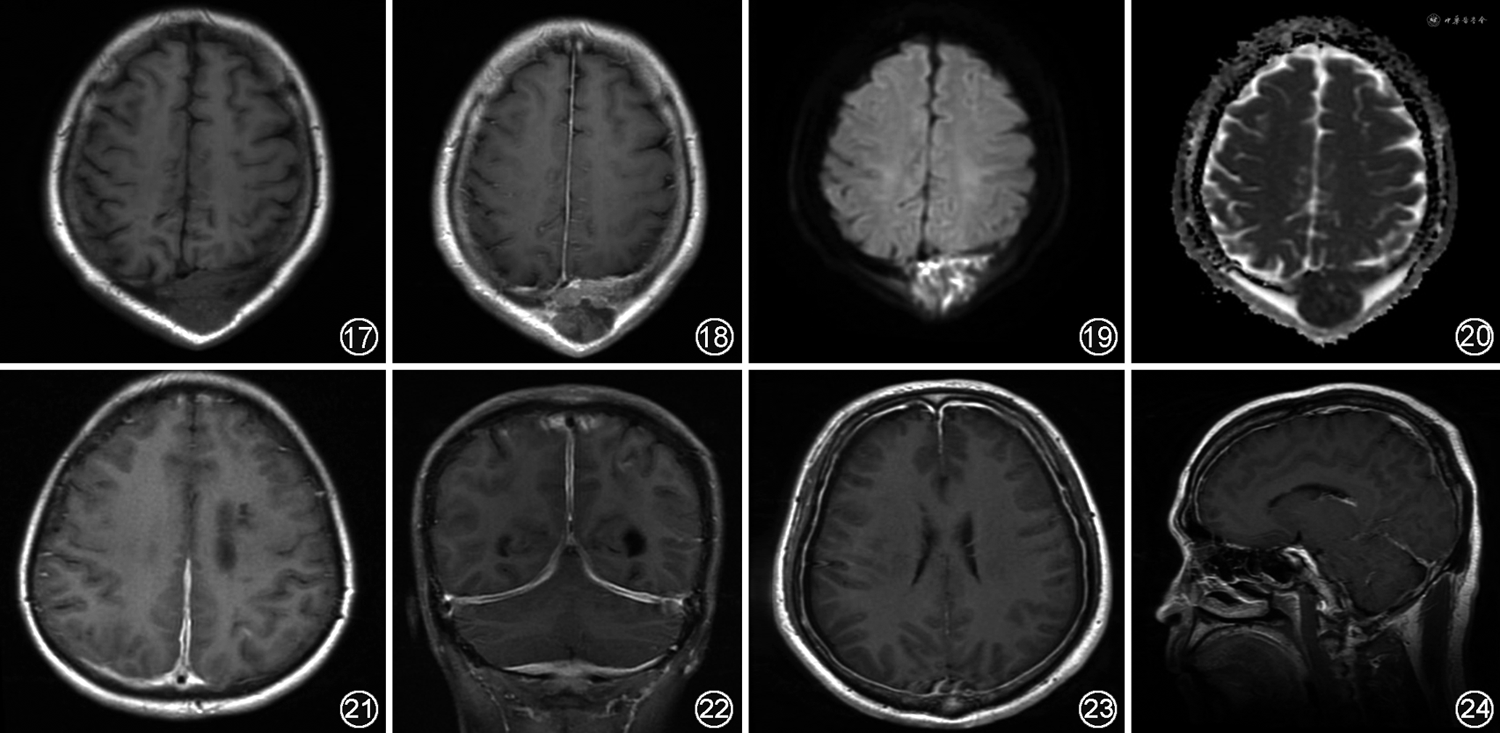

1.肥厚性硬脑膜炎:几乎所有系统性自身免疫性疾病都可累及中枢神经系统,其中部分表现为累及硬脑膜,最常见的是肥厚性硬脑膜炎。按病因来源肥厚性硬脑膜炎可分为特发性及继发性,特发性肥厚性硬脑膜炎是指病因并不十分明确者,而继发性肥厚性硬脑膜炎中自身免疫性因素最为常见,常见于IgG4相关疾病及抗中性粒细胞胞浆抗体(anti-neutrophil cytoplasmic antibody,ANCA)相关血管炎。肥厚性硬脑膜炎是一种以硬脑膜增厚及纤维化为主要特征的罕见神经系统疾病,主要临床症状为头痛,可伴有多组颅神经麻痹[30, 31]。硬脑膜炎可通过硬膜活检确诊,或脑脊液检查作排除性诊断。在临床中硬脑膜炎症状加重快,因此无创、方便的MRI检查在诊断硬脑膜炎中有很高的价值。一般来说,硬脑膜可表现为弥漫性或局灶性增厚。增厚的硬脑膜在T1WI呈等或略低信号,在T2WI、FLAIR及DWI上呈低信号,其中T2WI信号程度与纤维成分含量有关,纤维成分越多,T2WI信号越低,增强后表现为线状或结节状强化[32];在冠状面上可见特征性的“埃菲尔夜间征”(或“奔驰征”),即大脑镰后部和小脑幕硬脑膜外周边缘强化而中央无强化[33, 34, 35](图21,22)。
IgG4相关疾病是由免疫球蛋白IgG4介导的纤维炎性疾病,病理特征为大量IgG4阳性的浆细胞、淋巴细胞浸润及纤维炎性改变,常伴血清IgG4水平升高。IgG4相关疾病患者中肥厚性硬脑膜炎患病率约为2%[11],还可伴有漏斗垂体炎和周围神经疾病表现。硬脑膜受累主要表现为硬脑膜弥漫性线状增厚或局灶性结节样病变,在T2WI图像上呈低信号,增强扫描明显强化。病变可环绕颅内神经,沿三叉神经扩张与延伸较为常见[1]。
ANCA相关血管炎是一种累及小动脉的系统性血管炎,病理类型分为肉芽肿性多血管炎、显微镜下多血管炎和嗜酸性肉芽肿性多血管炎,其中肉芽肿性多血管炎硬脑膜受累较另外两者常见,约占82%[29, 30]。其硬脑膜增厚有两种分布模式:一种是鼻窦或眼眶病相邻的局灶性硬脑膜增厚伴强化,硬脑膜增厚较为局限,另一种为与鼻窦或眼眶病无关的弥漫性硬脑膜炎,可观察到弥漫性硬脑膜增厚[36],信号特点类似于其他肥厚性硬脑膜炎。
2.结节病:结节病是一种可累及中枢神经系统的肉芽肿性疾病,主要病理改变为非干酪样坏死性肉芽肿,可累及肺、肝脏及眼睛等其他器官[1],累及中枢神经系统时称为神经结节病。国外文献报道神经结节病占结节病5%~34%[37, 38],国内极为罕见,在临床中倾向采用排除方法对其他病因学进行合理的排除[28]。结节病主要表现为颅神经麻痹(主要为面神经和视神经)、慢性头痛及脑实质结节性病变等。神经结节病可累及硬脑膜,表现为硬脑膜局灶性肿块或弥漫性增厚,T2WI呈低信号,边缘呈不规则或结节状,增强扫描可见明显强化。此外,当下丘脑-垂体轴受累时,MRI可显示垂体柄增粗、腺体增大,部分病例可观察到垂体后叶T1WI高信号的丢失[11]。
低颅压综合征是一种由于颅内脑脊液量减少、压力下降,继而发生硬脑膜血管充血和间质水肿的疾病。93.1%的病例表现为体位性头痛,即卧位变换立位时头痛加重,恢复卧位时头痛消失或缓解[1]。表现为双侧硬脑膜对称、均匀增厚,可伴硬膜下积液,增厚的硬脑膜在T1WI呈稍低或等信号,T2WI呈稍高或高信号。增强后表现为弥漫性、均匀线样强化,可同时累幕上及幕下[39](图23,24)。若发生脑脊液漏,磁共振脊髓造影可观察到蛛网膜下腔异常走行的片絮状高信号。低颅压综合征还可合并获得性小脑扁桃体下疝畸形、垂体肿大、视交叉下移、脑桥变平与脑脊液池消失等其他颅内改变[40],为进一步鉴别诊断提供依据。
硬脑膜疾病病因广泛,临床表现及硬脑膜累及特点不尽相同,正确认识硬脑膜的解剖结构及其影像学特征十分重要,可借助MRI平扫及增强序列针对性分析硬脑膜受累部位、病灶分布特点及信号特征,结合多模态MRI检查进一步综合判断颅内硬脑膜病变性质,实现早期诊断及鉴别诊断硬脑膜病变,助力临床决策实施。
李钟惠, 有慧, 冯逢. 硬脑膜病变的MRI表现[J]. 中华放射学杂志, 2024, 58(5): 558-563. DOI: 10.3760/cma.j.cn112149-20240209-00069.
中华医学会放射学分会磁共振学组对本栏目给予大力支持
所有作者声明无利益冲突
1.累及硬脑膜较为常见的肿瘤不包括()
A.乳腺癌
B.脑膜瘤
C.淋巴瘤
D.肺癌
2.“奔驰征”常见于下列哪种疾病()
A.结核性脑膜炎
B.肥厚性硬脑膜炎
C.化脓性脑膜炎
D.病毒性脑膜炎
3.脑膜瘤最好发于哪个部位()
A.桥小脑角区
B.小脑幕
C.矢状窦旁
D.大脑凸面
4.下列哪种疾病可表现为颅内双侧对称性改变()
A.Rosai-Dorfman病
B.神经结节病
C.Erdheim-Chester病
D.低颅压综合征
5.下列关于Erdheim-Chester病说法正确的是()
A.可累及颅面部骨骼导致骨质增生硬化
B.可发生多中心溶骨性骨质破坏
C.可发生脑实质受累,常累及幕上脑组织
D.可累及柔脑膜,表现为“伪足样”改变



























