
第5版WHO甲状腺肿瘤分类提出高级别非间变性甲状腺滤泡源性癌,包括传统甲状腺低分化癌(PDTC)和高级别分化型甲状腺癌(DHGTC),预后介于高分化甲状腺癌和间变性甲状腺癌(ATC)之间,其中约50%患者放射性碘不摄取,因而该分类具有重要临床意义。本文对第5版WHO高级别非间变性甲状腺滤泡源性癌病理诊断标准及其分子特征进行解读,并与ATC进行比较。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
甲状腺滤泡上皮细胞和滤泡旁细胞共同构成甲状腺滤泡,前者通过合成和分泌甲状腺激素调节新陈代谢,后者为弥散神经内分泌细胞,分泌降钙素,参与体内钙代谢调节。甲状腺滤泡上皮源性肿瘤主要包括良性肿瘤、低风险肿瘤和恶性肿瘤[1]。甲状腺滤泡上皮起源的恶性肿瘤又可分为甲状腺乳头状癌(PTC)、甲状腺滤泡癌(FTC)、甲状腺嗜酸细胞癌(OCA)、甲状腺低分化癌(PDTC)和间变性甲状腺癌(ATC)。其中PTC、FTC和OCA合称为分化型甲状腺癌(DTC),占甲状腺癌的90%以上[2]。ATC肿瘤细胞未分化,可有局灶分化,为高度恶性甲状腺癌。第5版WHO甲状腺肿瘤分类提出高级别非间变性甲状腺滤泡源性癌同样为高度恶性甲状腺癌,包括高级别分化型甲状腺癌(DHGTC)和传统PDTC[1,3]。本文将两者与ATC进行比较,对甲状腺高度恶性肿瘤进行解读。
传统甲状腺滤泡上皮细胞起源的癌诊断要点包括PTC细胞核特征、包膜和(或)脉管内癌栓和(或)转移、细胞和组织学异型性及高级别形态学特征。这些诊断标准的判读存在不同程度差异,尤其是在包膜浸润和PTC细胞核特征的判定方面[4, 5],随着分子病理时代的到来而不断更新[1, 2]。
1. PTC细胞核特征:2016年提出具有乳头状核特征的非浸润性甲状腺滤泡性肿瘤(NIFTP)的概念,将PTC细胞核特征诊断要点概括为3点(图1):(1)细胞核大小和尺寸,包括细胞核增大/重叠/拥挤/拉长;(2)核膜不规则度,包括核膜不规则、核沟、核内假包涵体;(3)染色质状态,包括染色质透明伴边集或毛玻璃核[6]。即便对PTC细胞核特征进行了标准化,在国际及亚洲地区乃至我国仍然存在着不同程度的判读差异,从而导致病理诊断的不一致性[5,7, 8]。
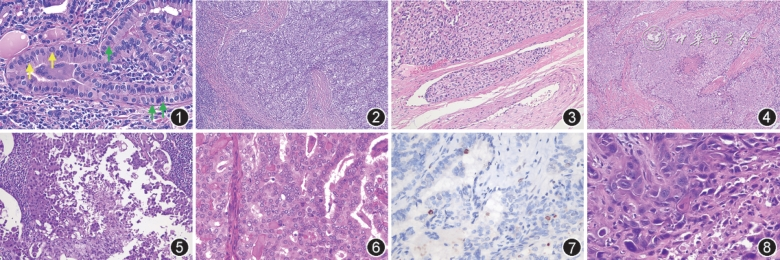

2. 包膜浸润、脉管内癌栓和转移:包膜浸润、脉管内癌栓的判定为有包膜甲状腺滤泡上皮源性肿瘤鉴别诊断的主要依据[1,3]。包膜浸润界定为肿瘤细胞穿透纤维结缔组织包膜,但表层可伴有少许纤维结缔组织反应(图2)。血管浸润界定包括两个方面:一是血管位于纤维结缔组织包膜内、肿瘤包膜外;二是真性血管浸润的判定,即浸润的肿瘤细胞团表面必须被覆血管内皮细胞或伴有纤维素性血栓形成(图3)。而对包膜浸润和血管浸润的判定,需加强认识并采取严格的标准,以避免漏诊和过诊,但对包膜浸润的判定仍然存在不同程度的差异[4,9]。第5版WHO对FTC、浸润性包裹性滤泡亚型PTC、OCA包膜和血管浸润采用相同包膜及血管浸润判定标准,并将三者均分为3个亚型:微小浸润型(仅包膜浸润)、包裹性血管浸润型和弥漫浸润型[3]。
3.高级别形态学特征:第5版WHO建议使用mm2这一标准测量单位替代高倍镜视野来计数核分裂象,以避免显微镜和目镜不同可能产生的判读差异,并可用于数字切片的评估。高级别形态学特征包括肿瘤性坏死、高核分裂活性(核分裂象计数≥5/2 mm2)(图4, 5, 6, 7)。在DTC中,只要出现其中一种特征,即可判定为DHGTC;而PDTC核分裂象计数标准为≥3/2 mm2(图6、7,表1)[1,3]。

高侵袭性甲状腺癌诊断标准及常见免疫表型
高侵袭性甲状腺癌诊断标准及常见免疫表型
| 项目 | 高级别非间变性甲状腺滤泡源性癌 | 间变性甲状腺癌 | |
|---|---|---|---|
| PDTC | DHGTC | ||
| 生长模式 | 实性、梁状、岛状 | 乳头状、滤泡状、实性a | 未分化、局灶可分化 |
| 细胞核 | 无PTC细胞核特征 | 不限 | 显著核多形性 |
| 其他 | 最低要求:以下3项中至少有1项:(1)核分裂象数≥3/2 mm2(2)肿瘤坏死(3)扭曲核 | 最低要求:以下2项中至少有1项:(1)核分裂象数≥5/2 mm2(2)肿瘤坏死 | 显著浸润(腺外浸润多见);坏死、核分裂象、病理性核分裂象常见;血管淋巴管浸润常见 |
| 间变特征 | 无 | 无 | 有 |
| 免疫表型 | |||
| CK | 阳性 | 阳性 | 可阴性 |
| TG | 阳性或阴性 | 阳性 | 可有表达,表达率低 |
| TTF1 | 阳性 | 阳性 | 阴性 |
| PAX8 | 阳性 | 阳性 | 80%阳性表达10336-1-AP; 54.4%阳性表达MRQ-50 |
| Ki67 | 10%~30% | 10%~30% | >30% |
注:PDTC为甲状腺低分化癌;PTC为甲状腺乳头状癌;DHGTC为高级别分化型甲状腺癌;a有实性生长和PTC核特征的肿瘤被归为DHGTC
根据细胞起源、组织形态学和临床生物学特点,高侵袭性甲状腺滤泡源性癌包括高级别非间变性甲状腺滤泡源性癌及ATC[1]。
1. 高级别非间变性甲状腺滤泡源性癌:生物学行为介于预后良好的DTC和预后极差的ATC之间。2000年Akslen和LiVolsi[10]提出根据肿瘤坏死和核分裂象高核分裂比对PTC进行分级。后来发现,即便不考虑肿瘤分化程度,单纯根据高核分裂活性和肿瘤坏死为基础的增殖性分级标准,也可辅助诊断预后介于DTC和ATC之间的甲状腺癌[10, 11, 12, 13]。1983年Sakamoto等[14]曾提出将低分化实性、梁状和岛屿状结构作为高级别癌的形态学标准,即所谓Sakamoto低分化癌。2006年,Hiltzik等[11]提出根据肿瘤性坏死和高核分裂活性定义甲状腺低分化癌,被第5版WHO用作DHGTC诊断标准[1]。第4版WHO采用2007年Turin共识提出的PDTC组织学诊断标准为:(1)滤泡上皮细胞起源的癌;(2)实性、梁状和岛屿状生长模式;(3)缺乏PTC细胞核特征;(3)具有以下3条中至少1条,即扭曲核、10个高倍镜视野≥3个核分裂象和肿瘤性坏死[15, 16]。第5版WHO甲状腺肿瘤分类中提出高级别滤泡细胞起源非间变性甲状腺癌,特指具有高级别组织学特征、缺乏间变、恶性程度高、预后介于DTC和ATC之间的甲状腺滤泡上皮源性癌。这些肿瘤可能分化差,也可表现为具有高级别形态学特征的其他高分化癌(如PTC,FTC和OCA)的相应组织学特征,可进一步分为传统PDTC和DHGTC[1,3,16, 17](表1)。DHGTC为浸润性DTC[1],保留了高分化癌的组织结构和(或)细胞学特性,如PTC核特征和(或)结构、FTC的滤泡生长模式,但同时可查见高核分裂活性和(或)肿瘤性坏死。两者组织学特点包括:(1)PDTC呈实性、小梁状或岛状生长,DHGTC绝大多数呈乳头状、滤泡状;(2)“葡萄干样”核:少数PDTC肿瘤细胞有,DHGTC则无;(3)肿瘤坏死:两者均可有;(4)如无肿瘤坏死,PDTC核分裂象计数≥3/2 mm2,而DHGTC为≥5/2 mm2;(5)PTC细胞核特征:PDTC中无,DHGTC可有或无;(6)DHGTC常见血管、淋巴管、神经周围浸润和甲状腺外侵犯。两者均不同程度表达滤泡上皮细胞免疫标记物,Ki67增殖指数高,通常在10%~30%。
2. ATC:ATC为间变性或未分化肿瘤细胞构成的高侵袭性甲状腺恶性肿瘤,可直接发生,也可由DTC去分化而来,可局灶表现为甲状腺滤泡上皮分化和(或)原DTC[1]。第5版WHO甲状腺肿瘤分类中将鳞状细胞癌归为ATC亚型(图8)。患者多表现为颈部迅速增大、固定不活动广泛浸润性结节。最常见症状为疼痛、声音嘶哑、呼吸和吞咽困难。肉眼可见肿瘤浸润性生长,切面多为灰白色、鱼肉样,伴出血和坏死。根据其形态学特征,可分为肉瘤样型、巨细胞型和上皮型,肿瘤均伴有坏死、核分裂象增多、浸润性生长。30%~40%患者伴有远处转移,最常见肺、骨和脑转移。
在分子病理时代,甲状腺病理诊断中免疫组化染色的应用已从传统的明确甲状腺肿瘤起源发展到鉴别肿瘤良恶性和预测临床生物学行为[18, 19]。第5版WHO甲状腺肿瘤分类提倡对所有甲状腺肿瘤进行磷酸组蛋白H3和Ki67免疫组化染色,以有效判定核分裂象,辅助肿瘤分级(图7)[1]。BRAF特异性抗体可有效鉴别PTC和ATC中的BRAFV600E基因突变,特异性100%,敏感性98.7%,推荐用于良恶性甲状腺滤泡上皮肿瘤的诊断(如NIFTP与滤泡亚型PTC的鉴别诊断),并强调必须对所有ATC进行及时的BRAFV600E突变检测[1,20]。
免疫标记物TTF1、PAX8、上皮角蛋白(CK)和甲状腺球蛋白(TG)在PDTC和DHGTC均可表达。Ki67增殖指数高,通常为10%~30%。在嗜酸细胞肿瘤中TG多为局灶性、点状弱阳性[21]。ATC中TG、TTF1多失表达,但约80%可表达多克隆PAX-8抗体10336-1-AP,54.4%可表达单克隆PAX-8抗体MRQ-50[22];CK阳性表达支持其上皮起源,但CK阴性不能完全排除ATC;Ki67增殖指数常高于30%。辅助免疫组化染色可排除其他肿瘤类型,如甲状旁腺癌和甲状腺转移癌,并可用于证实是否存在真性血管内癌栓。
在分子特征上,PDTC和DHGTC存在BRAFV600E、RAS或少数基因融合(常为RET或NTRK3)驱动突变[11,23]。此外,两者不同程度存在继发侵袭性基因异常,最常见的是TERT启动子和少数PI3K/PTEN/AKT和TP53等基因异常[24, 25, 26, 27]。PDTC中RAS突变多见,这是其诊断标准中首先要求肿瘤细胞缺乏PTC核特征的结果[24]。相反,DHGTC中BRAF突变更常见,因为多数DHGTC为高级别PTC,基因融合也高达25%[11, 12,24,28]。基因融合(如ALK、NTRK、RET融合等)相关PTC晚期病例多见,易复发,病程持久,因此也被归入BRAF样突变[29, 30]。染色体1q扩增常见于侵袭性或晚期组织学高级别PTC。TP53突变见于PDTC和DHGTC中,但ATC中更多见。
ATC通常携带复合性分子异常。RAS(10%~50%)和BRAFV600E(10%~50%)突变为早期分子异常[1, 2]。后期最常见分子异常包括TP53(40%~80%)和TERT启动子(30%~75%)突变、PIK3CA-PTEN-AKT-mTOR信号通路相关分子异常[如PIK3CA(5%~25%)、PTEN(10%~25%)和EIF1AX(5%~15%)突变]。表观遗传修饰(包括非编码RNAs)也参与ATC的发生发展。
PDTC和DHGTC十分罕见,女性略多见(女∶男1.1~2.1∶1)。PDTC发病率1%~6.7%。欧洲(6.7%)和南美(4%)的患病率较高,在北美(1.8%)和日本(0.3%)则相反。PDTC和DHGTC发病中位年龄为55~65岁,儿童和青年患者罕见。DHGTC初诊淋巴结转移率30%~40%,高于PDTC。初诊断时远处转移率20%~25%,最终高达40%~70%发生远处转移,常见部位为肺、骨和其他(脑、肝、皮肤、脾脏、肾脏)。少数DHGTC具有不同程度包膜浸润,多数为惰性肿瘤[31]。
PDTC和DHGTC临床生物学行为介于高分化甲状腺癌(PTC,FTC和OTC)与ATC之间,5年生存率50%~70%,多在发病后头3年内复发,约50%患者放射性碘不摄取。年龄≥45岁、肉眼甲状腺外浸润、肿瘤≥5 cm、远处转移这些因素与预后差相关。PDTC患者10年总生存率为46%,疾病特异生存率为60%,DHGTC大致与其相似[1, 2]。与PDTC相比,高级别PTC患者的无病生存率可能更低。嗜酸性与非嗜酸性PDTC的预后相似。青少年PDTC罕见,多数存在DICER1的体系或胚系突变,肿瘤死亡率为30%。
ATC为高侵袭性致死性甲状腺癌,预后差,3~6个月死亡率近90%。对可切除的肿块行广泛手术切除、大剂量外照射联合化学疗法、靶向治疗等多模式治疗可延长生存期,但多数患者仍在两年内死亡[1, 2]。原发肿瘤伴广泛浸润为预后差的影响因素。老年患者、急性症状、白细胞增多均与生存率低相关。DTC中偶然发现ATC成分者预后较好。
高级别非间变性甲状腺滤泡源性癌概念的提出以及其病理特征、分子特征和临床生物学行为的明确,为高度恶性甲状腺肿瘤的规范化诊疗提供了依据。甲状腺癌治疗方案包括:手术治疗、促甲状腺激素抑制治疗、放射性碘治疗和靶向治疗等,其中靶向治疗已逐渐由临床研究过渡到临床应用、由酪氨酸抑制剂过渡到精准靶向药物[28,32]。2017年至今索拉非尼和仑伐替尼相继在国内外获批用于治疗碘难治性复发转移性DTC;拉罗替尼用于携带NTRK基因融合的甲状腺癌患者;普拉替尼用于RET变异的MTC和DTC患者的治疗等。这些药物在甲状腺癌中的应用为高侵袭性甲状腺癌患者带来获益。第5版WHO建议所有ATC患者必须检测BRAFV600E突变以指导靶向治疗,BRAF和MEK抑制剂对突变型ATC有效且为美国FDA所认证。39%~60%的ATC患者细胞程序性死亡配体1免疫组化阳性(TPS≥1%)可通过免疫治疗获益。与此同时,免疫检查点抑制剂、嵌合抗原受体T细胞免疫疗法和个性化肿瘤疫苗等有望成为高级别非间变性甲状腺滤泡源性癌治疗的未来方向[33]。
周隽, 刘志艳. 第5版WHO高级别甲状腺滤泡源性癌病理诊断标准及特征解读[J]. 中华医学杂志, 2024, 104(18): 1578-1583. DOI: 10.3760/cma.j.cn112137-20230902-00374.
所有作者声明不存在利益冲突































