
探讨塞替哌、氟达拉滨联合白消安(TBF)的预处理方案用于单倍体造血干细胞移植的安全性及有效性。
回顾性分析苏州大学附属第一医院和苏州弘慈血液病医院2020年至2023年期间行单倍体造血干细胞移植的574例受者资料,其中20例接受TBF预处理方案(TBF组),其余554例接受白消安+环磷酰胺(mBUCY)预处理方案,采用倾向性匹配方法,匹配比例为1:2,以疾病类型、受者年龄及受者性别作为匹配因素,最终筛选出40例mBUCY预处理方案的受者作为对照(mBUCY组)。根据Bearman评分标准评估TBF预处理相关毒性;与mBUCY组比较,观察TBF方案在预处理相关毒性,长期生存的安全性及有效性。
TBF组20例受者预处理期间主要的并发症为I~Ⅱ级口腔黏膜炎和胃肠道症状,未发生严重的心血管不良事件。TBF组粒细胞系重建时间为11 d(9~14)d,mBUCY组时间为12 d(10~28)d,两组比较差异无统计学意义(P=0.2)。TBF组巨核细胞系重建时间为18 d(9~100)d,mBUCY组时间为20 d(11~100)d,两组比较差异无统计学意义(P=0.7)。TBF组100 d Ⅱ~Ⅳ度急性移植物抗宿主病(acute graft versus host disease,aGVHD)的发病率低于mBUCY组(5%比35%,P=0.01)。TBF组和mBUCY组受者的1年总存活率分别为68%和62%,差异无统计学意义(P=0.98),TBF组1年无复发无GVHD存活(graft-versus-host disease-free,relapse-free survival,GRFS)率优于mBUCY组,但差异无统计学意义(63%比37%,P=0.06)。
TBF预处理方案在单倍体造血干细胞移植中应用毒性低,安全性较好。TBF预处理方案与mBUCY预处理相比,能减少移植后Ⅱ~Ⅳ度aGVHD发生,可能改善受者的GRFS。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
预处理是造血干细胞移植(hematopoietic stem cell transplantation,HSCT)的重要环节,它通过大剂量放化疗的预处理,清除受者体内的肿瘤或异常细胞,后续回输供者干细胞,使受者重建正常造血和免疫系统。改良白消安联合环磷酰胺(modify BUCY,mBUCY)预处理方案是目前最常用的移植的方案。部分受者基础状况差,造血干细胞移植合并症指数(hematopoietic stem cell transplantation comorbidity index,HCT-CI)高,合并心脏基础疾病,采用传统mBUCY预处理移植并发症高。还有部分受者存在骨髓纤维化、脾大,采用传统mBUCY预处理可能存在植入失败或者植入不良风险。由塞替哌、白消安联合氟达拉滨组成的TBF预处理方案最初用于脐血造血干细胞移植[1,2],现已广泛用于单倍体造血细胞移植(allo-HSCT)中[3]。TBF方案中加入了塞替哌,它是一种具有免疫抑制作用的烷化剂,具有较强穿透血脑屏障及相对较低血液学毒性的特点,并且可以促进造血干细胞的植入[4,5]。目前国内尚缺乏TBF预处理方案在受者体内去除T淋巴细胞单倍体造血干细胞移植模式下的相关报道。本研究通过对比20例TBF预处理方案的allo-HSCT受者及倾向性匹配的同期行mBUCY预处理的40例受者相关资料,评价TBF方案的安全性及有效性以及预后。
2020年1月至2023年3月在苏州大学附属第一医院和苏州弘慈血液病医院行单倍体造血干细胞移植受者574例,其中20例接受TBF预处理方案(TBF组),其余554例均为同期接收mBUCY预处理的单倍体造血干细胞移植术受者。采用倾向性匹配方法,匹配比例为1∶2,以疾病类型、受者年龄及性别作为匹配因素,成功匹配40例改良BUCY预处理的受者作为对照(mBUCY组)。将TBF组(20例)和mBUCY组(40例)共同作为研究对象,回顾性分析两组受者的资料。本研究已通过医院伦理委员会批准[伦理号:(2022)伦审批第024号]。随访截止时间为2023年7月1日。随访时间14个月(3~52)个月。
受者年龄大于16岁,并且确诊恶性血液病,包括急性髓系白血病(acute myeloid leukemia,AML)、急性淋巴细胞白血病(acute lymphoblastic leukemia,ALL)、骨髓增生异常综合征(myelodysplastic syndrome,MDS)/骨髓增殖性肿瘤(myeloproliferative neoplasm,MPN)、骨髓纤维化(myeloferation,MF)和噬血细胞综合征(hemophagocytic lymphohistiocytosis,HLH),有异基因造血干细胞移植(allogeneic hematopoietic stem cell transplantation,allo-HSCT)适应证,且满足以下1条标准,给予TBF预处理:① HCT-CI≥2;②东部肿瘤协作组(eastern cooperative oncology group,ECOG)评分≥3分;③既往有心脏基础疾病病史或者脑钠肽(brian natriuretic peptide,BNP)≥2×103 g/L④骨髓活检提示MF≥2级;⑤腹部B超提示脾脏肿大(B超检查脾脏长径大于12 cm或厚径大于4 cm)。
塞替哌5 mg·kg-1·d-1(移植前6天至移植前5天);氟达拉滨30 mg·m-2·d-1×5 d(移植前6天至移植前2天);白消安0.8 mg·kg-1·d-1(每天4次×2 d,移植前4天至移植前3天)。
以短疗程甲氨蝶呤联合他克莫司或环孢素A预防急性移植物抗宿主病(acute graft versus host disease,aGVHD)。即移植前9天开始应用他克莫司(0.03 mg·kg-1·d-1)或环孢素A(3 mg·kg-1·d-1静脉滴注),胃肠道症状消失后改为口服,并根据情况移植后100天逐渐减量,至移植后12个月停用。甲氨蝶呤用法为移植后1天15 mg·m-2·d-1,移植后3、6、11天10 mg·m-2·d-1。移植前第9天加用霉酚酸酯30 mg·kg-1·d-1,同时在预处理中加用抗人T淋巴细胞免疫球蛋白(anti-human thymocyte immunoglobulin,ATG)2.5 mg·kg-1·d-1×3 d,静脉滴注,1次/d,移植前4天至移植前2天。
受者移植前体能状态评估主要包括HCT-CI,ECOG、脏器功能及植入高风险因素,包括有无MF及脾脏肿大情况。主要观察指标总存活率,次要观察指标包括无移植物抗宿主病无复发存活率(graft versus host disease,relapse free survive,GRFS)、粒细胞系植入和巨核细胞系植入时间、100 d内Ⅱ~Ⅳ度急性移植物抗宿主病(acute graft versus host disease,aGVHD)累积发病率。总存活率定义为死亡事件发生时距离移植日期的发生率。GRFS定义为移植后未发生Ⅱ~Ⅳ度aGVHD、严重的慢性移植物抗宿主病(chronic graft versus host disease,cGVHD)、疾病复发的受者存活率。粒细胞系植入标准:连续3 d外周血中性粒细胞绝对计数>0.5×109/L(第1天为粒细胞植入时间)。血小板植入标准:在未输注血小板的情况下,连续7 d外周血血小板计数>20×109/L(第1天为血小板植入时间)。预处理相关毒性根据Bearman评分标准来进行评估,主要包括心脏、肝、口腔黏膜、胃肠道、膀胱、中枢神经系统及肺毒性。
采用R statistical software 4.2. 3软件处理数据。符合正态分布的计量资料采用 ±s表示,不符合正态分布者采用M(范围)描述;计数资料采用频数、构成比、百分比和率等指标描述。符合正态分布的计量资料组间比较,采用t检验(方差齐性)或校正t检验(方差不齐),不符合正态分布者则采用非参数Wilcoxon秩和检验。计数资料组间比较采用χ2检验、Fisher精确概率法卡方检验或秩和检验。倾向性匹配采用R语言MatchIt包,GVHD及造血重建采用竞争风险模型,死亡或者复发是竞争风险因子。采用Kaplan-Meier法进行生存分析,组间比较采用Log-rank法。组间比较P值校正方法为Ben-jamini-Hochberg法。以P<0.05为差异有统计学意义。
±s表示,不符合正态分布者采用M(范围)描述;计数资料采用频数、构成比、百分比和率等指标描述。符合正态分布的计量资料组间比较,采用t检验(方差齐性)或校正t检验(方差不齐),不符合正态分布者则采用非参数Wilcoxon秩和检验。计数资料组间比较采用χ2检验、Fisher精确概率法卡方检验或秩和检验。倾向性匹配采用R语言MatchIt包,GVHD及造血重建采用竞争风险模型,死亡或者复发是竞争风险因子。采用Kaplan-Meier法进行生存分析,组间比较采用Log-rank法。组间比较P值校正方法为Ben-jamini-Hochberg法。以P<0.05为差异有统计学意义。
20例TBF预处理方案受者通过倾向性匹配的方法成功匹配40例mBUCY预处理的受者作为对照组。TBF组与mBUCY组在供受者年龄、性别、疾病类型、供受者血型错配、供者来源及人类白细胞抗原(human leucocyte antigen,HLA)相合度方面差异无统计学意义。TBF组受者中位年龄38岁,男性占60%。TBF组输注单个核细胞数15.1(6.7~39.3)×108/kg,CD34+T淋巴细胞计数6.6(3.6~20.7)×106/kg,高于mBUCY组,差异有统计学意义。(表1)
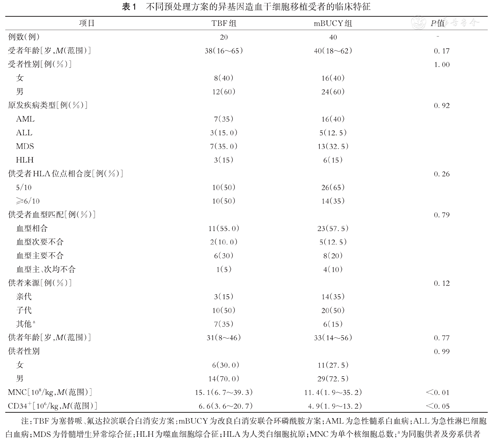
不同预处理方案的异基因造血干细胞移植受者的临床特征
不同预处理方案的异基因造血干细胞移植受者的临床特征
| 项目 | TBF组 | mBUCY组 | P值 |
|---|---|---|---|
| 例数(例) | 20 | 40 | - |
| 受者年龄[岁,M(范围)] | 38(16~65) | 40(18~62) | 0.17 |
| 受者性别[例(%)] | 1.00 | ||
| 女 | 8(40) | 16(40) | |
| 男 | 12(60) | 24(60) | |
| 原发疾病类型[例(%)] | 0.92 | ||
| AML | 7(35) | 16(40) | |
| ALL | 3(15.0) | 5(12.5) | |
| MDS | 7(35.0) | 13(32.5) | |
| HLH | 3(15) | 6(15) | |
| 供受者HLA位点相合度[例(%)] | 0.26 | ||
| 5/10 | 10(50) | 26(65) | |
| ≥6/10 | 10(50) | 14(35) | |
| 供受者血型匹配[例(%)] | 0.79 | ||
| 血型相合 | 11(55.0) | 23(57.5) | |
| 血型次要不合 | 2(10.0) | 5(12.5) | |
| 血型主要不合 | 6(30) | 8(20) | |
| 血型主、次均不合 | 1(5) | 4(10) | |
| 供者来源[例(%)] | 0.12 | ||
| 亲代 | 3(15) | 14(35) | |
| 子代 | 10(50) | 20(50) | |
| 其他a | 7(35) | 6(15) | |
| 供者年龄[岁,M(范围)] | 31(8~46) | 33(14~56) | 0.77 |
| 供者性别 | 0.99 | ||
| 女 | 6(30.0) | 11(27.5) | |
| 男 | 14(70.0) | 29(72.5) | |
| MNC[108/kg,M(范围)] | 15.1(6.7~39.3) | 11.4(1.9~35.2) | <0.01 |
| CD34+[106/kg,M(范围)] | 6.6(3.6~20.7) | 4.9(1.9~13.2) | <0.05 |
注:TBF为塞替哌、氟达拉滨联合白消安方案;mBUCY为改良白消安联合环磷酰胺方案;AML为急性髓系白血病;ALL为急性淋巴细胞白血病;MDS为骨髓增生异常综合征;HLH为噬血细胞综合征;HLA为人类白细胞抗原;MNC为单个核细胞总数;a为同胞供者及旁系供者
TBF组20例受者中有7例(35%)移植前体能状况差,其中4例(20%)受者HCT-CI指数≥2,4例ECOG评分≥3分;16例(80%)的受者移植前评估为植入高风险人群,其中8例受者移植前MF≥2级,15例受者合并脾肿大。根据Bearman评分,TBF与mBUCY两组均未发生严重Ⅲ级以上预处理相关毒性。TBF组受者预处理期间主要的并发症包括口腔黏膜炎、胃肠道症状和器官功能障碍,其中以口腔黏膜炎(35%)和胃肠道症状(20%)最常见。3例受者在移植预处理期间出现感染表现,1例表现为面部软组织感染,2例粒细胞缺乏伴发热,通过调整抗感染治疗方案和给予对症支持治疗后感染得到控制。TBF预处理中主要的器官损伤表现为轻度肝肾功能不全,发生率较低(5%)。(表2)
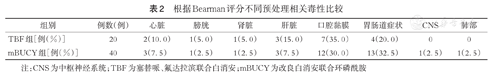
根据Bearman评分不同预处理相关毒性比较
根据Bearman评分不同预处理相关毒性比较
| 组别 | 例数(例) | 心脏 | 膀胱 | 肾脏 | 肝脏 | 口腔黏膜 | 胃肠道症状 | CNS | 肺部 |
|---|---|---|---|---|---|---|---|---|---|
| TBF组[例(%)] | 20 | 2(10.0) | 1(5.0) | 1(5.0) | 3(15.0) | 7(35.0) | 4(20.0) | 0 | 0 |
| mBUCY组[例(%)] | 40 | 3(7.5) | 1(2.5) | 1(2.5) | 3(7.5) | 12(30.0) | 13(32.5) | 1(2.5) | 1(2.5) |
注:CNS为中枢神经系统;TBF为塞替哌、氟达拉滨联合白消安;mBUCY为改良白消安联合环磷酰胺
60例受者均粒细胞系重建,其中TBF组粒细胞系重建时间11 d(9~14)d,mBUCY组粒细胞系重建时间12 d(10~28)d,两组在28 d累积重建率上的差异无统计学意义(P=0.2,图1A)。TBF组巨核细胞重建时间18 d(9~100)d,mBUCY组巨核细胞重建时间20 d(11~100)d,两组在100 d巨核累积重建率上的差异无统计学意义(P=0.7,图1B)。TBF组有1例(5%)、mBUCY组中2例(5%)受者巨核细胞未重建,两组差异无统计学意义(P=0.65)。移植后通过短串联重复序列(short tandem repeat,STR)方法检测供体干细胞DNA嵌合度。60例受者均达到完全供体干细胞嵌合,其中39例存活的受者在随访过程中持续供体干细胞嵌合,仅在TBF组1例噬血细胞综合征受者在移植后2个月余外周血STR下降,STR最低下降至80%,动态监测受者血常规未见下降,原发病无复发趋势,通过减停免疫抑制剂后供者STR持续稳定。
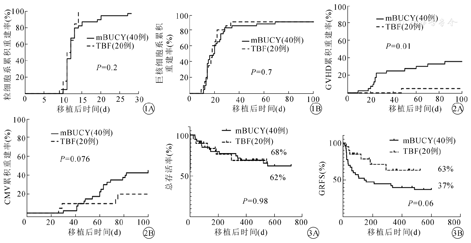

注:GVHD为移植物抗宿主病;CMV为巨细胞病毒;GRFS为无GVHD无复发生存
TBF组中仅1例(5%)100 d内发生Ⅱ~Ⅳ度aGVHD,通过激素联合CD25单抗治疗后好转,累积发生率5%,低于mBUCY组(35%,P=0.01,图2A);在病毒感染方面,TBF组中4例(20%)和mBUCY组18例(45%)受者100 d巨细胞病毒(CMV)激活,两组比较差异无统计学意义(P=0.076,图2B)。两组EB病毒感染率分别为20%和22.5%,差异无统计学意义(P=0.76),TBF组治疗期间发热共6例(30%),其中有1例(5%)在移植后出现血流感染(bloodstream infection,BSI)伴消化道出血,外周血及导管血培养提示肺炎克雷伯菌鼻菌亚种阳性,该受者经治疗无效死亡,而在mBUCY组中有4例(10%)发生BSI。
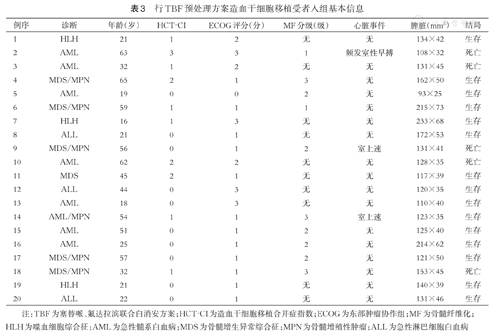
行TBF预处理方案造血干细胞移植受者入组基本信息
行TBF预处理方案造血干细胞移植受者入组基本信息
| 例序 | 诊断 | 年龄(岁) | HCT-CI | ECOG评分(分) | MF分级(级) | 心脏事件 | 脾脏(mm2) | 结局 |
|---|---|---|---|---|---|---|---|---|
| 1 | HLH | 21 | 1 | 2 | 无 | 无 | 134×42 | 生存 |
| 2 | AML | 63 | 3 | 3 | 1 | 频发室性早搏 | 108×32 | 死亡 |
| 3 | AML | 32 | 1 | 2 | 无 | 无 | 131×45 | 死亡 |
| 4 | MDS/MPN | 65 | 2 | 1 | 3 | 无 | 162×50 | 生存 |
| 5 | AML | 19 | 0 | 0 | 2 | 无 | 93×25 | 生存 |
| 6 | MDS/MPN | 59 | 1 | 1 | 1 | 无 | 215×73 | 生存 |
| 7 | HLH | 16 | 1 | 3 | 无 | 无 | 233×68 | 生存 |
| 8 | ALL | 21 | 0 | 1 | 无 | 无 | 172×53 | 生存 |
| 9 | MDS/MPN | 56 | 0 | 1 | 2 | 室上速 | 131×41 | 死亡 |
| 10 | AML | 62 | 2 | 2 | 无 | 无 | 128×35 | 死亡 |
| 11 | MDS | 45 | 2 | 1 | 无 | 无 | 117×39 | 生存 |
| 12 | ALL | 44 | 0 | 3 | 无 | 无 | 120×35 | 生存 |
| 13 | AML | 18 | 0 | 3 | 无 | 无 | 110×40 | 生存 |
| 14 | AML/MPN | 54 | 1 | 1 | 3 | 室上速 | 123×35 | 生存 |
| 15 | AML | 51 | 0 | 1 | 2 | 无 | 125×40 | 生存 |
| 16 | AML | 25 | 0 | 1 | 2 | 无 | 214×62 | 生存 |
| 17 | MDS/MPN | 57 | 0 | 1 | 2 | 无 | 121×50 | 生存 |
| 18 | MDS/MPN | 32 | 1 | 1 | 3 | 无 | 153×45 | 死亡 |
| 19 | HLH | 21 | 0 | 1 | 无 | 无 | 140×39 | 生存 |
| 20 | ALL | 22 | 0 | 1 | 无 | 无 | 131×46 | 生存 |
注:TBF为塞替哌、氟达拉滨联合白消安方案;HCT-CI为造血干细胞移植合并症指数;ECOG为东部肿瘤协作组;MF为骨髓纤维化;HLH为噬血细胞综合征;AML为急性髓系白血病;MDS为骨髓增生异常综合征;MPN为骨髓增殖性肿瘤;ALL为急性淋巴细胞白血病
TBF组20例受者中有5例(25%)移植后死亡,其中2例死于疾病复发,3例死于移植相关并发症(其中2例重症感染,1例移植后40 d出现腹胀伴转氨酶急剧升高,结合实验室检查及影像学检查结果,最后确诊为肝静脉闭塞综合征,经治疗无效死亡)。而mBUCY组有16例(40%)死亡,其中4例(10%)由于原发病复发合并器官功能衰竭死亡。4例(10%)受者死于Ⅱ~Ⅳ度aGVHD,5例(12.5%)死于重症感染(其中2例颅内感染,2例消化道出血,1例继发性血小板植入不良)。随访时间14个月(3~52个月),TBF组和mBUCY组1年总存活率分别为68%和62%(P=0.98,图3A),1年GRFS分别为63%和37%(P=0.06,图3B)。
造血干细胞移植是治愈恶性血液病的最有效的治疗方法之一。通过大剂量放射治疗和化学药物治疗预处理,清除受者体内的肿瘤或异常细胞,重建其正常的造血及免疫功能,改善受者的长期存活。然而,由预处理方案引起的毒性导致治疗相关并发症的发生和受者死亡。TBF预处理方案最早由西班牙团队提出,用于脐带血干细胞移植[4]。在恶性血液病受者中,TBF方案在脐血移植中提高造血干细胞植入,延长受者的长期无病存活率[6,7,8,9]。目前,TBF方案在欧美国家已广泛用于脐血移植及单倍体造血干细胞移植[4,10,11]。在2019年的一项全球多中心回顾性研究中,100例接受单倍体造血干细胞移植治疗的AML受者采用TBF方案预处理,2年DFS和总存活率分别为67%和71%[12]。另一项回顾性研究报道了在67例MF HSCT受者中,TBF方案与清髓性预处理相比,具有较低的非复发死亡率,并且1年的PFS达80%[13]。但在国内已报道的TBF预处理方案使用经验相对局限,特别是在单倍体造血干细胞移植模式下。本研究纳入的20例受者伴有心脏基础疾病、脾大或MF的恶性血液病,移植前行TBF预处理,随访1年总存活率68%,与国内外报道相符。
尽管TBF方案中含有两种烷化剂,但其安全性已在多个临床研究中证实[14,15]。塞替哌是一种乙烯亚胺类烷化剂抗肿瘤药物,为多功能烷化剂。通过鸟嘌呤碱基与DNA双链交联,导致DNA不可修复性损伤。恶性血液系统肿瘤患者的诱导化学药物治疗及巩固化学药物治疗方案通常不包含塞替哌,但塞替哌能透过血脑屏障,其作为HSCT预处理药物之一,可能通过克服肿瘤细胞的耐药性取得较好的疗效。在动物模型中,塞替哌被证实可改善异基因骨髓植入而不增加造血干细胞的损耗[16]。2017年欧洲血液与骨髓移植年会(European Society for Blood and Bone Marrow Transplantation,EBMT)一项回顾性研究中,含塞替哌的预处理方案提高了粒细胞系及巨核细胞系重建率[17]。在一项儿童急性淋巴细胞白血病回顾性研究中,含塞替哌的预处理相对于全身放射治疗(total body irradiation,TBI)预处理,粒细胞系植入更快,并且植入综合征的发生率更低[18]。本研究中,TBF方案用于单倍体造血干细胞移植,研究人群存在骨髓纤维化或者脾肿大等植入高危因素,在预处理方案中加入塞替哌,所有的受者均获得粒细胞系植入。此外,TBF方案预处理毒性低,主要表现为黏膜炎及胃肠道症状,与既往报道的相符[15]。在mBUCY预处理中,大剂量环璘酰胺的使用增加了心脏毒性。本研究采用氟达拉滨(静脉滴注,30 mg·m-2·d-1,连续5 d)替代以往BUCY方案中的环璘酰胺。TBF预处理方案心脏不良事件的发生率低,仅2例既往有室上性心律失常病史的受者在预处理期间因低钾血症再次出现心律失常,予以纠正病因治疗后迅速恢复正常,提示TBF方案用于allo-HSCT的安全性及可行性。另外,对于高龄、基础状况差的受者,TBF预处理相对更安全。本研究中4例受者HCT-CI指数≥2或ECOG评分≥3分,6例受者年龄≥55岁接受了allo-HSCT,已有研究证实在老年ALL受者使用TBF预处理方案降低了预处理毒性,2年的总存活率达73.2%,提高了老年受者移植的耐受性,改善了该部分受者的预后[19]。
值得关注的是在本研究中,有3例HLH受者通过TBF预处理获得长期生存,仅1例受者移植后出现STR下降(最低80%),通过减停免疫抑制剂后获得供者造血干细胞稳定嵌合状态。本研究mBUCY组中6例行传统清髓性预处理的HLH受者中有4例移植后死亡。TBF预处理组的3例HLH受者均长期存活,TBF预处理明显改善了该部分受者的长期预后。国外对于TBF用于HLH的报道,含塞替哌的预处理方案可促进造血干细胞重建,降低Ⅱ~Ⅳ度aGVHD发生率[20],但也可能伴随植入失败率的增加、混合嵌合状态的发生率增加以及移植后住院时间延长等,这都是临床医师持续关注的重点[21,22]。阿伦单抗可以作用于多种免疫细胞,是治疗HLH的有效药物,也是HSCT预处理的免疫抑制药物[23,24],但其尚未进入国内市场,目前采用的TBF+ATG预处理方案对于HLH受者也能获得较理想的预后。
与mBUCY预处理方案相比较,TBF组中100 d累计Ⅱ~Ⅳ度aGVHD发生率更低,TBF预处理方案改善了部分受者GRFS。最近一项研究报道了对于高危组恶性血液病受者,含塞替哌的预处理方案可降低aGVHD发生率[25]。同样,在后置环磷酰胺(post-transplantation cyclophosphamide,PTCY)移植模式下,部分研究表明TBF预处理方案可降低GVHD的发生率及疾病复发风险[10]。此外,另一项研究表明TBF预处理方案对AML受者行同胞全相和造血干细胞移植时,Ⅲ~Ⅳ度aGVHD的发生率高于BUCY预处理方案的受者,但TBF预处理一定程度上降低了原发病复发风险[13]。这可能与相当一部分受者使用大剂量白消安(3.2 mg·kg-1·d-1×4 d)联合塞替哌增加了预处理期间黏膜损伤,引起炎症因子释放进而增加aGVHD风险相关。
综上所述,TBF方案是对于高龄、基础状况差受者一种安全有效的预处理方案,能降低aGVHD的发生率的同时可能改善受者的GRFS。本研究为回顾性研究,样本量有限,存在一定的局限性。在后续的临床研究中,需要进一步长期大样本前瞻性的临床试验为TBF方案的临床安全性及有效性提供更有力的证据。
所有作者声明无利益冲突



























