
探讨小儿卵黄囊瘤的临床特点及预后影响因素。
收集2010年1月至2018年8月在安徽省儿童医院就诊的卵黄囊瘤85例患儿临床特征、治疗和预后的临床资料。采用Kaplan-Meier法绘制生存曲线;采用单因素及多因素Cox比例风险回归模型分析患儿预后的影响因素。
85例患儿中位年龄为20.5(0.03~166.6)个月,中位随访时间为62.1(1.5~133.1)个月,5年总体生存率为87.1%(95%CI:79.7%~94.5%),5年无进展生存率为79.8%(95%CI:70.6%~89.0%)。单因素Cox回归分析显示:生活地区、远处转移、延迟化疗、术前血清甲胎蛋白、术后2个月血清甲胎蛋白、复发均与其预后有相关性(P<0.05),是影响患儿生存的危险因素。多因素Cox回归分析显示,居住于农村地区(HR=7.830,95%CI:1.60~38.41,P=0.011)、延迟化疗(HR=5.323,95%CI:1.14~25.64,P=0.047)、术后2个月血清甲胎蛋白未降至正常(HR=15.704,95%CI:1.65~149.18,P=0.017)、肿瘤复发(HR=26.046,95%CI:3.03~224.07,P=0.003)是影响预后的独立危险因素。
生活于农村地区、延迟辅助化疗、术后2个月内甲胎蛋白未恢复正常、肿瘤复发可能提示预后不良,需要根据生活地区、化疗意愿、治疗后持续监测甲胎蛋白与影像学表现,对卵黄囊瘤儿童进行个体化治疗和随访。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
卵黄囊瘤(yolk sac tumor, YST)是一种罕见的恶性生殖细胞肿瘤(malignant germ cell tumor, MGCT),在15岁以下儿童癌症中占比为3.5%,在15~19岁人群中的占比为16%[1]。YST起源于内胚层,又称内胚窦瘤(endodermal sinus tumor),多见于儿童和青少年,主要发病部位是睾丸和卵巢等性腺,亦可发生于胚胎卵黄囊发育移行过程中的性腺外部位,如骶尾部、阴道、盆腔、腹膜后、纵隔等[2,3,4,5],约占所有部位的1/3。由于临床少见,关于YST的认识多来源于小样本研究,且多数研究仅涉及原发于单个部位或多种病理类型的MGCT。本研究通过安徽省儿童医院85例儿童卵黄囊瘤的临床资料,总结不同原发部位YST的临床特点并分析预后不良的危险因素,以提高对该疾病的认识,为患儿诊疗及随访提供帮助。
收集安徽省儿童医院2010年1月至2018年8月期间诊断为YST患儿的临床病例资料。纳入标准:①病理诊断确诊为YST;②年龄0~18岁;③具备完整的临床数据;④随访成功。排除标准:①其他病理类型的生殖细胞肿瘤;②颅内YST;③未在本院行手术治疗。根据纳入及排除标准,最终纳入85例YST患儿。
本研究经安徽省儿童医院伦理委员会审核通过(EYLL-2023-021),并征得患儿法定监护人的知情同意。
收集并纳入患儿的一般临床资料(包括诊断时的年龄、临床表现、甲胎蛋白肿瘤标志物资料)、影像学资料(超声、CT、MRI)、手术操作资料、化疗资料、病理结果及随访结果。YST根据儿童肿瘤学协作组(Children's Oncology Group, COG)提出的分期系统进行分期。术后第1年每1~3个月复查1次体格检查、甲胎蛋白(alpha fetal protein,AFP)测定、胸部X线/CT、原发部位超声检查,第2年每6个月复查1次,至第3年起每年复查1次。若术后血清AFP水平恢复正常却在随访重新评估时血清AFP持续升高,无论影像学是否发现转移病灶,都诊断为复发。
采用SPSS 25.0软件进行统计学处理。计量资料(年龄、随访时间、发病时间、肿瘤直径)服从正态分布或近似正态分布者以 ±s表示,组间比较采用独立样本t检验;不服从正态分布者以M(Q1, Q3)表示,组间比较采用Mann-Whitney U检验;计数资料以频率、百分比表示,组间比较采用χ2检验。生存分析采用Kaplan-Meier生存曲线,采用Log-rank法比较生存曲线间差异。采用单变量和多变量Cox比例风险回归模型分析预后的独立影响因素。采用Graphpad Prism 8.0.1软件进行生存分析结果绘图。P<0.05为差异有统计学意义。
±s表示,组间比较采用独立样本t检验;不服从正态分布者以M(Q1, Q3)表示,组间比较采用Mann-Whitney U检验;计数资料以频率、百分比表示,组间比较采用χ2检验。生存分析采用Kaplan-Meier生存曲线,采用Log-rank法比较生存曲线间差异。采用单变量和多变量Cox比例风险回归模型分析预后的独立影响因素。采用Graphpad Prism 8.0.1软件进行生存分析结果绘图。P<0.05为差异有统计学意义。
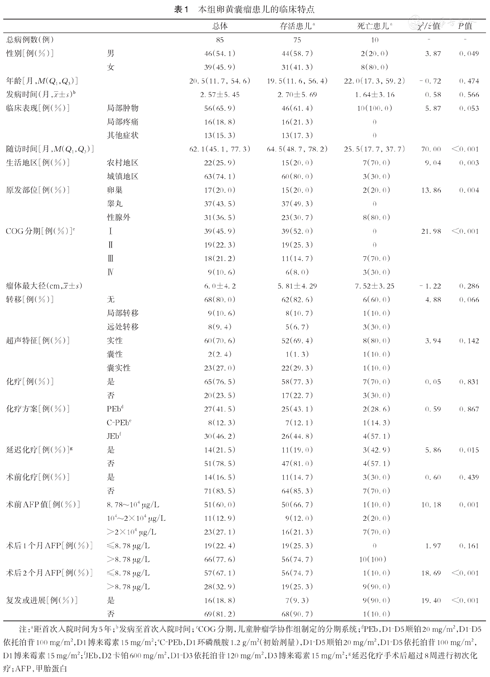
本研究共纳入85例YST患儿,原发部位分布包括性腺54例(63.5%,54/85):睾丸37例、卵巢17例。性腺外31例(36.5%,31/85):骶尾部17例、阴道5例、盆腔4例、腹膜后2例、腹壁2例、纵隔1例。不同原发部位的5年总体生存率(overall survival, OS)差异有统计学意义(P=0.004)。YST患儿中位诊断年龄为20.5(0.03~166.6)个月。37例睾丸卵黄囊瘤(testis yolk sac tumor, TYST)中30例<2岁,占81.1%;31例性腺外卵黄囊瘤(extragonadal yolk sac tumor, EYST)中21例<2岁,占67.7%;17例卵巢卵黄囊瘤(ovary yolk sac tumor, OYST)中16例>4岁,其年龄分布与预后显著相关(P=0.03)。
所有患儿由出现临床表现至初次就诊的中位时间是0.70(0.03~40.0)个月。31例性腺外YST中女患儿有22例,占71.0%;男患儿有9例,占29.0%。54例性腺YST中26例(48.1%,26/54)发生在左侧,28例(51.9%,28/54)发生在右侧。TYST常表现为无痛性阴囊包块(100.0%,37/37);OYST表现为下腹部疼痛者最多(10/17),腹部包块6例(6/17),无痛性阴道流血1例(1/17);EYST表现为无痛性局部包块者22例(71.0%,22/31),局部疼痛者3例(9.7%,3/31)。所有患儿中22例(25.9%,22/85)生活在农村地区,63例(74.1%,63/85)生活在城镇地区,两者5年OS差异有统计学意义(P=0.003)。(表1)
本组卵黄囊瘤患儿的临床特点
本组卵黄囊瘤患儿的临床特点
| 总体 | 存活患儿a | 死亡患儿a | χ2/z值 | P值 | ||
|---|---|---|---|---|---|---|
| 总病例数(例) | 85 | 75 | 10 | - | - | |
| 性别[例(%)] | 男 | 46(54.1) | 44(58.7) | 2(20.0) | 3.87 | 0.049 |
| 女 | 39(45.9) | 31(41.3) | 8(80.0) | |||
| 年龄[月,M(Q1,Q3)] | 20.5(11.7,54.6) | 19.5(11.6,56.4) | 22.0(17.3,59.2) | -0.72 | 0.474 | |
发病时间(月, ±s)b ±s)b | 2.57±5.45 | 2.70±5.69 | 1.64±3.16 | 0.58 | 0.566 | |
| 临床表现[例(%)] | 局部肿物 | 56(65.9) | 46(61.4) | 10(100.0) | 5.87 | 0.053 |
| 局部疼痛 | 16(18.8) | 16(21.3) | 0 | |||
| 其他症状 | 13(15.3) | 13(17.3) | 0 | |||
| 随访时间[月,M(Q1,Q3)] | 62.1(45.1,77.3) | 64.5(48.7,78.2) | 25.5(17.7,37.7) | 70.00 | <0.001 | |
| 生活地区[例(%)] | 农村地区 | 22(25.9) | 15(20.0) | 7(70.0) | 9.04 | 0.003 |
| 城镇地区 | 63(74.1) | 60(80.0) | 3(30.0) | |||
| 原发部位[例(%)] | 卵巢 | 17(20.0) | 15(20.0) | 2(20.0) | 13.86 | 0.004 |
| 睾丸 | 37(43.5) | 37(49.3) | 0 | |||
| 性腺外 | 31(36.5) | 23(30.7) | 8(80.0) | |||
| COG分期[例(%)]c | Ⅰ | 39(45.9) | 39(52.0) | 0 | 21.98 | <0.001 |
| Ⅱ | 19(22.3) | 19(25.3) | 0 | |||
| Ⅲ | 18(21.2) | 11(14.7) | 7(70.0) | |||
| Ⅳ | 9(10.6) | 6(8.0) | 3(30.0) | |||
瘤体最大径(cm, ±s) ±s) | 6.0±4.2 | 5.81±4.29 | 7.52±3.25 | -1.22 | 0.286 | |
| 转移[例(%)] | 无 | 68(80.0) | 62(82.6) | 6(60.0) | 4.88 | 0.066 |
| 局部转移 | 9(10.6) | 8(10.7) | 1(10.0) | |||
| 远处转移 | 8(9.4) | 5(6.7) | 3(30.0) | |||
| 超声特征[例(%)] | 实性 | 60(70.6) | 52(69.4) | 8(80.0) | 3.94 | 0.142 |
| 囊性 | 2(2.4) | 1(1.3) | 1(10.0) | |||
| 囊实性 | 23(27.0) | 22(29.3) | 1(10.0) | |||
| 化疗[例(%)] | 是 | 65(76.5) | 58(77.3) | 7(70.0) | 0.05 | 0.831 |
| 否 | 20(23.5) | 17(22.7) | 3(30.0) | |||
| 化疗方案[例(%)] | PEbd | 27(41.5) | 25(43.1) | 2(28.6) | 0.59 | 0.867 |
| C-PEbe | 8(12.3) | 7(12.1) | 1(14.3) | |||
| JEbf | 30(46.2) | 26(44.8) | 4(57.1) | |||
| 延迟化疗[例(%)]g | 是 | 14(21.5) | 11(19.0) | 3(42.9) | 5.86 | 0.015 |
| 否 | 51(78.5) | 47(81.0) | 4(57.1) | |||
| 术前化疗[例(%)] | 是 | 14(16.5) | 11(14.7) | 3(30.0) | 0.60 | 0.439 |
| 否 | 71(83.5) | 64(85.3) | 7(70.0) | |||
| 术前AFP值[例(%)] | 8.78~104 μg/L | 51(60.0) | 50(66.7) | 1(10.0) | 10.18 | 0.001 |
| 104~2×104 μg/L | 11(12.9) | 9(12.0) | 2(20.0) | |||
| >2×104 μg/L | 23(27.1) | 16(21.3) | 7(70.0) | |||
| 术后1个月AFP[例(%)] | ≤8.78 μg/L | 19(22.4) | 19(25.3) | 0 | 1.97 | 0.161 |
| >8.78 μg/L | 66(77.6) | 56(74.7) | 10(100) | |||
| 术后2个月AFP[例(%)] | ≤8.78 μg/L | 57(67.1) | 56(74.7) | 1(10.0) | 18.69 | <0.001 |
| >8.78 μg/L | 28(32.9) | 19(25.3) | 9(90.0) | |||
| 复发或进展[例(%)] | 是 | 16(18.8) | 7(9.3) | 9(90.0) | 19.40 | <0.001 |
| 否 | 69(81.2) | 68(90.7) | 1(10.0) |
注:a距首次入院时间为5年;b发病至首次入院时间;cCOG分期,儿童肿瘤学协作组制定的分期系统;dPEb,D1-D5顺铂20 mg/m2,D1-D5依托泊苷100 mg/m2,D1博来霉素15 mg/m2;eC-PEb,D1环磷酰胺1.2 g/m2(初始剂量),D1-D5顺铂20 mg/m2,D1-D5依托泊苷100 mg/m2,D1博来霉素15 mg/m2;fJEb,D2卡铂600 mg/m2,D1-D3依托泊苷120 mg/m2,D3博来霉素15 mg/m2;g延迟化疗手术后超过8周进行初次化疗;AFP,甲胎蛋白
所有患儿术前AFP值均高于8.78 μg/L的正常值;66例(77.6%,66/85)术后1个月内未降至正常;28例(32.9%,28/85)术后2个月内未降至正常,57例(67.1%,57/85)术后2个月内降至正常,两者5年OS差异有统计学意义(P<0.001)。大部分TYST患儿(75.7%,28/37)术前AFP<10 000 μg/L,5例(13.5%,5/37)AFP>20 000 μg/L;术后1个月29例(78.4%,29/37)AFP未降至正常;术后2个月6例(16.2%,6/37)AFP未降至正常,其中2例发生复发,但在后续治疗中均获得完全缓解。大部分OYST患儿(10/17)术前AFP<10 000 μg/L,4例(4/17)>AFP 20 000 μg/L;术后1个月9例(9/17)AFP未降至正常;6例(6/17)在术后2个月AFP未降至正常,其中2例出现复发。近一半的EYST患儿(51.6%,16/31)术前AFP>20 000 μg/L,10例(32.3%,10/31)AFP<10 000 μg/L;术后1个月大部分患儿(90.3%,28/31)AFP值未降至正常;术后2个月仍有16例(51.6%,16/31)AFP未降至正常,其中11例出现复发或进展。所有患儿术前均行超声检查,主要为实性占位(70.6%,60/85);44例行CT检查,0~40 HU占比绝大多数(88.6%,39/44);50例行MRI检查,主要表现为T1、T2高信号(76.0%,38/50)。
COG分期Ⅰ~Ⅳ期分别占比为45.9%、22.3%、21.2%,10.6%。大部分(97.3%,36/37)TYST为COGⅠ期,OYST患儿则Ⅱ期占比最多(11/17),EYST患儿中Ⅲ、Ⅳ期分别占比41.9%、25.8%。TYST、OYST与EYST的瘤体最大径分别为(2.94±1.17)cm、(10.15±4.73)cm、(7.39±3.54)cm,三者间差异有统计学意义(P<0.001),但在所有YST患儿中瘤体最大径与5年OS相关性没有统计学意义(P=0.228)。所有患儿中初诊时即局部转移(含淋巴结转移)者9例(10.6%,9/85),远处转移者8例(9.4%,8/85)。TYST患儿中1例因存在腹膜后淋巴结转移,故为COG Ⅲ期;OYST患儿中1例发生肝转移,1例侵犯大网膜,2例发生区域淋巴结转移;EYST患儿中7例存在远处转移,3例发生区域淋巴结转移,2例浸润邻近组织。三者间差异有统计学意义(P=0.002)。(表1)
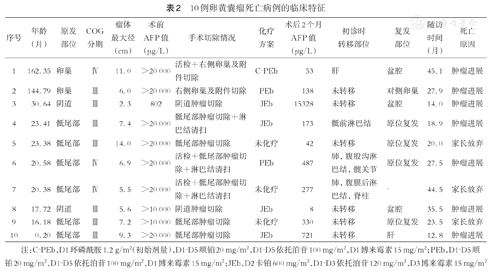
所有患儿均行根治性肿瘤切除术,对于COG Ⅲ、Ⅳ期患儿均进行了淋巴结活检及术中冰冻,病理结果提示淋巴结受侵者施行区域淋巴结清扫。14例(16.5%,14/85)行术前新辅助化疗,65例(76.5%,65/85)接受化疗,其中采取PEb、C-PEb、JEb方案者分别为27例(41.5%, 27/65)、8例(12.3%, 8/65)、30例(46.2%,30/65);51例(78.5%,51/65)在手术后8周内接受化疗,延迟化疗(delay of adjuvant chemotherapy, DAC)与否的5年OS差异有统计学意义(P=0.015)。TYST患儿均行经腹股沟入路的患侧睾丸及精索切除术,术后23例(62.2%,23/37)接受化疗。OYST患儿均接受患侧卵巢及附件切除术,15例术后行化疗。6例在术后2个月AFP未降至正常,其中2例出现复发,1例经手术切除+PEb方案化疗6个周期后AFP降至正常,于末次化疗8个月后出现盆腔多发转移。1例经术前C-PEb方案化疗4个周期+手术切除+术后C-PEb方案化疗6个周期后AFP降至正常,于末次化疗6个月后发生对侧卵巢转移。另有1例AFP降至正常患儿发生主动脉旁淋巴结、大网膜转移经手术切除+PEB方案化疗4个周期获得完全缓解。EYST患儿27例(87.1%,27/31)接受化疗,11例复发,8例死亡。(表1、表2)
10例卵黄囊瘤死亡病例的临床特征
10例卵黄囊瘤死亡病例的临床特征
| 序号 | 年龄(月) | 原发部位 | COG分期 | 瘤体最大径(cm) | 术前AFP值(μg/L) | 手术切除情况 | 化疗方案 | 术后2个月AFP值(μg/L) | 初诊时转移部位 | 复发部位 | 随访时间(月) | 死亡原因 |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 162.35 | 卵巢 | Ⅳ | 11.0 | >20 000 | 活检+右侧卵巢及附件切除 | C-PEb | 53 | 肝 | 盆腔 | 45.1 | 肿瘤进展 |
| 2 | 144.79 | 卵巢 | Ⅲ | 6.0 | >20 000 | 右侧卵巢及附件切除 | PEb | 138 | 未转移 | 对侧卵巢 | 27.9 | 肿瘤进展 |
| 3 | 30.64 | 阴道 | Ⅲ | 2.3 | 802 | 阴道肿瘤切除 | JEb | 15328 | 未转移 | 盆腔 | 14.0 | 肿瘤进展 |
| 4 | 23.41 | 骶尾部 | Ⅲ | 7.4 | >20 000 | 骶尾部肿瘤切除+淋巴结清扫 | JEb | 173 | 骶前淋巴结 | 原位复发 | 18.9 | 肿瘤进展 |
| 5 | 23.38 | 骶尾部 | Ⅲ | 14.0 | >20 000 | 骶尾部肿瘤切除 | 未化疗 | 42 | 未转移 | 原位复发 | 20.0 | 家长放弃 |
| 6 | 20.58 | 骶尾部 | Ⅳ | 6.9 | >20 000 | 活检+骶尾部肿瘤切除+淋巴结清扫 | PEb | 487 | 肺,腹股沟淋巴结,髋关节 | 原位复发 | 27.5 | 肿瘤进展 |
| 7 | 20.38 | 骶尾部 | Ⅳ | 5.5 | >20 000 | 活检+骶尾部肿瘤切除+淋巴结清扫 | 未化疗 | 277 | 肺,腹膜后淋巴结,脊柱 | - | 44.5 | 家长放弃 |
| 8 | 17.72 | 阴道 | Ⅲ | 5.6 | >10 000 | 阴道肿瘤切除 | JEb | 8 | 未转移 | 盆腔 | 35.5 | 肿瘤进展 |
| 9 | 16.18 | 骶尾部 | Ⅲ | 7.2 | >10 000 | 骶尾部肿瘤切除 | 未化疗 | 330 | 未转移 | 原位复发 | 23.5 | 家长放弃 |
| 10 | 0.20 | 骶尾部 | Ⅲ | 9.3 | >20 000 | 骶尾部肿瘤切除 | JEb | 721 | 未转移 | 肝 | 12.8 | 肿瘤进展 |
注:C-PEb,D1环磷酰胺1.2 g/m2(初始剂量),D1-D5顺铂20 mg/m2,D1-D5依托泊苷100 mg/m2,D1博来霉素15 mg/m2;PEb,D1-D5顺铂20 mg/m2,D1-D5依托泊苷100 mg/m2,D1博来霉素15 mg/m2;JEb,D2卡铂600 mg/m2,D1-D3依托泊苷120 mg/m2,D3博来霉素15 mg/m2
中位随访时间为62.1(1.5~133.1)个月。16例复发患儿中,6例SYST发生原位复发,4例胸腔肺转移,3例发生盆腔多发转移,1例肝转移,1例大网膜、主动脉旁淋巴结转移,1例OYST转移至对侧卵巢。14例复发患儿接受了挽救性治疗,其余2例患儿家长放弃继续救治。存活75例,死亡10例(表2)。不同原发部位的5年无进展生存率(progression-free survival, PFS)差异具有统计学意义(P=0.004),分别为94.6%、82.4%、64.5%。全体患儿的5年OS为87.1%(95%CI:79.7%~94.5%),5年PFS为79.8%(95%CI:70.6%~89.0%)(图1)。
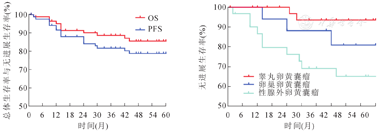

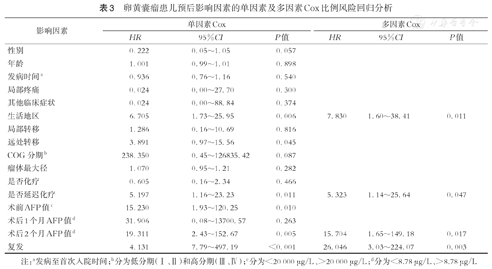
单因素Cox分析结果显示患儿生活地区、远处转移、DAC、术前血清AFP、术后2个月血清AFP、复发均与其预后相关(P<0.05)。将P<0.05的变量纳入多因素Cox分析,结果显示居住于农村地区(HR=7.830,95%CI:1.60~38.41,P=0.011)、DAC(HR=5.323,95%CI:1.14~25.64,P=0.047)、术后2个月血清AFP未降至正常(HR=15.704,95%CI:1.65~149.18,P=0.017)、肿瘤复发(HR=26.046,95%CI:3.03~224.07,P=0.003)均为预后不良因素。(表3)
卵黄囊瘤患儿预后影响因素的单因素及多因素Cox比例风险回归分析
卵黄囊瘤患儿预后影响因素的单因素及多因素Cox比例风险回归分析
| 影响因素 | 单因素Cox | 多因素Cox | ||||
|---|---|---|---|---|---|---|
| HR | 95%CI | P值 | HR | 95%CI | P值 | |
| 性别 | 0.222 | 0.05~1.05 | 0.057 | |||
| 年龄 | 1.001 | 0.99~1.01 | 0.898 | |||
| 发病时间a | 0.936 | 0.76~1.16 | 0.540 | |||
| 局部疼痛 | 0.024 | 0.00~27.70 | 0.300 | |||
| 其他临床症状 | 0.024 | 0.00~88.84 | 0.374 | |||
| 生活地区 | 6.705 | 1.73~25.95 | 0.006 | 7.830 | 1.60~38.41 | 0.011 |
| 局部转移 | 1.286 | 0.16~10.69 | 0.816 | |||
| 远处转移 | 3.891 | 0.97~15.56 | 0.045 | |||
| COG分期b | 238.350 | 0.45~126835.42 | 0.087 | |||
| 瘤体最大径 | 1.070 | 0.95~1.21 | 0.282 | |||
| 是否化疗 | 0.605 | 0.16~2.34 | 0.466 | |||
| 是否延迟化疗 | 5.197 | 1.16~23.23 | 0.011 | 5.323 | 1.14~25.64 | 0.047 |
| 术前AFP值c | 15.230 | 1.93~120.25 | 0.010 | |||
| 术后1个月AFP值d | 31.906 | 0.08~13700.57 | 0.263 | |||
| 术后2个月AFP值d | 19.311 | 2.43~152.67 | 0.005 | 15.704 | 1.65~149.18 | 0.017 |
| 复发 | 4.131 | 7.79~497.19 | <0.001 | 26.046 | 3.03~224.07 | 0.003 |
注:a发病至首次入院时间;b分为低分期(Ⅰ、Ⅱ)和高分期(Ⅲ、Ⅳ);c分为<20 000 μg/L、>20 000 μg/L;d分为<8.78 μg/L、>8.78 μg/L
卵黄囊瘤最常见的发病部位包括性腺(睾丸或卵巢)、骶尾部等[1]。不同原发部位的发病率有很大差别,相较于OYST,TYST发生率明显更高,这与既往研究一致[6]。Wilhelm等[7]发现这种差异的生物学上的合理解释可能是由于女性女生殖细胞在青春期前会经历减数分裂的停止,而男性生殖细胞的有丝分裂增殖在出生后不久便会恢复并持续整个儿童期。YST具有明显的年龄分布特征,TYST、EYST的发病高峰为0~2岁,OYST常见于>4岁儿童[8,9,10]。而OYST患儿年龄与预后显著相关(P=0.03),这与陈雪莲和何连利[11]的研究结果一致。EYST女性占比更高可能是由于女性生殖细胞的发育性凋亡过程更易出现异常。在动物研究中,当这一异常发生时,可在雌性小鼠的骶尾部发现原始的异位生殖细胞[12]。若在人类胚胎发育过程中发生该现象,可能会使逃脱了发育性凋亡的生殖细胞继续形成骶尾部肿瘤,而女性生殖细胞凋亡总数远多于男性可能使得其罹患EYST风险增大。
TYST通常表现为无痛性睾丸肿块[1,13]。鉴别诊断包括鞘膜积液、感染、睾丸扭转、性索间质肿瘤、白血病和睾丸旁横纹肌肉瘤。OYST的典型表现是腹胀、盆腔肿块或剧烈疼痛(提示肿瘤扭转、破裂或出血)。鉴别诊断包括卵巢囊肿、性索间质肿瘤和儿童罕见的卵巢上皮癌[14]。骶尾部卵黄囊瘤(sacrococcygeal yolk sac tumor,SYST)多表现为单发的巨大外生性肿物,可能导致胎儿分娩困难。若无可触及的外部肿块,则可能表现为坐位时疼痛、臀部不对称、排尿困难和便秘等。由于SYST体积一般较大,常在产前超声检查时发现[3]。
本研究发现生活地区是儿童YST预后的独立危险因素(P=0.011),农村地区患儿生存率低于城市地区,与陈琼等[15]和杨中婷等[16]的研究结果一致。既往研究表明,城市地区和农村地区儿童在肿瘤治疗可及性、所在地区医疗服务质量以及不同地区患儿对治疗方案的可负担性等方面的差异可能是导致预后不同的原因[17,18]。Larfors等[19]对癌症患儿的性别、年龄、个人收入、教育水平、是否独居进行了分层分析,发现确诊年龄晚、个人收入低、文化程度低、独居是影响预后的独立危险因素。Lauseker等[20]发现经济状况较好的家庭通常会选择一些医疗技术条件较好的大型医院进行诊疗,治疗效果也较好,这提示后续研究中应关注患儿家庭的社会经济因素以期发现不同居住地区的YST儿童生存率差异的深层原因。
血清AFP是诊断和评估YST疗效的重要标志[21]。在90%以上的YST患儿中可见到AFP水平的升高[22]。在本研究中,所有患儿均观察到AFP水平的升高。AFP也是随访的重要指标,AFP的生物半衰期为5 d,术后应持续监测AFP水平以评估其下降趋势。研究表明,术后AFP下降缓慢的患儿可能预后较差[23]。本研究中,AFP水平未能在术后2个月内恢复正常是预后不良因素(P=0.017),这与Li等[9]的研究结果一致。因此,对于术后2个月内AFP水平未能恢复正常的患儿,建议及时干预,如1~2个周期的化疗可改善预后。超声是YST患儿首选的影像学检查,其灵敏度几乎为100% [24]。但超声不能完全区分良恶性肿瘤,对肿瘤转移的敏感性有限。若怀疑转移,应对颅脑、胸部和腹盆腔进行CT或MRI扫描[25]。YST的典型超声表现是实性、低回声包块[26]。
本研究结果提示COG分期与YST的5年OS相关性具有统计学意义(P<0.001),高分期患儿预后较差。既往研究发现YST直径与预后有关[9]。本研究未发现两者的相关性,这与不同部位YST的异质性有关,不同原发部位的肿瘤大小差异有统计学意义(P<0.001)。本研究建议肿瘤直径较大的患儿应进行CT或MRI扫描,以评估肿瘤分期。大约20%的患儿存在转移,最常累及肺部,也可能转移至骨骼、肝脏或大脑[27,28]。远处转移作为COG高分期的标准之一,同样是YST患儿预后的影响因素(P=0.045),与刘亮华等[29]的研究结果一致。
手术治疗是YST综合性治疗的基石。早期切除对患儿预后有积极意义,分期切除仅应用于肿瘤浸润严重的病例[30]。针对YST患儿的手术后化学治疗需要从COG分期、手术切除情况、AFP变化趋势以及患儿家长意愿等多方面综合考虑,确定化疗的患儿应限期进行[31]。DAC通常是指接受辅助化疗的患儿自术后首日到初次辅助化疗开始的时间间隔过长。既往对DAC的定义存在≥3个月、≥60 d等差异,但目前一般以8周为界。大量研究显示,DAC≥8周的患儿其预后明显变差[32,33,34]。本研究发现DAC是预后的危险因素(P=0.047)。对于导致DAC的原因,Chen等[35]发现自费、低收入和严重术后并发症和DAC相关。儿童YST较之其他恶性实体瘤(如神经母细胞瘤、肝母细胞瘤)5年OS率明显更高,主要是由于20世纪80年代以铂类为主的化疗广泛应用[36]。对于高危组患儿应积极采用高剂量PEb方案,但需警惕顺铂的远期毒性;同时也可采取增加疗程的化疗策略。对一线化疗方案不敏感患儿应积极采取二线化疗方案。De Pasquale等[37]研究指出,对于复发性和难治性YST,在二线常规剂量化疗后,残余肿瘤可以手术切除。根据COG的AGCT0521研究,TIC方案(紫杉醇、异环磷酰胺和卡铂)为儿童复发性YST挽救性治疗的有效手段,特别是对于已出现耳毒性的患儿[38]。儿童颅内YST、颅外YST脑转移和高分期纵隔YST应采用手术、化疗、放疗等综合治疗。
虽然YST总体生存率较高,但不同原发部位的生存率存在差异,在本研究中性腺YST的5年OS率显著高于性腺外YST(P=0.007),与众多研究的结论一致[39,40]。也有报道称,根据性腺外位置,生存率也不尽相同[40,41]。在本研究中不同原发部位YST的异质性明显,但目前病例数量不足以按性腺外位置进行分层。根据不同原发部位的生存分析可知睾丸、卵巢、性腺外的危险度依次升高。据报道,与性腺外YST相比,性腺YST的较高生存率可能是由于性腺YST可以被切除得更加彻底[28]。另外,性腺YST对铂基化疗更敏感也是可能原因。
儿童YST的预后一般是良好的。不同部位YST的临床特点有较大差别。TYST、EYST最常见于<2岁儿童,OYST多发于>4岁女孩。无痛性肿块是TYST、EYST最常见的表现,所有YST术前AFP水平均升高。生活于农村地区、未及时化疗、术后2个月AFP未降至正常、肿瘤复发提示预后不良。本研究的局限性可能存在选择偏倚与回忆偏倚,限于儿童卵黄囊瘤的低发病率,目前的病例数据不足以得出令人信服的统计结果来进行不同原发部位的亚组分析。后续研究需要根据生活地区、化疗意愿、治疗后持续监测AFP与影像学表现,对卵黄囊瘤儿童进行个体化治疗和随访。
所有作者均声明不存在利益冲突



























