
探讨影响新生儿胃穿孔的预后相关因素。
收集2010年1月至2022年1月昆明医科大学附属儿童医院收治的115例新生儿胃穿孔患儿的临床资料,其中男76例,女39例;足月儿41例,早产儿74例;平均体重为2.37 kg,体重范围是1.15~3.85 kg;发病时平均日龄为3.25 d,日龄范围是1.23~7.55 d,其中发病日龄1~3 d的有88例;胃壁肌层缺损109例,胃壁炎症、坏死穿孔6例。根据患儿是否存活,将其分为生存组与死亡组,其中生存组85例,死亡组30例,比较可能影响新生儿胃穿孔预后的部分临床因素、手术因素及病理因素;对生存组患儿进行随访,了解其生存情况。
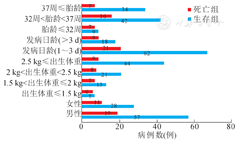
生存组与死亡组两组患儿间性别、是否早产、是否合并其他消化道畸形、是否存在胃壁肌层缺损、是否存在凝血功能异常、是否存在电解质紊乱、术前降钙素值、术前血清白蛋白值、术前血红蛋白值、穿孔最大径、手术时间及术中出血量的差异均无统计学意义(P>0.05),两组间术前乳酸值、是否低出生体重及发现临床症状到就诊时间的差异有统计学意义(P<0.05);将术前乳酸值、是否低出生体重及发现临床症状到就诊时间纳入多因素logistic回归分析中得出影响新生儿胃穿孔预后的独立因素为发现临床症状到就诊时间(P<0.05)。随访结果显示,生存组85例患儿中有2例术后出现粘连性肠梗阻,1例行肠粘连松解手术治疗,1例经保守治疗后缓解,所有患儿生长发育正常,营养状况良好;新生儿胃穿孔死亡30例,死亡率高达26.1%(30/115)。
发病到就诊的时间是影响新生儿胃穿孔最重要的预后因素,故及时就诊治疗是患儿获得生存的关键。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
消化道穿孔是新生儿常见的急腹症之一,以肠穿孔较为多见,胃穿孔发病率较低,约占新生儿消化道穿孔病例的10%[1]。胃穿孔虽然发病率相对较低,但起病急、进展快、病死率较高,约为15%~70%[2,3,4],对小儿外科医生及新生儿内科医师都是挑战。但若能及时就诊、快速准确诊断、及时手术和围手术期有力的监护及支持治疗,则可大大降低其病死率。本研究回顾性分析了昆明医科大学附属昆明市儿童医院2010年1月至2022年1月间收治的115例胃穿孔新生儿的临床资料及随访情况,对可能影响其预后的因素进行单因素和多因素logistic回归分析,旨在明确影响患儿生存的独立预后因素,为临床选择合理的治疗方案提供科学依据和临床思路。
收集2010年1月至2022年1月就诊于昆明医科大学附属儿童医院普通外科、新生儿外科及新生儿科的经手术确诊为胃穿孔115例患儿的临床资料,其中男76例(66.1%,76/115),女39例(33.9%,39/115),男女比为1.95∶1;足月儿41例(35.7%,41/115),早产儿74例(64.3%,74/115);发病时平均日龄为3.25 d,日龄范围是1.23~7.55 d,其中发病日龄1~3 d的有88例(76.5%,88/115);平均体重为2.37 kg,体重范围是1.15~3.85 kg。
本研究已通过昆明市儿童医院伦理委员会审核批准(2022-03-306-K01)。
回顾性分析患儿的临床资料,包括性别、胎龄、入院日龄、入院时体重、主要临床表现、术前相关检查结果、手术情况、术后病理及预后,根据患儿是否存活,将其分为生存组与死亡组,分析导致患儿死亡的主要相关因素。生存组及死亡组患儿的性别、胎龄、日龄、体重的分布情况见图1、表1。

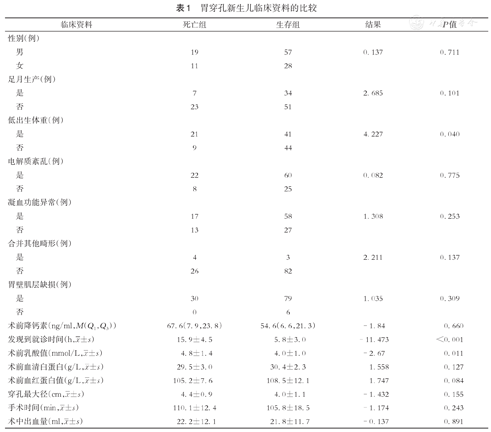
胃穿孔新生儿临床资料的比较
胃穿孔新生儿临床资料的比较
| 临床资料 | 死亡组 | 生存组 | 结果 | P值 |
|---|---|---|---|---|
| 性别(例) | ||||
| 男 | 19 | 57 | 0.137 | 0.711 |
| 女 | 11 | 28 | ||
| 足月生产(例) | ||||
| 是 | 7 | 34 | 2.685 | 0.101 |
| 否 | 23 | 51 | ||
| 低出生体重(例) | ||||
| 是 | 21 | 41 | 4.227 | 0.040 |
| 否 | 9 | 44 | ||
| 电解质紊乱(例) | ||||
| 是 | 22 | 60 | 0.082 | 0.775 |
| 否 | 8 | 25 | ||
| 凝血功能异常(例) | ||||
| 是 | 17 | 58 | 1.308 | 0.253 |
| 否 | 13 | 27 | ||
| 合并其他畸形(例) | ||||
| 是 | 4 | 3 | 2.211 | 0.137 |
| 否 | 26 | 82 | ||
| 胃壁肌层缺损(例) | ||||
| 是 | 30 | 79 | 1.035 | 0.309 |
| 否 | 0 | 6 | ||
| 术前降钙素(ng/ml,M(Q1,Q3)) | 67.6(7.9,23.8) | 54.6(6.6,21.3) | -1.84 | 0.660 |
发现到就诊时间(h, ±s) ±s) | 15.9±4.5 | 5.8±3.0 | -11.473 | <0.001 |
术前乳酸值(mmol/L, ±s) ±s) | 4.8±1.4 | 4.0±1.0 | -2.67 | 0.011 |
术前血清白蛋白(g/L, ±s) ±s) | 29.5±3.0 | 30.4±2.3 | 1.558 | 0.127 |
术前血红蛋白值(g/L, ±s) ±s) | 105.2±7.6 | 108.5±12.1 | 1.747 | 0.084 |
穿孔最大径(cm, ±s) ±s) | 4.4±0.9 | 4.0±1.1 | -1.432 | 0.155 |
手术时间(min, ±s) ±s) | 110.1±12.4 | 105.8±18.5 | -1.174 | 0.243 |
术中出血量(ml, ±s) ±s) | 22.2±12.1 | 21.8±11.7 | -0.137 | 0.891 |
患儿术前均行腹部X线及腹部彩色多普勒超声检查。常规查血常规、血气分析、肝肾功能、电解质、凝血功能、C反应蛋白、降钙素等。诊断标准:手术及病理确诊。
患儿入院后积极做好术前准备,尽快实施手术治疗,术前给予抗感染、抗休克、改善微循环、积极纠正严重贫血及凝血功能障碍、纠正电解质紊乱并维持内环境稳定,对于严重腹胀伴呼吸困难的患儿可行腹腔穿刺排气减压及吸氧或呼吸机辅助通气。手术中对先天性胃壁肌层缺损穿孔者应仔细判断穿孔部位及胃壁肌层缺损的范围,彻底切除无肌层的胃壁,再作胃壁全层及浆肌层两层缝合。对后天性胃壁炎症、坏死穿孔者,可行单纯穿孔修补。同时,术中需仔细探查肠道,重点探查是否存在十二指肠梗阻情况,如十二指肠隔膜、环形胰腺、肠旋转不良等,术中尽可能一并手术治疗。对于胃壁广泛坏死缺损、腹腔感染极重、生命体征极不稳定等情况可先行胃造瘘术,等待二期手术机会。术后禁食水、持续胃肠减压,必要时呼吸机辅助呼吸。抗生素治疗感染、补液维持内环境稳定。给予肠外营养支持治疗,根据病情恢复情况逐步过渡到全肠内营养。
应用SPSS 26.0统计学软件进行分析,等级资料采用卡方检验分析,正态性分布计数资料采用两组独立样本t检验分析,非正态分布的计数资料采用两组独立样本秩和检验分析,多因素分析采用logistic回归分析,P<0.05为差异有统计学意义。
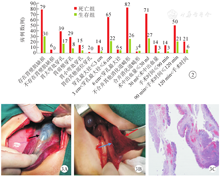
患儿发病前均无明确诱因,其临床表现为腹胀97例(84.3%,97/115),呕吐73例(63.5%,73/115),烦哭89例(77.4%,89/115),发热91例(79.1%,91/115),拒奶71例(61.7%,71/115),精神萎靡82例(71.3%,82/115),呼吸困难27例(23.5%,27/115)。腹片检查提示气腹112例(97.4%,112/115),B型超声检查提示腹腔积液99例(86.1%,99/115)。
对生存组及死亡组患儿术前电解质、凝血功能、血清白蛋白值、血红蛋白值、乳酸值及降钙素值进行对比分析,两组间术前电解质、凝血功能、血清白蛋白值、血红蛋白值及降钙素值差异均无统计学意义(均P>0.05),两组间术前乳酸值差异有统计学意义,生存组为(4.0±1.0),死亡组为(4.8±1.4),P=0.011。(表1)
所有患儿均经手术治疗并确诊为胃穿孔,其中胃壁肌层缺损109例(94.8%,109/115);穿孔部位最多为胃大弯及胃前壁,共93例(80.9%,93/115);平均穿孔直径为4.13(0.8~6.5)cm;平均手术时间为106.94(65~145)min;平均术中出血量为21.91(5~65)ml;合并消化道畸形7例,其中3例患儿合并先天性肠旋转不良,2例患儿合并环形胰腺,1例患儿合并十二指肠隔膜,1例患儿合并小肠闭锁(图2、图3)。

比较生存组及死亡组患儿的部分临床因素、手术因素及病理因素,两组间性别、是否早产、是否合并其他消化道畸形、是否存在胃壁肌层缺损、是否存在凝血功能异常、是否存在电解质紊乱、术前降钙素值、术前血清白蛋白值、术前血红蛋白值、穿孔最大径、手术时间及术中出血量的差异均无统计学意义(P>0.05),两组间术前乳酸值(P=0.011)、是否低出生体重(P=0.040)及发现临床症状到就诊时间(P<0.001)的差异有统计学意义。(表1)
将单因素统计结果中与死亡相关的因素:术前乳酸值、是否低出生体重及发现临床症状到就诊时间纳入logistic回归分析。结果显示:两组间术前乳酸值(P=0.834)及是否低出生体重(P=0.178)的差异无统计学意义;两组间发现临床症状到就诊时间的差异有统计学意义(P<0.05)。(表2)

新生儿胃穿孔预后的多因素logistic回归分析
新生儿胃穿孔预后的多因素logistic回归分析
| 自变量 | 回归系数 | Wald值 | P值 | OR值 | 95%置信区间 |
|---|---|---|---|---|---|
| 是否低出生体重 | -1.138 | 1.817 | 0.178 | 0.321 | 0.061~1.676 |
| 发现临床症状到就诊时间 | 0.643 | 22.381 | <0.05 | 1.903 | 1.458~2.484 |
| 术前乳酸值 | 0.076 | 0.044 | 0.834 | 1.079 | 0.529~2.200 |
查阅生存组患儿的门诊复查资料及再次住院资料,并进行电话随访,85例患儿中有2例分别于术后8个月、11个月出现粘连性肠梗阻,其中1例行肠粘连松解术、1例经保守治疗后缓解,其余患儿均无肠梗阻症状。生存组所有患儿术后进食正常,无腹胀、呕吐不适,营养状况良好、生长发育正常。
本组115例胃穿孔的新生儿生存85例(73.9%,85/115),死亡30例(26.1%,30/115),术前乳酸值、是否低出生体重及发现临床症状到就诊时间是影响新生儿胃穿孔患儿的预后因素,其中发现临床症状到就诊时间是影响新生儿胃穿孔患儿最重要的独立预后因素,故及时就诊治疗是患儿获得生存的关键。
新生儿胃穿孔是一种临床上较为少见的消化道疾病,有文献报道其发病率约为1:5 000 [5,6]。该病进展快,死亡率高,我国报道该类患儿死亡率约为30%~40%[7,8]。本组病例的总病死率为26.1%,较文献报道的略低,这与目前医疗水平的不断提高,新生儿内科、新生儿外科、新生儿重症监护病房、外科重症监护病房及新生儿科内的加速康复外科病房等多学科的协作不断加强有关,新生儿胃穿孔患儿救治成功率不断提升。鉴于该类疾病发病率较低,目前国内外的报道多为个案及小样本的病例分析,关于新生儿胃穿孔的大样本预后多因素分析报道相对较少。本研究回顾性分析了近12年本院收治的115例胃穿孔的新生儿,对可能影响其预后的因素进行单因素和多因素logistic回归分析,发现术前乳酸值、是否低出生体重及发现临床症状到就诊时间是影响患儿的预后因素,其中发现临床症状到就诊时间是影响患儿预后最重要的独立因素,这为今后的临床诊疗提供了一定的理论依据。
本研究临床资料数据显示新生儿胃穿孔多发生于早产儿(74/115,64.3%)及低出生体重儿(62/115,53.9%),男婴发病率明显高于女婴(男女比为1.95∶1)。目前对新生儿胃穿孔发病机制众说纷纭,归纳起来主要有以下几种。
先天性胃壁肌层缺损。本研究病例绝大部分患儿是由胃壁肌层缺损引起的(109/115,94.8%),这是由胚胎发育过程缺陷所致,胚胎在发育第4~5周时胃开始发育,胃壁环肌发生最早,始于食管下端,渐向胃底、胃大弯演进,到胚胎第9周时出现斜肌,最后形成纵肌。在此过程中产生发育不全、过慢、发育停顿,便可形成胃壁肌层缺损。可能由于胃底部和大弯侧扩张较快,该处最易发生缺损。故胃壁肌层缺损的患儿穿孔多位于胃前壁和胃大弯处[9]。本研究病例胃前壁和胃大弯穿孔合计占比为80.9%(93/115)。但也有学者认为这是正常肌层发育尚未完全的薄弱间隙,是正常的发育过程,在出生后不久便会逐渐发育完善。
胃壁肌层缺血性损伤。在围生期呼吸障碍,或当分娩时窒息、低体温、低氧血症时,为了保证生命中枢的血供,可出现血液选择性分流,胃大弯侧相对是一个血管盲区,血供相对减少,发生局部选择性缺血现象,导致坏死穿孔。本院近12年统计胃穿孔新生儿较其他研究中心报道的病例数多,可能和云南地处高原,海拔高、氧浓度低,胎儿期的孕妇及患儿在新生儿期均较其他地区缺氧的可能性大,但这方面的研究还有待进一步探讨。
胃肠蠕动不协调,胃内压增高。Byun等[10]研究表明新生儿胃肠道肌群蠕动功能直到出生3 d后才能逐渐趋于协调,因此生后3 d之内,患儿胃肠道蠕动功能尚不协调,易导致胃内压力不平衡,形成胃穿孔发病高峰,目前已有较多文献报道新生儿胃穿孔发病年龄在生后1周之内[4,6]。本研究76.5%(88/115)的患儿在出生后1~3 d时发病,与文献报道相符[4,6]。新生儿在早期胃的蠕动不稳定,啼哭、哺乳、吸吮、呕吐时吞入空气等均可使胃腔内压增加,这可能也是发生胃穿孔的诱因,本研究表明84.3%患儿就诊症状有腹胀,77.4%的患儿有烦哭,63.5%的患儿有呕吐。
消化道梗阻。如患儿合并有上消化道梗阻时,胃腔压力亦会升高,也是诱发胃穿孔的危险因素之一[11]。尤其是肠旋转不良的患儿同时还多会伴有一定的胃肠道血液循环障碍,致胃壁缺血,从而诱发胃穿孔[12]。本组病例中患儿合并消化道畸形7例(7/115,6.1%),其中合并肠旋转不良3例,2例患儿合并环形胰腺,1例患儿合并十二指肠隔膜,1例患儿合并小肠闭锁,因此术中探查整个消化道是非常有必要的。
此外,还有些学者认为新生儿对感染的抵抗能力差易导致胃肠道的菌群过度繁殖产生胃炎[13],可引起新生儿胃壁炎症、坏死及穿孔。还有Cajal间质细胞减少[10,14]、医源性及不明原因的特发性胃穿孔等。各家观点不能解释所有的病例,应考虑是局部因素和全身因素综合所致。
早产、低出生体重被公认为新生儿胃穿孔的危险因素,早产、低出生体重儿病死率也更高,极低出生体重儿胃穿孔病死率高达62.5%[15,16,17,18]。考虑早产、低出生体重儿器官发育不成熟,器官功能储备差,免疫功能脆弱,更容易出现脓毒症、感染性休克和多器官衰竭。本研究中死亡组患儿低出生体重儿占比70.0%(21/30),生存组低出生体重儿占比48.2%(41/85),组间比较差异有统计学意义(P<0.05),可见新生儿发生胃穿孔时低出生体重儿较正常体重儿死亡率高,与文献报道相符。同时,本研究中生存组患儿术前检查中血气分析中的乳酸水平明显低于死亡组患儿;生存组患儿中从发现临床症状到就诊时间明显小于死亡组,差异均有统计学意义(均P<0.05),可见致新生儿胃穿孔患儿死亡的原因多与严重的腹腔感染致感染中毒性休克、弥散性血管内凝血及多器官功能障碍综合征有关。新生儿免疫功能不完善,尤其是低出生体重儿及早产儿抗感染能力较弱,而胃穿孔的面积多较大,短时间内大量的消化液及食物会快速瘘入腹腔,造成强烈的化学刺激。同时,大量的细菌进入腹腔致严重的腹腔感染,从而加速患儿并发感染性休克、弥散性血管内凝血及器官衰竭等,最终致患儿死亡。因此及时的手术治疗,迅速清除腹腔内的食物残渣,减轻毒素的吸收,尽快去除患儿的腹腔感染,可以明显提高患儿的生存率[19,20]。
综上所述,新生儿胃穿孔多因先天性胃壁肌层发育缺陷引起,胃内压增高是穿孔的诱因,但其发生的具体机制目前尚未完全明了,影响着患儿预后的因素也有很多,救治成功与否取决于患儿的确诊时间和是否得到及时有效的治疗,早确诊、尽早手术探查和积极的围手术期治疗是提高治愈率的关键。
所有作者均声明不存在利益冲突



























