
免疫检查点抑制剂(ICIs)通过激活机体免疫系统抵御肿瘤细胞,目前已成为多种恶性肿瘤的重要治疗手段。但其使用过程中可能发生多种不同类型的皮肤不良反应,包括斑丘疹、瘙痒、水疱病变、色素减退和脱发等,严重者出现类似Steven-Johnson综合征/中毒性表皮坏死松解症(SJS/TEN)样表现。这些ICIs相关皮肤相关不良反应(cirAEs)发生率高,严重影响患者的生活质量和医师的治疗决策,部分严重的皮肤不良反应(SCARs)甚至危及生命。为此,中华医学会皮肤性病学分会、中国医师协会皮肤科医师分会、中国老年医学学会皮肤医学分会和其他相关领域的专家共同讨论并制订了《免疫检查点抑制剂相关皮肤不良反应诊治中国专家共识(2024版)》。此共识包括cirAEs的命名与流行病学、发病机制、临床特征、分类分级、诊断依据、治疗策略与ICIs的重启治疗等,旨在为中国cirAEs的诊治提供更科学、更权威的参考依据。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
免疫检查点抑制剂(ICIs)是一类新型的抗肿瘤药物,通过增强T细胞的杀伤作用抑制肿瘤生长,已广泛应用于晚期恶性肿瘤的患者。目前已有多种ICIs在国内外相继获批用于治疗恶性黑色素瘤、非小细胞肺癌、肾细胞癌和头颈部鳞状细胞癌等。国际上已获批上市的ICIs药物包括抗程序性细胞死亡受体-1(PD-1)/程序性细胞死亡配体-1(PD-L1)单克隆抗体(单抗),如纳武利尤单抗(Nivolumab)、帕博利珠单抗(Pembrolizumab),以及抗细胞毒性T淋巴细胞相关抗原-4(CTLA-4)单抗,如伊匹木单抗(Ipilimumab)等。国产代表性的ICIs主要为抗PD-1/PD-L1单抗,如特瑞普利单抗(Toripalimab)、卡瑞利珠单抗(Camrelizumab)、信迪利单抗(Sintilimab)和替雷利珠单抗(Tislelizumab),以及同时靶向PD-1和CTLA-4的艾帕洛利托沃瑞利单抗(Iparomlimab and tuvonralimab)和卡度尼利单抗(Cadonilimab)等。然而,ICIs可能引发多系统的免疫相关不良反应(irAEs),如皮肤不良反应、肠炎、肝炎、关节痛和甲状腺功能异常等[1]。其中,ICIs导致的免疫相关皮肤不良反应(cirAEs)发生率最高,甚至引起严重的皮肤不良反应(SCARs),极大地影响患者的生活质量和抗肿瘤的治疗决策[2, 3, 4]。
ICIs可能引发皮肤不良反应,包括SCARs,但目前处理原则和诊疗规范主要由肿瘤科医师主导,需要联合皮肤科医师共同决策。《免疫检查点抑制剂相关皮肤不良反应的诊治中国专家共识(2024版)》由中华医学会皮肤性病学分会、中国医师协会皮肤科医师分会、中国老年医学学会皮肤医学分会等包括皮肤科、肿瘤科和药剂科等多学科专家联合制订,旨在为cirAEs的诊治提供标准化和规范化的指导。
本专家共识制订由中华医学会皮肤性病学分会、中国医师协会皮肤科医师分会、中国老年医学学会皮肤医学分会发起,邀请皮肤科、肿瘤科、药剂科及相关基础研究领域的共31位专家,成立共识制订工作组,同时邀请循证医学专家参与指导。专家共识制订工作于2023年3月启动,于2024年3月定稿。
本专家共识适用于各级医疗机构和管理机构组织开展cirAEs的诊疗工作。本专家共识的使用者包括但不限于各级各类从事cirAEs相关工作的医师、护理人员、教学、科研人员,主要包括皮肤科、肿瘤科、基础研究中心、科研教学团队等。专家共识的应用目标人群为计划使用ICIs,以及使用ICIs治疗中引起cirAEs的肿瘤患者。本专家共识不具备强制性,不作为医疗事故鉴定和医学责任认定依据,仅供从事cirAEs相关的医护人员参考。
通过系统检索cirAEs领域已发表的指南、共识、综述类文献以及部分专家述评,工作组初拟了包含14大类主要讨论问题的框架;针对所列讨论问题的重要性及框架、内容设置,进行第1轮次咨询,共收到28位专家反馈意见,进一步确定了本专家共识的框架及内容设置。
专家共识制订工作组成立了证据检索与评价小组,针对最终纳入的并发症项目,按照人群、干预、对照和结局原则进行文献检索,文献数据库包括PubMed、Embase、Cochrane Library、Web of Science、中国知网、万方知识服务平台、维普资讯网和中国生物医学文献数据库。此外,工作组还对cirAEs相关综述指南的参考文献进行滚雪球式检索。证据检索截止日期为2023年10月30日。
专家组基于证据评价小组提供的国内外证据,同时考虑我国cirAEs患者的临床特征以及干预措施等因素后,初步拟定了cirAEs诊治中国专家共识的推荐意见。2023年11至12月开展了第一轮次的德尔菲函询,向30位专家发出邀请。所有专家一致认为有必要制订此共识,最终根据具体反馈并考虑实际检索证据的可获得性、问题设置逻辑关系确认等,在该轮次咨询后编写组对初拟推荐意见所涉及的7大类、31个问题进行了修改完善,并于2024年3月开展了第二轮次的德尔菲函询,针对不同种类cirAEs治疗药物的用法用量,参照国际皮肤学界的指南和常用标准(扫描首页二维码查看附录表1)进行了专家投票及意见汇总,直至达成共识。
专家共识发布后,工作组将主要通过以下方式对专家共识进行传播和推广:(1)在相关学术会议中对专家共识进行解读;(2)有计划地在中国部分省(自治区、直辖市)组织专家共识推广专场会议,确保基层的相关多学科医务人员充分了解并正确应用本专家共识;(3)通过学术期刊和书籍出版社公开发表本专家共识;(4)通过媒体等进行宣传推广。工作组将综合临床实践的需求与证据产生的进展,并且参考更新专家共识报告清单,对本专家共识进行更新。计划每两年对本共识的内容进行更新。
本共识不具备强制性,不作为医疗事故鉴定和医学责任认定依据,仅供医疗机构涉及使用ICIs治疗中引起cirAEs的肿瘤患者诊疗和监测相关指标的相关医护人员参考。
目前国内不同组织、协会针对cirAEs的命名有所差别。美国肿瘤免疫治疗学会(SITC)、美国临床肿瘤学会(ASCO),以及欧洲皮肤性病学会针对癌症患者的任务组以“irAEs或皮肤irAEs(dirAEs)”命名。而美国国立综合癌症网络(NCCN)、欧洲肿瘤内科学会(ESMO)以及中国临床肿瘤学会(CSCO)均以“免疫检查点抑制剂相关毒性”命名。部分学者提出以“分子靶向药物的新型药疹”“肿瘤靶向药相关皮肤病”命名,更为科学、客观[5]。本共识制订专家组认为cirAEs更可取,原因如下:(1)“cirAEs”的名称沿用“irAEs”的概念,方便记忆与使用;(2)此类皮肤反应不同于化疗药的毒性效应,也有别于传统的药疹。
cirAEs的发病率的数据在大陆地区人群中尚不完善。中山大学肿瘤防治中心一项针对93例接受PD-1抑制剂治疗的黑色素瘤患者的回顾性研究结果显示,cirAEs的发生率为67.8%,其中以瘙痒(30.1%)、斑丘疹(24.7%)及白癜风样皮肤色素减退/脱失较多见(16.1%)[6]。世界范围内的荟萃数据分析显示,cirAEs的平均发生率约为25.1%[7];其中接受抗CTLA-4单抗比抗PD-1/PD-L1单抗治疗的患者出现cirAEs的比例相对更高[8, 9, 10, 11]。根据各组临床数据显示,不同种类的ICIs联用时的cirAEs发生率更高,但Ⅲ/Ⅳ级cirAEs及SCARs总体在5%以下[12, 13, 14, 15]。使用不同种类的抗PD-1单抗治疗引起的反应性毛细血管增生症(RCCEP)发生率有较大的差异[16, 17, 18](表1)。
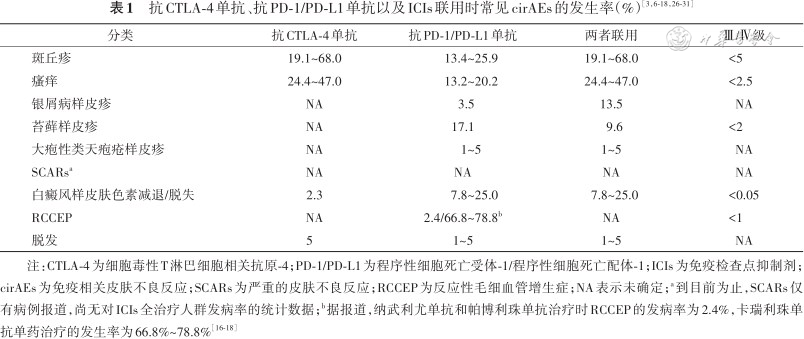
| 分类 | 抗CTLA-4单抗 | 抗PD-1/PD-L1单抗 | 两者联用 | Ⅲ/Ⅳ级 |
|---|---|---|---|---|
| 斑丘疹 | 19.1~68.0 | 13.4~25.9 | 19.1~68.0 | <5 |
| 瘙痒 | 24.4~47.0 | 13.2~20.2 | 24.4~47.0 | <2.5 |
| 银屑病样皮疹 | NA | 3.5 | 13.5 | NA |
| 苔藓样皮疹 | NA | 17.1 | 9.6 | <2 |
| 大疱性类天疱疮样皮疹 | NA | 1~5 | 1~5 | NA |
| SCARsa | NA | NA | NA | NA |
| 白癜风样皮肤色素减退/脱失 | 2.3 | 7.8~25.0 | 7.8~25.0 | <0.05 |
| RCCEP | NA | 2.4/66.8~78.8b | NA | <1 |
| 脱发 | 5 | 1~5 | 1~5 | NA |
在irAEs的发病机制上,不同器官或组织的发生机制不尽相同。目前认为皮肤及其附属器部位的irAEs与该部位免疫细胞分布密集,免疫功能活化过度有关[2]。其中,抗CTLA-4单抗可促进T细胞活化和增殖,使CD4+CD25+Treg细胞存活受阻和17型T辅助细胞数量增加,此外还可诱导自身抗体的产生等;而抗PD-1和PD-L1单抗则导致Treg细胞存活数量减少、抑制功能降低,以及细胞因子产生增加[3]。但总体而言,具体有以下主要因素:(1)预先存在的自身免疫易感性增加:患有自身免疫性疾病或具有自身免疫易感性的患者[19, 20];(2)异常活化的免疫细胞:ICIs可能导致T细胞和其他免疫细胞异常活化,释放出抗体和炎性因子,引起皮肤炎症反应[1,21, 22, 23];(3)共同抗原增强免疫识别:皮肤中存在与肿瘤组织相关的共同抗原,当免疫细胞被ICIs激活后,其可能识别并攻击这些共同抗原[2,24];(4)表皮细菌的异常寄居与炎症激活:ICIs治疗可能导致表皮细菌的寄居异常,引发炎症反应[25];(5)免疫应答的重新激活破坏了促血管生成因子与抗血管生成因子之间的动态平衡,从而引起皮肤毛细血管内皮细胞的增殖[26]。此外,有研究表明,皮肤irAEs的严重程度可能还与患者的性别、年龄和肿瘤类型等因素有关。比如,黑素瘤免疫治疗导致的cirAEs多发生在绝经前期的女性[27];而ICIs治疗导致的Ⅱ/Ⅲ级斑丘疹见于肝细胞癌的比例约为非小细胞肺癌的11.24倍[27, 28]。
cirAEs的潜伏期差异大,停药后皮疹可能继续存在,因此在诊断时需要谨慎对待。既往发生cirAEs病史,以及同时出现其他系统irAEs症状,可为cirAEs诊断提供重要参考。同时,皮肤组织活检等检测可用来辅助诊断。对cirAEs的分类、分级和诊断主要基于相应的皮损特征及其严重程度,同时参考了美国国家癌症研究所不良事件通用术语标准(CTCAE)5.0版(表2)。值得注意的是,近期一项针对cirAEs的荟萃分析发现,cirAEs的出现即意味着有更长的总生存期和无进展生存期(PFS)[29]。这项研究结果突出了cirAEs在肿瘤治疗中的预后价值,给了肿瘤患者继续治疗的信心,也给了医师重新认识cirAEs的思考。

cirAEs的分类分级体系
cirAEs的分类分级体系
| 分类 | 分级 |
|---|---|
| 斑丘疹 | Ⅰ级:皮损区域<10%BSA,伴或不伴症状(例如瘙痒、灼痛或紧绷); Ⅱ级:皮损区域占10%~30%BSA,伴或不伴症状,或>30%BSA,轻微伴随症状; Ⅲ级:皮损区域>30%BSA,且伴有明显症状,日常生活自理明显受限 |
| 瘙痒 | Ⅰ级:轻微或局限; Ⅱ级:强烈或广泛,间歇性,抓挠致皮肤受损(如:水肿、丘疹、脱屑、苔藓化、渗出/结痂); Ⅲ级:强烈或广泛,持续性,日常生活自理明显受限或影响睡眠 |
| 银屑病样皮疹、苔藓样皮疹、大疱性类天疱疮样皮疹 | Ⅰ级:皮损区域<10%BSA,伴或不伴症状; Ⅱ级:10%~30%伴疼痛,日常使用工具受限; Ⅲ级:皮损区域>30%BSA,日常生活自理明显受限; Ⅳ级:皮损区域>30%BSA,伴有体液及电解质紊乱 |
| SCARs | Ⅲ级:皮损区域<10%BSA,伴红斑、紫癜、表皮脱落和黏膜脱落; Ⅳ级:皮损区域涉及10%~30%BSA,伴红斑、紫癜、表皮脱落和黏膜脱落和(或)全身症状以及相关的血液检查异常,致死性 |
| RCCEP | Ⅰ级:单个或多个皮肤和(或)黏膜丘疹,最大直径≤1 cm,伴或不伴局部破溃出血; Ⅱ级:单个或多个皮肤和(或)黏膜结节,最大结节直径>1 cm,伴或不伴局部破溃出血; Ⅲ级:皮肤和(或)黏膜结节呈泛发性,可并发感染,严重者可能需要住院治疗 |
| 白癜风样皮肤色素减退/脱失 | Ⅰ级:色素沉着或脱色覆盖<10%BSA,没有社会心理影响; Ⅱ级:色素沉着或脱色覆盖>10%BSA,有社会心理影响 |
| 脱发 | 依据SALT评分标准分为以下亚类: S0=无脱发,S1=<24%脱发,S2=25%~49%脱发,S3=50%~74%脱发,S4=75%~99%脱发,S5=100%脱发 |
注:cirAEs为免疫相关皮肤不良反应;SCARs为严重的皮肤不良反应;RCCEP为反应性毛细血管增生症;BSA为即体表面积;SALT为脱发严重度工具,即通过拍摄脱发患者头皮的4个视图(左侧、右侧、顶部和背面),分别计算每个视图的头皮脱发表面积的百分比,评分结果为各个视图头皮脱发百分比数值的总和[54];上述cirAEs的分类分级标准来自常见不良反应事件评价标准(CTCAE)5.0版
斑丘疹是免疫治疗患者最常见的cirAEs,发生率高达50%。根据皮损区域的面积和伴随症状的严重程度可将其分为Ⅰ~Ⅲ级;Ⅲ级皮损定义为覆盖30%以上的体表面积,且伴有明显症状,或影响到日常生活及自理能力。其中抗CTLA-4单抗及联合治疗导致斑丘疹的发生率相较抗PD-1/PD-L1单抗治疗更高,但多为自限性或低级别(Ⅰ~Ⅱ级)。皮疹一般在ICIs治疗后的2~5周即出现,部分患者可在用药后立即出现,并随着剂量的累积而加重[24]。表现为非特异性、多发性红斑和丘疹,可聚集成斑块,好发于躯干和四肢伸侧,面部一般不受累[30, 31, 32]。通常伴瘙痒,但也可表现为无瘙痒症状的皮疹。组织病理学检查主要提示为湿疹样改变,可见表皮海绵水肿及真皮内淋巴细胞、嗜酸性粒细胞浸润[24]。值得注意的是,斑丘疹可能是SCARs的早期表现。对于可疑部位或形态异常的皮损,需要更进一步地检查,以排除SCARs的情况。例如,在接触药物2~8周内出现面部和耳部的斑丘疹、肿胀,需进行嗜酸性粒细胞计数、外周血涂片和肝功能检查来排查药物反应伴嗜酸性粒细胞增多和全身性症状(DRESS)[33]。此外,应注意与ICIs治疗导致的原发性皮肤疾病的复发与进展情况相鉴别,如皮肤T细胞淋巴瘤[34]等。
ICIs导致的瘙痒通常在免疫治疗早期(3~10周)出现,可伴随各种类型的皮疹发生,但瘙痒也可先于皮疹出现,或出现于外观正常的部位。根据瘙痒发作的范围、频率以及对日常生活的影响,可将其分为Ⅰ~Ⅲ级。与抗PD-1/PD-L1单抗相比,抗CTLA-4单抗导致的瘙痒发生率更高,两者联用可导致瘙痒症状更严重[35]。当出现瘙痒时,需明确患者的用药史,并通过细致全面的皮肤、黏膜检查,判断是否伴随其他的cirAEs。
有报道ICIs引起的银屑病样皮疹83%由单一抗PD-1单抗治疗引起,其中有77.0%~85.7%出现于男性患者;发病时间平均为使用ICIs后的第8.8周,约50%患者既往无银屑病病史;新发银屑病患者的皮损出现时间可能较复发患者延后(平均为90.5比32.8 d,P=0.1)[36, 37, 38]。按皮疹的分布面积和对日常生活的影响,也将其分为了Ⅰ~Ⅲ级;其中Ⅲ级的受累体表面积超过30%,且开始出现日常生活自理能力的受限。约70%为寻常型,21%为点滴型,少量为脓疱型[36]。典型表现为边界清晰的红色斑块,上覆银白色鳞屑,可累及手掌/足底[39]。组织病理学上改变与经典的银屑病无异,部分可同时出现空泡化界面改变,血管周围可见少许嗜酸性粒细胞。有报道皮损处角质形成细胞上的PD-1及PD-L1分子表达下调[40]。
苔藓样皮疹最常见于接受抗PD-1/PD-L1单抗药物治疗的肿瘤患者,皮疹发生和消退较为缓慢,多数在数周至数月后出现,停止使用免疫治疗后,皮疹可持续数月[39]。根据皮疹的分布面积和对日常生活的影响,可分为Ⅰ~Ⅲ级。临床表现为多发性、瘙痒性、紫红色轻度角化性丘疹或斑块,主要位于躯干和四肢伸侧,黏膜部位也可能受累,但掌跖部位较罕见,瘙痒程度不一[11]。皮肤病理:角质层可见灶性角化不全,真皮-表皮交界处的带状致密淋巴细胞浸润,伴基底层的液化变性和空泡化,可夹杂少许嗜酸性粒细胞。
大疱性类天疱疮样皮疹多由抗PD-1/PD-L1单抗诱导,出现时间较晚,多在治疗数月后出现[39]。与经典大疱性类天疱疮相比,黏膜受累更常见,主要位于四肢[41, 42]。根据CTCAE 5.0的分级标准,将其分为了Ⅰ~Ⅳ级;Ⅲ级的大疱覆盖超过30%体表面积,且开始影响自理性日常生活,Ⅳ级伴有体液和电解质紊乱。初期可表现为非特异性斑丘疹,伴剧烈瘙痒,而后进展为正常皮肤或红斑基础上的大疱、水疱,伴疼痛。直接免疫荧光法(DIF)、间接免疫荧光法(IIF)和血清特异性抗体(BP180/BP230抗体)检测进行辅助诊断[11]。皮肤病理:表皮下水疱,疱腔内有嗜酸性粒细胞,血管周围有淋巴细胞浸润,直接免疫荧光基底膜带可见IgG和C3线状沉积。
免疫治疗导致的大疱性类天疱疮样皮疹和Steven-Johnson综合征(SJS)/中毒性表皮坏死松解症(TEN)在严重程度以及治疗预后上存在显著差异,且通常被非皮肤科医师忽视。因此,大疱性类天疱疮样皮疹和SJS/TEN的鉴别诊断是十分重要的,二者可通过特异性的血清抗体、组织病理学改变检查等进行鉴别[43]。
SCARs主要包括SJS/TEN、DRESS、急性泛发性发疹性脓疱病(AGEP)。SCARs的分级仅有Ⅲ、Ⅳ两级,常伴红斑、紫癜、表皮脱落和黏膜脱落;Ⅳ级SCARs会出现全身症状,可危及生命。免疫治疗导致的SCARs伴随多系统的损伤,出现的时间跨度大,进展迅速,致死率高,需要进行多种检查,以评估疾病进展[39]。
ICIs导致SJS/TEN的初期可表现为难治性斑丘疹,而后转变为泛发水肿性红斑、瘀斑,出现水疱、大疱或血疱,伴全身皮肤及黏膜的坏死剥脱、发热等,并可累及多个器官系统[43, 44, 45]。皮肤病理:全层表皮坏死伴空泡界面改变,表皮下裂隙,含纤维蛋白和嗜酸性粒细胞,真皮有淋巴细胞、嗜酸性粒细胞和中性粒细胞浸润[43]。
ICIs治疗导致的DRESS表现为全身广泛性斑丘疹,伴发热和其他系统受累(如转氨酶升高、氮质血症和结肠炎等)[43]。皮肤病理学无特异性,可进行嗜酸性粒细胞计数、外周血涂片和肝功能等检查来辅助诊断DRESS[33]。
ICIs治疗导致的AGEP表现为在红斑基础上迅速出现非毛囊性无菌性脓疱,常伴发热。通常在开始使用药物48 h内发作,并可能出现自发性消退[46, 47, 48]。皮肤病理:角层下脓疱和表皮下炎性细胞浸润[47,49]。
此外,也有报道提到罕见的、具有潜在致死性的中性粒细胞性药疹,包括皮肤小血管炎和嗜中性粒细胞性皮肤病(坏疽性脓皮病和Sweet综合征)[11],其中坏疽性脓皮病可表现为皮肤大片糜烂和溃疡,伴剧烈疼痛;Sweet综合征主要表现为面颈部以及四肢突发疼痛性红斑,可伴发热、关节和肌肉疼痛等。
RCCEP可见于纳武利尤单抗和帕博利珠单抗治疗的患者,但最常见于单药使用卡瑞利珠单抗。卡瑞利珠是我国自主研发的抗PD-1单抗,可用于治疗经典型霍奇金淋巴瘤、肝细胞癌、RCCEP和食管鳞状细胞癌,临床应用广泛。患者主要位于颜面、颈部及前胸,且具有独特的形态学表现,呈现出红痣型、珍珠型、桑葚型、斑片型及瘤样型五种大体分型[17]。极少数可出现在口腔、鼻腔或眼睑黏膜部位,但目前尚未发现发生于呼吸道和消化道黏膜,以及引起内脏出血的报道[18]。根据皮肤或黏膜皮损的分布和大小可将RCCEP分为Ⅰ~Ⅲ级,Ⅲ级皮损呈泛发性,可并发感染,严重者需住院观察治疗。皮肤病理表现主要为真皮层毛细血管内皮增生,其中,“红痣型”毛细血管的内皮细胞均为单层,管腔内大多为单个红细胞;“珍珠型”或“瘤样型”内皮细胞为多层,管腔内可见多个红细胞,毛细血管呈分叶状或结节状排列,间质可出现纤维化。免疫组化及荧光染色可见毛细血管内皮细胞增殖分裂,血管内皮生长因子水平局灶性增加,毛细血管周围CD4+T细胞显著增加[18]。
ICIs诱导的白癜风样皮肤色素减退/脱失最常见于黑素瘤患者,一般于治疗数月后开始出现,通常呈对称分布,也可能发生在原有的痣、睫毛、眉毛或头皮毛发中。与大多数皮肤不良反应不同,白癜风样皮肤色素减退/脱失很少是可逆的。即使治疗停止后,色素脱失斑仍可持续存在。根据色素沉着或脱色范围及对患者心理影响可分为Ⅰ、Ⅱ两级。其发生机制可能与黑素瘤细胞和正常黑素细胞存在共同抗原有关,因此白癜风样皮肤色素减退/脱失被认为是治疗反应和总体生存期良好的预测指标[14,50, 51]。皮肤病理:表皮黑素细胞减少或缺失,基底层轻度液化变性,真皮浅层有少许淋巴细胞及噬黑素细胞。
ICIs治疗导致的脱发通常在ICIs治疗后的3~6个月发生,可表现为斑秃,甚至全秃和普秃[8,52]。通常采用SALT评分标准进行分级,诊断性检查包括:毛发镜检查、头皮临床评估、拔毛试验、头皮标本活检以及实验室检测,其中的实验室检查可排除其他原因导致的脱发,如甲状腺功能障碍和锌、维生素D或铁缺乏等[8,53]。ICIs治疗的患者发生斑秃也可能是预后良好的另一个预测因素,独立于白癜风。皮肤病理表现:急性期为毛囊周围大量淋巴细胞浸润及毛囊小型化;亚急性和慢性期休止期/生长期毛发比例倒置。
一项汇聚了112项临床试验、涵盖了19 217例肿瘤患者的回顾性分析数据显示,各系统irAEs的总死亡率仅为0.64%[55]。其中,大多数cirAEs都较轻微,相关致死性事件罕见[55]。对于irAEs,当前仍主要依赖于糖皮质激素的治疗。对于Ⅲ/Ⅳ级cirAEs,且在48~72 h内对系统使用糖皮质激素不敏感的患者(难治性cirAEs[11]),靶向治疗可能取得良好的效果[56]。此外,cirAEs可能伴发或先于其他系统损害,因此应重视对重要脏器的监测。
针对cirAEs进行分类分级处理,其总体治疗策略如下:(1)多数cirAEs轻微,仅需对症治疗,且无需停止ICIs药物的使用;(2)对于Ⅱ级及以上级别的cirAEs,需考虑暂停或永久停用ICIs药物,并考虑使用系统糖皮质激素、丙种球蛋白以及血浆置换术等治疗;(3)对于难治性cirAEs,除了上述治疗方式外,可考虑相应的靶向药物治疗;(4)除外有致死风险的SCARs,其他cirAEs经治疗降至Ⅰ级时,可综合肿瘤进展情况,考虑重启ICIs治疗。
多数斑丘疹类皮损属于Ⅰ/Ⅱ级,可通过口服抗组胺药和局部使用糖皮质激素类乳膏来控制病情。对于病情控制不佳的Ⅱ级或更高级别的严重皮损,口服或静脉给予糖皮质激素治疗是必要的。通常情况下,不需停止ICIs治疗[11]。
对于难治性斑丘疹,考虑使用度普利尤单抗、英夫利昔单抗和托珠单抗等治疗,在一项探究度普利尤治疗糖皮质激素依赖性cirAEs的患者特征和结局的回顾性队列研究中,共纳入39例受试者,其中16例顽固性斑丘疹患者中有15例(93.8%)对度普利尤治疗表现出良好反应[44]。此外,在以往文献中指出,对于激素抵抗性斑丘疹,可考虑英夫利昔单抗和托珠单抗等靶向治疗[11,53,57]。
推荐意见1:Ⅰ/Ⅱ级的斑丘疹患者无需停用ICIs治疗,推荐口服抗组胺药、外用润肤剂以及强效或超强效糖皮质激素(如0.05%丙酸倍他米松、0.1%曲安奈德或0.05%氯倍他索乳膏)治疗(Ⅳ,A)。对于2~4周后仍无缓解的Ⅱ级以及Ⅲ级患者,应考虑暂停ICIs,同时口服泼尼松(0.5~1 mg·kg-1·d-1),最大给药剂量可达2 mg·kg-1·d-1泼尼松或同等剂量(Ⅳ,A)。
多数免疫治疗相关的皮疹都伴随不同程度的瘙痒,治疗主要以对症处理为主。对于Ⅰ/Ⅱ级别的瘙痒患者,建议外用中至强效的糖皮质激素乳膏,口服抗组胺药物,并不需要停用ICIs治疗。但对于Ⅲ级的瘙痒情况,需要暂停ICIs治疗,同时给予强效的抗瘙痒治疗,并考虑系统性糖皮质激素、γ-氨基丁酸(GABA)类似物(如加巴喷丁、普瑞巴林)等治疗[58]。在一项探究免疫治疗导致皮肤不良反应的治疗结局的回顾性分析中,17例患者接受了GABA类似物普瑞巴林或加巴喷丁治疗,全部(100%)得到了中度至显著的改善;16例瘙痒患者接受了口服抗组胺药物治疗,有13例患者(81%)的瘙痒症状得到缓解[57]。此外,在抗PD-1药物治疗的患者中经常观察到皮肤干燥伴有瘙痒,建议局部使用润肤剂[39]。
对于难治性瘙痒,考虑使用度普利尤单抗、奥马珠单抗等治疗[43]。在一项回顾性队列研究中,纳入了39例局部和(或)全身糖皮质激素治疗无效的瘙痒患者,34例(87.2%)患者对度普利尤治疗表现出部分或完全缓解[44]。在1例病例报道中,使用度普利尤单抗治疗难治性瘙痒,同时未延迟或中断肿瘤免疫治疗,患者症状得到了明显改善[59]。在一项多中心回顾性分析中,奥马珠单抗在ICIs导致的IgE升高性瘙痒患者中显示出良好的临床疗效(82%瘙痒患者得到缓解)[60]。此外,神经激肽-1(NK-1)受体拮抗剂阿瑞匹坦(80 mg/d,连续使用5 d)也在个案报道中,用于改善接受抗PD-1单抗治疗导致的顽固性瘙痒患者[61]。
推荐意见2:Ⅰ/Ⅱ级的瘙痒患者无需停用ICIs治疗,推荐外用润肤剂(V,B)、抗组胺药(Ⅳ,B),以及外用强效或超强效糖皮质激素(如0.1%曲安奈德或0.05%氯倍他索乳膏)治疗(Ⅳ,B)。对于Ⅱ级的瘙痒患者,考虑将抗组胺药替换为GABA类似物(如加巴喷丁100~300 mg 3次/d、普瑞巴林50~100 mg 3次/d)(Ⅳ,B),以及NK-1受体拮抗剂(如阿瑞匹坦,第1天125 mg,第3和5天分别为80 mg)(Ⅴ,C),或考虑奥马珠单抗300 mg,每4周1次(Ⅳ,B)。对于所有Ⅲ级的瘙痒患者,应考虑暂停ICIs,除上述治疗外,给予系统性糖皮质激素(泼尼松0.5~1 mg·kg-1·d-1或同等剂量)治疗(Ⅳ,B)。
ICIs导致的Ⅰ级银屑病样皮疹通常仅需局部治疗,如外用强效糖皮质激素、维生素D3衍生物等,而无需停用ICIs药物;Ⅱ/Ⅲ级银屑病样皮疹需根据患者病情进行评估,考虑暂停ICIs治疗,加强局部治疗,并可考虑使用阿维A、中波紫外线(UVB)光疗、甲氨蝶呤等[8]。在一项探究ICIs致银屑病样皮疹的回顾性队列研究中,纳入了115例受试者,阿维A(20.1%)作为最常见的系统性治疗,表现出良好安全性和有效性[62]。由于全身性糖皮质激素使用对银屑病样皮损的长期控制效果不佳,且在逐渐减量时容易引发复发,我们强调,不建议长时间使用系统糖皮质激素对银屑病样皮损进行治疗[36]。
对于难治性银屑病样皮疹,考虑使用阿普米司特、生物制剂等治疗。多项研究均报道了阿普米司特在ICIs致银屑病样皮疹中的有效性[63, 64, 65],但其长期安全性仍有待评估[66]。此外,选择生物制剂治疗应更加受到重视。有研究表明,肿瘤坏死因子-α(TNF-α)抑制剂在治疗银屑病样皮疹的同时可治疗ICIs导致的胃肠道不良反应[67],经临床评价后可考虑使用。有病例报道IL-17A抑制剂治疗银屑病样皮疹的有效性[68, 69, 70],但存在潜在的胃肠道不良反应[71],以及肿瘤患者使用的禁忌证[37],综合考虑后酌情使用。另有研究报道了难治性银屑病样皮疹患者,分别在接受IL-12/23抑制剂以及IL-6受体抑制剂治疗后,得到了明显的改善[57,72]。
推荐意见3:对于Ⅰ/Ⅱ级新发或复发的银屑病患者,无需停用ICIs,建议外用强效糖皮质激素、维生素D3衍生物,以及联合0.05%他扎罗汀、煤焦油以及水杨酸等多种外用方案(Ⅳ,A)。对于Ⅱ级的患者,可考虑窄谱UVB光疗,阿维A(10~30 mg/d)、甲氨蝶呤(10~25 mg/周)、阿普米司特(30 mg,2次/d)等治疗(Ⅳ,A)。对于Ⅲ级的患者,建议暂停ICIs,除上述治疗外,还可考虑TNF-α抑制剂(如英夫利昔单抗、阿达木单抗),以及IL-23抑制剂(如古塞奇尤单抗、乌司奴单抗、Risankizumab等)(Ⅳ,B)。
Ⅰ级苔藓样皮疹需局部使用强效糖皮质激素;如伴瘙痒,可口服抗组胺药物,一般无需停止ICIs治疗。Ⅱ/Ⅲ级苔藓样皮疹暂停ICIs治疗,口服泼尼松/静脉给予甲泼尼龙0.5~1 mg·kg-1·d-1,还可考虑口服阿维A以及UVB光疗。有研究表明,当出现糖皮质激素抵抗性苔藓样皮疹时,可检查血清IL-6和TNF-α水平,并进行综合评估,考虑托珠单抗或英夫利昔单抗等靶向治疗[53,57]。
推荐意见4:对于Ⅰ/Ⅱ级的苔藓样皮疹患者,无需停用ICIs治疗,推荐外用强效或超强效糖皮质激素(如0.05%丙酸倍他米松、0.1%曲安奈德或0.05%氯倍他索乳膏),保湿及抗组胺药等常规治疗(Ⅳ,A)。对于Ⅱ级的患者,还应考虑口服泼尼松(0.5~1 mg·kg-1·d-1)并维持4~6周,以及异维A酸或阿维A(20~30 mg/d)治疗(Ⅳ,A)。对于Ⅲ级的患者,应考虑暂停ICIs治疗,系统性糖皮质激素(泼尼松1 mg·kg-1·d-1或同等剂量)治疗,以及窄谱UVB光疗、免疫抑制剂(如甲氨蝶呤),并进行住院治疗(Ⅴ,B/C)。
Ⅰ级大疱性类天疱疮样皮疹可继续ICIs治疗,并局部使用强效糖皮质激素治疗;Ⅱ级大疱性类天疱疮样皮疹暂停ICIs治疗,加强外用糖皮质激素治疗,并考虑口服泼尼松/静脉给予甲泼尼龙0.5~1 mg·kg-1·d-1;Ⅲ级大疱性类天疱疮样皮疹终止ICIs治疗,考虑口服泼尼松/静脉给予甲泼尼龙1~2 mg·kg-1·d-1,并考虑静脉注射用免疫球蛋白(IVIG)治疗[8,33]。
对于Ⅲ级及以上大疱性类天疱疮样皮疹还可以考虑多种新型治疗方法。虽然抗CD20单抗并不常规作为大疱性类天疱疮的优先推荐方案,但是在一项回顾性研究中,纳入了20例受试者,随访平均时间为169 d。结果显示,75%(n=15)患者在利妥昔单抗治疗后皮损获得改善[73]。还有文献报道了针对大疱性皮肤病,使用多西环素联用烟酰胺、奥马珠单抗、血浆置换联用利妥昔单抗等治疗方案[58,74]。对于系统性糖皮质激素抵抗性患者,有文献报道成功使用度普利尤单抗[75, 76],尽管当前对于2型细胞因子(IL-4与IL-13),以及度普利尤单抗在肿瘤免疫微环境及免疫治疗中的作用仍存在一定争议[77, 78]。
推荐意见5:Ⅰ/Ⅱ级的大疱性类天疱疮患者无需停用ICIs,推荐外用超强效糖皮质激素(如丙酸倍他米松,30~40 g/d,分2次全身涂抹使用、0.1%曲安奈德或0.05%氯倍他索乳膏);若无缓解,给予口服泼尼松(≤10 mg/d)(Ⅳ,A)。对于Ⅱ级皮疹的患者,考虑系统性糖皮质激素治疗(泼尼松0.5~1 mg·kg-1·d-1或同等剂量),并借助凡士林及非黏性敷料护理创面(Ⅳ,A)。对于Ⅲ级的患者,除上述处理,可考虑停用ICIs,并住院接受治疗(Ⅳ,A)。对于Ⅳ级患者则建议停用ICIs,给予静脉甲泼尼龙(1~2 mg·kg-1·d-1),并在重症监护病房(ICU)或烧伤病房接受治疗(Ⅴ,A)。
当出现SJS/TEN、DRESS和AGEP等SCARs时,推荐永久停用ICIs治疗。Maloney等[63]在2020年总结了文献报道中ICIs导致SJS/TEN的病例,其中有3/5的TEN患者出现死亡。根据癌症支持疗法多国学会(MASCC)2020年版针对免疫治疗相关SCARs的临床指导建议,对于Ⅲ级的重症皮疹停用ICIs治疗,Ⅳ级则永久停用ICIs治疗。一般情况下,不建议SCARs病史患者重启ICIs治疗[79]。
此外,对于临床上出现ICIs导致SCARs的患者应立即收治入院,请多个科室急会诊,完善相关检查,如血常规、肝肾功能、电解质、C-反应蛋白和补体等,明确诊断及严重程度[33]。在治疗上,除永久停用ICIs治疗外,建议给予支持治疗,预防继发感染[43],以及早期、足量、足疗程的系统性糖皮质激素治疗。对于SJS/TEN,系统性糖皮质激素应按照口服泼尼松或甲强龙1~2 mg·kg-1·d-1给药,联合IVIG(1 g·kg-1·d-1,持续给药3~4 d)治疗[33,43]。根据本共识专家组的经验,也可选择大剂量甲泼尼龙的冲击治疗,持续3~5 d,以及IVIG(400 mg·kg-1·d-1,持续给药3~5 d)的治疗方案。此外,也可考虑环孢菌素和TNF-α抑制剂(如依那西普等)、托珠单抗等治疗[33,43]。对于DRESS,应给予更长疗程、足剂量的系统激素(泼尼松1 mg·kg-1·d-1),并在症状缓解后6~8周内缓慢减量;必要时还可考虑生物靶向治疗,如TNF-α抑制剂(如依那西普)、托珠单抗和度普利尤单抗等[39,43,80, 81]。对于AGEP,建议口服泼尼松(0.5~1 mg·kg-1·d-1)或使用同等剂量系统性糖皮质激素控制病情。此外,在既往传统药物引起AGEP中,也有报道成功使用IL-17A抑制剂进行治疗[82]。
相较于其他cirAEs,SCARs进展迅速,致死率高。因此,对SCARs的管理应该注重多学科合作(MDT)的模式,要加强治疗中的监测和治疗后的随访。通过联合肿瘤科、皮肤科、药剂科,以及其他相关学科专家,共同探讨是否需要停药换药、是否调整剂量、是否需要住院治疗等问题,以实现有效的个体化管理,最大限度地保证抗肿瘤效应,同时减轻患者的不适感和确保治疗的安全性[83]。
推荐意见6:如遇严重的皮肤不良反应,建议永久停用ICIs治疗(Ⅴ,A)。对于体表大面积破溃或水疱性皮损,应注意全身营养支持治疗及预防继发感染(Ⅴ,A)。对于SJS/TEN,给予系统性糖皮质激素(泼尼松或甲强龙1~2 mg·kg-1·d-1)联合IVIG(1 g·kg-1·d-1,持续给药3~4 d),同时考虑环孢菌素和TNF-α抑制剂(如依那西普等)等(Ⅴ,A)。对于DRESS,推荐更长疗程、足剂量的系统性糖皮质激素(泼尼松1 mg·kg-1·d-1)治疗,可考虑TNF-α抑制剂、托珠单抗和度普利尤单抗等生物靶向治疗(Ⅴ,A)。对于AGEP,推荐使用系统性糖皮质激素(泼尼松0.5~1 mg·kg-1·d-1或同等剂量)控制病情(Ⅴ,B)。
虽然ICIs导致的RCCEP、白癜风样皮肤色素减退/脱失及脱发通常对健康的影响较小,通常无需积极治疗,但近期也有新的治疗手段引起关注。例如,9例RCCEP患者使用沙利度胺(50 mg/d)后,皮损得到显著改善[84];外用JAK抑制剂芦可替尼已被美国食品药品监督管理局获批用于白癜风的治疗[85],有望作为潜在治疗药物。由于这类皮损在免疫治疗停止后可能持续存在,且随病情进展可影响患者的外观,在管理这类皮损时,除了监测病情发展、临床改善,还需注意患者满意度和心理健康,给患者进行必要的宣教工作,让他们了解并接受相关情况[8,50]。
推荐意见7:Ⅰ/Ⅱ级的RCCEP一般无需停用免疫治疗;且在停用免疫治疗后,皮损通常会自行萎缩消退或坏死脱落(Ⅴ,B)。RCCEP对糖皮质激素治疗不敏感,可考虑使用沙利度胺(50 mg/d)(Ⅲ,B);当出现较大结节破溃或易摩擦部位的出血时,可局部使用外用药物或压迫止血(Ⅴ,B)。对于影响外观的结节,推荐采取激光美容或手术切除(Ⅴ,A)。Ⅲ级皮损并发感染者,可考虑局部或全身的抗生素治疗,并停用ICIs,待症状缓解降至Ⅰ~Ⅱ级后再恢复免疫治疗(Ⅴ,A)。对于难治性RCCEP,也可考虑替换其他治疗药物(Ⅴ,A)。
推荐意见8:无论Ⅰ/Ⅱ级的白癜风样皮肤色素减退/脱失,都无需停用ICIs治疗,可考虑中长波紫外线(UVB/UVA)进行光疗,以及局部应用强效糖皮质激素或钙调神经磷酸酶抑制剂(Ⅲ~Ⅳ,A)。
推荐意见9:无论Ⅰ/Ⅱ级的脱发一般无需治疗,或考虑皮损内使用曲安奈德,局部外用强效糖皮质激素、米诺地尔酊(Ⅴ,A)。对于Ⅱ级的患者,还可外用二苯基环丙烯酮(DPCP)或JAK抑制剂(Ⅴ,A)。对于任何级别的顽固性脱发患者,也可考虑免疫抑制药物(如甲氨蝶呤),以及假发、纹饰等(Ⅴ,C)。
综合ICIs重启的安全性及肿瘤治疗的获益情况,在以下情况可考虑重启ICIs治疗:(1)除有致死风险的SCARs外,其他种类的cirAEs症状缓解至≤Ⅰ级;(2)极少数不能完全停用系统性糖皮质激素使用时,泼尼松剂量≤10 mg/d(或等效剂量);(3)初次发生irAEs程度较轻,而ICIs抗肿瘤治疗尚未获得完全或部分缓解。重启的具体建议:(1)尽量选择不同类型的ICIs治疗药物;(2)为了重启ICIs的安全性,可考虑有针对地联用免疫抑制药物(如小分子抑制剂、细胞因子拮抗剂等)。
仅针对cirAEs停用或重启ICIs的研究相对较少。三项回顾性研究的分析显示,重启ICIs治疗总体irAEs的发生率为39%~55%,与初治接受ICIs治疗持平[86, 87, 88]。重启ICIs后仅有1例新发致死性SJS/TEN的报道,其余绝大多数仍属于轻症[51]。因此,重启ICIs治疗总体认为是安全的。虽然理论上重启ICIs治疗与系统性糖皮质激素的使用是矛盾的,但目前认为极少数不能完全停用糖皮质激素使用时,泼尼松剂量≤10 mg/d(或等效剂量)仍可考虑重启ICIs治疗[86, 87]。另外,也有研究报道系统性糖皮质激素或其他免疫调节药物的使用对抗PD-1单抗的抗肿瘤效应无影响[88]。此外,是否重启ICIs需权衡初次发生irAEs的严重程度与肿瘤免疫治疗的缓解情况。初次发生irAEs的程度较重,且肿瘤缓解情况良好时,相对不建议重启ICIs治疗[86]。同时,肿瘤免疫治疗获得完全缓解或部分缓解的患者,重启ICIs时更易出现irAEs的复发或新发[86]。
对于重启ICIs的具体建议,由于抗CTLA-4单抗与抗PD-1/PD-L1单抗的免疫学作用机制不重叠,因此重启时选择不同类型的ICIs药物,可能安全性更高[89]。两项回顾性研究分别发现发生irAEs停药后,67例从抗CTLA-4单抗切换到抗PD-1单抗的转移性黑色素瘤患者中34%发生了复发及新发的irAEs[90];40例从抗PD-1单抗切换到抗CTLA-4单抗治疗的转移性黑色素瘤患者中发生Ⅲ级以上irAEs的患者比例为35%[91],总体在可控范围。另外,在切换不同种类的ICIs药物时,应特别注意药物的半衰期,以避免产生药物联用导致的不良后果。一般认为,此类药物的体内半衰期可达到2个月以上[89]。此外,ICIs重启时,联合使用选择性免疫治疗(如小分子抑制剂、细胞因子拮抗剂等)可能对于重启的安全性和肿瘤的长期预后更有利[11,89]。例如,有研究表明,在ICIs导致的高嗜酸性粒细胞综合征(HES)的ICIs重启治疗中可联合抗IL-5单抗(Mepolizumab)或抗IL-5R单抗(Benralizumab)[92, 93];对于ICIs导致的关节炎可联合抗IL-6R单抗(Tocilizumab)进行ICIs的重启治疗[94]。
ICIs通过激活机体免疫系统抵御肿瘤细胞,已被广泛应用于多种恶性肿瘤的治疗。然而,ICIs的使用也伴随着全身多系统的免疫相关不良反应,对患者的生活质量和治疗效果具有重大的影响。其中,cirAEs发生率高、种类复杂,因此需要皮肤科专科医师的指导建议。为填补这一空白,此共识以皮肤科专家的经验与建议为主,充分整合各个专业领域的知识,以及国内外最新的研究进展,旨在为cirAEs的诊治管理提供更为权威和全面的指导,为患者得以维持长期、安全的抗肿瘤免疫治疗保驾护航。当前,对cirAEs不同皮损的认识,以及难治性、重症类型的有效管理仍在不断丰富与完善,未来还有望进一步通过人工智能模型,预测个体不良反应的发生概率,指导患者的安全用药。此共识将有助于进一步推动cirAEs相关领域的研究与应用,为我国未来免疫治疗相关不良反应的诊疗提供更科学、更权威的参考依据。
本共识制订专家委员会名单
专家组组长(按姓氏汉语拼音排序):陶娟(华中科技大学同济医学院附属协和医院皮肤科);陈翔(中南大学湘雅医院皮肤科)
专家组(按姓氏汉语拼音排序):陈柳青(武汉市第一医院皮肤科);顾恒(中国医学科学院皮肤病研究所);耿松梅(西安交通大学第二附属医院皮肤科);郝飞(重庆医科大学附属第三医院皮肤整形美容中心);纪超(福建医科大学附属第一医院皮肤科);康晓静(新疆维吾尔自治区人民医院皮肤性病科);李春英(空军军医大学西京医院皮肤科);李军(武汉市中心医院皮肤科);李航(北京大学第一医院皮肤性病科);李俞婷(华中科技大学同济医学院附属协和医院肿瘤中心);刘业强(上海市皮肤病医院皮肤病理科);鲁严(南京医科大学第一附属医院皮肤科);陆洪光(贵州医科大学附属医院皮肤性病科);崔儒涛(浙江大学医学院皮肤病研究所);孟睿(华中科技大学同济医学院附属协和医院肿瘤中心);乔建军(浙江大学医学院附属第一医院皮肤科);申晨(华中科技大学同济医学院附属协和医院皮肤科);史琛(华中科技大学同济医学院附属协和医院药剂科);宋志强(陆军军医大学西南医院皮肤性病科);粟娟(中南大学湘雅医院皮肤科);王亮春(中山大学孙逸仙纪念医院皮肤科);王秀丽(上海市皮肤病医院);杨骥(复旦大学附属中山医院皮肤科);杨柳(华中科技大学同济医学院附属协和医院皮肤科);杨井(华中科技大学同济医学院附属协和医院皮肤科);谢君(武汉大学中南医院皮肤科);张福仁(山东第一医科大学附属皮肤病医院);钟文宏(厦门长庚医院皮肤科);朱威(首都医科大学宣武医院皮肤科)
秘书组:申晨(华中科技大学同济医学院附属协和医院皮肤科);熊沿(华中科技大学同济医学院附属协和医院皮肤科);刘宇晴(华中科技大学同济医学院附属协和医院皮肤科)
中华医学会皮肤性病学分会, 中国医师协会皮肤科医师分会, 中国老年医学学会皮肤医学分会. 免疫检查点抑制剂相关皮肤不良反应诊治中国专家共识(2024版)[J]. 中华医学杂志, 2024, 104(20): 1790-1803. DOI: 10.3760/cma.j.cn112137-20240112-00091.
所有作者声明不存在利益冲突




























