新型冠状病毒(新冠病毒)感染虽已不再构成“国际关注的突发公共卫生事件”,但仍在全球范围内处于低水平流行。小分子口服药物是我国目前推荐的针对新冠病毒感染的主要抗病毒治疗方案。虽然国内已上市多种抗新冠病毒小分子药物,但目前尚无针对特殊人群的具体用药推荐。中华医学会细菌感染与耐药防治分会联合国家呼吸医学中心、国家呼吸系统疾病临床医学研究中心组织国内呼吸、病毒学、感染、重症、急诊、药学等各领域专家制订了本共识。本共识的主要内容包括7种抗新冠病毒小分子药物介绍,重点阐述了老年人群、合并慢性疾病人群、肿瘤患者、孕妇、儿童等14种特殊人群用药推荐,为临床医师规范用药提供建议。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
新型冠状病毒(简称新冠病毒)感染主要累及上呼吸道,传染性强,全人群普遍易感,新冠病毒感染者是主要传染源,发病后3 d内传染性最强。感染后主要临床表现为咽干、咽喉肿痛、咳嗽、发热等,发热多呈中低热,少数患者病情持续进展并出现肺炎相关表现。重症患者多在发病5~7 d后出现呼吸困难和(或)低氧血症。严重者可快速进展为急性呼吸窘迫综合征、脓毒性休克及多器官衰竭等[1]。
3年多以来,新冠病毒感染对全球人类健康及生命造成严重损害。虽然世界卫生组织在2023年5月5日宣布新冠病毒感染疫情(简称新冠疫情)不再构成“国际关注的突发公共卫生事件”,但并不意味着新冠疫情作为全球健康的重要威胁已经结束。从当前流行趋势来看,新冠疫情在全球范围内低水平流行,新冠病毒仍在不断变异,甚至在个别地区疫情发生率呈小幅上升。因此,国务院应对新冠疫情联防联控机制综合组《关于对新型冠状病毒感染实施“乙类乙管”的总体方案》[2]要求,继续落实“乙类乙管”各项措施,提高科学精准防控水平,不断完善新冠病毒感染治疗相关药物的准备,包括抗新冠病毒小分子药物、中药、对症治疗药物等准备,强化临床救治能力。
目前我国已有七种口服抗新冠病毒小分子药物获国家药品监督管理局(National Medical Products Administration,NMPA)附条件批准上市。为促进抗新冠病毒小分子药物在临床中合理应用,中华医学会细菌感染与耐药防治分会联合国家呼吸医学中心、国家呼吸系统疾病临床医学研究中心组织国内呼吸、病毒学、感染、重症、急诊、药学等各领域专家对相关资料进行整理和分析,就抗新冠病毒小分子药物应用相关问题展开调研与讨论。基于《新型冠状病毒感染诊疗方案(试行第十版)》[1],并结合我国对新冠病毒的诊疗经验,编写本专家共识,以期提高临床医师对抗新冠病毒口服小分子药物的认识,为临床医师规范用药提供建议。
检索的主要关键词包括:新型冠状病毒感染(COVID-19)、抗病毒治疗(antiviral therapy)、小分子药物(small molecule drugs)、早期(early stage)、特殊人群(special population)。依据系统检索获取截至2024年2月的文献及其他证据,包括:(1)PubMed数据库;(2)万方数据资源系统、中国知网系列数据库;(3)手工检索关于新冠病毒感染、抗病毒治疗相关的证据,纳入相关的临床研究、指南、共识、综述等文献。
通过呼吸病学、病毒学、感染、重症、急诊、药学等各领域知名专家进行充分讨论及商榷,并归纳专家的诊疗建议。
通过专家集体讨论及商榷,必要时采取投票方式,统一相应推荐意见。
本共识基于国内外新冠病毒感染的流行病学、循证医学证据和临床研究等方面数据,采用GRADE证据质量与推荐强度分级系统,经过专家多次研讨并达成一致意见。见表1。
本共识已在国际实践指南注册与透明化平台(http://www.guidelines-registry.org/index)进行注册,注册编号:PREPARE-2023CN617,读者可联系指南发起组织索要计划书。
抗新冠病毒小分子药物是通过阻止新冠病毒复制,达到治疗新冠病毒感染的目的。包括3-胰凝乳蛋白酶样蛋白酶(又称主蛋白酶,3-chymotrypsin like protease,3CLpro)抑制剂和RNA依赖性RNA聚合酶(RNA-dependent RNA polymerase,RdRp)抑制剂(图1)。截止至2024年3月4日,NMPA已附条件批准7种口服抗新冠病毒小分子药物上市。其中4种为3CLpro抑制剂,包括奈玛特韦/利托那韦、先诺特韦/利托那韦、来瑞特韦和阿泰特韦/利托那韦。另外3种为RdRp抑制剂,包括莫诺拉韦、阿兹夫定和氢溴酸氘瑞米德韦。
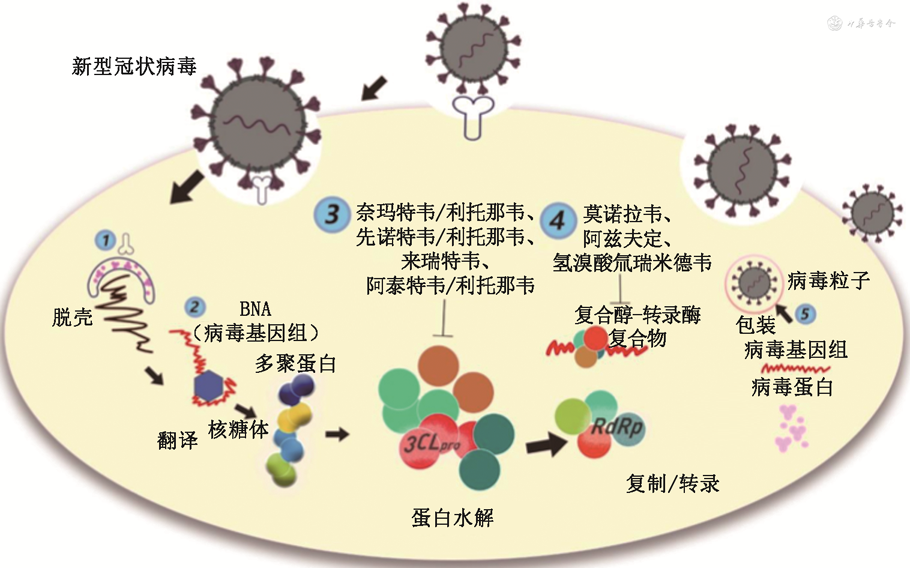

注:3CLpro为3-胰凝乳蛋白酶样蛋白酶;①新冠病毒脱壳;②新冠病毒翻译;③新冠病毒复制过程中蛋白水解酶水解;④由RNA依赖性RNA聚合酶(RdRp)介导的新冠病毒复制过程;⑤新合成的病毒核酸和蛋白质被组装成熟成新的病毒颗粒
1. 奈玛特韦/利托那韦:2022年2月NMPA附条件批准进口注册,3CLpro抑制剂。对新冠病毒变异株α、γ、δ、λ、Mu和奥密克戎(B.1.1.529)具有相似的活性,半数效应浓度(median effect concentration,EC50)为62~186 nmol/L。Ⅱ/Ⅲ期临床研究显示,对于非住院但具有重症高危因素患者,接受奈玛特韦/利托那韦治疗第5天病毒载量下降约0.9 lg拷贝/ml,相较安慰剂组降低住院或死亡风险87.8%[5]。不良事件大多为1级或2级,安全性良好。
2. 阿兹夫定:2022年7月25日NMPA应急附条件批准其增加新冠病毒感染适应证注册申请,RdRp抑制剂。对BetaCoV/Wuhan/WIV04/2019毒株具有抑制活性,EC50为4.31 μmol/L。Ⅲ期临床研究表明,阿兹夫定首次给药后7 d内,临床病情改善患者比例较安慰剂组高近3倍,且缩短临床症状改善中位时间3 d。总体安全性和耐受性良好[4]。
3. 莫诺拉韦:2022年12月29日NMPA应急附条件批准进口注册,RdRp抑制剂。对α、β、γ、δ、λ、Mu和奥密克戎(B.1.1.529/BA.1和BA.1.1)毒株具有相似抑制活性,EC50为0.95~2.60 μmol/L。MOVE-OUT研究显示,对具有重症高风险的轻中度患者,相较安慰剂组,接受莫诺拉韦治疗患者病毒载量下降更快,显著降低住院或死亡风险31%[6]。不良事件大多为1级或2级,安全性良好。
4. 先诺特韦/利托那韦:2023年1月NMPA附条件批准上市,3CLpro抑制剂。其对P1、P2、P4基团进行优化,最终使先诺特韦/利托那韦具有更强的3CLpro抑制活性。对WIV04、Delta及奥密克戎毒株具有抑制活性(EC50分别为26、34及43 nmol/L)[7]。Ⅱ/Ⅲ期临床试验显示,较安慰剂组,服用先诺特韦/利托那韦可缩短重症高风险亚组患者11种预设临床症状缓解时间,降低病毒载量,缩短核酸转阴时间2.2 d。不良事件大多为1级或2级,安全性良好。
5. 氢溴酸氘瑞米德韦:2023年1月29日NMPA附条件批准上市,RdRp抑制剂。其是瑞德西韦母体核苷的氘代三异丁酸酯前药,在体内快速代谢为母体核苷(116-N1)。116-N1在细胞内转化为三磷酸核苷活性形式,干扰SARS-CoV-2的RNA依赖性RNA聚合酶的功能,从而发挥抗病毒作用。氢溴酸氘瑞米德韦及116-N1对奥密克戎变异株(B.1.1.529)EC50分别为0.041 μmol/L和0.186 μmol/L,对奥密克戎变异株(BA.5.2)EC50分别为0.189 μmol/L和0.310 μmol/L。Ⅲ期临床研究显示,相较安慰剂组,氢溴酸氘瑞米德韦组11种预设临床症状快速缓解,首次达到持续恢复中位时间缩短;无论是否伴有进展为重症的高风险因素,病毒学指标在数值上均较优。不良事件大多为1级或2级,安全性良好。
6. 来瑞特韦:2023年3月23日NMPA附条件批准上市,3CLpro抑制剂。来瑞特韦将P1~P3三个基团进行了优化,有效延缓了其在蛋白酶抑制剂复合物中的解离速度,药物靶点停留时间显著延长[8]。针对不同新冠病毒变体EC50值分别为95 nmol/L(WT)、130 nmol/L(α)、277 nmol/L(β)、97 nmol/L(δ)、86 nmol/L(奥密克戎BA.1)和158 nmol/L(奥密克戎BA.5)[8]。Ⅱ期研究显示,来瑞特韦较安慰剂组缩短病毒核酸转阴时间4.2 d[9]。Ⅲ期临床研究显示,较安慰剂组,来瑞特韦组11种预设的临床症状均快速缓解,首次达到持续恢复中位时间缩短约1 d,在高风险亚组和基线病毒载量亚组中也观察到相似现象。不良事件大多为1级或2级,安全性良好。
7. 阿泰特韦/利托那韦:2023年11月24日NMPA附条件批准上市,3CLpro抑制剂。对不同新冠病毒变异株(包括WT、β、δ、奥密克戎)具有广谱的抗新冠病毒活性[10]。Ⅲ期临床研究显示,较安慰剂组,阿泰特韦/利托那韦患者组11种预设的临床症状均快速缓解,首次达到持续恢复中位时间缩短2 d;还可快速降低病毒载量,缩短核酸转阴中位时间2 d。不良事件大多为1级或2级,安全性良好。
不同抗新冠病毒小分子药物其适用人群、用法用量、特殊人群使用情况、不良反应及安全性以及药物相互作用也有所不同,详细掌握相关问题有助于安全用药,表2, 3, 4详细阐述当前已获批抗新冠病毒小分子药物临床应用情况以及药物相互作用。
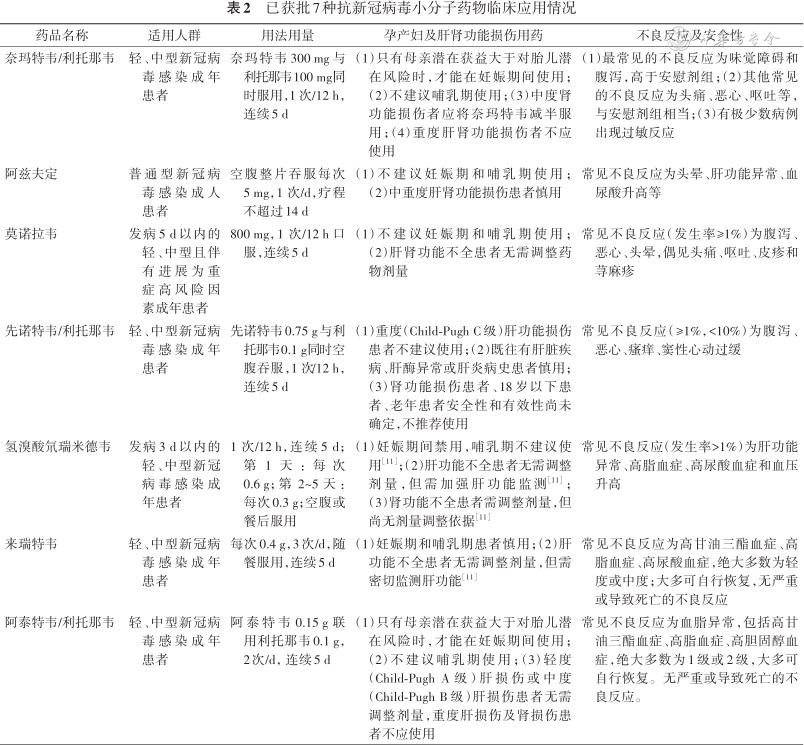
已获批7种抗新冠病毒小分子药物临床应用情况
已获批7种抗新冠病毒小分子药物临床应用情况
| 药品名称 | 适用人群 | 用法用量 | 孕产妇及肝肾功能损伤用药 | 不良反应及安全性 |
|---|---|---|---|---|
| 奈玛特韦/利托那韦 | 轻、中型新冠病毒感染成年患者 | 奈玛特韦300 mg与利托那韦100 mg同时服用,1 次/12 h,连续5 d | (1)只有母亲潜在获益大于对胎儿潜在风险时,才能在妊娠期间使用;(2)不建议哺乳期使用;(3)中度肾功能损伤者应将奈玛特韦减半服用;(4)重度肝肾功能损伤者不应使用 | (1)最常见的不良反应为味觉障碍和腹泻,高于安慰剂组;(2)其他常见的不良反应为头痛、恶心、呕吐等,与安慰剂组相当;(3)有极少数病例出现过敏反应 |
| 阿兹夫定 | 普通型新冠病毒感染成人患者 | 空腹整片吞服每次5 mg,1 次/d,疗程不超过14 d | (1)不建议妊娠期和哺乳期使用;(2)中重度肝肾功能损伤患者慎用 | 常见不良反应为头晕、肝功能异常、血尿酸升高等 |
| 莫诺拉韦 | 发病5 d以内的轻、中型且伴有进展为重症高风险因素成年患者 | 800 mg,1 次/12 h口服,连续5 d | (1)不建议妊娠期和哺乳期使用;(2)肝肾功能不全患者无需调整药物剂量 | 常见不良反应(发生率≥1%)为腹泻、恶心、头晕,偶见头痛、呕吐、皮疹和荨麻疹 |
| 先诺特韦/利托那韦 | 轻、中型新冠病毒感染成年患者 | 先诺特韦0.75 g与利托那韦0.1 g同时空腹吞服,1 次/12 h,连续5 d | (1)重度(Child-Pugh C级)肝功能损伤患者不建议使用;(2)既往有肝脏疾病、肝酶异常或肝炎病史患者慎用;(3)肾功能损伤患者、18岁以下患者、老年患者安全性和有效性尚未确定,不推荐使用 | 常见不良反应(≥1%,<10%)为腹泻、恶心、瘙痒、窦性心动过缓 |
| 氢溴酸氘瑞米德韦 | 发病3 d以内的轻、中型新冠病毒感染成年患者 | 1 次/12 h,连续5 d;第1天:每次0.6 g;第 2~5天:每次0.3 g;空腹或餐后服用 | (1)妊娠期间禁用,哺乳期不建议使用[11];(2)肝功能不全患者无需调整剂量,但需加强肝功能监测[11];(3)肾功能不全患者需调整剂量,但尚无剂量调整依据[11] | 常见不良反应(发生率>1%)为肝功能异常、高脂血症、高尿酸血症和血压升高 |
| 来瑞特韦 | 轻、中型新冠病毒感染成年患者 | 每次0.4 g,3次/d,随餐服用,连续5 d | (1)妊娠期和哺乳期患者慎用;(2)肝功能不全患者无需调整剂量,但需密切监测肝功能[11] | 常见不良反应为高甘油三酯血症、高脂血症、高尿酸血症,绝大多数为轻度或中度;大多可自行恢复,无严重或导致死亡的不良反应 |
| 阿泰特韦/利托那韦 | 轻、中型新冠病毒感染成年患者 | 阿泰特韦0.15 g联用利托那韦0.1 g,2次/d,连续5 d | (1)只有母亲潜在获益大于对胎儿潜在风险时,才能在妊娠期间使用;(2)不建议哺乳期使用;(3)轻度(Child-Pugh A级)肝损伤或中度(Child-Pugh B级)肝损伤患者无需调整剂量,重度肝损伤及肾损伤患者不应使用 | 常见不良反应为血脂异常,包括高甘油三酯血症、高脂血症、高胆固醇血症,绝大多数为1级或2级,大多可自行恢复。无严重或导致死亡的不良反应。 |

已获批7种抗新冠病毒小分子药物相互作用
已获批7种抗新冠病毒小分子药物相互作用
| 药品名称 | 相互作用机制 | 常见相互作用药物 |
|---|---|---|
| 奈玛特韦/利托那韦 | 任何经CYP3A代谢的药物、CYP3A抑制剂或诱导剂都可能与其产生药物相互作用;奈玛特韦/利托那韦还是转运蛋白(P-gp、BCRP、MDR1、MATE1、OCT1和OATP1B1)的抑制剂,可能诱导CYP1A2、CYP2C8、CYP2C9和CYP2C19的葡萄糖醛酸化和氧化作用,从而增加通过这些途径代谢的部分药品的生物转化,并可能导致此类药品的全身暴露量降低,从而降低或缩短其疗效 | 与多种药物均存在相互作用,用药前应仔细评估合并用药情况,具体情况详见表4 |
| 阿兹夫定 | P-gp底物及弱效P-gp诱导剂,与P-gp底物及P-gp抑制剂、P-gp诱导剂联用时需慎重 | 常见药物如下:(1)P-gp底物:地高辛、达比加群酯、秋水仙碱等;(2)P-gp抑制剂:环孢素、伊曲康唑、伏立康唑等唑类抗真菌药,利托那韦、胺碘酮、维拉帕米、克拉霉素、葡萄柚汁等;(3)P-gp诱导剂:利福平等 |
| 莫诺拉韦 | 主要活性代谢产物是NHC;莫诺拉韦和NHC不是主要的药物代谢酶和转运体的抑制剂或诱导剂 | 尚未发现有临床意义的药物相互作用 |
| 先诺特韦/利托那韦 | 主要由CYP3A酶代谢,是P-gp转运体的底物。诱导CYP3A和(或)P-gp的药物可能降低先诺特韦的血药浓度,从而降低本品的疗效,而抑制CYP3A和(或)P-gp的药物可能增加先诺特韦的血药浓度,从而增加安全性风险 | 具体参考奈玛特韦/利托那韦 |
| 氢溴酸氘瑞米德韦 | 主要代谢产物116-N1是P-gp和BCRP的底物,与影响P-gp和BCRP活性的药物同时使用时可能会发生药物相互作用 | 常见药物:长春新碱、洛伐他汀、维拉帕米、硝苯地平、甲氨蝶呤等 |
| 来瑞特韦[8] | 来瑞特韦与经CYP3A酶代谢药物联用,可升高后者血药浓度。使用抑制或诱导CYP3A以及P-gp的药品可能分别升高或降低本品的药物浓度 | (1)CYP3A诱导剂:利福平、利福布丁、利福喷丁、地塞米松、苯妥英、卡马西平或苯巴比妥等;(2)CYP3A抑制剂:酮康唑、伊曲康唑、克拉霉素、沙奎那韦等;(3)P-gp抑制剂:环孢素、伏立康唑等唑类抗真菌药,利托那韦、胺碘酮、维拉帕米、克拉霉素等;(4)P-gp诱导剂:利福平等 |
| 阿泰特韦/利托那韦 | CYP3A的抑制剂,可升高由CYP3A代谢的药物的血浆浓度。使用抑制或诱导CYP3A以及P-gp的药品可能会分别升高或降低本品的药物浓度 | 具体参考奈玛特韦/利托那韦 |
注:CYP3A为细胞色素P4503A;P-gp为P-糖蛋白;BCRP为一种膜转运蛋白;MDR1为多药耐药蛋白1;MATE1为转运蛋白1;OCT1为八聚体结合转录因子1;OATP1B1为有机阴离子转运多肽1B1;NHC为胞苷核苷类似物N4-羟基胞苷
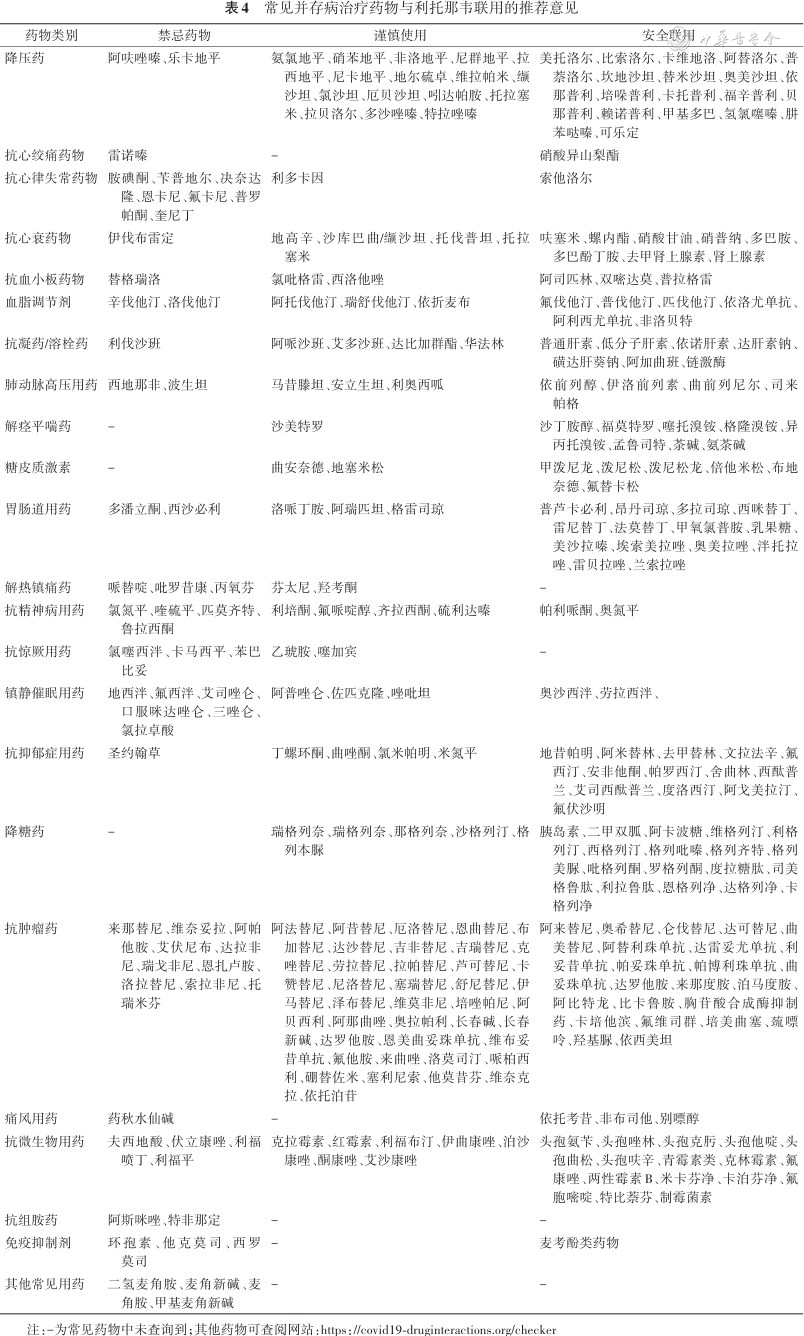
常见并存病治疗药物与利托那韦联用的推荐意见
常见并存病治疗药物与利托那韦联用的推荐意见
| 药物类别 | 禁忌药物 | 谨慎使用 | 安全联用 |
|---|---|---|---|
| 降压药 | 阿呋唑嗪、乐卡地平 | 氨氯地平、硝苯地平、非洛地平、尼群地平、拉西地平、尼卡地平、地尔硫卓、维拉帕米、缬沙坦、氯沙坦、厄贝沙坦、吲达帕胺、托拉塞米、拉贝洛尔、多沙唑嗪、特拉唑嗪 | 美托洛尔、比索洛尔、卡维地洛、阿替洛尔、普萘洛尔、坎地沙坦、替米沙坦、奥美沙坦、依那普利、培哚普利、卡托普利、福辛普利、贝那普利、赖诺普利、甲基多巴、氢氯噻嗪、肼苯哒嗪、可乐定 |
| 抗心绞痛药物 | 雷诺嗪 | - | 硝酸异山梨酯 |
| 抗心律失常药物 | 胺碘酮、苄普地尔、决奈达隆、恩卡尼、氟卡尼、普罗帕酮、奎尼丁 | 利多卡因 | 索他洛尔 |
| 抗心衰药物 | 伊伐布雷定 | 地高辛、沙库巴曲/缬沙坦、托伐普坦、托拉塞米 | 呋塞米、螺内酯、硝酸甘油、硝普纳、多巴胺、多巴酚丁胺、去甲肾上腺素、肾上腺素 |
| 抗血小板药物 | 替格瑞洛 | 氯吡格雷、西洛他唑 | 阿司匹林、双嘧达莫、普拉格雷 |
| 血脂调节剂 | 辛伐他汀、洛伐他汀 | 阿托伐他汀、瑞舒伐他汀、依折麦布 | 氟伐他汀、普伐他汀、匹伐他汀、依洛尤单抗、阿利西尤单抗、非洛贝特 |
| 抗凝药/溶栓药 | 利伐沙班 | 阿哌沙班、艾多沙班、达比加群酯、华法林 | 普通肝素、低分子肝素、依诺肝素、达肝素钠、磺达肝葵钠、阿加曲班、链激酶 |
| 肺动脉高压用药 | 西地那非、波生坦 | 马昔滕坦、安立生坦、利奥西呱 | 依前列醇、伊洛前列素、曲前列尼尔、司来帕格 |
| 解痉平喘药 | - | 沙美特罗 | 沙丁胺醇、福莫特罗、噻托溴铵、格隆溴铵、异丙托溴铵、孟鲁司特、茶碱、氨茶碱 |
| 糖皮质激素 | - | 曲安奈德、地塞米松 | 甲泼尼龙、泼尼松、泼尼松龙、倍他米松、布地奈德、氟替卡松 |
| 胃肠道用药 | 多潘立酮、西沙必利 | 洛哌丁胺、阿瑞匹坦、格雷司琼 | 普芦卡必利、昂丹司琼、多拉司琼、西咪替丁、雷尼替丁、法莫替丁、甲氧氯普胺、乳果糖、美沙拉嗪、埃索美拉唑、奥美拉唑、泮托拉唑、雷贝拉唑、兰索拉唑 |
| 解热镇痛药 | 哌替啶、吡罗昔康、丙氧芬 | 芬太尼、羟考酮 | - |
| 抗精神病用药 | 氯氮平、喹硫平、匹莫齐特、鲁拉西酮 | 利培酮、氟哌啶醇、齐拉西酮、硫利达嗪 | 帕利哌酮、奥氮平 |
| 抗惊厥用药 | 氯噻西泮、卡马西平、苯巴比妥 | 乙琥胺、噻加宾 | - |
| 镇静催眠用药 | 地西泮、氟西泮、艾司唑仑、口服咪达唑仑、三唑仑、氯拉卓酸 | 阿普唑仑、佐匹克隆、唑吡坦 | 奥沙西泮、劳拉西泮、 |
| 抗抑郁症用药 | 圣约翰草 | 丁螺环酮、曲唑酮、氯米帕明、米氮平 | 地昔帕明、阿米替林、去甲替林、文拉法辛、氟西汀、安非他酮、帕罗西汀、舍曲林、西酞普兰、艾司西酞普兰、度洛西汀、阿戈美拉汀、氟伏沙明 |
| 降糖药 | - | 瑞格列奈、瑞格列奈、那格列奈、沙格列汀、格列本脲 | 胰岛素、二甲双胍、阿卡波糖、维格列汀、利格列汀、西格列汀、格列吡嗪、格列齐特、格列美脲、吡格列酮、罗格列酮、度拉糖肽、司美格鲁肽、利拉鲁肽、恩格列净、达格列净、卡格列净 |
| 抗肿瘤药 | 来那替尼、维奈妥拉、阿帕他胺、艾伏尼布、达拉非尼、瑞戈非尼、恩扎卢胺、洛拉替尼、索拉非尼、托瑞米芬 | 阿法替尼、阿昔替尼、厄洛替尼、恩曲替尼、布加替尼、达沙替尼、吉非替尼、吉瑞替尼、克唑替尼、劳拉替尼、拉帕替尼、芦可替尼、卡赞替尼、尼洛替尼、塞瑞替尼、舒尼替尼、伊马替尼、泽布替尼、维莫非尼、培唑帕尼、阿贝西利、阿那曲唑、奥拉帕利、长春碱、长春新碱、达罗他胺、恩美曲妥珠单抗、维布妥昔单抗、氟他胺、来曲唑、洛莫司汀、哌柏西利、硼替佐米、塞利尼索、他莫昔芬、维奈克拉、依托泊苷 | 阿来替尼、奥希替尼、仑伐替尼、达可替尼、曲美替尼、阿替利珠单抗、达雷妥尤单抗、利妥昔单抗、帕妥珠单抗、帕博利珠单抗、曲妥珠单抗、达罗他胺、来那度胺、泊马度胺、阿比特龙、比卡鲁胺、胸苷酸合成酶抑制药、卡培他滨、氟维司群、培美曲塞、巯嘌呤、羟基脲、依西美坦 |
| 痛风用药 | 药秋水仙碱 | - | 依托考昔、非布司他、别嘌醇 |
| 抗微生物用药 | 夫西地酸、伏立康唑、利福喷丁、利福平 | 克拉霉素、红霉素、利福布汀、伊曲康唑、泊沙康唑、酮康唑、艾沙康唑 | 头孢氨苄、头孢唑林、头孢克肟、头孢他啶、头孢曲松、头孢呋辛、青霉素类、克林霉素、氟康唑、两性霉素B、米卡芬净、卡泊芬净、氟胞嘧啶、特比萘芬、制霉菌素 |
| 抗组胺药 | 阿斯咪唑、特非那定 | - | - |
| 免疫抑制剂 | 环孢素、他克莫司、西罗莫司 | - | 麦考酚类药物 |
| 其他常见用药 | 二氢麦角胺、麦角新碱、麦角胺、甲基麦角新碱 | - | - |
注:-为常见药物中未查询到;其他药物可查阅网站:https://covid19-druginteractions.org/checker
老年人群、合并慢性疾病人群、肿瘤人群、孕妇等特殊群体由于免疫功能低下,其感染新冠病毒后可能面临比普通人群更高的住院或死亡风险[12],需积极进行抗病毒治疗。国内虽已上市多种抗新冠病毒小分子药物,但目前国内尚无针对特殊人群的具体用药推荐,因此本共识将重点介绍一些特殊人群用药推荐,以供临床用药参考。
推荐意见1:对于重症人群,建议在发病5 d内使用抗新冠病毒小分子药物。对于发病超过5 d但病毒载量仍较高(Ct值<30)重症人群,推荐使用抗新冠病毒小分子药物,且应适当延长抗新冠病毒小分子药物使用时间。(2D)
推荐说明:尽管目前尚无明确的循证医学证据表明现有抗新冠病毒小分子药物可以治疗重症/危重症患者,但一些临床研究也提示降低病毒载量或许能够改善重症/危重症患者预后。
伴有多种合并症或免疫功能低的重症患者入院时病毒载量更高[13],其病毒脱落持续时间长,可长达40 d[14],而病毒脱落时间及载量与患者预后密切相关。有研究发现,42.2%的重症患者有持续性病毒脱落,并与6个月死亡风险增加显著相关[15]。高病毒载量(Ct值<25)与30 d内住院、重症监护病房入住以及死亡风险增加有关[16]。新冠病毒在上、下呼吸道复制持续时间存在相当大的异质性,并且在大多数机械通气患者中,持续病毒复制与过度促炎反应同时发生,而非普遍认为的依次发生[17]。因此,在重症患者中使用抗病毒治疗药物仍具有重要意义,且在发病5 d内使用抗病毒药物获益的可能性更大。对于发病超过5 d但病毒载量仍较高(Ct值<30)的重症患者,应用抗病毒药物仍可能有一定获益[18]。但重症患者常伴有多种合并症,服药期间应密切监测药物不良反应,以及与其他药物间的相互作用,尤其是含利托那韦药物。考虑到利托那韦与多种药物存在相互作用,联用时可能影响疗效或增加不良反应风险,需要特别注意进行药物相互作用筛查。
推荐意见2:对于感染新冠病毒心血管疾病人群,推荐其在感染早期使用抗新冠病毒小分子药物,需注意药物相互作用。(1A)
推荐说明:合并高血压等心血管疾病患者感染新冠病毒后重症和死亡风险显著增加[19]。研究显示,对于合并心血管疾病患者,感染早期使用奈玛特韦/利托那韦或莫诺拉韦可缩短到达低病毒负荷(Ct值≥30)时间约2.5 d,降低复合疾病进展风险约40%,降低全因死亡风险50%以上[20]。但部分小分子药物与心血管疾病药物联用会增加药物相互作用风险[21]。大部分钙离子通道拮抗剂(CCB)类降压药物主要经由CYP3A4代谢,与先诺特韦/利托那韦、奈玛特韦/利托那韦或阿泰特韦/利托那韦联用可能会导致药物的血药浓度升高,增加不良反应风险。部分ARB类药物(厄贝沙坦、氯沙坦)和托拉塞米主要由CYP2C9代谢,联用时可产生一定的相互作用,需加强监测[11]。因此,心血管疾病人群选择新冠治疗方案时需要重点关注药物的相互作用。
推荐意见3:对于感染新冠病毒的糖尿病人群,推荐其在感染早期使用抗新冠病毒小分子药物,需注意药物相互作用。(1A)
推荐说明:合并糖尿病的新冠病毒患者重症和死亡风险显著增加[19],研究显示,与安慰剂组相比,口服奈玛特韦/利托那韦或莫诺拉韦均可使2型糖尿病患者的全因死亡和住院风险显著降低29%[22]。另一项研究显示,在糖尿病患者中,使用奈玛特韦/利托那韦可降低重症或死亡风险56%[23]。但部分抗新冠病毒小分子药物与糖尿病药物联用会增加药物相互作用风险[21]。因此,糖尿病人群选择治疗方案时同样需要重点关注药物的相互作用。
推荐意见4:对于长新冠人群,在对症治疗的同时,且充分考虑获益风险比后,可酌情选择抗新冠病毒小分子药物。(1D)
推荐说明:长新冠人群是一种新冠感染后的多系统疾病,常见症状包括疲劳、呼吸急促、咳嗽和认知功能障碍等,这些症状可持续数周、数月或数年[24]。目前有少量研究报道感染早期使用抗新冠病毒小分子药物,可降低长新冠发生风险。队列研究显示,具有重症高危因素患者服用奈玛特韦/利托那韦可降低长新冠风险26%[25]。其他研究也证实患者在感染早期服用奈玛特韦/利托那韦或莫诺托韦可降低长新冠风险[26]。前瞻性队列研究显示,新冠病毒感染后服用奈玛特韦/利托那韦可降低患者出院6个月后患长新冠风险[27]。目前尚无针对长新冠的有效治疗方法,临床诊疗多是经验性对症治疗。极少量案例报道显示,抗新冠病毒小分子药物可改善长新冠症状。另有1例患者长新冠持续2年,在再次感染新冠后服用奈玛特韦/利托那韦,其长新冠症状缓解[28]。未来仍需大样本临床研究来证实抗新冠病毒感染小分子药物在长新冠人群中的疗效和安全性。
推荐意见5:复阳人群病毒转阴时间长,建议复阳人群不同机制的抗新冠病毒小分子药物联合或交替使用药物,加快患者转阴。联合应用尚无安全性数据,临床应用需要权衡利弊,并密切监测可能的不良反应。(2D)
推荐说明:新冠病毒感染患者初步恢复后的2~8 d内可能出现病毒感染症状复发或在转阴后再次出现阳性[29]。回顾性研究显示,复阳患者病毒转阴时间长,95%和45%的患者分别需要21 d和42 d才能完全转阴[30]。长期阳性(首发症状后53~112 d持续阳性)患者可能与自然杀伤细胞产生的γ-干扰素降低和低中和抗体有关[31]。建议复阳患者不同机制抗新冠病毒小分子药物联合或交替使用药物,尽快使病毒载量下降、核酸转阴[4]。
推荐意见6:对于感染新冠病毒免疫抑制人群,应综合考虑患者疾病及免疫抑制剂使用情况,在感染早期合理地选用抗新冠病毒小分子药物,且根据患者转阴情况,适当延长抗新冠病毒小分子药物疗程。延长疗程可能增加不良反应风险,需要密切监测。(1A)
推荐说明:免疫抑制人群指因先天性免疫功能缺陷或继发性免疫功能抑制造成的机体免疫功能低下的人群,如体器官移植受者(solid organ transplant recipients,SOTR)、服用免疫抑制剂患者等,其新冠病毒感染后重症和死亡风险显著增加。有研究显示,奈玛特韦/利托那韦可显著降低免疫抑制人群重症/死亡风险71%,安全性良好[23]。另有研究也显示奈玛特韦/利托那韦或莫诺拉韦治疗可降低SOTR死亡风险[32]。
因长期服用免疫抑制剂,部分SOTR即使接受抗病毒治疗,仍会核酸检测持续阳性,但是并非所有患者都需要再次接受抗病毒治疗。当核酸检测Ct值>30时,病毒复制或传播可能性较低;因此,仅当Ct值≤30 时,才建议继续进行抗病毒治疗。结合病例报道以及专家临床治疗经验,建议可适当延长原有药物治疗时间。此外,也可以换用或者联用其他不同作用机制的抗病毒药物治疗[33]。
在使用抗新冠病毒小分子药物时,需要注意与环孢素、他克莫司、西罗莫司等免疫抑制剂的相互作用。已有文献报道SOTR使用奈玛特韦/利托那韦时继续服用他克莫司,出现需住院治疗的严重不良反应[34]。因此在临床治疗过程中,应重点关注联合用药及药物相互作用。但接受环孢素、他克莫司、西罗莫司等免疫抑制剂治疗的SOTR如需服用来瑞特韦,则不建议停用免疫抑制剂。
推荐意见7:对于感染新冠病毒肿瘤人群,应综合考虑患者疾病及抗肿瘤药物使用情况,在感染早期合理地选用抗新冠病毒小分子药物,降低重症和死亡风险。(1A)
推荐说明:肿瘤患者新冠病毒感染后面临更高重症和死亡风险。其感染早期接受抗病毒治疗,可降低重症及死亡风险。前瞻性研究显示,感染新冠病毒血液肿瘤患者接受奈玛特韦/利托那韦或莫诺拉韦抗病毒治疗与较低的重症风险相关,安全性良好[35]。EPICOVIDEHA研究显示,接受奈玛特韦/利托那韦治疗可降低血液肿瘤患者死亡风险81.8%[36]。但肿瘤患者抗肿瘤治疗期间,需要特别关注化疗、靶向药物与抗病毒药物之间的相互作用,如奈拉替尼、维奈托克、阿帕他胺、达拉非尼、瑞戈非尼、恩扎卢胺、洛拉替尼及托瑞米芬等禁止与奈玛特韦/利托那韦联用。
推荐意见8:对于感染新冠病毒老年人群,推荐其在感染早期使用抗新冠病毒小分子药物。有药物相互作用风险的老年患者推荐在感染早期使用莫诺拉韦或单药3CLpro抑制剂(来瑞特韦)。(1A)
推荐说明:老年人群是新冠病毒感染的高风险群体,感染后进展为重症风险高。临床研究显示,老年人群在感染早期服用奈玛特韦/利托那韦[5]或莫诺拉韦[6]可降低重症和死亡风险,安全性良好。真实世界研究显示,在发病前5 d服用莫诺拉韦,可降低80岁及以上患者死亡风险58.5%,安全性良好[37];在发病5 d内服用奈玛特韦/利托那韦可显著降低住院风险,安全性良好[38]。但老年人群易合并多种疾病,如高血压、糖尿病,多药联合会增加药物相互作用风险[21]。因此,选择治疗方案时需要重点关注安全性。奈玛特韦/利托那韦可能干扰CYP3A酶活性,有较多药物相互作用相关风险,使用前需详细询问患者疾病与药物使用情况。来瑞特韦是3CLpro抑制剂,在化学结构式上进行了优化,有效延缓了其在蛋白酶抑制剂复合物中的解离速度,能有效避免联用利托那韦带来的药物相互作用风险,临床安全性更高[8],其Ⅲ期临床研究显示老年人群使用来瑞特韦安全有效。根据有限的已知数据,尚未发现莫诺拉韦有临床意义的药物相互作用。因此,推荐使用多种药物的老年患者在新冠病毒感染早期选择来瑞特韦或莫诺拉韦。阿兹夫定和氢溴酸氘瑞米德韦的临床试验纳入的老年受试者有限,先诺特韦/利托那韦和阿泰特韦/利托那韦暂无老年人使用的相关数据,因此老年人群使用这些抗新冠病毒小分子药物时需严密监测。
推荐意见9:对于感染新冠病毒的孕妇,建议其在充分评估风险与获益后,在感染早期可选择服用奈玛特韦/利托那韦进行抗病毒治疗;来瑞特韦仅在确定获益大于风险时才能使用,其他抗新冠病毒小分子药物不推荐使用。(2D)
推荐说明:孕妇感染新冠病毒后的住院风险更高[39],目前已上市小分子抗新冠病毒药物在孕妇获得的观察数据中极为有限,临床前研究显示奈玛特韦/利托那韦、来瑞特韦未对动物胚胎-胎仔发育产生相关影响。观察性研究显示,接受奈玛特韦/利托那韦治疗的孕妇中,新冠病毒感染相关症状的平均持续时间短于对照组。研究组未观察到严重不良事件,味觉障碍和腹泻是最常见的不良反应,奈玛特韦/利托那韦组观察到剖腹产率较高,需对使用奈玛特韦/利托那韦孕妇及其后代进行长期随访[40]。未来仍需相关大样本量安全性数据,因此建议孕妇使用前需进行风险获益评估。来瑞特韦的临床前大鼠生殖毒性研究,未见其对胚胎-胎仔发育毒性和胎仔致畸毒性,但临床试验中缺乏来瑞特韦使用相关安全性数据,故确需应用本品时,需要充分知情同意,仅在确定获益大于风险时才能使用本品。莫诺拉韦、氢溴酸氘瑞米德韦、阿兹夫定和阿泰特韦/利托那韦临床前生殖毒性试验结果显示上述药物会对大鼠胚胎造成损害,因此建议妊娠期间禁止使用上述药物。
推荐意见10:不推荐哺乳期妇女服用任何抗新冠病毒小分子药物。(1D)
推荐说明:目前暂无哺乳期妇女使用抗新冠病毒小分子药物的相关数据,因此建议妇女在哺乳期间禁止使用上述药物。若病情严重,服用抗新冠病毒小分子药物获益明显大于风险,可慎重服用莫诺拉韦、氢溴酸氘瑞米德韦、来瑞特韦、奈玛特韦/利托那韦以及先诺特韦/利托那韦。但在治疗期间和莫诺拉韦末次给药后4 d内不要进行母乳喂养,治疗期间和氢溴酸氘瑞米德韦、来瑞特韦、奈玛特韦/利托那韦、先诺特韦/利托那韦及阿泰特韦/利托那韦末次给药后7 d内不要进行母乳喂养。
(十一)儿童
推荐意见11:对于感染新冠病毒的儿童,禁止服用莫诺拉韦,其他抗新冠病毒小分子药物谨慎使用。(2D)
推荐说明:美国食品药品监督管理局(FDA)批准奈玛特韦/利托那韦可用于12岁以上的儿童患者[41]。回顾性研究显示,奈玛特韦/利托那韦对3例新冠病毒感染患儿(年龄12~18岁)的治疗有效且相对安全[42]。莫诺拉韦可能会影响儿童骨和软骨生长,儿童应禁止使用;其他药物在儿童中的安全性和有效性尚未确定,建议谨慎使用。
(十二)肝、肾功能不全人群
推荐意见12:对于感染新冠病毒的肝、肾功能不全患者,建议其在感染早期优先选择莫诺拉韦和来瑞特韦,但肝功能不全者使用来瑞特韦时需密切监测肝功能。奈玛特韦/利托那韦,轻度肾损伤[估算肾小球滤过率(eGFR)≥60至<90 ml/min]、轻中度肝损伤(Child Pugh A、B级)患者无需调整剂量,中度肾损伤(eGFR≥30~<60 ml/min)患者奈玛特韦剂量减半,重度肾损伤(eGFR<30 ml/min)、重度肝损伤患者不建议使用。阿泰特韦/利托那韦,轻中度肝损伤(Child Pugh A、B级)患者无需调整剂量,重度肝损伤及肾损伤患者不建议使用。其他抗新冠病毒小分子药物不建议使用。(2D)
推荐说明:伴有严重基础疾病患者感染新冠病毒后重症率、病死率高于一般人群[1],肝、肾功能不全患者需要格外谨慎地选择和使用抗新冠病毒小分子药物。奈玛特韦主要经肾脏排泄,利托那韦主要经过肝胆系统清除。临床试验结果显示奈玛特韦的暴露量随着肾功能损伤严重程度的增加而增加,轻、中度肝功能不全受试者暴露量与健康受试者相当,暂无重度肝功能不全试验数据。因此建议轻度肾损伤(eGFR≥60~<90 ml/min)、轻中度肝损伤(Child Pugh A、B级)患者无需调整剂量,中度肾损伤(eGFR≥30~<60 ml/min)患者奈玛特韦剂量减半,重度肾损伤(eGFR<30 ml/min)、重度肝损伤患者不建议使用。基于阿泰特韦/利托那韦在肝功能损害和正常肝功能受试者中进行的Ⅰ期临床结果,建议轻度轻中度肝损伤(Child Pugh A、B级)患者无需调整剂量;目前尚无严重肝损伤及肾损伤患者研究数据,因此,重度肝损伤及肾损伤患者不应使用本品。莫诺拉韦不经肝肾代谢,肝肾功能不全患者无需调整剂量;来瑞特韦主要以原型药物形式经粪便排泄,肾功能不全患者无需调整剂量。来瑞特韦和安慰剂引起的两项或以上肝功能异常(大部分为谷丙转氨酶和谷草转氨酶升高)发生率分别为1.6%和1.2%,且大部分为1级,建议用药期间监测肝功能[11]。先诺特韦/利托那韦、阿兹夫定和氢溴酸氘瑞米德韦尚未在肝/肾功能不全患者中开展临床研究,肝/肾损伤人群应谨慎使用上述药物。
(十三)围手术期人群
推荐意见13:围手术期新冠病毒感染会明显增加围手术期死亡率和手术并发症发生率,需在新冠病毒感染早期进行抗病毒治疗,加快转阴,尽早改善症状,减少麻醉及围手术期并发症发生。(2D)
推荐说明:围手术期新冠病毒感染会显著增加围手术期死亡率和手术并发症的发生率,前瞻性队列研究显示,如果在新冠病毒感染后6周内进行手术,术后并发症发病率和死亡率也会增加[43]。值得注意的是,这些风险增加一直持续到新冠病毒感染后7周。基于此,《SARS-CoV-2 感染后择期手术的时机和风险评估》共识建议,择期手术应在新冠病毒感染后延迟7周[44]。值得注意的是,即使在7周后,症状持续存在患者和中重度新冠病毒感染患者仍可能面临更大的手术并发症和死亡风险。抗新冠病毒小分子药物可以缩短转阴及症状持续时间,降低重症和死亡风险[4]。围手术期患者往往伴有基础疾病,需要服用其他药物,服药期间应密切监测药物不良反应,以及药物间相互作用,特别是含利托那韦药物。
(十四)需要管饲的人群
推荐意见14:对于需要管饲的人群感染新冠病毒后,可在感染早期选用奈玛特韦/利托那韦、先诺特韦/利托那韦、莫诺拉韦、氢溴酸氘瑞米及来瑞特韦进行抗病毒治疗。(2D)
推荐说明:对于神志昏迷、吞咽障碍或存在胃肠道通路障碍等患者,管饲是唯一经胃肠道给药的途径。该类患者用药方式特殊,需要注意各种抗新冠病毒小分子药物的使用方式。
奈玛特韦/利托那韦可掰开或研碎服用,吞咽困难患者可选择合适的方式使用药物[45];莫诺拉韦可以打开胶囊进行鼻饲给药;先诺特韦/利托那韦、氢溴酸氘瑞米及来瑞特韦可压碎后制备混悬液管饲;而阿兹夫定和阿泰特韦/利托那韦不能研碎需整片空腹吞服,不推荐管饲患者使用。
抑制病毒生命周期关键步骤的药物是对抗急性病毒感染最直接、毒性最小的选择。大量研究证实,在新冠病毒感染早期使用抗新冠病毒小分子药物可以有效降低高危人群重症和死亡风险[46, 47, 48]。但在重症/危重症人群中的疗效和安全性尚缺乏循证医学证据,对长新冠的预防及治疗仍缺乏统一的数据。另外,对免疫低下人群、老年人群及孕妇等特殊人群使用抗新冠病毒小分子药物的疗效和安全性仍然证据不足,需要更多大型的临床研究验证。
共识制订专家组成员
专家组组长:钟南山(广州医科大学附属第一医院广州呼吸健康研究院)
专家组副组长(按姓氏汉语拼音排序):李时悦(广州医科大学附属第一医院广州呼吸健康研究院);唐小平(广州医科大学附属市八医院感染科);王贵强(北京大学第一医院感染科);王明贵(复旦大学附属华山医院抗生素研究所);杨子峰、郑劲平(广州医科大学附属第一医院广州呼吸健康研究院)
呼吸病学专家(按姓氏汉语拼音排序):蔡绍曦(南方医科大学南方医院呼吸内科);曹照龙(北京大学人民医院呼吸内科);陈新(南方医科大学珠江医院呼吸内科);程璘令(广州医科大学附属第一医院广州呼吸健康研究院);郭禹标(中山大学附属第一医院呼吸与危重症医学科);江山平(中山大学孙逸仙纪念医院呼吸内科);巨春蓉(广州医科大学附属第一医院广州呼吸健康研究院);赖国祥(福建中医药大学附属第二人民医院呼吸与危重症医学科);李时悦、梁振宇(广州医科大学附属第一医院广州呼吸健康研究院);孙瑞琳(北京大学深圳医院呼吸与危重症医学科);王凌伟(深圳市人民医院呼吸与危重症医学科);文富强(四川大学华西医院呼吸内科);徐金富(同济大学附属上海肺科医院);叶枫(广州医科大学附属第一医院广州呼吸健康研究院);尹燕(中国医科大学附属第一医院呼吸与危重症医学科);袁兵(云南省第一人民医院呼吸与危重症医学科);占扬清(广州医科大学附属第一医院广州呼吸健康研究院);张静(复旦大学附属中山医院呼吸与危重症医学科);张晓菊(河南省人民医院呼吸内科);郑劲平(广州医科大学附属第一医院广州呼吸健康研究院)
重症/急诊医学(按姓氏汉语拼音排序):李欣(广东省人民医院急诊科);李粤平(广州医科大学附属市八医院感染ICU);刘晓青(广州医科大学附属第一医院广州呼吸健康研究院);余涛(中山大学孙逸仙纪念医院急诊科)
感染科(按姓氏汉语拼音排序):侯金林(南方医科大学南方医院感染科);黄朝林(武汉市金银潭医院胸外科);林炳亮(中山大学附属第三医院感染科);林玲(三亚中心医院心内科);卢洪洲(深圳市第三人民医院感染科);毛青(陆军军医大学西南医院感染科);彭劼(南方医科大学南方医院感染科);任红(重庆医科大学附属第二医院感染科);唐小平(广州医科大学附属市八医院感染科);王贵强(北京大学第一医院感染科);王明贵(复旦大学附属华山医院抗生素研究所);吴昊(首都医科大学附属北京佑安医院感染与免疫医学科);向天新(南昌大学第一附属医院公卫医学中心);曾文铤(广州医科大学附属第一医院感染科);卓超(广州医科大学附属第一医院感染科)
临床药学(按姓氏汉语拼音排序):陈艳芳(广州医科大学附属市八医院药学部);丁艳华(吉林大学白求恩第一医院药学部);李咏梅(广州医科大学附属第五医院药学部);魏理(广州医科大学附属第一医院药学部);钟洪兰(广州市胸科医院药剂科);邹尚荣(广州医科大学附属市八医院药学部)
临床病毒学:杨子峰(广州医科大学附属第一医院广州呼吸健康研究院)
循证医学:江梅(广州医科大学附属第一医院广州呼吸健康研究院)
秘书组成员(按姓氏汉语拼音排序):梁振宇、占扬清、张冬莹、王明蝶(广州医科大学附属第一医院广州呼吸健康研究院)
中华医学会细菌感染与耐药防治分会, 国家呼吸医学中心, 国家呼吸系统疾病临床医学研究中心. 抗新型冠状病毒小分子药物临床应用专家共识[J]. 中华医学杂志, 2024, 104(20): 1812-1824. DOI: 10.3760/cma.j.cn112137-20240124-00177.
所有作者声明不存在利益冲突