
分析甲状腺微小髓样癌(MTMC)临床特征及预后情况。
病例系列研究。回顾性分析2013年1月至2019年12月天津医科大学肿瘤医院收治的经术后病理确诊为甲状腺髓样癌(MTC)的初次治疗且具有完整随访资料的患者的临床资料。共170例,其中男70例,女100例,年龄(49.7±12.3)岁。其中MTMC患者61例,根据肿瘤最大径是否>0.5 cm分为A组(肿瘤最大径≤0.5 cm,n=13)和B组(肿瘤最大径>0.5~≤1.0 cm,n=48)对其病理结果及预后进行了分析。
在所有MTC中MTMC占比为26.4%(61/231),其中男26例,女35例,年龄M[Q1,Q3]51.0(41.0,59.0)岁。MTMC患者中Ⅰ期占比57.4%(35/61),Ⅲ期占比16.4%(10/61),Ⅳ期占比26.2%(16/61)。对于肿瘤最大径≤0.5 cm和最大径>0.5~≤1.0 cm的MTMC,两组在性别、年龄、混合癌、侵犯腺叶、多灶性、中央区淋巴结转移及侧颈淋巴结转移率等病理特征方面的差异均无统计学意义(均P>0.05)。在预后方面,MTMC患者的无复发生存时间为83.1(68.0,97.0)个月。其中,5例(8.2%)术后出现肿瘤结构性复发,1例(1.6%)死亡。预期的5年及10年生存率分别为93.4%及89.0%。MTMC患者、肿瘤最大径>1.0~≤2.0 cm的MTC患者以及肿瘤最大径>2.0 cm的MTC患者在无复发生存时间方面的差异无统计学意义(均P>0.05)。
MTMC表现出较强的侵袭性,尽管多数MTMC的预后相对较好,但其远期复发及死亡风险仍然较高。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
甲状腺髓样癌(medullary thyroid cancer,MTC)是一种起源于甲状腺滤泡旁细胞(C细胞)的少见神经内分泌肿瘤,占所有甲状腺恶性肿瘤的0.73%,其临床特征是患者血清降钙素升高[1]。目前国内和国际甲状腺肿瘤诊疗指南对于≤1 cm的低危甲状腺恶性结节建议可采取主动监测的策略,但并未对降钙素的筛查提出强制要求,因此对于直径≤1 cm的甲状腺微小髓样癌(medullary thyroid microcarcinoma,MTMC)的筛查成为难点。由于MTMC在超声影像上的特征与甲状腺微小乳头状癌(papillary thyroid microcarcinoma,PTMC)难以完全区分[2],在不筛查降钙素的情况下对MTMC可能会给出不恰当的主动监测的建议。鉴于针对MTMC的生物学行为的研究相对较少,本研究回顾性分析MTMC的临床特征及预后情况,旨在对其临床诊治提供一定参考。
病例系列研究。回顾性分析2013年1月至2019年12月就诊于天津医科大学肿瘤医院甲状腺颈部肿瘤科并经术后病理确诊为MTC的初次治疗患者的临床资料,共231例。排除失访病例59例,未达到根治标准患者2例,最终入选MTC患者170例,男70例,女100例,年龄(49.7±12.3)岁。纳入标准:(1)甲状腺肿瘤初次治疗的患者;(2)患者术后石蜡病理证实为MTC的患者;(3)接受了根治性切除手术,且无同期伴发的远处转移的患者;(4)随访及临床资料完备者。排除标准:(1)合并其他部位恶性肿瘤者;(2)不能根据要求按时随访者。
将纳入患者中根据原发灶肿瘤最大径是否≤1.0 cm,将患者分为MTMC组(最大径≤1.0 cm,n=61)和非MTMC组(最大径>1.0 cm,n=109);在MTMC组中,以原发灶肿瘤最大径0.5 cm为界限,将患者分为A组(肿瘤最大径≤0.5 cm)和B组(肿瘤最大径>0.5~≤1.0 cm);另外,在109例非MTMC患者中,又将肿瘤最大径>1.0~≤2.0 cm的患者定义为C组(n=61),肿瘤最大径>2.0 cm为48例。本研究已通过天津医科大学肿瘤医院医学伦理委员会批准(批号:bc2023122),回顾性研究豁免知情同意。
1. 收集患者临床资料,包括年龄、性别、手术方式、病例特征、随访时间、肿瘤复发及生存情况等。
2. 随访及预后定义:本研究中所有患者均进行了根治性手术治疗,术后嘱患者每3~6个月复查血降钙素及甲状腺功能,每半年至1年复查颈部影像学1次。若出现降钙素持续升高或者颈部超声提示的复发,行颈部CT明确残留甲状腺或颈部淋巴结情况,必要时进行颈部细针穿刺细胞学检查明确复发肿物性质。所有MTC患者术后每年接受电话随访或查询门诊就诊记录,记录复发及生存状态。随访截止日期为2023年6月。本研究定义的“复发”为术后随诊过程中影像学或穿刺细胞学病理结果确定淋巴结转移或甲状腺区域复发,即结构性复发。术后单纯降钙素升高但影像学检查无明确病灶者(即生化复发或生化持续状态)在本研究中未被定义为复发。
应用SPSS 26.0进行数据分析。符合正态分布的计量资料以表示,组间比较采用独立样本t检验;非正态分布数据以M(Q1,Q3)表示;计数资料以例(%)表示,组间比较行χ2检验。采用Kaplan-Meier生存曲线评估纳入患者预后情况。双侧检验,检验水平取α=0.05。
研究期限内天津医科大学肿瘤医院甲状腺颈部肿瘤科共收治初诊甲状腺癌患者32 740例,其中初诊MTC患者231例。MTMC在所有MTC中占26.4%(61/231),MTMC在所有初诊甲状腺癌中占1.86‰(61/32 740)。
MTMC组共纳入患者61例,男26例,女35例,年龄51.0(41.0,59.0)岁。所有纳入的患者术前均常规行颈部超声或CT检查,以评估颈部甲状腺结节性质及颈部淋巴结状态。14例患者接受了全甲状腺切除+患侧或双侧中央区淋巴结清扫,12例行全甲状腺切除+患侧或双侧中央区淋巴结清扫+患侧侧颈淋巴结清扫术。另外,27例患者因个人原因要求保留健侧甲状腺腺叶而行单侧(即患侧)腺叶切除+患侧中央区淋巴结清扫术,4例行单侧(即患侧)腺叶切除+患侧中央区淋巴结清扫+患侧侧颈淋巴结清扫术,剩余4例接受了甲状腺次全切术+双侧中央区淋巴结清扫术。
10(16.4%)例原发灶中出现MTC与甲状腺乳头状癌(papillary thyroid carcinoma,PTC)并存,17(27.9%)例患者出现肿瘤侵犯包膜,13(21.3%)例存在多灶性病变,20(32.8%)例存在中央区淋巴结转移,16(26.2%)例存在侧颈淋巴结转移,根据美国癌症联合委员会(the American Joint Committee on Cancer,AJCC)第8版pTNM分期[3],Ⅰ期35例、Ⅲ期10例、Ⅳ期16例,见表1。

甲状腺微小髓样癌患者临床病理特征
甲状腺微小髓样癌患者临床病理特征
| 项目 | 例数(n=61) |
|---|---|
| 男/女(例) | 23/38 |
| 手术时年龄[岁,M(Q1,Q3)] | 49.8(41.0,59.0) |
| 随访时间[月,M(Q1,Q3)] | 84.3(68.0,97.3) |
| 肿瘤最大径[mm,M(Q1,Q3)] | 8.0(6.0,9.2) |
| 肿瘤最大径分组[例(%)] | |
| ≤0.5 cm | 13(21.3) |
| >0.5~≤1.0 cm | 48(78.7) |
| 多灶病变[例(%)] | 13(21.3) |
| 侵犯腺叶[例(%)] | 17(27.9) |
| N分期[例(%)] | |
| N0 | 35(57.4) |
| N1a | 10(16.4) |
| N1b | 16(26.2) |
| 分期[例(%)]a | |
| Ⅰ | 35(57.4) |
| Ⅲ | 10(16.4) |
| Ⅳ | 16(26.2) |
注:a美国癌症联合委员会第8版pTNM分期
A组13例患者,其中2例患者原发灶中出现MTC与PTC并存,1例患者出现肿瘤侵犯包膜或腺叶,2例患者出现多灶性病变,1例患者存在中央区淋巴结转移,2例患者存在侧颈区淋巴结转移。B组48例患者,其中8例患者原发灶中存在MTC与PTC并存,16例患者原发灶肿瘤侵犯包膜或腺叶,11例患者存在多灶性病变,19例患者出现中央区淋巴结转移,14例患者存在侧颈区淋巴结转移。两组患者在性别、年龄、混合癌、侵犯腺叶、多灶性、中央区淋巴结转移及侧颈区淋巴结转移等方面差异均无统计学意义(均(P>0.05),见表2。
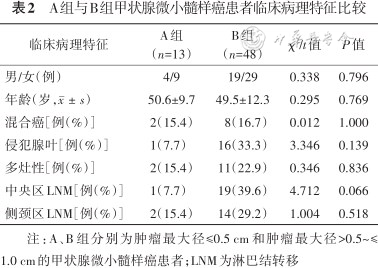
A组与B组甲状腺微小髓样癌患者临床病理特征比较
A组与B组甲状腺微小髓样癌患者临床病理特征比较
| 临床病理特征 | A组(n=13) | B组(n=48) | χ2/t值 | P值 |
|---|---|---|---|---|
| 男/女(例) | 4/9 | 19/29 | 0.338 | 0.796 |
| 年龄(岁,) | 50.6±9.7 | 49.5±12.3 | 0.295 | 0.769 |
| 混合癌[例(%)] | 2(15.4) | 8(16.7) | 0.012 | 1.000 |
| 侵犯腺叶[例(%)] | 1(7.7) | 16(33.3) | 3.346 | 0.139 |
| 多灶性[例(%)] | 2(15.4) | 11(22.9) | 0.346 | 0.836 |
| 中央区LNM[例(%)] | 1(7.7) | 19(39.6) | 4.712 | 0.066 |
| 侧颈区LNM[例(%)] | 2(15.4) | 14(29.2) | 1.004 | 0.518 |
注:A、B组分别为肿瘤最大径≤0.5 cm和肿瘤最大径>0.5~≤1.0 cm的甲状腺微小髓样癌患者;LNM为淋巴结转移
根据AJCC第8版pTNM分期,MTC原发灶肿瘤最大径≤2.0 cm的病灶均为T1期,其中包括MTMC患者与C组患者(n=61),9例患者为混合癌,25例患者病灶侵犯腺叶,22例患者为多灶性病变,34例患者出现了中央区淋巴结转移,28例患者存在侧颈区淋巴结转移。MTMC组与C组在性别、年龄、混合癌、多灶性及侵犯腺叶等方面的差异均无统计学意义(均P>0.05),但两组在中央区淋巴结转移(P=0.011)及侧颈区淋巴结转移(P=0.024)方面差异均有统计学意义,见表3。
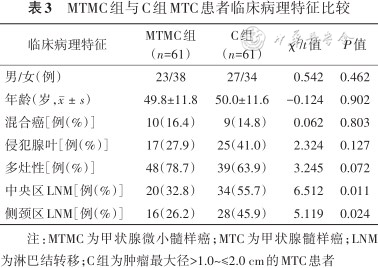
MTMC组与C组MTC患者临床病理特征比较
MTMC组与C组MTC患者临床病理特征比较
| 临床病理特征 | MTMC组(n=61) | C组(n=61) | χ2/t值 | P值 |
|---|---|---|---|---|
| 男/女(例) | 23/38 | 27/34 | 0.542 | 0.462 |
| 年龄(岁,) | 49.8±11.8 | 50.0±11.6 | -0.124 | 0.902 |
| 混合癌[例(%)] | 10(16.4) | 9(14.8) | 0.062 | 0.803 |
| 侵犯腺叶[例(%)] | 17(27.9) | 25(41.0) | 2.324 | 0.127 |
| 多灶性[例(%)] | 48(78.7) | 39(63.9) | 3.245 | 0.072 |
| 中央区LNM[例(%)] | 20(32.8) | 34(55.7) | 6.512 | 0.011 |
| 侧颈区LNM[例(%)] | 16(26.2) | 28(45.9) | 5.119 | 0.024 |
注:MTMC为甲状腺微小髓样癌;MTC为甲状腺髓样癌;LNM为淋巴结转移;C组为肿瘤最大径>1.0~≤2.0 cm的MTC患者
Kaplan-Meier生存分析发现,MTMC患者预期5年及10年无复发生存率分别为93.4%及89.0%,非MTMC组则分别为90.3%及82.8%。MTMC组中,5例(8.2%)出现术后肿瘤结构性复发,其中1例(1.6%)死亡。分期方面:Ⅰ期无患者复发,无患者死亡;Ⅲ期有2例患者复发,无患者死亡;Ⅳ期有3例患者复发,1例患者死亡;患者的无复发生存时间为83.1(68.0,97.0)个月。MTMC患者临床病理特征方面:多灶性(P=0.027)、中央区是否存在淋巴结转移(P=0.020)及pTNM分期(P=0.033)均是患者术后的无复发生存时间的影响因素,而性别(P=0.996)、侵犯包膜(P=0.115)及侧区颈淋巴结转移(P=0.077)则并非患者的术后无复发生存时间的影响因素(均P>0.05),见图1A、1B。Ⅰ、Ⅲ和Ⅳ期MTC患者术后无复发生存时间比较,Ⅰ期与Ⅲ期(P=0.013)、Ⅰ期与Ⅳ期(P=0.008)比较差异均有统计学意义,Ⅲ期与Ⅳ期(P=0.995)比较差异无统计学意义,见图1C。MTMC组、C组以及肿瘤最大径>2.0 cm组两两比较(MTMC组比C组,P=0.500;MTMC组比肿瘤最大径>2.0 cm组,P=0.178;C组比肿瘤最大径>2.0 cm组,P=0.462)患者术后无复发生存时间差异均无统计学意义,见图1D。
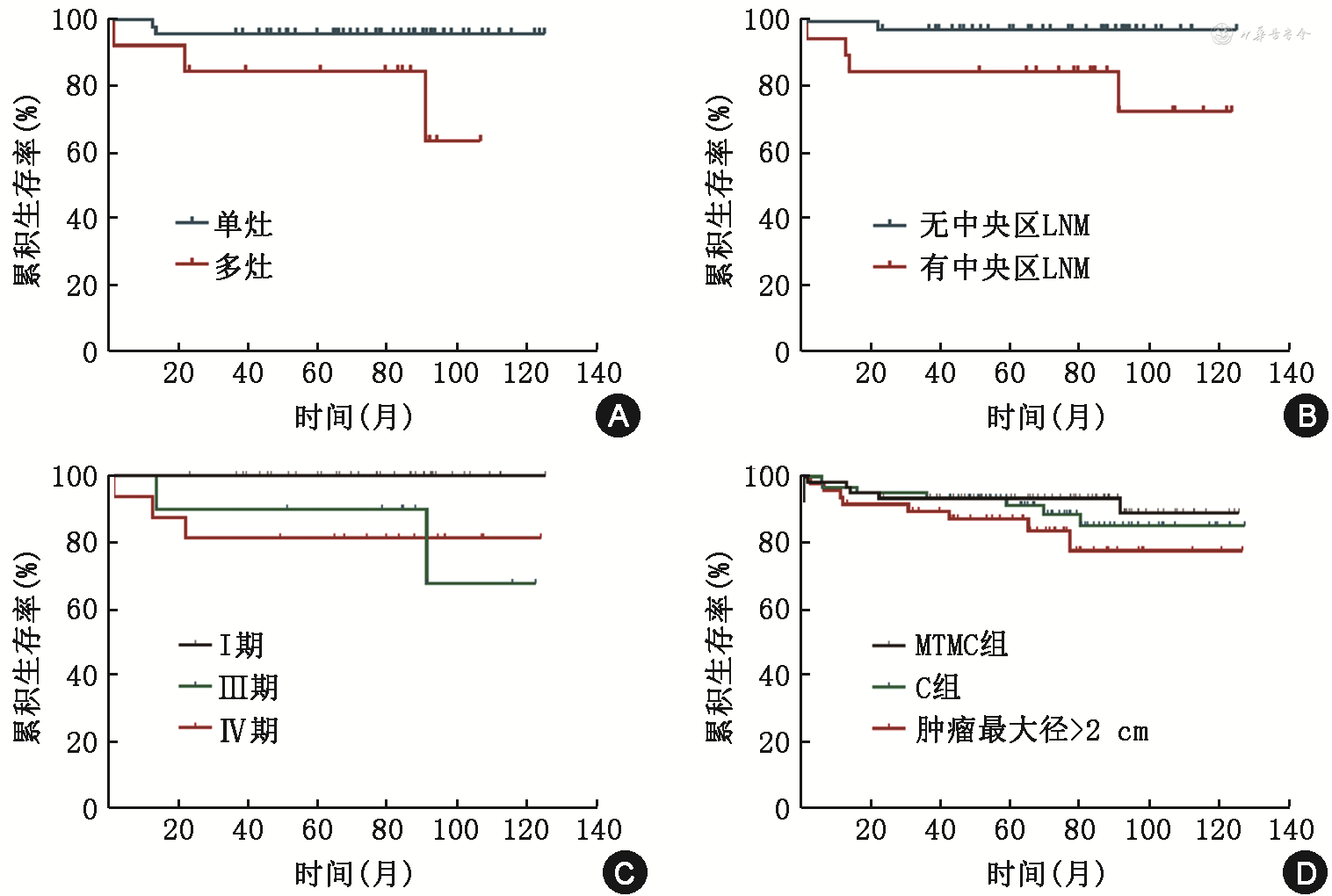

注:MTC为甲状腺髓样癌;LNM为淋巴结转移;MTMC为甲状腺微小髓样癌
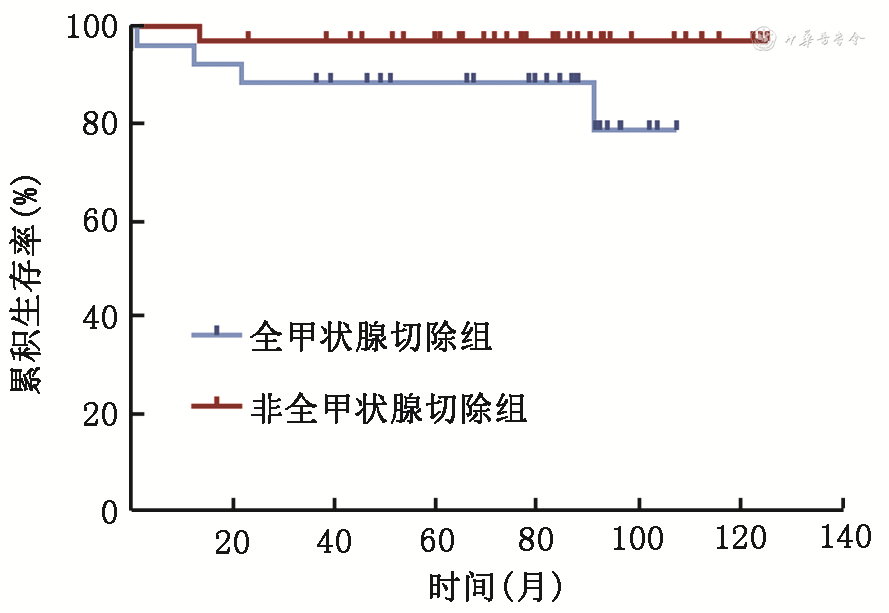
另外,进一步分析了不同手术方式与复发的情况,见表4。结果显示,尽管接受了非全甲状腺切除的患者的复发率较接受了全甲状腺切除患者的复发率更低,但差异无统计学意义(P=0.084),见图2。
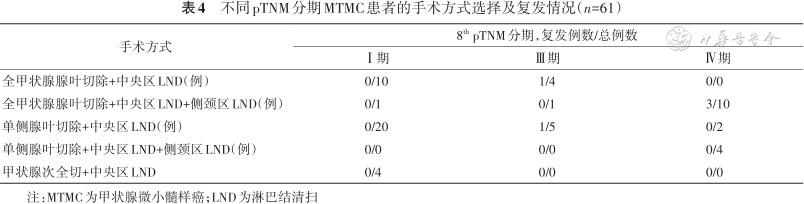
不同pTNM分期MTMC患者的手术方式选择及复发情况(n=61)
不同pTNM分期MTMC患者的手术方式选择及复发情况(n=61)
| 手术方式 | 8th pTNM分期,复发例数/总例数 | ||
|---|---|---|---|
| Ⅰ期 | Ⅲ期 | Ⅳ期 | |
| 全甲状腺腺叶切除+中央区LND(例) | 0/10 | 1/4 | 0/0 |
| 全甲状腺腺叶切除+中央区LND+侧颈区LND(例) | 0/1 | 0/1 | 3/10 |
| 单侧腺叶切除+中央区LND(例) | 0/20 | 1/5 | 0/2 |
| 单侧腺叶切除+中央区LND+侧颈区LND(例) | 0/0 | 0/0 | 0/4 |
| 甲状腺次全切+中央区LND | 0/4 | 0/0 | 0/0 |
注:MTMC为甲状腺微小髓样癌;LND为淋巴结清扫

主动监测成为近年来针对极低风险PTMC患者的新的治疗策略选择[4, 5],但是否在建议对低危甲状腺结节主动监测前常规筛查降钙素存在争议。主动监测过程大多依靠超声影像提供的肿物的大小尺寸、位置和结节是否增大来综合评判,却没有要求降钙素的筛查。2015美国甲状腺协会成人甲状腺结节与分化型甲状腺癌诊治指南并不推荐将降钙素检测作为常规筛查或是主动监测前的必须手段,这样一来可能会造成部分MTMC患者延误治疗的时机[5]。本研究回顾了2013年1月至2019年12月天津医科大学肿瘤医院收治的MTC患者的临床特征和预后情况,发现MTMC占所有MTC约1/4,占所有初诊甲状腺癌的1.86‰。因此建议对于符合主动监测条件的甲状腺癌患者,在不进行细针穿刺活检的情况下,仍然建议降钙素的筛查以除外MTMC可能。
值得注意的是,尽管MTMC的预后报道不一,但多数研究认为,MTMC的预后虽然相较肿瘤直径>1 cm MTC预后稍好,但其复发和死亡风险仍然较高[6]。Wu等[7]学者报道,相较肿瘤直径>1 cm的MTC患者,MTMC患者有着更少的侧颈淋巴结转移率以及更低的局部复发率,但MTMC患者总生存期的差异与之相比不具有统计学意义,提示MTMC总体的预后死亡风险仍然较高,这一发现与本研究结果一致。但尽管MTMC患者与肿瘤直径>1 cm MTC患者在生存方面的差异无统计学意义,其复发和死亡风险仍然稍低于肿瘤直径>1 cm MTC患者。MTC初始治疗时较大的肿瘤直径、较高的临床分期及术后较高的血清降钙素水平是复发或转移的危险因素,也是无复发生存期的影响因素[8]。
本研究还显示,在侧颈区淋巴结转移率方面,肿瘤最大径≤5 mm的MTMC的中央区淋巴结转移以及侧颈区淋巴结转移的比例与肿瘤最大径>0.5~≤1.0 cm的MTMC相比是相当的(P=0.066及P=0.518),提示针对MTC不能仅看肿瘤直径的大小,一定要考虑到MTC的生物学行为。另外,与PTMC不同的是,MTMC仍然具有一定的远处转移比例。本研究显示,在中位随访7年的过程中,术后远处转移的患者比例为2/61(3.3%)。Machens和Dralle[9]在回顾性分析了233例MTMC患者后发现,术后远处转移比例仅为1.3%。但Nicholas等[10]中位随访6.6年的42例MTMC的报道中,术后远处转移比例为4.8%(2/42),而在Kazaure等[6]的更大规模的报道中,5年随访中术后出现远处转移的比例为5%。上述结果提示,MTMC仍然是恶性程度不容小觑的甲状腺癌亚型。
综上所述,尽管多数MTMC的预后相对较好,但其远期复发及死亡风险仍然较高。医师在给出主动监测的决策前,应当对患者的MTMC风险进行筛查;同时,术后病理明确为MTMC的患者亦应告知患者其复发及死亡风险较PTC高,在随访中注意监测降钙素及全面的影像学检查。
李大鹏, 张金铭, 张艳辉, 等. 甲状腺微小髓样癌的临床特征及预后分析[J]. 中华医学杂志, 2024, 104(20): 1825-1830. DOI: 10.3760/cma.j.cn112137-20231225-01476.
所有作者声明不存在利益冲突



























