
探讨宫颈细胞学PAX1/JAM3双基因甲基化检测在子宫颈癌筛查中的应用价值。
本研究为一项多中心前瞻性研究。2022年5至10月,在中国医学科学院北京协和医院、浙江大学医学院附属第二医院和浙江省人民医院妇科门诊行子宫颈癌机会性筛查的女性中,将接受液基薄层细胞学检测(TCT)、高危型人乳头瘤病毒(hrHPV)DNA检测与PAX1/JAM3双基因甲基化(PAX1m/JAM3m)检测者为研究对象,共1 184例。基于hrHPV和细胞学结果,根据现行指南对于需要转诊阴道镜的女性提供相关检查和活检。根据组织病理学结果,研究比较各项检测方法及其组合用于子宫颈癌筛查的准确性。
1 184例研究对象的年龄[M(Q1,Q3)]为39(32,51)岁,其中子宫颈良性或慢性子宫颈炎(正常)、子宫颈上皮内瘤变(CIN)1、CIN2、CIN3和子宫颈癌分别为541例(45.7%)、273例(23.1%)、168例(14.2%)、140例(11.8%)和62例(5.2%)。根据病理学结果,PAX1m/JAM3m检测诊断CIN2或更严重病变(CIN2+)的灵敏度、特异度分别为74.1%和95.9%,诊断CIN3+的灵敏度、特异度分别为87.6%和86.8%。受试者工作特征曲线显示,对于诊断CIN3+,PAX1m/JAM3m优于TCT或hrHPV检测,曲线下面积(AUC)(95%CI)分别为0.872(0.847~0.897)、0.580(0.551~0.610)和0.503(0.479~0.515)(均P<0.05)。
子宫颈脱落细胞中PAX1m/JAM3m检测对于诊断CIN2+和CIN3+均具有优异的准确性,优于传统的筛查方案和筛查策略。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
子宫颈癌是威胁女性健康的重大卫生经济问题[1, 2]。高效和精准的筛查策略是实现“消除子宫颈癌”的关键措施之一。在传统筛查方案中,高危型人乳头状瘤病毒(high-risk human papillomavirus positive,hrHPV)DNA检测是目前首选的筛查方案[3, 4],但特异度较低[5, 6],亟需能够改善筛查特异度的分流方案以减少筛查的假阳性率和阴道镜转诊率,从而减少过度诊疗。目前主流的细胞病理学分流方案易受评估者的主观影响,可重复性差,敏感度也因受主观判定的影响在不同研究中存在差异[4, 5, 6, 7, 8]。因此,开发新的筛查或分流技术方案已经成为子宫颈癌诊疗领域的重点和热点方向。
DNA甲基化作为一种表观遗传学的生物标志物,目前在子宫颈病变筛查诊断中的应用已涵盖多个临床的应用场景,包括作为hrHPV阳性患者的管理[9, 10, 11, 12]、细胞学微小异常筛查结果的管理[13, 14],以及子宫颈三型转化区与腺癌患者的管理等[15, 16, 17]。PAX1[18, 19, 20]和JAM3[21, 22]这两个靶基因的联合甲基化检测用于子宫颈高级别病变的筛查诊断已见于报道[10]。
本研究旨在多中心前瞻性研究中,根据组织病理结果,评价PAX1/JAM3双基因甲基化(PAX1m/JAM3m)检测、hrHPV分型检测和细胞学分析对子宫颈癌筛查人群子宫颈上皮内瘤变(cervical intraepithelial neoplasia,CIN)2及CIN2+、CIN3+的检测效果,同时对PAX1m/JAM3m甲基化检测作为hrHPV分流方案的可能性进行探讨。
本研究为前瞻性多中心研究,在中国医学科学院北京协和医院、浙江大学医学院附属第二医院和浙江省人民医院3个单位中实施。在医院妇科门诊筛查队列中开展hrHPV DNA检测和细胞学分析,剩余样本则进行PAX1和JAM3甲基化检测。主要研究目的是比较不同筛查方案及其组合对于诊断CIN2+、CIN3+的准确性。
以2022年5至10月在上述医院妇科门诊行机会性子宫颈癌筛查的女性作为研究对象。纳入标准包括:(1)≥18岁,有性生活史,具有完整子宫颈;(2)无HIV感染、器官移植史、使用免疫抑制剂治疗等严重的免疫缺陷疾病或问题;(3)同意接受常规子宫颈癌筛查和甲基化检测。排除标准:已知女性生殖道恶性肿瘤或其他部位仍在治疗中的恶性肿瘤。所有研究对象均自愿参加本次研究,并签署知情同意书。本研究通过了中国医学科学院北京协和医院伦理委员会审核,批号:KS2021211。总计入组了6 262例行宫颈机会性筛查的女性,其中5 078例依据国内现行诊疗指南进行随访观察,1 184例进行了阴道镜检查并经子宫颈组织病理学诊断。
1. 液基细胞学检测:使用新柏氏液基细胞学检查(thinprep cytologic test,TCT)。将宫颈刷插入子宫颈并顺时针旋转5~6次,收集宫颈口和宫颈管的脱落细胞,置于专用液基细胞保存液PreservCyt®液体(豪洛捷医疗科技有限公司,北京)。由2名以上有经验医师根据2014年The Bethesda System分类法对细胞学进行评估和诊断[23]。
2. hrHPV DNA检测:使用Cobas HPV检测试剂盒(罗氏诊断产品有限公司,上海)进行基因分型检测,包括HPV16、18型和其他12种hrHPV(31、33、35、39、45、51、52、56、58、59、66和68型)。Cobas HPV检测按照厂家说明书使用Cobas 4800平台进行检测。
3. PAX1m/JAM3m检测:使用人PAX1和JAM3基因甲基化检测试剂盒(PCR-荧光探针法)(北京起源聚禾生物科技有限公司)进行基因甲基化检测。甲基化判断标准为ΔCtPAX1≤6.6或ΔCtJAM3≤10.0,二者任一满足标准定义为PAX1m/JAM3m阳性。试验步骤和判定标准参见研究者既往方案[9,24, 25]。
根据《中国子宫颈癌筛查指南》[26]与《中国子宫颈癌筛查及异常管理相关问题专家共识》[27, 28],对hrHPV和(或)细胞学筛查结果异常的女性提供阴道镜转诊和子宫颈活检。甲基化阳性并不作为转诊阴道镜检查的指征。阴道镜的应用参考《阴道镜应用的中国专家共识》[29],由参与研究医院具有资质的术者完成。两名有经验的病理医师对子宫颈活检结果进行诊断,诊断结果作为判定筛查方案的金标准。
采用SPSS 26.0统计软件包进行数据整理和统计学分析。符合正态分布的计量资料用表示,多组间的差异采用方差分析。非正态分布的计量资料用M(Q1,Q3)表示,两组间的差异采用Mann‐Whitney U检验。计数资料采用率或百分比(%)进行统计描述,组间比较采用χ² 检验。以病理诊断结果为金标准,利用受试者工作特征(receiver operating characteristic,ROC)曲线下的面积(area under curve,AUC)评估hrHPV DNA检测、TCT检测和PAX1m/JAM3m 检测对筛查人群中CIN2+与CIN3+检出的灵敏度、特异度、阳性预测值(PPV)、阴性预测值(NPV)及其95%CI值。双侧检验,检验水准α=0.05。
1 184例研究对象的年龄为39(32,51)岁。组织病理提示,子宫颈良性或慢性子宫颈炎(正常)、CIN1、CIN2、CIN3和子宫颈癌分别为541例(45.7%)、273例(23.1%)、168例(14.2%)、140例(11.8%)和62例(5.2%)。子宫颈癌患者中鳞癌和腺癌分别为57和5例。不同组织病理患者的TCT、HPV与PAX1m/JAM3m检测结果见表1。在正常、CIN1、CIN2、CIN3、子宫颈鳞癌和子宫颈腺癌的人群中,PAX1m(+)的比例分别为2.4%(13/541)、6.2%(17/273)、50.0%(84/168)、71.4%(100/140)、100.0%(57/57)和80.0%(4/5)(P<0.001),JAM3m(+)的比例分别为1.7%(9/541)、4.0%(11/273)、44.6%(75/168)、65.0%(91/140)、96.5%(55/57)和100.0%(5/5)(P<0.001),PAX1m/JAM3m(+)的比例分别为2.6%(14/541)、7.0%(19/273)、57.7%(97/168)、82.1%(115/140)、100.0%(57/57))和100.0%(5/5)(P<0.001)。
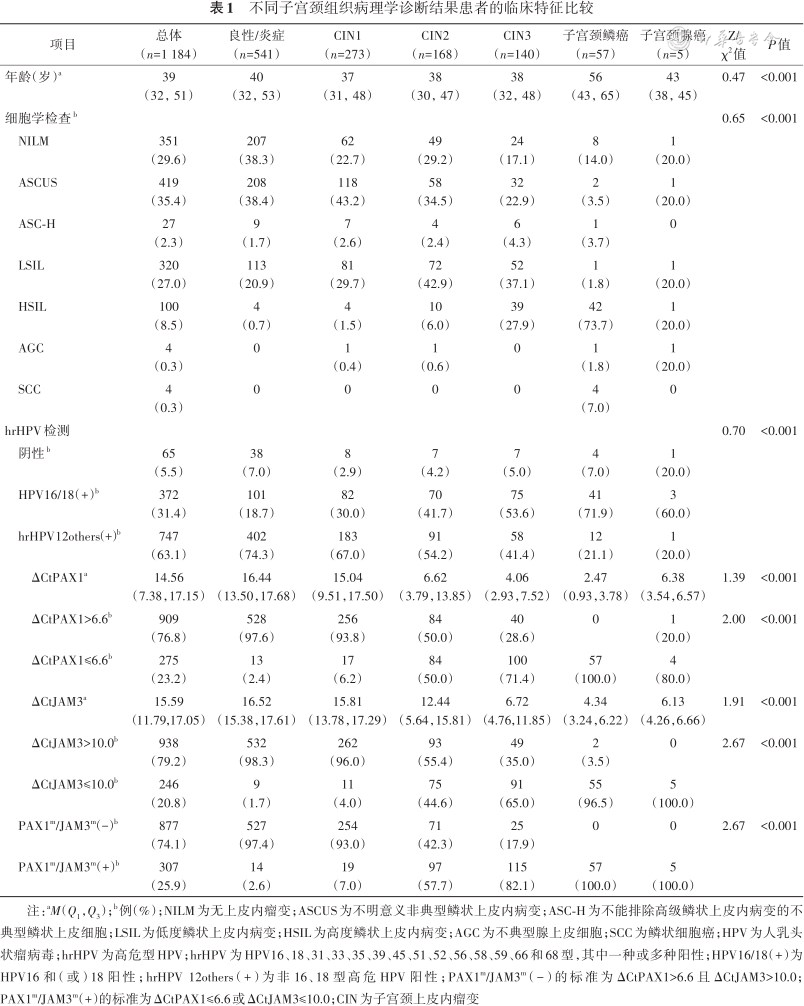
不同子宫颈组织病理学诊断结果患者的临床特征比较
不同子宫颈组织病理学诊断结果患者的临床特征比较
| 项目 | 总体(n=1 184) | 良性/炎症(n=541) | CIN1(n=273) | CIN2(n=168) | CIN3(n=140) | 子宫颈鳞癌(n=57) | 子宫颈腺癌(n=5) | Z/χ2值 | P值 |
|---|---|---|---|---|---|---|---|---|---|
| 年龄(岁)a | 39(32,51) | 40(32,53) | 37(31,48) | 38(30,47) | 38(32,48) | 56(43,65) | 43(38,45) | 0.47 | <0.001 |
| 细胞学检查b | 0.65 | <0.001 | |||||||
| NILM | 351(29.6) | 207(38.3) | 62(22.7) | 49(29.2) | 24(17.1) | 8(14.0) | 1(20.0) | ||
| ASCUS | 419(35.4) | 208(38.4) | 118(43.2) | 58(34.5) | 32(22.9) | 2(3.5) | 1(20.0) | ||
| ASC-H | 27(2.3) | 9(1.7) | 7(2.6) | 4(2.4) | 6(4.3) | 1(3.7) | 0 | ||
| LSIL | 320(27.0) | 113(20.9) | 81(29.7) | 72(42.9) | 52(37.1) | 1(1.8) | 1(20.0) | ||
| HSIL | 100(8.5) | 4(0.7) | 4(1.5) | 10(6.0) | 39(27.9) | 42(73.7) | 1(20.0) | ||
| AGC | 4(0.3) | 0 | 1(0.4) | 1(0.6) | 0 | 1(1.8) | 1(20.0) | ||
| SCC | 4(0.3) | 0 | 0 | 0 | 0 | 4(7.0) | 0 | ||
| hrHPV检测 | 0.70 | <0.001 | |||||||
| 阴性b | 65(5.5) | 38(7.0) | 8(2.9) | 7(4.2) | 7(5.0) | 4(7.0) | 1(20.0) | ||
| HPV16/18(+)b | 372(31.4) | 101(18.7) | 82(30.0) | 70(41.7) | 75(53.6) | 41(71.9) | 3(60.0) | ||
| hrHPV12others(+)b | 747(63.1) | 402(74.3) | 183(67.0) | 91(54.2) | 58(41.4) | 12(21.1) | 1(20.0) | ||
| ΔCtPAX1a | 14.56(7.38,17.15) | 16.44(13.50,17.68) | 15.04(9.51,17.50) | 6.62(3.79,13.85) | 4.06(2.93,7.52) | 2.47(0.93,3.78) | 6.38(3.54,6.57) | 1.39 | <0.001 |
| ΔCtPAX1>6.6b | 909(76.8) | 528(97.6) | 256(93.8) | 84(50.0) | 40(28.6) | 0 | 1(20.0) | 2.00 | <0.001 |
| ΔCtPAX1≤6.6b | 275(23.2) | 13(2.4) | 17(6.2) | 84(50.0) | 100(71.4) | 57(100.0) | 4(80.0) | ||
| ΔCtJAM3a | 15.59(11.79,17.05) | 16.52(15.38,17.61) | 15.81(13.78,17.29) | 12.44(5.64,15.81) | 6.72(4.76,11.85) | 4.34(3.24,6.22) | 6.13(4.26,6.66) | 1.91 | <0.001 |
| ΔCtJAM3>10.0b | 938(79.2) | 532(98.3) | 262(96.0) | 93(55.4) | 49(35.0) | 2(3.5) | 0 | 2.67 | <0.001 |
| ΔCtJAM3≤10.0b | 246(20.8) | 9(1.7) | 11(4.0) | 75(44.6) | 91(65.0) | 55(96.5) | 5(100.0) | ||
| PAX1m/JAM3m(-)b | 877(74.1) | 527(97.4) | 254(93.0) | 71(42.3) | 25(17.9) | 0 | 0 | 2.67 | <0.001 |
| PAX1m/JAM3m(+)b | 307(25.9) | 14(2.6) | 19(7.0) | 97(57.7) | 115(82.1) | 57(100.0) | 5(100.0) |
注:aM(Q1,Q3);b例(%);NILM为无上皮内瘤变;ASCUS为不明意义非典型鳞状上皮内病变;ASC-H为不能排除高级鳞状上皮内病变的不典型鳞状上皮细胞;LSIL为低度鳞状上皮内病变;HSIL为高度鳞状上皮内病变;AGC为不典型腺上皮细胞;SCC为鳞状细胞癌;HPV为人乳头状瘤病毒;hrHPV为高危型HPV;hrHPV为HPV16、18、31、33、35、39、45、51、52、56、58、59、66和68型,其中一种或多种阳性;HPV16/18(+)为HPV16和(或)18阳性;hrHPV 12others(+)为非16、18型高危HPV阳性;PAX1m/JAM3m(-)的标准为ΔCtPAX1>6.6且ΔCtJAM3>10.0;PAX1m/JAM3m(+)的标准为ΔCtPAX1≤6.6或ΔCtJAM3≤10.0;CIN为子宫颈上皮内瘤变
PAX1m/JAM3m与子宫颈病变严重程度的相关性见表2。以PAX1m/JAM3m(-)组为参考,PAX1m/JAM3m(+)的患者发生CIN1、CIN2、CIN3的OR值(95%CI)分别为2.8(1.4~5.8)、50.5(28.2~97.0)和168.0(87.3~344.0)(均P<0.05)。以PAX1m/JAM3m(-)组为参考,PAX1m/JAM3m(+)的患者发生细胞学低度鳞状上皮内病变或更严重病变的OR值(95%CI)为3.7(2.7~5.3),发生HPV16/18(+)的OR值(95%CI)为2.1(1.2~3.9)(均P<0.05)。
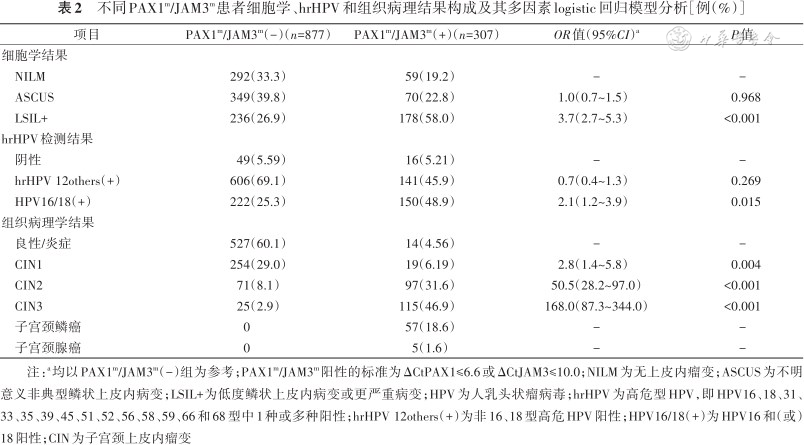
不同PAX1m/JAM3m患者细胞学、hrHPV和组织病理结果构成及其多因素logistic回归模型分析[例(%)]
不同PAX1m/JAM3m患者细胞学、hrHPV和组织病理结果构成及其多因素logistic回归模型分析[例(%)]
| 项目 | PAX1m/JAM3m(-)(n=877) | PAX1m/JAM3m(+)(n=307) | OR值(95%CI)a | P值 |
|---|---|---|---|---|
| 细胞学结果 | ||||
| NILM | 292(33.3) | 59(19.2) | - | - |
| ASCUS | 349(39.8) | 70(22.8) | 1.0(0.7~1.5) | 0.968 |
| LSIL+ | 236(26.9) | 178(58.0) | 3.7(2.7~5.3) | <0.001 |
| hrHPV检测结果 | ||||
| 阴性 | 49(5.59) | 16(5.21) | - | - |
| hrHPV 12others(+) | 606(69.1) | 141(45.9) | 0.7(0.4~1.3) | 0.269 |
| HPV16/18(+) | 222(25.3) | 150(48.9) | 2.1(1.2~3.9) | 0.015 |
| 组织病理学结果 | ||||
| 良性/炎症 | 527(60.1) | 14(4.56) | - | - |
| CIN1 | 254(29.0) | 19(6.19) | 2.8(1.4~5.8) | 0.004 |
| CIN2 | 71(8.1) | 97(31.6) | 50.5(28.2~97.0) | <0.001 |
| CIN3 | 25(2.9) | 115(46.9) | 168.0(87.3~344.0) | <0.001 |
| 子宫颈鳞癌 | 0 | 57(18.6) | - | - |
| 子宫颈腺癌 | 0 | 5(1.6) | - | - |
注:a均以PAX1m/JAM3m(-)组为参考;PAX1m/JAM3m阳性的标准为ΔCtPAX1≤6.6或ΔCtJAM3≤10.0;NILM为无上皮内瘤变;ASCUS为不明意义非典型鳞状上皮内病变;LSIL+为低度鳞状上皮内病变或更严重病变;HPV为人乳头状瘤病毒;hrHPV为高危型HPV,即HPV16、18、31、33、35、39、45、51、52、56、58、59、66和68型中1种或多种阳性;hrHPV 12others(+)为非16、18型高危HPV阳性;HPV16/18(+)为HPV16和(或)18阳性;CIN为子宫颈上皮内瘤变
不同检测方式用于检测子宫颈病变与子宫颈癌的ROC曲线结果见图1。以组织病理结果作为金标准,PAX1m/JAM3m(+)检测CIN2+病变的灵敏度、特异度、PPV、NPV分别为74.1%(69.6%~78.5%)、95.9%(94.6%~97.3%)、89.3%(85.8%~92.7%)和89.1%(87.0%~91.1%)。TCT结果为不明意义非典型鳞状上皮内病变或更严重病变(atypical squamous cells of undetermined significance or worse,≥ASCUS)、hrHPV(+)、HPV16/18(+)或PAX1m/JAM3m(+)、hrHPV(+)且PAX1m/JAM3m(+)对CIN2+的筛查效果详见表3。不同筛查方案检测CIN2+的准确性见图1B。PAX1m/JAM3m(+)与TCT(≥ASCUS)、hrHPV(+)、HPV16/18(+)或PAX1m/JAM3m(+)、hrHPV(+)且PAX1m/JAM3m(+)联合筛查方案相比,均有更高的AUC(0.850,95%CI:0.827~0.873;均P<0.001)。
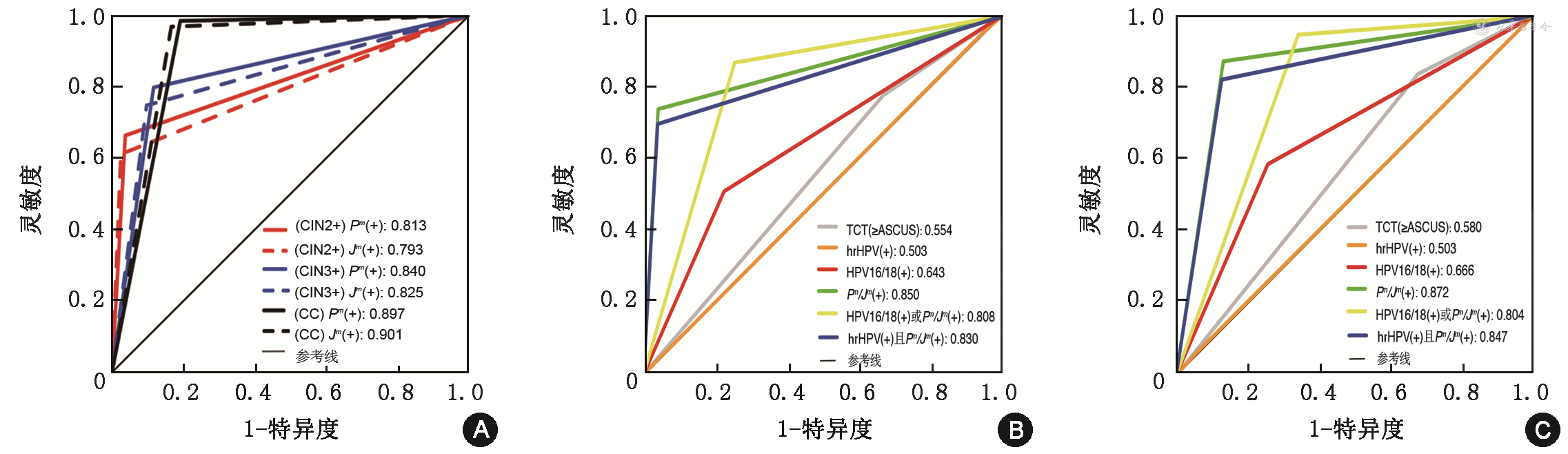

注:CIN为子宫颈上皮内瘤变;CC为子宫颈癌,包括子宫颈鳞癌和子宫颈腺癌;Pm(+)ΔCtPAX1≤6.6;Jm(+)为ΔCtJAM3≤10.0;TCT(≥ASCUS)(+)为细胞学检测结果为不明意义非典型鳞状上皮内病变及以上病变;HPV为人乳头状瘤病毒;hrHPV(+)为高危型HPV阳性;HPV16/18(+)为HPV16和(或)HPV18;Pm/Jm(+)[即PAX1m/JAM3m(+)]的标准为ΔCtPAX1≤6.6或ΔCtJAM3≤10.0;HPV16/18(+)或PAX1m/JAM3m(+)为HPV16和(或)18阳性,或ΔCtPAX1≤6.6,或ΔCtJAM3≤10.0;hrHPV(+)且PAX1m/JAM3m(+)为hrHPV阳性且ΔCtPAX1≤6.6,或hrHPV阳性且ΔCtJAM3≤10.0
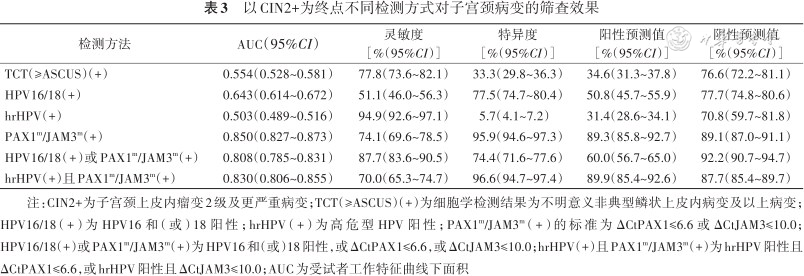
以CIN2+为终点不同检测方式对子宫颈病变的筛查效果
以CIN2+为终点不同检测方式对子宫颈病变的筛查效果
| 检测方法 | AUC(95%CI) | 灵敏度[%(95%CI)] | 特异度[%(95%CI)] | 阳性预测值[%(95%CI)] | 阴性预测值[%(95%CI)] |
|---|---|---|---|---|---|
| TCT(≥ASCUS)(+) | 0.554(0.528~0.581) | 77.8(73.6~82.1) | 33.3(29.8~36.3) | 34.6(31.3~37.8) | 76.6(72.2~81.1) |
| HPV16/18(+) | 0.643(0.614~0.672) | 51.1(46.0~56.3) | 77.5(74.7~80.4) | 50.8(45.7~55.9) | 77.7(74.8~80.6) |
| hrHPV(+) | 0.503(0.489~0.516) | 94.9(92.6~97.1) | 5.7(4.1~7.2) | 31.4(28.6~34.1) | 70.8(59.7~81.8) |
| PAX1m/JAM3m(+) | 0.850(0.827~0.873) | 74.1(69.6~78.5) | 95.9(94.6~97.3) | 89.3(85.8~92.7) | 89.1(87.0~91.1) |
| HPV16/18(+)或PAX1m/JAM3m(+) | 0.808(0.785~0.831) | 87.7(83.6~90.5) | 74.4(71.6~77.6) | 60.0(56.7~65.0) | 92.2(90.7~94.7) |
| hrHPV(+)且PAX1m/JAM3m(+) | 0.830(0.806~0.855) | 70.0(65.3~74.7) | 96.6(94.7~97.4) | 89.9(85.4~92.6) | 87.7(85.4~89.7) |
注:CIN2+为子宫颈上皮内瘤变2级及更严重病变;TCT(≥ASCUS)(+)为细胞学检测结果为不明意义非典型鳞状上皮内病变及以上病变;HPV16/18(+)为HPV16和(或)18阳性;hrHPV(+)为高危型HPV阳性;PAX1m/JAM3m(+)的标准为ΔCtPAX1≤6.6或ΔCtJAM3≤10.0;HPV16/18(+)或PAX1m/JAM3m(+)为HPV16和(或)18阳性,或ΔCtPAX1≤6.6,或ΔCtJAM3≤10.0;hrHPV(+)且PAX1m/JAM3m(+)为hrHPV阳性且ΔCtPAX1≤6.6,或hrHPV阳性且ΔCtJAM3≤10.0;AUC为受试者工作特征曲线下面积
以组织病理结果作为金标准,PAX1m/JAM3m(+)检测CIN3+病变的灵敏度、特异度、PPV、NPV分别为87.6%(83.1%~92.2%)、86.8%(84.6%~88.9%)、57.7%(52.1%~63.2%)和97.1%(96.6%~98.3%)。TCT(≥ASCUS)、hrHPV(+)、HPV16/18(+)或PAX1m/JAM3m(+)、hrHPV(+)且PAX1m/JAM3m(+)对CIN3+病变的筛查效果详见表4。不同筛查方案检测CIN3+的准确性见图1C。PAX1m/JAM3m(+)与TCT(≥ASCUS)、hrHPV(+)、HPV16/18(+)或PAX1m/JAM3m(+)、hrHPV(+)且PAX1m/JAM3m(+)联合筛查方案相比,均有更高的AUC(0.872,95%CI:0.847~0.897;均P<0.001)。

以CIN3+为终点不同检测方式对子宫颈病变的筛查效果(95%CI)
以CIN3+为终点不同检测方式对子宫颈病变的筛查效果(95%CI)
| 检测方法 | AUC(95%CI) | 灵敏度[%(95%CI)] | 特异度[%(95%CI)] | 阳性预测值[%(95%CI)] | 阴性预测值[%(95%CI)] |
|---|---|---|---|---|---|
| TCT(≥ASCUS)(+) | 0.580(0.551~0.610) | 83.7(78.6~88.8) | 32.4(29.5~35.3) | 20.3(17.6~23.0) | 90.6(87.5~93.7) |
| HPV16/18(+) | 0.666(0.629~0.702) | 58.9(52.1~65.7) | 74.2(71.5~77.0) | 32.2(27.2~36.7) | 89.8(87.7~91.9) |
| hrHPV(+) | 0.503(0.479~0.515) | 94.1(89.6~96.8) | 5.4(4.1~7.0) | 17.0(14.9~19.3) | 82.9(80.8~85.1) |
| PAX1m/JAM3m(+) | 0.872(0.847~0.897) | 87.6(83.1~92.2) | 86.8(84.6~88.9) | 57.7(52.1~63.2) | 97.1(96.6~98.3) |
| HPV16/18(+)或PAX1m/JAM3m(+) | 0.804(0.783~0.825) | 95.5(92.1~98.0) | 65.5(62.7~68.7) | 36.6(32.2~40.4) | 98.8(97.5~99.4) |
| hrHPV(+)且PAX1m/JAM3m(+) | 0.847(0.819~0.876) | 82.2(76.9~87.5) | 87.7(85.2~89.4) | 57.7(51.4~62.7) | 96.6(94.7~97.3) |
注:CIN3+为子宫颈上皮内瘤变3级及更严重病变;TCT(≥ASCUS)(+)为细胞学检测结果为不明意义非典型鳞状上皮内病变及以上病变;HPV16/18(+)为HPV16和(或)18阳性;hrHPV(+)为高危型HPV阳性;PAX1m/JAM3m(+)的标准为ΔCtPAX1≤6.6或ΔCtJAM3≤10.0;HPV16/18(+)或PAX1m/JAM3m(+)为HPV16和(或)18阳性,或ΔCtPAX1≤6.6,或ΔCtJAM3≤10.0;hrHPV(+)且PAX1m/JAM3m(+)为hrHPV阳性且ΔCtPAX1≤6.6,或hrHPV阳性且ΔCtJAM3≤10.0;AUC为受试者工作特征曲线下面积
对于检测CIN2+或CIN3+,hrHPV(+)且PAX1m/JAM3m(+)均具有较高的特异度,分别为96.6%(94.7%~97.4%)和87.7%(85.2%~89.4%),CIN2+中灵敏度最高的为hrHPV(+),为94.1%(89.6%~96.8%),CIN3+灵敏度最高的为HPV16/18或PAX1m/JAM3m(+),为95.5%(92.1%~98.0%),见表3和4。
本研究采用了多中心前瞻性研究设计,全面评估了不同检测方式对于子宫颈癌筛查的有效性。本研究结果表明,采用子宫颈脱落细胞PAX1m/JAM3m在检测CIN2+与CIN3+方面表现出良好的准确性。同时本研究还探讨了PAX1m/JAM3m联合hrHPV检测用于子宫颈癌筛查的检测效能,研究发现HPV16/18(+)或PAX1m/JAM3m(+)在检测CIN2+与CIN3+方面有着较高的灵敏度,而hrHPV(+)且PAX1m/JAM3m(+)在检测CIN2+与CIN3+方面有着最优的特异度和良好的灵敏度,hrHPV分型检测与PAX1m/JAM3m检测的合理搭配有望最大程度发挥二者在子宫颈癌筛查中的作用。
甲基化检测应用于子宫颈癌筛查已经成为日益成熟可靠的技术方案。2021年7月WHO指出了未来甲基化检测在子宫颈癌筛查中应用的可行性[30, 31]。在以往的一些研究中PAX1与JAM3甲基化在子宫颈癌筛查中展现出较好的检测效能[22,32, 33, 34]。本课题组前期的一项在国内开展的DNA甲基化应用于子宫颈癌筛查的研究表明,对于CIN2+的检测,EPB41L3和JAM3基因甲基化状态检测与hrHPV联合甲基化检测具有相同的PPV(0.930比0.954,P=0.395),并且对于HPV阴性的女性,EPB41L3和JAM3基因甲基化状态能够很好地区分CIN2+的患者[9],并在其验证集研究中证明无论hrHPV状态如何甲基化检测都可以作为独立的筛查方法[25]。本研究结果显示,PAX1m/JAM3m可对子宫颈癌(包括鳞癌和腺癌)100%的检出,这提示了在未来的研究中可以对PAX1m/JAM3m是否能成为子宫颈癌筛查的独立工具进行进一步的探究。
hrHPV基因分型与TCT检查是目前临床对子宫颈癌进行筛查的主要手段,但是TCT的灵敏度比较低,容易产生假阴性,HPV基因分型与TCT联合检测的灵敏度虽然得到了提升,但特异性并没有得到改善[26]。本研究将HPV基因分型与PAX1m/JAM3m检测进行联合,有效地提升了检测的灵敏度与特异性。对于初筛hrHPV检测异常的患者PAX1m/JAM3m提供了一个可行的、无创的辅助诊断方法,PAX1m/JAM3m在组织病理良性/炎症组和CIN1组的低阳性率(2.6%和7.0%)与子宫颈组织病理CIN2、CIN3高阳性率(57.7%和82.1%),表明PAX1m/JAM3m能够将子宫颈筛查结果异常的患者分流到不同的管理策略。已有文献研究提到,甲基化作为HPV阳性女性分流的价值相当于甚至优于细胞学检测,特别是在基于HPV筛查的人群中对于CIN3+的分流效果[35, 36, 37, 38, 39]。甲基化也可以作为细胞学初筛异常的管理方式[40, 41],并且甲基化还可以用于预测子宫颈病变进展[22]。一项欧洲的多中心研究表明细胞学FAM19A4/miR124-2 DNA甲基化状态可以预测CIN2/3的消退状态[42]。本研究中hrHPV联合PAX1m/JAM3m双基因甲基化在CIN2+与CIN3+的高准确性与高特异度表明hrHPV联合PAX1m/JAM3m具有潜在的子宫颈癌筛查价值。DNA甲基化检测使得对子宫颈癌大规模筛查和监测成为可能,从而提高了对子宫颈癌早期诊断的可行性。对于低风险患者,甲基化联合HPV筛查可能有助于减少进一步的检查和干预,在降低了漏诊的风险的同时也避免了过度治疗和避免造成患者不必要的焦虑。这将有助于优化子宫颈癌筛查策略,使其更加精确和个性化。
总之,本研究发现,子宫颈脱落细胞中PAX1m/JAM3m检测对于CIN2+和CIN3+均具有优异的准确性,优于传统的筛查方案和筛查策略。由于hrHPV联合甲基化检测具备最佳的特异性,因此PAX1m/JAM3m检测有望替代细胞学成为hrHPV(+)女性的分流方案。
商晓, 孔令华, 肖晓萍, 等. 子宫颈细胞学PAX1/JAM3双基因甲基化检测用于子宫颈癌筛查的多中心研究[J]. 中华医学杂志, 2024, 104(20): 1852-1859. DOI: 10.3760/cma.j.cn12137-20231004-00630.
北京起源聚禾生物科技有限公司为本研究提供了甲基化分析试剂盒;刘沛、刘禹利、王林海、靳希桐为本研究提供了技术支持
所有作者声明不存在利益冲突



























