
甲状腺激素(TH)具有促进生长发育、调节能量和物质代谢等生物学效应,主要由两种甲状腺激素受体(TR),即TRα和TRβ介导。TH对心血管和骨骼的作用主要由TRα介导,而对糖脂代谢的调控活性主要由TRβ介导。TRβ选择性和(或)器官选择性受体激动剂能够改善代谢,同时避免激动TRα引起的不良反应,有望用于治疗以非酒精性脂肪性肝炎为代表的代谢性疾病,以及一些神经系统脱髓鞘疾病。本文主要介绍TH及TR在肝脏、脂肪组织、骨骼肌和中枢神经系统中的作用,以及选择性TR激动剂的研究进展。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
甲状腺激素(TH)是调控代谢与发育的基础性激素,其生物学效应主要由各组织器官中的甲状腺激素受体(TR)介导。TH能够提高基础代谢率并改善糖脂代谢,然而,过量的TH会造成各种不良反应,如心脏毒性、骨质疏松等。研制TR亚型选择性和(或)器官选择性受体激动剂,能够充分利用TH的代谢获益,同时规避不良反应。近年来,选择性TRβ激动剂对非酒精性脂肪性肝炎(NASH)的治疗作用备受关注,还在一些神经系统脱髓鞘疾病中展现出治疗潜力。本文主要介绍TH及TR在肝脏、脂肪组织、骨骼肌和中枢神经系统(CNS)中的生理作用,以及选择性TR激动剂在基础和临床研究中的进展,并对靶向激活CNS、脂肪和肝脏TR的新型药物设计进行简介。
甲状腺分泌的TH主要为四碘甲腺原氨酸(T4)和三碘甲腺原氨酸(T3)。T4在外周经1型脱碘酶(DIO1)和2型脱碘酶(DIO2)作用下转化为活性更强的T3,经3型脱碘酶(DIO3)灭活形成反三碘甲腺原氨酸(rT3),后者也是TH降解的关键步骤[1]。TH的分泌主要受到中枢下丘脑-垂体-甲状腺轴的反馈调控,同时存在神经、免疫以及甲状腺自身调节等调控机制[2]。TH的生理作用非常广泛,主要可以概括为促进生长发育、调节能量和物质代谢,从而影响各器官系统功能。例如胚胎或幼儿期缺乏TH引起神经系统发育障碍及骨骼生长迟滞,甲状腺功能减退症(简称甲减)患者出现基础代谢率降低、能量消耗减少、体重增加、胆固醇水平升高、脂解和糖异生减少;反之,甲状腺功能亢进症(简称甲亢)患者高代谢状态,表现为基础代谢率升高、能量消耗增加、体重减轻、胆固醇水平降低、脂解和糖异生增加[3]。
TR位于细胞核内,属于核转录因子家族,结构包括配体结合域、具有锌指结构的DNA结合域和转录激活域[4]。TR有两种亚型TRα和TRβ,分别由两个基因编码,即人类17号染色体上的THRA和3号染色体上的THRB基因。其初级转录进一步产生了α1、α2、β1和β2等选择性剪接产物,并在配体-受体结合方面具有不同的效应[5]。TR亚型的表达具有时空特异性,在不同发育阶段的组织,以及不同组织器官中的表达和分布存在差异,例如在人类中,TRα在心脏、大脑和骨骼中占主导地位,而TRβ在肝脏、肾脏、垂体和大脑中普遍存在[5]。TR亚型表达的组织特异性,以及组织内每种亚型的相对表达丰度,是TH发挥生物学作用的主要途径[6],也是选择性TR激动剂规避不良反应的结构基础。
1. 肝脏:肝脏主要表达TRβ,通过不同的途径参与糖脂代谢。THRB基因突变的甲状腺激素抵抗综合征患者相较于其未突变的亲属,肝脏脂肪含量增加,且循环游离脂肪酸(FFA)水平显著较高[7],提示肝内TRβ信号通路缺陷对肝脏脂质代谢具有负面影响。最近的一些研究认为,“肝脏内部的甲状腺功能减退症”是NASH的重要驱动因素,肝实质细胞DIO1表达减少导致肝脏组织局部的T3降低,而肝间质细胞DIO3表达增加则进一步导致肝脏组织局部的T3灭活增多,rT3增高,由此导致了“肝脏内部的甲状腺功能减退症”,继而引起脂毒性物质的积累并诱发肝损伤[8]。除了由低密度脂蛋白(LDL)受体介导的血清胆固醇清除,肝脏TRβ激活还可以通过诱导调控胆汁酸合成中限速步骤的胆固醇7α-羟化酶表达,促进胆固醇转化为胆汁酸并排泄。笔者团队研究发现,T3还能通过表观遗传学机制发挥作用,T3能够正向调控肝细胞中的微小RNA-378(miR-378),而调控胆汁酸合成的转录抑制因子小Maf转录因子G(MAFG)是miR-378的靶基因。抑制MAFG能够促进胆汁酸经典和替代合成途径中关键酶的表达,从而增加肝脏胆汁酸的合成和排泄,降低血清胆固醇水平并抵抗饮食诱导的高胆固醇血症[9]。此外,肝脏TRβ还介导T3诱导的肝细胞自噬,其与脂肪酸β-氧化紧密结合,调节脂质稳态[10]。多项研究表明,给予T3或选择性TRβ激动剂可以纠正动物模型或人类的血脂异常,改善肝脂肪变性[11],提示TRβ是脂质代谢相关疾病治疗的一个重要靶点。
在糖代谢方面:一方面,T3能够直接刺激肝脏糖异生。在甲状腺毒症大鼠中,糖异生的关键酶磷酸烯醇式丙酮酸羧化激酶(PEPCK)的表达显著增高,并能拮抗胰岛素的降糖作用[12],而在TRβ突变的小鼠中则观察到了糖异生受损和PEPCK表达下调[13],提示肝脏TRβ在糖异生过程中发挥了重要作用;另一方面,T3还能够通过间接的机制降低血糖。采用甲巯咪唑诱导的甲减小鼠表现为血糖升高及糖耐量受损,而补充T3能显著改善甲减小鼠的糖代谢。笔者团队研究发现,T3能够通过肝脏TRβ介导抑制胆固醇12α-羟化酶表达,导致肝脏胆汁酸组分改变,具有法尼醇X受体(FXR)拮抗作用的非12α羟基胆汁酸含量增加,后者能够抑制肠道FXR信号传导,增加胰高血糖素样肽-1和胰岛素分泌,从而改善糖代谢[14]。这些研究共同确立了肝脏TRβ在糖脂代谢调控中的双重作用,为开发靶向肝脏的TRβ激动剂以及治疗代谢性疾病奠定了理论基础。
2. 脂肪组织:脂肪组织同时表达TRα和TRβ两种受体。棕色脂肪组织一直是内分泌代谢领域的研究热点,其产热耗能的生理作用主要由1型解偶联蛋白(UCP1)介导[15]。以往研究认为,产热脂肪中的UCP1由去甲肾上腺素和T3协同调节,其中TRβ主要调控UCP1的表达并增加线粒体的生物发生和耗氧率[16, 17],而TRα主要介导对肾上腺素能信号的感知和敏感性[18]。笔者团队的研究发现,激活TRα还可通过上调原癌基因c-Myc以促进棕色脂肪前体细胞的有丝分裂,诱导小鼠肩胛间棕色脂肪增生,增加产热和能量消耗[19]。这些发现进一步拓宽了对棕色脂肪代谢调控机制的认识,展现了其作为肥胖和其他代谢病治疗靶点的潜力。
在白色脂肪组织中,以往研究发现T3能够通过TRβ在转录水平直接调控碳水化合物反应元件结合蛋白(ChREBP)[20]。ChREBP是一种感知葡萄糖的转录因子,能够调控一系列参与脂质从头合成途径关键酶的表达,将摄取的葡萄糖转化为脂质存储在脂肪细胞中。为了深入研究TRα和TRβ在白色脂肪中的作用,笔者团队分别构建了脂肪组织特异性TRα和TRβ敲除的小鼠模型,发现TRβ是介导T3对腹股沟白色脂肪中多种代谢途径基因表达调控的主要亚型,包括葡萄糖摄取和使用、脂肪酸从头合成以及UCP1依赖性及非依赖性产热,脂肪组织特异性TRβ敲除的小鼠在高脂饮食喂养后更易发生肥胖和代谢失调[21],提示除了肝脏,靶向激动脂肪组织TRβ也能改善代谢,弥补了肝脏选择性TR激动剂难以促进脂解、减轻体重的缺点。
3. 骨骼肌:骨骼肌主要表达TRα,在收缩功能、能量代谢和损伤修复方面受到TH的调控。笔者团队以往的研究发现,TH能够通过上调微小RNA-133a1(miR-133a1)来抑制TEA域家族成员1(TEAD1)的表达,TEAD1是调控慢肌纤维中Ⅰ型肌球蛋白重链(MyHC Ⅰ)表达的上游转录因子,T3通过miR-133a1/TEAD1间接抑制MyHC Ⅰ的表达,促使慢肌纤维向快肌纤维转变,由此调控骨骼肌收缩功能[22]。在能量代谢方面,研究发现TH在骨骼肌中能够以剂量和时间依赖的方式诱导自噬,并上调线粒体活性和生物发生[23]。而笔者团队的研究发现,受T3正向调控的miR-378可通过分别抑制靶基因磷酸肌醇依赖性蛋白激酶1(PDK1)和半胱氨酸天冬氨酸蛋白酶9(Caspase 9),诱导骨骼肌细胞自噬并抑制其凋亡[24]。在再生医学方面,Milanesi等[25]发现T3能够通过Wnt/β-catenin信号通路调控骨骼肌中成肌细胞的增殖和分化,TRα突变的小鼠骨骼肌损伤后修复功能受损,而TRβ突变的小鼠则不受影响,这一发现为骨骼肌损伤后修复提供了潜在的治疗靶点。
4. CNS:CNS中的TR分布同样具有亚型的相对差异,如TRα在CNS普遍存在,但TRβ仅存在于发育后期的下丘脑、视网膜、垂体和耳蜗。TRα通常被认为与神经元形成和发育密切相关,如在TRα敲除小鼠中γ-氨基丁酸(GABA)能使神经元的树突和轴突的形成延迟[26]。而TRβ和视黄酸X受体在胎儿和成人中的表达差异可能与少突胶质细胞前体细胞(OPCs)分化成熟和髓鞘形成能力有关[27],动物实验也证实TRβ的过表达增加了OPCs的分化,表明TRβ在髓鞘再形成中具有重要作用[28]。这些发现为CNS脱髓鞘疾病的治疗开辟了新的方向。
此外,在激素运输和分布方面,TH主要通过单羧酸转运体8(MCT8)和有机阴离子转运蛋白1C1(OATP1C1)介导穿过血脑屏障,其中人类MCT8缺陷可引起一种临床表现为中枢甲减和外周甲状腺毒症的综合征(Allan-Herndon-Dudley综合征)[29]。以往认为OATP1C1对小鼠的TH运输尤为重要,而人类则更依赖于MCT8;但2018年Strømme等[30]首次报道了OATP1C1缺陷患者的中枢甲减症和神经退行性疾病,提示其可能对人类血脑屏障上TH的转运同样具有重要影响(图1)。
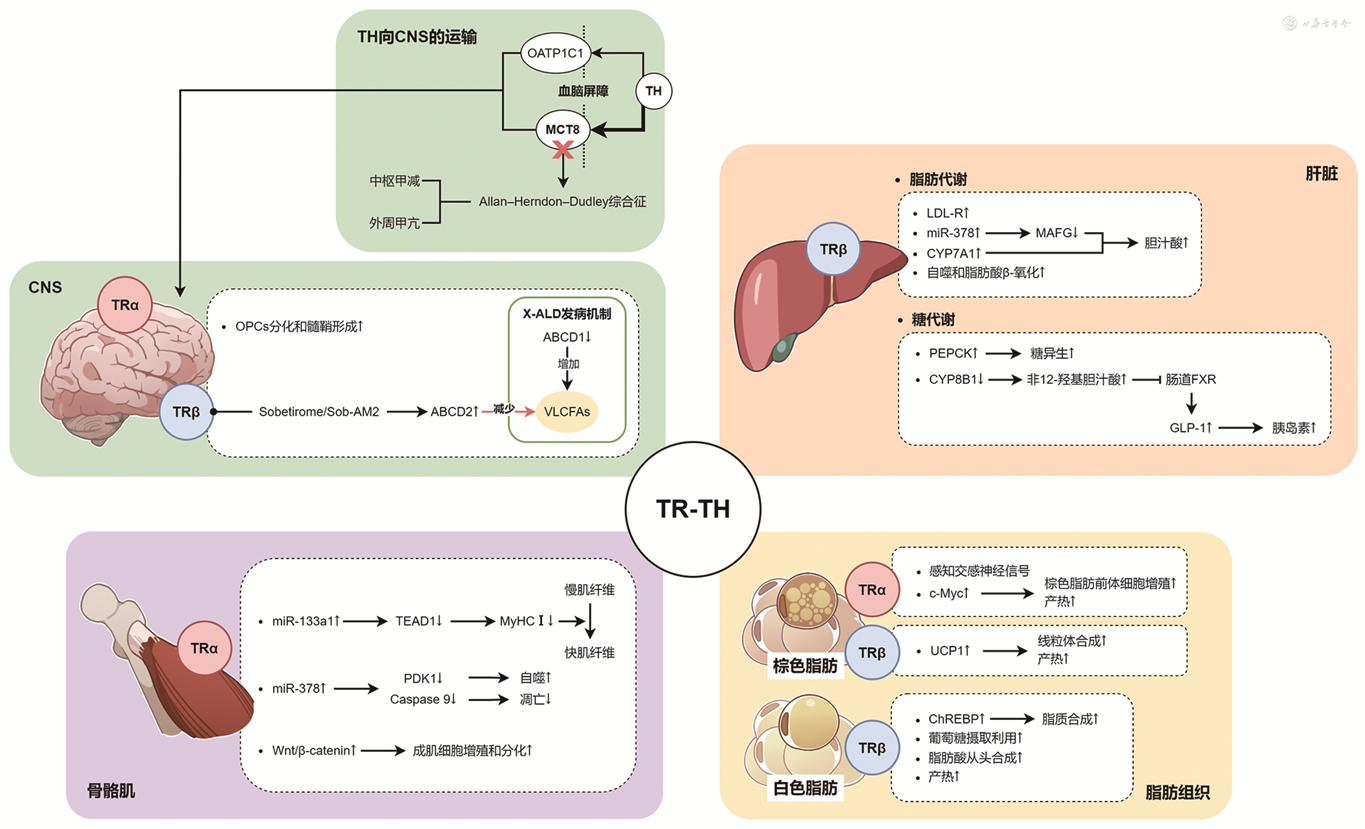

注:TR为甲状腺激素受体;TH为甲状腺激素;CNS为中枢神经系统;OATP1C1为有机阴离子转运蛋白1C1;MCT8为单羧酸转运体8;Allan-Herndon-Dudley综合征为MCT8基因突变导致的一种临床表现为中枢甲状腺功能减退和外周甲状腺毒症的遗传综合征;TRα为甲状腺激素受体α;TRβ为甲状腺激素受体β;OPCs为少突胶质细胞前体细胞;X-ALD为X连锁的肾上腺脑白质营养不良;ABCD为极长链脂酰辅酶A跨膜转运蛋白;VLCFAs为极长链脂肪酸;miR-133a1为微小RNA-133a1;TEAD1为TEA域家族成员1;MyHC Ⅰ为Ⅰ型肌球蛋白重链;miR-378为微小RNA-378;PDK1为磷酸肌醇依赖性蛋白激酶1;Caspase 9为半胱氨酸天冬氨酸蛋白酶9;LDL-R为低密度脂蛋白受体;MAFG为小Maf转录因子G:CYP7A1为胆固醇7α-羟化酶;PEPCK为磷酸烯醇式丙酮酸羧化激酶;CYP8B1为胆固醇12α-羟化酶;FXR为法尼醇X受体;GLP-1为胰高血糖素样肽-1;UCP1为1型解偶联蛋白;ChREBP为碳水化合物反应元件结合蛋白
数十年前,基于对甲状腺功能异常患者血脂变化的临床观察,研究者们产生了运用TH及其类似物治疗高胆固醇血症的设想。1957年Galioni等[31]发现使用甲状腺冻干粉可以降低人体血浆低密度脂蛋白胆固醇(LDL-C)水平,提示TH可能具有治疗血脂升高的潜力。但是非选择性TH类似物可激动肝外TR,引起心脏毒性、肌肉和骨质丢失等不良反应。因此,如何实现靶器官的选择性成为了深入研究的方向。20世纪80年代,L-94901等一批肝脏选择性TH类似物展现出降低啮齿动物血清胆固醇水平的疗效,且不伴心脏毒性[32]。在发现TR亚型后,主要存在于肝脏并介导脂质代谢的TRβ成为了药物研发的新靶点。
根据受体亚型,TR激动剂可分为TRβ选择性和TRα选择性。研究显示影响前者的结构基础是受体结构域内的Arg282、Arg320、Asn331、Gly332、Thr329和His435残基,而后者则是Ala225、Arg228、Met259、Arg262和His381残基[33]。目前药物研发主要着眼于TRβ选择性,以避免引起由TRα介导的不良反应,故本文主要介绍选择性TRβ激动剂(表1)。另外,根据所靶向的器官,TR激动剂目前可分为肝脏选择性和中枢选择性。

选择性TRβ激动剂Sobetirome、Eprotirome、VK2809和Resmetirom的研发情况
选择性TRβ激动剂Sobetirome、Eprotirome、VK2809和Resmetirom的研发情况
| 化合物名称 | 研发公司 | 适应证 | 临床研究阶段 |
|---|---|---|---|
| Sobetirome(GC-1) | QuatRx Pharmaceuticals | 高脂血症 | Ⅰ期临床 |
| 肾上腺脑白质营养不良 | Ⅰ/Ⅱ期临床 | ||
| Eprotirome(KB2115) | Karo Bio | 高胆固醇血症 | Ⅱ期临床 |
| 杂合子型家族性高胆固醇血症 | Ⅲ期临床(终止) | ||
| VK2809(MB07811) | Viking Therapeutics | 非酒精性脂肪性肝炎 | Ⅱ期临床 |
| 高胆固醇血症 | Ⅱ期临床 | ||
| Resmetirom(MGL-3196) | Madrigal Pharmaceuticals | 非酒精性脂肪性肝炎 | Ⅲ期临床(完成) |
1. Sobetirome(GC-1):Sobetirome是第一代选择性TRβ激动剂,合成于20世纪90年代,其与T3的不同之处主要在于分子远端苯环上的三个碘原子被异丙基取代。Sobetirome对TRβ的选择性是TRα的3~5倍,在动物模型中表现出良好的降脂能力,可降低甲减小鼠和高胆固醇血症大鼠的血清胆固醇和甘油三酯水平,还能在载脂蛋白E(ApoE)缺陷小鼠模型中通过降低动脉壁中胆固醇酯的水平来预防动脉粥样硬化,且对心脏和骨骼肌没有明显不良反应[34, 35]。在机制上,Sobetirome可通过增加肝细胞上高密度脂蛋白和LDL受体的活性直接促进肝外组织胆固醇的逆向转运,并能够促进肝内胆固醇向胆汁酸的转化[36],其降脂能力也可能由刺激棕色脂肪产热介导[16]。虽然在Ⅰ期临床试验中Sobetirome表现出良好的降LDL-C疗效[37],但由于缺乏资金,Sobetirome的临床研究已于2008年终止[3]。
基于TH对CNS中少突胶质细胞分化和髓鞘形成的促进作用[38],以及Sobetirome可以进入大脑的药代动力学特性[29],近年来,该药物也被试用于治疗CNS脱髓鞘疾病。研究发现,Sobetirome可以促进啮齿动物(体外和体内)和人类(体外)OPCs的分化[39]。Hartley等[40]进一步发现,Sobetirome能够促进髓鞘形成相关基因的转录表达,并且观察到Sobetirome在慢性脱髓鞘小鼠模型中表现出优于TH的髓鞘修复作用。X连锁的肾上腺脑白质营养不良是一种以肾上腺皮质功能不全和CNS脱髓鞘疾病为特征的遗传性疾病,由过氧化物酶体膜上负责跨膜转运极长链脂肪酸(VLCFAs)的极长链脂酰辅酶A跨膜转运蛋白1(ABCD1)功能丧失所致。研究发现,Sobetirome可以代偿性地上调肾上腺脑白质营养不良小鼠脑中编码同源过氧化物酶体转运蛋白的基因ABCD2,从而降低小鼠血液、外周器官和大脑中的VLCFAs [41]。这些发现展现了TRβ激动剂在CNS脱髓鞘疾病中的应用潜力。
2. Eprotirome(KB2115):Eprotirome是第1个用于治疗血脂异常并进入Ⅲ期临床试验阶段的TH类似物。Eprotirome对TRβ亚型的亲和力略高于TRα,并显示出肝脏选择性摄取,可能与肝脏特异性胆汁酸转运蛋白SLC10A1对其的有效转运有关[42]。多项研究表明,Eprotirome可降低受试者的血清LDL-C和载脂蛋白B水平,且不引起心脏和骨骼的不良反应;在垂体-甲状腺轴功能方面,Eprotirome给药仅造成T4水平下降,对促甲状腺激素及T3水平则没有影响[43, 44]。虽然Eprotirome在临床试验中能够有效纠正高胆固醇血症患者的各项血脂异常,但由于其对犬科动物软骨的损害[11],此项目已终止。同期一项Ⅲ期临床试验发现,Eprotirome可在短期给药后引起受试者肝酶和结合胆红素异常升高,表明其可能诱发肝损伤[45]。迄今为止,尚不清楚Eprotirome引起的肝脏不良反应是由于肝脏TR的不当激活,还是由于化合物本身的毒性所致[46]。
3. VK2809(MB07811):VK2809是一种靶向肝脏的选择性TRβ激动剂前药,在肝脏中由细胞色素P450激活,裂解产生TH类似物MB07344,由此规避对肝外TR的不当激活[47]。在动物模型[48]、Ⅰ期和Ⅱa期临床试验中,VK2809可显著降低血清LDL-C水平和肝脏脂肪含量,且具有良好的安全性和耐受性,未观察到明显肝损伤、心脏毒性或垂体-甲状腺轴异常[3]。目前正在开展VK2809的Ⅱb期VOYAGE研究,可能为NASH等多种脂质代谢相关疾病的治疗带来进展[11]。此外,Zhou等[49]发现VK2809还可以通过调节自噬、线粒体生物发生和脂肪酸β-氧化等途径,降低Ⅰa型糖原贮积病小鼠肝脏中的甘油三酯水平,为治疗不同疾病引起的肝脂肪变性提供了新视点。
4. Resmetirom(MGL-3196):Resmetirom具有肝脏选择性和显著的TRβ选择性,其对TRβ的选择性是TRα的28倍[50]。Resmetirom对肝脏的选择性由有机阴离子转运蛋白1B1(OATP1B1)的肝细胞特异性转运和本身的TRβ选择性共同介导[51]。在临床前、Ⅰ期及Ⅱ期临床试验中,Resmetirom均能有效改善健康受试者或NASH患者的血清LDL-C水平及其他血脂异常[52, 53]。在NASH和肝纤维化小鼠模型中,Resmetirom以不依赖减重的方式改善肝脏和全身脂质代谢,并下调肝纤维化相关基因的表达。值得注意的是,在上述研究中Resmetirom均未表现出明显肝损伤或心脏、骨骼不良反应,且不影响机体原有的甲状腺功能调控。而在最近公布的Ⅲ期临床试验中,Resmetirom能显著改善NASH受试者的血脂水平并减少肝脏脂肪,还能降低因NASH升高的肝酶[54]。Resmetirom具有良好的耐受性,副作用以轻至中度消化道不良反应为主,一般不会导致停药。2024年3月14日Resmetirom获得FDA批准,成为全球首个用于治疗NASH的药物[55]。
除了上述各种较为经典的选择性TRβ激动剂,还有更多药物正在研发中。如新型TRβ激动剂前药TG68及其活性化合物IS25,在小鼠模型中具有抗脂肪生成活性和保护肝脏的作用,且不伴有明显的肝外不良反应[56]。总之,此类研究有助于设计更特异、有效的肝脏选择性TRβ激动剂,为NASH、血脂异常等代谢性疾病提供候选治疗药物。
1. 靶向中枢的选择性TRβ激动剂:鉴于Sobetirome在CNS脱髓鞘疾病中的应用前景,研究者在其基础上研发出了具有更优CNS靶向性的Sob-AM2。和VK2809类似,Sob-AM2也是一种前药。Sobetirome因其带有的羧酸基团影响了通过血脑屏障的能力;而Sob-AM2将前者的羧酸基团替换为N-甲基酰胺,能够更好地通过血脑屏障,然后在CNS中被脂肪酸酰胺水解酶选择性水解并转化为Sobetirome,由此在全身给药的条件下达到CNS分布增加、外周暴露减少的效果[57]。与相同剂量和给药途径的Sobetirome相比,Sob-AM2可以使CNS中Sobetirome的水平增加2~4倍[58]。
在生物学效应方面,Bárez-López等[29]发现Sob-AM2不需要MCT8的转运即可进入CNS,能够激动中枢的TRβ,同时导致循环T4和T3水平下降,因此Sob-AM2可能改善MCT8基因突变所致的Allan-Herndon-Dudley综合征。而在慢性脱髓鞘小鼠模型中,Sob-AM2可以显著改善临床症状并修复髓鞘,而直接给予TH则会抑制内源性髓鞘修复并加重疾病[40]。在同样以CNS脱髓鞘病变为病理表现的Pitt-Hopkins综合征小鼠模型中,Sob-AM2也能使OPCs与少突胶质细胞的密度恢复正常[59]。综上所述,Sob-AM2作为一种能通过血脑屏障并具有CNS特异性分布特征的选择性TRβ激动剂,为治疗各种CNS脱髓鞘疾病提供了新思路。
2. 靶向脂肪组织的脂质纳米颗粒递送T3:将T3选择性地递送到脂肪组织同样可以降低脱靶引起的副作用。Chen等[60]首次制备了装载T3的脂质纳米颗粒,并通过脂肪组织归巢肽修饰纳米颗粒,从而将T3靶向递送到脂肪组织中,同时避免了T3对心血管和骨骼的不良反应。这种脂质纳米颗粒克服了全身性T3给药对交感神经系统的反馈抑制作用,促进了白色脂肪组织的耗能产热,同时还能重塑白色脂肪组织的表型,减轻炎症并增加脂联素水平,由此减轻体重、改善小鼠的糖耐量以及胰岛素抵抗。此外,装载T3的脂质纳米颗粒还能通过不依赖于减重的方式缓解ApoE缺陷小鼠的高胆固醇血症和动脉粥样硬化。这种创新性的设计提供了改善脂肪组织代谢的新思路,同时也印证了靶向激活脂肪组织TR有助于治疗代谢性疾病的观点。
3. 靶向肝脏的胰高血糖素/T3杂交偶联物:肽类激素主要通过与细胞表面的特异性受体结合,内化并激活下游信号通路来发挥生物学作用。这些特异性受体的表达往往具有组织特异性,例如胰高血糖素的受体主要在肝脏中表达。将分子量较小的化合物与分子量较大的多肽类激素共价连接构建的杂交偶联物,能够将小分子特异性地递送到表达肽类激素受体的靶器官中[61]。基于上述思路,Finan等[62]创新性地合成了胰高血糖素/T3杂交偶联物,发现该偶联物能够特异性地靶向作用于肝脏,改善高脂饮食诱导的肥胖小鼠的高脂血症、脂肪肝、糖代谢异常,并减轻体重。由胰高血糖素受体介导的肝脏选择性摄取避免了T3作用于心血管系统及骨骼系统导致的各种不良反应,而靶向作用于肝脏的T3则同时抵消了胰高血糖素的升糖作用。尽管这种偶联物还需要更多的深入研究,但其设计思路为治疗各种内分泌代谢疾病开辟了一个新的领域。
综上,近年来选择性TR激动剂的研究不断进展,新研发的器官选择性和(或)TRβ选择性激动剂在基础和临床试验中展现出乐观的结果,有望成为代谢性疾病的候选药物。其中Resmetirom、Sobetirome和VK2809的临床试验均在治疗血脂异常和NASH方面获得了阳性结果,且未发现明显的肝损伤或甲状腺毒症相关的不良反应。而在器官靶向性的研究方面,前药策略为药物研发提供了可行的途径。VK2809以肝脏靶向性为设计目标,正在进行Ⅱb期临床试验以进一步评估药效及安全性,而Sob-AM2以CNS靶向性为设计目标,在脱髓鞘疾病中的治疗前景值得期待。靶向脂肪的T3脂质体和胰高血糖素/T3杂交偶联物也为实现T3的靶向递送以及在靶器官中发挥协同作用提供了新的视角,并为将来的药物研发开辟了新的方向。
陈沛文, 陈晶晶, 应浩, 等. 甲状腺激素受体及其选择性激动剂的研究进展[J]. 中华医学杂志, 2024, 104(20): 1881-1887. DOI: 10.3760/cma.j.cn112137-20231130-01252.
所有作者声明不存在利益冲突



























