
探讨脊柱-骨盆矢状面参数和腰椎前凸分布指数对短节段腰椎融合术后邻近节段退变(adjacent segment degeneration,ASD)的影响。
回顾性分析2009年1月至2019年1月南京医科大学附属常州市第二人民医院和南京大学医学院附属鼓楼医院因腰椎退变性疾病接受后路椎间融合手术的患者234例,男102例、女132例,年龄(60.1±10.0)岁(范围41~78岁)。根据术后是否出现ASD分为ASD组和无ASD组。比较两组患者的一般资料及手术前后的骨盆入射角(pelvic incidence,PI)、骶骨倾斜角(sacral slope,SS)、骨盆倾斜角(pelvic tilt,PT)、腰椎前凸角(lumbar lordosis,LL)、下腰椎前凸角(distal lordosis,DL)、融合节段前凸角(segmental lordosis,SL)、腰椎前凸分布指数(lordosis distribution index,LDI)和矢状面平衡(sagittal vertical axis,SVA)。采用二分类logistic回归分析腰椎融合术后发生ASD的独立危险因素。绘制受试者工作特征曲线(receiver operating characteristic curve,ROC),计算各独立危险因素的曲线下面积。
所有患者均顺利完成手术并获得随访,随访时间为(70.6±11.9)个月(范围60~121个月)。234例患者中116例术后发生ASD。ASD组与无ASD组年龄(t=2.697,P=0.008)、融合节段(χ2=16.439,P<0.001)、术前PT(t=2.268,P=0.024)、术前LL(t=2.042,P=0.042)、术前DL(t=2.724,P=0.007)、术后DL(t=3.104,P=0.002)、术后LDI(t=2.063,P=0.040)及手术前后SVA差值(Z=2.001,P=0.045)的差异有统计学意义。二分类logistic回归分析结果显示术后LDI降低(OR=0.971,P=0.002)、双节段融合(OR=3.477,P<0.001)、手术前后SVA差值增加(OR=0.992,P=0.039)是腰椎融合术后发生ASD的独立危险因素。ROC曲线显示融合节段数、术后LDI、手术前后SVA差值的曲线下面积及95%CI分别为0.633(0.561,0.704)、0.583(0.510,0.656)和0.576(0.502,0.649)。联合预测模型的曲线下面积为0.702,预测价值为中。
双节段融合、术后LDI降低、手术前后SVA差值增加是腰椎融合术后发生ASD的独立危险因素,三者联合预测具有良好的预测效能。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
腰椎椎间融合术已广泛应用于治疗腰椎退行性疾病,能够有效缓解椎管狭窄或不稳引起的腰腿痛和活动受限[1]。然而,椎间融合可能引起相邻节段活动度增大和生物力学改变,从而导致邻近节段退变(adjacent segment degeneration,ASD)[2]。ASD会降低患者术后中远期的临床疗效,成为椎间融合术后翻修的主要原因。
为寻找可能的预防方法,既往研究已经提出了很多ASD的相关危险因素。目前,越来越多的学者开始关注异常的脊柱-骨盆矢状面形态对ASD发生发展的作用。有研究证实在进行腰椎融合手术时,维持或恢复正常的脊柱-骨盆矢状面形态能够有效预防术后ASD的发生[3]。Schwab等[4]提出骨盆入射角(pelvic incidence,PI)与腰椎前凸角(lumbar lordosis,LL)之差<10°为理想的矢状面形态,并在成人脊柱畸形患者中进行了验证。随后有研究进一步证实了PI-LL不匹配与ASD之间的关系,提出采用二者差值预测ASD的发生具有一定局限[5]。不同人群PI-LL的阈值存在差异,所以固定的正常范围无法应用于所有人群[5,6]。随着年龄的增长,矢状面形态参数的理想范围也会发生变化[7]。因此,Lafage等[8]建立并验证了基于年龄校正的理想脊柱-骨盆矢状面参数。Seok等[9]使用年龄校正的PI-LL建立了矢状面平衡的标准,并分析了ASD患者翻修手术后矢状面失衡加重的危险因素。
有学者指出在腰椎融合手术中仅关注整体前凸大小而忽视前凸比例是不合理的[10,11]。腰椎退变性疾病的典型特征是下腰椎前凸减少以及骨盆后旋,这一变化使上下腰椎前凸比例出现异常,从而发生腰椎-骨盆形态不匹配,最终导致术后并发症的发生[10]。腰椎前凸分布指数(lordosis distribution index,LDI)是一种新型矢状面形态参数,用于评估下腰椎前凸占整体前凸的比例[5]。LDI是脊柱整体形态与平衡评分的组成部分之一,最初用于评估脊柱-骨盆矢状面平衡以及预测成人脊柱畸形手术后的机械性并发症[12]。Zheng等[13]研究发现短节段腰椎融合术后LDI异常的患者更容易发生ASD。既往文献证实PI与LDI呈线性负相关[14],这表明LDI的正常值范围同样会随着PI的变化而变化,使用固定理想值评估脊柱-骨盆矢状面平衡仍不准确。
本研究回顾性分析因腰椎退变性疾病接受短节段腰椎融合术的患者,观察其影像学资料及术后并发症情况。研究目的:(1)分析腰椎融合术后发生ASD的危险因素;(2)探讨基于年龄校正的PI-LL和LDI等脊柱-骨盆矢状面参数对腰椎融合术后ASD发生的影响。
纳入标准:(1)因腰椎退行性疾病接受单节段或双节段经椎间孔腰椎椎间融合(transforaminal lumbar interbody fusion, TLIF)及后路椎弓根螺钉内固定治疗;(2)初次手术年龄为30~80岁。
排除标准:(1)既往有腰椎手术史、外伤史、肿瘤史或感染病史;(2)腰椎侧凸Cobb角>10°;(3)术后发生急性或迟发性深部感染;(4)临床资料不全或随访时间<5年。
回顾性分析2009年1月至2019年1月南京医科大学附属常州市第二人民医院(69例)和南京大学医学院附属鼓楼医院(165例)因腰椎退变性疾病接受腰椎后路椎间融合手术的患者234例,男102例、女132例,初次手术年龄为(60.1±10.0)岁(范围41~78岁)。术前诊断:腰椎间盘突出症38例、腰椎管狭窄症30例、退变性滑脱62例、崩裂性滑脱28例、合并两种及以上诊断76例。融合节段:单节段(L4,5)118例、双节段(L3~L5)116例。术前合并疾病:冠心病34例、糖尿病53例、高血压150例、脑梗死8例、骨质疏松症12例。术前均摄站立位全脊柱正侧位X线片、腰椎CT及MRI,评估关节突关节及椎间盘退变程度,测量脊柱矢状面参数。根据术后是否出现ASD分为ASD组(118例)和无ASD组(116例)。
本研究经常州第二人民医院[(2022)KY316-01]和南京鼓楼医院(2019-029-01)伦理委员会批准,所有患者或家属均签署知情同意书。
患者全身麻醉,俯卧位,腹部悬空。常规消毒、铺巾。取后正中切口,切开皮肤、皮下组织及腰背筋膜。沿棘突两侧剥离椎旁肌肉至关节突外侧,暴露固定节段的上下关节突及椎弓根进针点。在"C"型臂X线机辅助下置入椎弓根螺钉,使用超声骨刀去除相应节段的椎板、关节突,清除黄韧带、纤维环、髓核,确保神经根得到充分减压。处理软骨终板,植入碎骨粒至椎间隙,放置椎间融合器,连接并锁紧椎弓根螺钉[15,16]。透视确认螺钉和融合器位置满意,再次探查神经根及硬膜。生理盐水冲洗术区,彻底止血。切口内放置引流管,逐层缝合,无菌敷料包扎。
患者术后3、6、12、24、60个月于门诊随访,摄站立位全脊柱正侧位X线片,测量脊柱-骨盆矢状面参数,末次随访时摄腰椎MRI及腰椎动力位X线片,评估ASD的发生并测量影像学指标。
ASD的诊断标准:(1)站立位全脊柱侧位X线片示椎间隙高度下降>3 mm[3];(2)站立位全脊柱侧位X线片示椎体前或后滑移进行性增加>3 mm[3,17];(3)邻近节段过伸位与过屈位X线片示上、下终板夹角变化>10°或椎体滑移距离变化量>3 mm[18,19];(4)腰椎MRI示椎间盘退变进展≥1级[19];(5)腰椎间盘突出症加重。满足以上任意一项即可诊断为ASD。
基于腰椎MRI采用Pfirrmann分级[20]评估椎间盘退变程度:1级,结构均质、亮白高信号,椎间盘高度正常;2级,结构不均质、白色高信号,可有水平带,髓核与纤维环分界清晰,椎间盘高度正常;3级,结构不均质、灰色中等信号,髓核与纤维环分界不清晰,椎间盘高度轻度减低;4级,结构不均质、灰黑低信号,髓核与纤维环分界消失,椎间盘高度中度减低;5级,结构不均质、黑色低信号,髓核与纤维环分界消失,椎间隙塌陷。
基于术前腰椎CT评估关节突关节退变程度:0级,关节突关节间隙正常(2~4 mm);1级,关节突关节间隙<2 mm、关节突轻度增生;2级,关节突关节间隙进一步变窄、中度关节突增生、轻度下关节突骨侵蚀;3级,关节突关节间隙明显变窄、重度关节突增生、中度下关节突骨侵蚀[21]。
C7铅垂线至骶骨后上角的水平距离。C7铅垂线位于骶骨后上角前方为正值,后方为负值。
S1上缘中点至股骨头中心点连线与S1上缘中垂线的夹角,用于评估骨盆的旋转能力及矢状面失平衡的代偿能力。
S1上缘与水平线之间形成的夹角,用于评估骶骨的倾斜程度。
S1上缘中点至双侧股骨头中点的连线与铅垂线的夹角,用于评估骨盆的倾斜程度。
L1椎体上终板延长线与S1椎体上终板延长线间的夹角,前凸记为正值,后凸记为负值,用于评估腰椎前凸的程度。
L4锥体上终板与S1锥体上终板的夹角,用于评估下腰椎前凸的程度。
L4~S1前凸占L1~S1前凸的百分比。
融合节段上端固定椎上终板与下端固定椎下终板间的夹角。
骨盆入射角与腰椎前凸角的差值,≤10°为匹配,>10°为不匹配。
(年龄-55)/2+3。实际PI-LL和年龄校正PI-LL差值的正常值为-10°~10°,≤-10°为矫正不足,≥10°为矫正过度。
腰椎过伸位与过屈位X线片上同一椎间隙上位椎体下终板与下位椎体上终板切线夹角的差值。
过伸位与过屈位X线片上同一节段上位椎体相对于下位椎体滑移距离的差值。
采用SPSS 25.0统计学软件(SPSS公司,美国)进行统计学分析。年龄、体质指数、椎间隙高度、手前和术后PT、PI、SS、LL、DL、SL、LDI和手术前后PT差值经正态性检验服从正态分布和方差齐性,采用 ±s表示,组间比较采用独立样本t检验。术前和术后SVA、手术前后PI、SS、LL、DL、SL、LDI及SVA差值经正态性检验不服从正态分布,采用M(Q1,Q3)表示,组间比较采用Mann-Whitney U检验。性别、融合节段、关节突关节退变分级、椎间盘退变分级、合并疾病等计量资料采用频数(例,%)表示,组间比较采用χ2检验。将组间差异有统计学意义的指标纳入二分类logistic回归分析,观察腰椎融合术后发生ASD的独立危险因素。检验水准α值取双侧0.05。
±s表示,组间比较采用独立样本t检验。术前和术后SVA、手术前后PI、SS、LL、DL、SL、LDI及SVA差值经正态性检验不服从正态分布,采用M(Q1,Q3)表示,组间比较采用Mann-Whitney U检验。性别、融合节段、关节突关节退变分级、椎间盘退变分级、合并疾病等计量资料采用频数(例,%)表示,组间比较采用χ2检验。将组间差异有统计学意义的指标纳入二分类logistic回归分析,观察腰椎融合术后发生ASD的独立危险因素。检验水准α值取双侧0.05。
绘制腰椎融合术后发生ASD的受试者工作特征(receiver operating characteristic,ROC)曲线,计算各独立危险因素的曲线下面积(area under curve,AUC)和95%CI、灵敏度及特异度。0.5<AUC<0.7为预测价值差,0.7≤AUC<0.8为预测价值中,0.8≤AUC<0.9为预测价值良,AUC≥0.9为预测价值优。使用Pearson或Spearman相关分析观察术后矢状面参数与PI之间的相关性。
234例患者随访时间为(70.6±11.9)个月(范围60~121个月)。至末次随访时118例(50.4%)患者发生ASD。影像学表现为腰椎间盘突出或椎间隙塌陷4例、腰椎不稳22例、腰椎后滑脱40例、腰椎管狭窄症28例、腰椎间盘退变加重24例。ASD组患者年龄和接受双节段融合的构成比大于无ASD组,差异有统计学意义(P<0.05,表1);两组性别、体质指数、术前椎间隙高度、关节突关节退变分级、椎间盘退变分级及术前合并疾病的差异均无统计学意义(P>0.05,表1)。
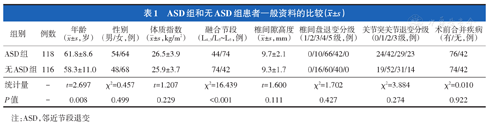
ASD组和无ASD组患者一般资料的比较( ±s)
±s)
ASD组和无ASD组患者一般资料的比较( ±s)
±s)
| 组别 | 例数 | 年龄( ±s,岁) ±s,岁) | 性别(男/女,例) | 体质指数( ±s,kg/m2) ±s,kg/m2) | 融合节段(L4,5/L3~L5,例) | 椎间隙高度( ±s,mm) ±s,mm) | 椎间盘退变分级(1/2/3/4/5级,例) | 关节突关节退变分级(0/1/2/3级,例) | 术前合并疾病(有/无,例) |
|---|---|---|---|---|---|---|---|---|---|
| ASD组 | 118 | 61.8±8.6 | 54/64 | 26.5±3.9 | 44/74 | 9.7±2.1 | 0/10/66/42/0 | 24/42/29/23 | 76/42 |
| 无ASD组 | 116 | 58.3±11.0 | 48/68 | 25.9±3.7 | 74/42 | 9.3±1.7 | 0/16/60/40/0 | 19/52/31/14 | 74/42 |
| 统计量 | - | t=2.697 | χ2=0.457 | t=1.207 | χ2=16.439 | t=1.600 | χ2=1.702 | χ2=3.884 | χ2=0.010 |
| P值 | - | 0.008 | 0.499 | 0.229 | <0.001 | 0.111 | 0.427 | 0.274 | 0.922 |
注:ASD,邻近节段退变
ASD组患者术前PT为19.3°±7.8°,大于无ASD组的17.0°±7.6°。ASD组术前LL和DL分别为41.8°±13.6°和26.2°±9.9°,小于无ASD组的45.0°±10.7°和29.5°±8.6°,差异有统计学意义(P<0.05,表2)。两组术前PI、SS、SL、LDI和SVA的差异均无统计学意义(P>0.05,表2)。
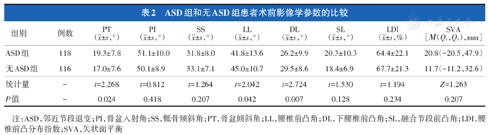
ASD组和无ASD组患者术前影像学参数的比较
ASD组和无ASD组患者术前影像学参数的比较
| 组别 | 例数 | PT( ±s,°) ±s,°) | PI( ±s,°) ±s,°) | SS( ±s,°) ±s,°) | LL( ±s,°) ±s,°) | DL( ±s,°) ±s,°) | SL( ±s,°) ±s,°) | LDI( ±s,%) ±s,%) | SVA[Μ(Q1,Q3),mm] |
|---|---|---|---|---|---|---|---|---|---|
| ASD组 | 118 | 19.3±7.8 | 51.1±10.0 | 31.8±8.0 | 41.8±13.6 | 26.2±9.9 | 20.3±10.3 | 64.4±22.1 | 20.8(-20.5,47.9) |
| 无ASD组 | 116 | 17.0±7.6 | 50.1±8.9 | 33.1±7.1 | 45.0±10.7 | 29.5±8.6 | 18.4±6.9 | 67.7±21.3 | 11.7(-11.2,32.6) |
| 统计量 | - | t=2.268 | t=0.812 | t=1.264 | t=2.042 | t=2.724 | t=1.530 | t=1.194 | Z=1.263 |
| P值 | - | 0.024 | 0.418 | 0.207 | 0.042 | 0.007 | 0.128 | 0.234 | 0.207 |
注:ASD,邻近节段退变;PI,骨盆入射角;SS,骶骨倾斜角;PT,骨盆倾斜角;LL,腰椎前凸角;DL,下腰椎前凸角;SL,融合节段前凸角;LDI,腰椎前凸分布指数;SVA,矢状面平衡
ASD组患者术后DL和LDI分别为28.5°±8.0°和62.3%±15.8%,小于无ASD组的31.9°±8.6°和66.5%±15.3%,差异有统计学意义(P<0.05,表3)。两组术前PT、PI、SS、LL、SL和SVA的差异均无统计学意义(P>0.05,表3)。
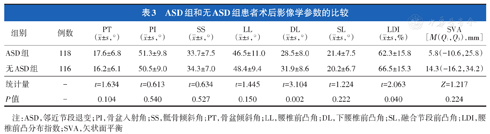
ASD组和无ASD组患者术后影像学参数的比较
ASD组和无ASD组患者术后影像学参数的比较
| 组别 | 例数 | PT( ±s,°) ±s,°) | PI( ±s,°) ±s,°) | SS( ±s,°) ±s,°) | LL( ±s,°) ±s,°) | DL( ±s,°) ±s,°) | SL( ±s,°) ±s,°) | LDI( ±s,%) ±s,%) | SVA[Μ(Q1,Q3),mm] |
|---|---|---|---|---|---|---|---|---|---|
| ASD组 | 118 | 17.6±6.8 | 51.3±9.8 | 33.7±7.5 | 46.5±11.0 | 28.5±8.0 | 21.4±7.5 | 62.3±15.8 | 5.8(-10.6,25.8) |
| 无ASD组 | 116 | 16.2±6.1 | 50.5±9.0 | 34.3±7.0 | 48.4±9.4 | 31.9±8.6 | 20.2±6.7 | 66.5±15.3 | 14.3(-16.2,34.2) |
| 统计量 | - | t=1.634 | t=0.613 | t=0.634 | t=1.445 | t=3.104 | t=1.224 | t=2.063 | Z=1.217 |
| P值 | - | 0.104 | 0.540 | 0.527 | 0.150 | 0.002 | 0.222 | 0.040 | 0.224 |
注:ASD,邻近节段退变;PI,骨盆入射角;SS,骶骨倾斜角;PT,骨盆倾斜角;LL,腰椎前凸角;DL,下腰椎前凸角;SL,融合节段前凸角;LDI,腰椎前凸分布指数;SVA,矢状面平衡
ASD组患者手术前后SVA差值为-9.2(-38.2±9.6) mm,大于无ASD组的-4.7(-19.7±21.7) mm,差异有统计学意义(P<0.05,表4)。两组手术前后PT、PI、SS、LL、DL、SL和LDI差值的差异均无统计学意义(P>0.05,表4)。
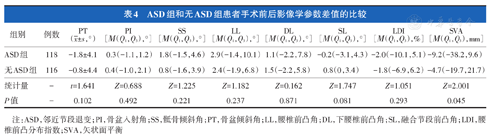
ASD组和无ASD组患者手术前后影像学参数差值的比较
ASD组和无ASD组患者手术前后影像学参数差值的比较
| 组别 | 例数 | PT( ±s,°) ±s,°) | PI[Μ(Q1,Q3),°] | SS[Μ(Q1,Q3),°] | LL[Μ(Q1,Q3),°] | DL[Μ(Q1,Q3),°] | SL[Μ(Q1,Q3),°] | LDI[Μ(Q1,Q3),%] | SVA[Μ(Q1,Q3),mm] |
|---|---|---|---|---|---|---|---|---|---|
| ASD组 | 118 | -1.8±4.1 | 0.3(-1.1,1.2) | 1.8(-1.5,4.6) | 2.9(-1.4,10.1) | 1.1(-2.2,7.8) | -0.2(-3.1,4.3) | -2.0(-10.1,5.1) | -9.2(-38.2,9.6) |
| 无ASD组 | 116 | -0.8±4.4 | 0.4(-1.0,2.1) | 0.8(-1.6,3.9) | 2.4(-1.9,6.8) | 1.5(-2.2,5.8) | 0.8(0,3.4) | -1.8(-6.9,6.2) | -4.7(-19.7,21.7) |
| 统计量 | - | t=1.641 | Z=0.688 | Z=1.225 | Z=1.182 | Z=0.162 | Z=1.747 | Z=1.051 | Z=2.001 |
| P值 | - | 0.102 | 0.492 | 0.221 | 0.237 | 0.871 | 0.081 | 0.293 | 0.045 |
注:ASD,邻近节段退变;PI,骨盆入射角;SS,骶骨倾斜角;PT,骨盆倾斜角;LL,腰椎前凸角;DL,下腰椎前凸角;SL,融合节段前凸角;LDI,腰椎前凸分布指数;SVA,矢状面平衡
ASD组86例术后PI-LL≤10°,32例术后PI-LL>10°;无ASD组94例术后PI-LL≤10°,22例术后PI-LL>10°,构成比的差异无统计学意义(χ2=2.190,P=0.139 )。
ASD组18例术后年龄校正PI-LL<10°,70例为-10°~10°,30例>10°;无ASD组10例术后年龄校正PI-LL<10°,78例为-10°~10°,28例>10°,构成比的差异无统计学意义(χ2=2.770,P=0.250 )。
将年龄、融合节段、术前PT、术前LL、术前DL、术后DL、术后LDI、手术前后SVA差值纳入腰椎融合术后发生ASD的二分类logistic回归分析,结果显示双节段融合(OR=3.477,P<0.001)、术后LDI降低(OR=0.971,P=0.002)、手术前后SVA差值增加(OR=0.992,P=0.039)是腰椎融合术后发生ASD的独立危险因素(表5)。
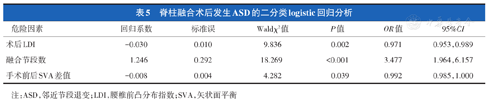
脊柱融合术后发生ASD的二分类logistic回归分析
脊柱融合术后发生ASD的二分类logistic回归分析
| 危险因素 | 回归系数 | 标准误 | Waldχ2值 | P值 | OR值 | 95%CI |
|---|---|---|---|---|---|---|
| 术后LDI | -0.030 | 0.010 | 9.836 | 0.002 | 0.971 | 0.953,0.989 |
| 融合节段数 | 1.246 | 0.292 | 18.269 | <0.001 | 3.477 | 1.964,6.157 |
| 手术前后SVA差值 | -0.008 | 0.004 | 4.282 | 0.039 | 0.992 | 0.985,1.000 |
注:ASD,邻近节段退变;LDI,腰椎前凸分布指数;SVA,矢状面平衡
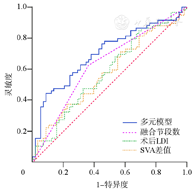
绘制独立危险因素预测腰椎融合术后发生ASD的ROC曲线并计算AUC,结果显示融合节段数、术后LDI、手术前后SVA差值的曲线下面积及95%CI分别为0.633(0.561,0.704)、0.583(0.510,0.656)和0.576(0.502,0.649)。联合预测模型的曲线下面积为0.702,预测价值为中(图1)。

Pearson和Spearman相关性分析结果显示,年龄与SVA(rp=0.192,P=0.003)及年龄校正PI-LL(rs= 0.429,P<0.001)呈正相关。PI与PT(rs=0.612,P<0.001)、SS(r=0.727,P<0.001)、LL(r=0.479,P<0.001)、SL(rs=0.395,P<0.001)、PI-LL(rs=0.418,P<0.001)、年龄校正PI-LL(rs=0.416,P<0.001)及SVA(rp=0.160,P=0.014)呈正相关,与LDI(rs=-0.300,P<0.001)呈负相关,与DL(rs=0.098,P=0.133)无相关性。
既往很多文献报道了脊柱融合术后发生ASD的危险因素。本研究结果显示年龄、融合节段数以及脊柱-骨盆矢状面形态参数与ASD的发生密切相关。尽管有研究已经证实了异常的脊柱矢状面形态在ASD发展过程中具有重要作用,但是关于正常矢状面形态的定义仍然存在争议。Senteler等[6]的生物力学模型证实,PI-LL≥15°是ASD接受翻修手术的危险因素。Rothenfluh等[22]同样发现接受腰椎后外侧融合术的患者中,PI-LL不匹配(>10°)组发生ASD的风险比匹配组高10倍。然而,Toivonen等[23]的一项为期10年随访研究证实,术后PI-LL>9°并不会增加ASD翻修手术的风险。本研究结果证实PI-LL不是腰椎融合术后发生ASD的危险因素,与既往研究结果相似。
Spearman相关性分析结果显示PI-LL与PI存在正相关,对不同PI值的患者PI-LL的理想范围存在差异。因此,仅通过PI-LL<10°这一指标不能有效降低术后ASD的发生率。有学者指出在进行矢状面矫正时,需充分考虑年龄引起的退行性变化,并根据不同年龄段制定相应的理想参考值[7]。有文献报道使用基于年龄校正的理想脊柱-骨盆矢状面参数可有效评估术后ASD的发生风险[24]。因此,有学者将年龄校正的PI-LL应用于腰椎退行性疾病手术前后矢状面失平衡的评估。Seok等[9]发现基于年龄校正PI-LL评估接受后路翻修手术的ASD患者时,矫正不足组术前的矢状面失衡通常比矫正理想组的患者更严重。然而,本研究发现年龄仅与年龄校正PI-LL和SVA存在相关性。此外,本研究结果显示术后矫正过度(差值>10°)或矫正不足(差值<-10°)并不会显著增加ASD的发生率。因此,将理想差值定义为-10°~10°并不能代表理想的脊柱矢状面形态,临床中应慎重使用。
腰椎退行性疾病最常见于下腰椎,可导致DL明显降低以及矢状面严重失衡。因此,下腰椎融合手术是治疗退行性疾病的主要手术方式[1,16]。腰椎融合手术中恢复理想的DL和腰椎前凸比例可显著降低腰椎融合术后并发症的发生率。Bari等[14]研究证实接受腰椎融合手术的患者中,腰椎前凸比例异常会导致术后翻修的风险显著升高。Zheng等[13]纳入了200例因腰椎退行性疾病接受L4~S1融合手术的患者,结果显示术后LDI值较低的患者ASD的发生率更高。本研究结果显示术后较低的LDI是ASD发生的独立危险因素。ROC曲线结果显示融合节段数、术后LDI、手术前后SVA差值的曲线下面积及95%CI分别为0.633(0.561,0.704)、0.583(0.510,0.656)和0.576(0.502,0.649)。联合预测模型的曲线下面积为0.702,预测价值为中。
既往研究发现DL在不同PI的人群中无差异,随着PI增大,上腰椎前凸增加是导致整体前凸增加的主要原因,因此PI与LDI呈负相关[25]。本研究也发现类似的结果,这说明不同PI患者DL重建目标可能是相同的,50%~80%并不能作为LDI的理想值范围。当脊柱柔韧性降低时,腰椎前凸减少后骨盆后旋是最先出现且唯一的代偿方式[26]。如果手术未能达到理想的DL和LDI,则骨盆后旋和矢状面失衡将难以逆转,最终导致平背综合征[27]。当脊柱具有一定柔韧性时,邻近节段椎体会过度张开以代偿丢失的腰椎前凸[26]。如果术后DL没有得到足够的矫正,为维持整体SVA,邻近节段会持续过度张开甚至出现后滑脱。虽然这种代偿机制能够维持SVA在正常范围内,但会显著增加脊柱后方结构承受的负荷,久而久之发生ASD[26]。
本研究尚存在一定局限:(1)虽然分析了患者一般资料及矢状面平衡参数对ASD的影响,但仍缺乏其他相关危险因素,如椎旁肌萎缩程度、脂肪浸润程度和骨密度等;(2)样本量较小,结果的可靠性一般。为提高结论的可信度,需进一步纳入更多患者来验证本研究结果;(3)随访时间较短,ASD的发生率随着时间的延长而不断增高。末次随访时未发生ASD的患者在后续长期随访过程中仍有可能发展为ASD。
预后研究Ⅳ级
所有作者均声明无利益冲突



























