
比较阿扎胞苷联合维奈克拉或CAG方案对初治老年急性髓系白血病(AML)的疗效和安全性。
回顾性队列研究。回顾性分析2018年5月至2023年8月大同市第五人民医院收治的34例老年初治AML患者的临床资料。依据治疗方案将患者分为维奈克拉组(阿扎胞苷+维奈克拉,17例)和CAG组(阿扎胞苷+CAG方案,17例)。比较两组患者的临床特征、疗效、不良反应及生存情况。
两组临床资料比较,差异均无统计学意义(均P>0.05)。维奈克拉组完全缓解率和客观反应率分别为70.6%(12/17)、82.4%(14/17),均高于CAG组的47.1%(8/17)、64.7%(11/17),但两组差异均无统计学意义(χ2=2.00,P=0.163;χ2=2.00,P=0.244)。患者随访时间[M(Q1,Q3)]为25.4个月(7.2个月,60.3个月)。至随访结束,34例患者中19例生存(维奈克拉组13例,CAG组6例),15例死亡(维奈克拉组4例,CAG组11例)。维奈克拉组和CAG组中位总生存时间分别为14.22个月(95% CI:8.2~60.3个月)和10.56个月(95% CI:7.2~50.2个月),中位无进展生存时间分别为9.97个月(95% CI:5.4~40.5个月)和6.82个月(95% CI:5.0~36.2个月),两组总生存、无进展生存时间差异均无统计学意义(均P>0.05)。维奈克拉组和CAG组分别有16、14例患者发生3~4级血液学不良反应。两组粒细胞缺乏时间、血小板缺乏时间、感染及出血发生率比较,差异均无统计学意义(均P>0.05)。
阿扎胞苷联合维奈克拉或CAG方案治疗老年初治AML患者均有较好的临床效果和安全性。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
急性髓系白血病(AML)好发于老年人群,且随着年龄增长,发病率也逐渐升高[1]。AML治疗以化疗和靶向治疗为主,预后中等和不良患者需进行异基因造血干细胞移植,但移植受年龄限制,所以老年患者治疗多以化疗为主。由于老年患者存在体能状态相对较差、基础疾病相对较多及耐药等因素,大多不能耐受标准剂量化疗[2]。去甲基化药物是针对不适合强化疗的新诊断老年AML患者一种新的治疗方法[3]。去甲基化药物单药疗效较差,以去甲基化药物为主的联合方案不良反应相对较轻,是老年AML患者目前的最佳选择。阿扎胞苷联合CAG[阿糖胞苷+阿柔比星+重组人粒细胞集落刺激因子(G-CSF)]方案和阿扎胞苷联合维奈克拉是目前临床上较为常用的方案。本研究对比阿扎胞苷联合维奈克拉或CAG方案治疗老年初治AML患者的效果和安全性。
纳入标准:(1)参照世界卫生组织(WHO)2016造血和淋巴组织肿瘤分类标准,明确诊断为成年人AML(非急性早幼粒细胞白血病)[4];(2)年龄≥60岁,初治;(3)美国东部肿瘤协作组(ECOG)体能状态评分0~2分,重要器官功能无明显异常;(4)治疗前进行充分医患沟通,沟通内容包括化疗方案的选择、化疗过程及化疗后可能出现的不良反应,患者或家属考虑选择采用阿扎胞苷+维奈克拉或阿扎胞苷+CAG方案,并签署化疗同意书。排除标准:(1)存在重要脏器不全;(2)合并严重感染或出血;(3)存在其他恶性肿瘤性疾病;(4)临床资料不全。本研究为回顾性队列研究。回顾性分析大同市第五人民医院2018年5月至2023年8月收治的34例老年初治AML患者的临床资料,依据治疗方案将患者分为维奈克拉组(阿扎胞苷+维奈克拉治疗,17例)和CAG组(阿扎胞苷+CAG方案治疗,17例)。
(1)维奈克拉组:阿扎胞苷100 mg/d,皮下注射,第1天至第7天。维奈克拉100 mg,口服,第1天;200 mg,口服,第2天;400 mg,口服,第3天至第28天(根据血细胞计数情况调整使用时间,一般不少于14 d)。(2)CAG组:阿扎胞苷100 mg/d,皮下注射,第1天至第7天。阿糖胞苷10 mg/m2,皮下注射,1次/12 h,第1天至第14天。阿柔比星20 mg,静脉滴注,第1天至第4天。G-CSF 300 μg,皮下注射,第0天至第14天(白细胞计数≥20×109/L时暂停使用)。伴有FLT3-ITD突变的患者同时口服索拉菲尼。治疗过程中隔日进行血常规、肝肾功能、心肌酶、电解质检测,治疗2周和4周时行骨髓细胞形态学检查,根据患者临床表现及实验室指标检测结果调整药物剂量及使用时间。
如果诱导缓解治疗获得完全缓解(CR),继续巩固治疗5~6个周期。维奈克拉组巩固治疗方案与诱导方案相同,若患者耐受性差,则巩固治疗时适当缩短阿扎胞苷及维奈克拉使用时间;CAG组巩固治疗方案也与诱导治疗方案相同,若患者耐受性差,则使用阿扎胞苷单药巩固治疗。若治疗1个周期未达CR,则继续使用原方案进行再诱导治疗;若治疗2个周期仍未达CR,则退出本研究,换用其他方案治疗。
治疗期间给予护胃、保肝、保护心脏、止吐等药物辅助治疗,定期监测血常规、肝肾功能、心肌酶、电解质等。如发生感染,根据细菌培养+药敏试验结果选用敏感抗生素治疗。对于无明确感染灶且无病原学依据者,经验性给予广谱抗生素治疗。对于粒细胞缺乏伴发热且广谱抗菌药物治疗4~7 d无效的患者,经验性加用广谱抗真菌药物治疗。对于血细胞严重减少的患者积极给予成分血输注:对于血红蛋白<60 g/L,或血红蛋白≥60 g/L但贫血症状严重的患者,积极输注去白细胞悬浮红细胞治疗;血小板计数≤10×109/L时,及时输注单采血小板。对于治疗后粒细胞缺乏的患者,在治疗结束24 h后给予G-CSF。
随访截至2023年8月30日,随访方式包括门诊复诊或微信、电话随访,平均每2个月随访1次,随访内容主要包括临床表现及血液学检查结果。
参考第4版《血液病诊断及疗效标准》[5]进行疗效评价,分为CR、部分缓解(PR)、未缓解(NR)。客观反应率(ORR)以CR+PR计算。参照美国国立癌症研究所通用不良反应术语标准(CECAT)进行不良反应评价,分为5级[6]。
采用SPSS 26.0软件对数据进行统计学分析。偏态分布计量资料以M(Q1,Q3)表示,组间比较用秩和检验;计数资料以频数(%)表示,组间比较采用χ2检验或Fisher确切概率法。采用Kaplan-Meier法进行生存分析,行log-rank检验。P<0.05为差异有统计学意义。
两组患者性别、年龄、ECOG评分、预后等级、分子遗传学特征、骨髓原始幼稚细胞比例、血红蛋白、白细胞计数及血小板计数比较,差异均无统计学意义(均P>0.05)(表1)。
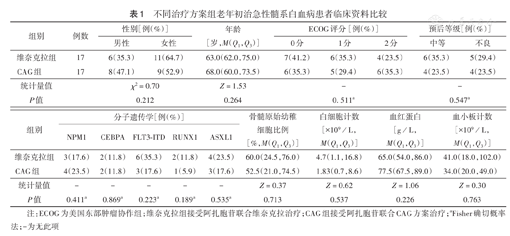
不同治疗方案组老年初治急性髓系白血病患者临床资料比较
不同治疗方案组老年初治急性髓系白血病患者临床资料比较
| 组别 | 例数 | 性别[例(%)] | 年龄[岁,M(Q1,Q3)] | ECOG评分[例(%)] | 预后等级[例(%)] | ||||
|---|---|---|---|---|---|---|---|---|---|
| 男性 | 女性 | 0分 | 1分 | 2分 | 中等 | 不良 | |||
| 维奈克拉组 | 17 | 6(35.3) | 11(64.7) | 63.0(62.0,75.0) | 7(41.2) | 6(35.3) | 4(23.5) | 6(35.3) | 5(29.4) |
| CAG组 | 17 | 8(47.1) | 9(52.9) | 68.0(60.0,73.5) | 6(35.3) | 5(29.4) | 6(35.3) | 4(23.5) | 4(23.5) |
| 统计量值 | χ2=0.70 | Z=1.53 | - | - | |||||
| P值 | 0.212 | 0.264 | 0. 511a | 0.547a | |||||
| 组别 | 分子遗传学[例(%)] | 骨髓原始幼稚细胞比例[%,M(Q1,Q3)] | 白细胞计数[×109/L,M(Q1,Q3)] | 血红蛋白[g/L,M(Q1,Q3)] | 血小板计数[×109/L,M(Q1,Q3)] | ||||
|---|---|---|---|---|---|---|---|---|---|
| NPM1 | CEBPA | FLT3-ITD | RUNX1 | ASXL1 | |||||
| 维奈克拉组 | 3(17.6) | 2(11.8) | 6(35.3) | 2(11.8) | 4(23.5) | 60.0(24.5,76.0) | 4.7(1.1,16.8) | 65.0(54.0,86.0) | 41.0(18.0,102.0) |
| CAG组 | 4(23.5) | 2(11.8) | 3(17.6) | 1(5.9) | 3(17.6) | 52.5(21.0,74.5) | 1.83(0.7,8.6) | 77.5(67.5,89.0) | 34.0(20.0,49.0) |
| 统计量值 | - | - | - | - | - | Z=0.37 | Z=0.62 | Z=1.06 | Z=0.30 |
| P值 | 0.411a | 0.869a | 0.223a | 0.189a | 0.535a | 0.713 | 0.537 | 0.226 | 0.763 |
注:ECOG为美国东部肿瘤协作组;维奈克拉组接受阿扎胞苷联合维奈克拉治疗;CAG组接受阿扎胞苷联合CAG方案治疗;aFisher确切概率法;-为无此项
维奈克拉组的CR率、ORR均高于CAG组,但差异均无统计学意义(均P>0.05)(表2)。
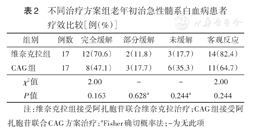
不同治疗方案组老年初治急性髓系白血病患者疗效比较[例(%)]
不同治疗方案组老年初治急性髓系白血病患者疗效比较[例(%)]
| 组别 | 例数 | 完全缓解 | 部分缓解 | 未缓解 | 客观反应 |
|---|---|---|---|---|---|
| 维奈克拉组 | 17 | 12(70.6) | 2(11.8) | 3(17.7) | 14(82.4) |
| CAG组 | 17 | 8(47.1) | 3(17.7) | 6(35.3) | 11(64.7) |
| χ2值 | 2.00 | - | - | 2.00 | |
| P值 | 0.163 | 0.628a | 0.244a | 0.244 |
注:维奈克拉组接受阿扎胞苷联合维奈克拉治疗;CAG组接受阿扎胞苷联合CAG方案治疗;aFisher确切概率法;-为无此项
患者中位随访时间为25.4个月(7.2个月,60.3个月)。随访结束,34例患者中19例生存,其中维奈克拉组13例,CAG组6例;死亡15例,其中维奈克拉组4例,CAG组11例。维奈克拉组和CAG组中位总生存(OS)时间分别为14.22个月(95% CI:8.2~60.3个月)和10.56个月(95% CI:7.2~50.2个月),中位无进展生存(PFS)时间分别为9.97个月(95% CI:5.4~40.5个月)和6.82个月(95% CI:5.0~36.2个月),两组OS、PFS差异均无统计学意义(均P>0.05)。
两组最常见的不良反应为化疗后骨髓抑制及其所致的感染和出血。维奈克拉组3~4级血液学不良反应发生率为94.1%(16/17),CAG组为82.35%(14/17)。维奈克拉组和CAG组粒细胞缺乏时间、血小板缺乏时间及出血、胃肠道反应、肝损伤、感染发生率比较,差异均无统计学意义(均P>0.05)(表3)。两组感染部位均以肺部为主,其次为皮肤软组织和肠道;出血部位以皮肤黏膜为主,其次为牙龈,无致命性内脏出血。上述不良反应经对症治疗后均可缓解,未发生治疗相关死亡。
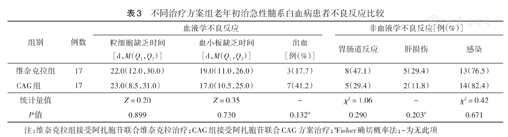
不同治疗方案组老年初治急性髓系白血病患者不良反应比较
不同治疗方案组老年初治急性髓系白血病患者不良反应比较
| 组别 | 例数 | 血液学不良反应 | 非血液学不良反应[例(%)] | ||||
|---|---|---|---|---|---|---|---|
| 粒细胞缺乏时间[d,M(Q1,Q3)] | 血小板缺乏时间[d,M(Q1,Q3)] | 出血[例(%)] | 胃肠道反应 | 肝损伤 | 感染 | ||
| 维奈克拉组 | 17 | 22.0(12.0,30.0) | 19.0(11.0,26.0) | 3(17.7) | 8(47.1) | 5(29.4) | 13(76.5) |
| CAG组 | 17 | 23.0(8.5,31.0) | 17.0(10.5,25.0) | 7(41.2) | 5(29.4) | 2(11.8) | 14(82.4) |
| 统计量值 | Z=0.20 | Z=0.35 | - | χ2=1.06 | - | χ2=0.42 | |
| P值 | 0.899 | 0.730 | 0.132a | 0.290 | 0.203a | 0.671 | |
注:维奈克拉组接受阿扎胞苷联合维奈克拉治疗;CAG组接受阿扎胞苷联合CAG方案治疗;aFisher确切概率法;-为无此项
老年AML患者多合并多种基础疾病,化疗后骨髓抑制期长、并发症多,仅约15%的患者化疗后能获得长期生存[7,8]。阿扎胞苷是一种去甲基化抗肿瘤药物,通过引起DNA去甲基化和对骨髓中异常造血细胞的直接细胞毒作用而发挥抗肿瘤作用。阿扎胞苷为胞嘧啶核苷类药物,临床上作为一、二线药物治疗AML取得了一定的效果,但单药缓解率有限,且起效时间较长[9],长时间单药治疗易产生耐药。
CAG方案是治疗老年初治AML及复发难治AML患者的常用方案。该方案中阿柔比星属蒽环类药物,可在细胞内长时间保持较高浓度而发挥细胞毒作用。阿糖胞苷是细胞周期特异性药物,通过阻断正常细胞周期中DAN的合成而发挥作用[10]。AML患者白血病细胞均存在G-CSF受体,G-CSF进入人体后,能促进白血病细胞从G0期向增殖期转化,从而增加白血病细胞对阿糖胞苷的敏感性。小剂量阿柔比星联合阿糖胞苷对白血病前体细胞也具有杀伤作用。但有研究结果显示,部分AML患者对CAG方案中的药物耐药而影响疗效,仅CAG方案很难达到较好疗效[11]。基础研究结果证实,去甲基化药物与G-CSF具有协同作用,后者可增强去甲基化药物的疗效,同时去甲基化药物可增强白血病细胞对阿糖胞苷的敏感性[12]。体外实验也发现,去甲基化药物能够增强细胞毒药物的活性,其与CAG方案联合可使AML缓解率进一步提高。
维奈克拉是一种口服的强效bcl-2选择性抑制剂。2018年被美国食品药品管理局批准与阿扎胞苷联合治疗初治、不适合高强度化疗的AML患者。该两药联合方案在复发难治AML患者中疗效较好[6,13,14]。临床研究结果也表明,去甲基化药物和维奈克拉之间存在协同作用[6,15,16,17]。维奈克拉联合阿扎胞苷的低强度治疗方案对不适合高强度化疗的老年AML患者亦显示出良好的疗效和耐受性[6,15,16,17]。Pollyea等[17]开展的ⅠB期临床试验对39例≥65岁初治AML患者给予维奈克拉联合地西他滨或阿扎胞苷治疗,结果显示CR率为76.9%(30/39),主要不良反应为恶心、中性粒细胞减少伴发热、腹泻及食欲减退。第56届美国血液学会年会上报道的一项多中心、非盲Ⅱ期临床试验研究结果显示,32例老年AML患者接受维奈克拉联合地西他滨或阿扎胞苷治疗后,无一例发生急性肿瘤溶解综合征(ATLS)[14,18]。体外实验结果亦证实,维奈克拉与阿扎胞苷在抗白血病方面具有协同作用[19]。一项大样本、多中心、非随机、开放标签ⅠB期临床试验采用维奈克拉联合地西他滨或阿扎胞苷方案治疗145例初治AML老年患者的结果显示,67%(97/145)的患者达到CR,且不良反应小,未观察到ATLS,血液学和胃肠道不良反应常见,但无一例患者因不良反应而停用维奈克拉;3~4级不良反应包括中性粒细胞减少伴发热、贫血、血小板减少、肺炎。由此可见,维奈克拉联合阿扎胞苷治疗老年AML患者安全、有效,并且患者耐受性良好。
去甲基化药物联合CAG方案治疗老年AML患者在临床上广泛使用,疗效和安全性得到肯定。维奈克拉与阿扎胞苷联合治疗老年AML患者的研究已取得较大进展,但疗效和安全性是否优于阿扎胞苷联合CAG方案,国内相关报道较少。本研究显示,维奈克拉组的CR率、ORR、PFS及OS均优于CAG组,但差异均无统计学意义(均P>0.05),这可能与本研究样本量相对较少有关。两组骨髓抑制发生率均较高,且多为3~4级骨髓抑制,但均无治疗相关死亡。维奈克拉组感染、出血发生率均低于CAG组,胃肠道反应、肝损伤发生率均高于CAG组,但差异均无统计学意义(均P>0.05)。
综上,阿扎胞苷联合维奈克拉与阿扎胞苷联合CAG方案均可作为老年初治AML患者一线诱导方案,安全性均较好,但仍需要更大样本量、多中心、前瞻性研究进一步验证。
葛文军,葛宋钰,张向臣,等.阿扎胞苷联合维奈克拉或CAG方案治疗老年初治急性髓系白血病患者效果和安全性比较[J].肿瘤研究与临床,2024,36(5):356-360. DOI:10.3760/cma.j.cn115355-20231206-00223.
所有作者声明无利益冲突



























