
探究心力衰竭(心衰)患者基线血清尿酸水平与预后的相关性。
本研究入选了2006年11月至2016年11月在阜外医院心衰重症监护病区住院的1 594例心力衰竭患者,对其进行长期、规律随访,主要终点事件是全因死亡。采用限制性立方样条函数拟合血清尿酸水平与终点事件发生风险的趋势。采用Kaplan-Meier曲线评估不同血清尿酸水平终点事件发生率差异。采用Cox风险回归模型分析不同血清尿酸水平对患者终点事件的预测价值。
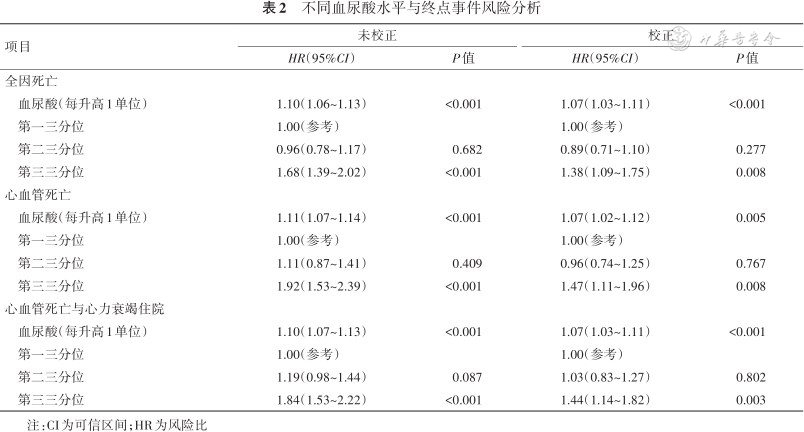
本研究中患者中位年龄为57.0岁,28.1%为女性。中位随访时间为975天,有640例患者发生了全因死亡,其中461例(72.4%)为心血管死亡,204例患者发生了心力衰竭再住院。Kaplan-Meier生存曲线显示,与血清尿酸第一三分位组(<6.3 mg/dL)患者相比,尿酸较高的第三三分位组(>8.5 mg/dL)患者全因死亡、心血管死亡及心血管死亡和心力衰竭住院的复合事件的发生率均更高(P<0.001),但随着随访时间延长,第一三分位组相比第二三分位组(6.3~8.5 mg/dL)显示出全因死亡终点事件增加的趋势。Cox风险回归模型校正患者临床特征、心力衰竭病因及合并症、实验室检查指标及用药后,单位血清尿酸水平升高与全因死亡[风险比(HR)1.07,95%可信区间(CI)1.03~1.11,P<0.001]、心血管死亡(HR 1.07,95%CI 1.02~1.12,P=0.005)、心血管死亡与心力衰竭住院的复合终点(HR 1.07,95%CI 1.03~1.11,P<0.001)风险增加均相关。与尿酸第一三分位组比,第三三分位组者全因死亡(HR 1.38,95%CI 1.09~1.75,P=0.008)、心血管死亡(HR 1.47,95%CI 1.11~1.96,P=0.008)、心血管死亡与心力衰竭住院的复合终点(HR 1.44,95%CI 1.14~1.92,P=0.003)风险均更高。
血清尿酸水平升高是心力衰竭患者全因死亡、心血管死亡及心血管死亡与心力衰竭住院的复合终点的独立危险因素。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
作为各种心脏疾病的严重表现或晚期阶段,心力衰竭(心衰)患者预后很差,确诊后1年内病死率约为20%,5年内病死率约为50%[1]。心衰是包含神经内分泌、代谢、免疫系统改变在内的复杂病理过程,患者常合并包括尿酸代谢在内的整体代谢紊乱,心衰患者合并血尿酸水平异常十分常见[2]。一项日本多中心观察性研究表明,超过50%住院心衰患者患有高尿酸血症[3]。已有研究提示,血尿酸升高可能与心衰患者的不良临床结局有关。Anker等人[4]进行的一项小型研究提示升高的血尿酸水平是中重度心衰患者预后不良的标志物,且血尿酸升高与患者症状加重,运动耐量降低和心功能下降相关。但是,Vaduganathan等人[5]纳入4 133例心衰合并高尿酸血症患者的队列研究,结果显示,估算的肾小球滤过率(estimated glomerular filtration rate,eGFR)<30mL·min-1·1.73m-2的患者,血尿酸水平与全因死亡和心血管死亡无关。血尿酸水平是否能作为心衰患者预后不良的独立危险因素尚有争议。目前,关于中国心衰住院患者基线血尿酸水平与预后之间相关性的大样本、长期随访研究数据有限。本研究纳入10年间的心衰住院患者,并对患者进行长期规律随访,通过回顾性分析来评估心衰患者基线血尿酸水平与预后的相关性。
1. 研究对象:纳入2006年11月至2016年11月于中国医学科学院阜外医院心衰重症监护病房住院并被诊断患有心衰的患者。纳入标准:根据《国家心力衰竭指南2023》[1],心衰诊断明确,血尿酸等基线数据完整。排除标准:活动性肿瘤;严重血液疾病和自身免疫性疾病;基线血尿酸等数据不完整;失访。
2. 临床资料采集:通过电子病历系统收集基线临床资料,多次住院的患者仅采集首次住院资料。包括患者的年龄、性别、体质量指数(body mass index,BMI)、收缩压、舒张压、心率、既往史与合并症[高血压、冠状动脉性心脏病(冠心病)、心房颤动(房颤)、糖尿病、慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)],吸烟史,纽约心脏协会(New York Heart Association,NYHA)心功能分级,超声心动图检查指标[左心室射血分数(left ventricular ejection fraction,LVEF)、左心房内径(1eft atrium diameter,LAD)、左心室舒张末期内径(left ventricular end-diastolic dimension,LVEDD)],心衰治疗药物使用情况[包括血管紧张素转换酶抑制剂(angiotensin-converting enzyme inhibitor,ACEI)、血管紧张素Ⅱ受体阻滞剂(angiotensin II receptor blocker,ARB)、β受体阻滞剂、醛固酮受体拮抗剂/盐皮质激素受体拮抗剂(mineralocorticoid receptor antagonists,MRA)、利尿剂及地高辛等],实验室指标[血尿酸、N末端B型利钠肽原(N terminal-pro B-type natriuretic peptide,NT-proBNP)、血肌酐(serum creatinine,Scr)、eGFR、白细胞(white blood cell,WBC)、血红蛋白、白蛋白(albumin,ALB)、丙氨酸氨基转移酶(alanine aminotransferase,ALT)、血钠、血钾、低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C)、高敏C反应蛋白(high- sensitivity C-reactive protein,hs-CRP)等]。血液样本在患者入院后次晨从患者的静脉抽取血样并收集到无菌真空试管中,所有患者的血液样本均在阜外医院临床实验室立即进行检测。血尿酸检测由自动生化分析仪完成。
3. 随访:本研究的主要终点是全因死亡,次要终点为心血管死亡、心血管死亡和心衰住院的复合终点。患者从出院后每隔3个月进行规律门诊或电话随访,直至患者死亡。采集信息包括目前症状、活动耐量、用药情况、有无再住院及其时间和原因或死亡时间及原因。
4. 统计学方法:使用R 4.3.2版进行统计分析。正态分布的计量资料以均数±标准差来描述,不符合正态分布的计量资料以中位数和四分位间距(interquartile range,IQR)描述,根据分布情况,组间比较使用t检验、方差分析或秩和检验。分类变量以例数和百分比(%)描述,组间比较使用卡方检验或Fisher精确检验。采用限制性立方样条函数拟合血尿酸水平与终点事件发生风险的趋势。通过Kaplan-Meier曲线法评估不同组终点事件发生差异。血尿酸水平与终点事件的关系采用单因素和多因素Cox回归分析。以P<0.05为差异有统计学意义。
1. 一般临床资料比较:共纳入1 592例心衰住院患者,基线临床资料情况见表1。研究人群的年龄为57.0(46.0,68.0)岁,448例(28.1%)为女性。患者中位LVEF为36.0%,血尿酸水平为7.4(5.8,9.3)mg/dL(1 mg/dL=88.4 μmol/L),NT-proBNP水平为1 773.0(828.0,3 862.9)ng/L。NYHA心功能Ⅲ~Ⅳ级的患者1 262例(占79.2%)。中位随访时间975(331,1855)d,有640例患者发生了全因死亡,其中,461例为心血管死亡,204例患者发生了心衰再住院。根据患者在住院或随访期间是否发生全因死亡分为死亡组(n=640)和存活组(n=954)。与存活组患者相比,死亡组患者的基线血尿酸水平更高,两组患者在年龄、BMI、收缩压、舒张压、NYHA心功能分级、冠心病、房颤、COPD、ALT、NT-proBNP、hs-CRP、血钠、血钾、Scr、ALB、血红蛋白、LDL-C、ACEI/ARB、β受体阻滞剂、MRA、LAD、LVEDD方面差异均有统计学意义(P均<0.05)。两组患者在性别、心率、吸烟史、高血压、糖尿病、eGFR、WBC、利尿剂、地高辛、LVEF方面差异均无统计学意义(P均>0.05)。
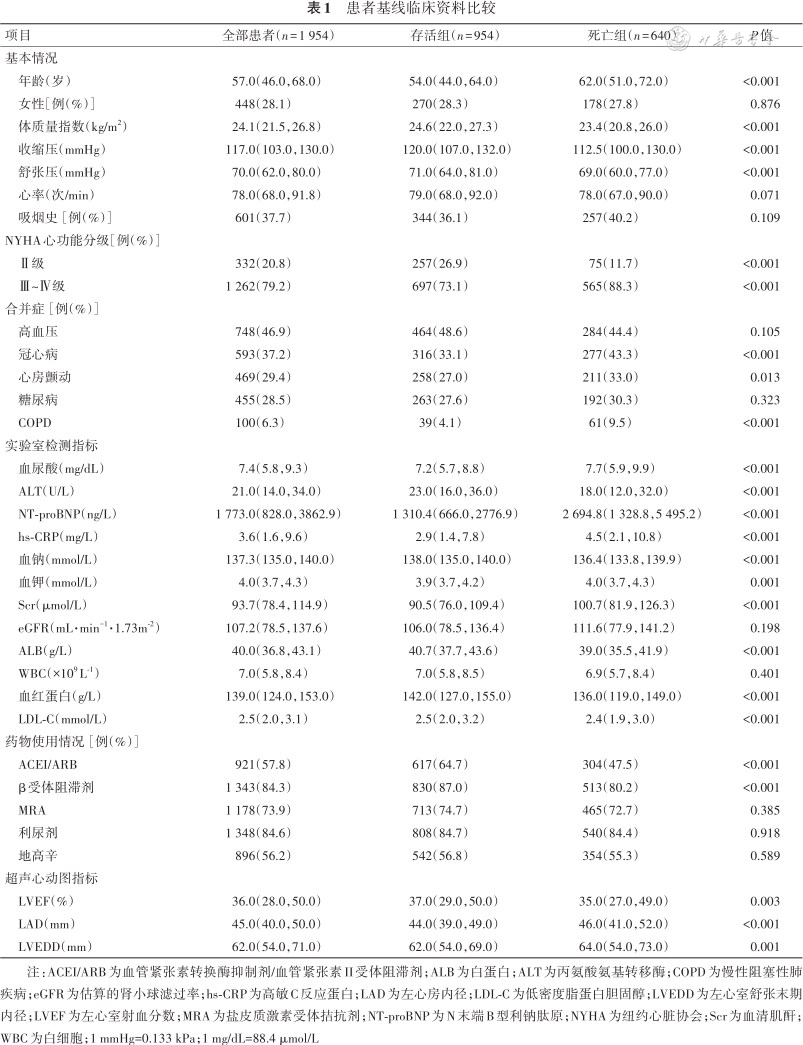
患者基线临床资料比较
患者基线临床资料比较
| 项目 | 全部患者(n=1 954) | 存活组(n=954) | 死亡组(n=640) | P值 |
|---|---|---|---|---|
| 基本情况 | ||||
| 年龄(岁) | 57.0(46.0,68.0) | 54.0(44.0,64.0) | 62.0(51.0,72.0) | <0.001 |
| 女性[例(%)] | 448(28.1) | 270(28.3) | 178(27.8) | 0.876 |
| 体质量指数(kg/m2) | 24.1(21.5,26.8) | 24.6(22.0,27.3) | 23.4(20.8,26.0) | <0.001 |
| 收缩压(mmHg) | 117.0(103.0,130.0) | 120.0(107.0,132.0) | 112.5(100.0,130.0) | <0.001 |
| 舒张压(mmHg) | 70.0(62.0,80.0) | 71.0(64.0,81.0) | 69.0(60.0,77.0) | <0.001 |
| 心率(次/min) | 78.0(68.0,91.8) | 79.0(68.0,92.0) | 78.0(67.0,90.0) | 0.071 |
| 吸烟史[例(%)] | 601(37.7) | 344(36.1) | 257(40.2) | 0.109 |
| NYHA心功能分级[例(%)] | ||||
| Ⅱ级 | 332(20.8) | 257(26.9) | 75(11.7) | <0.001 |
| Ⅲ~Ⅳ级 | 1 262(79.2) | 697(73.1) | 565(88.3) | <0.001 |
| 合并症[例(%)] | ||||
| 高血压 | 748(46.9) | 464(48.6) | 284(44.4) | 0.105 |
| 冠心病 | 593(37.2) | 316(33.1) | 277(43.3) | <0.001 |
| 心房颤动 | 469(29.4) | 258(27.0) | 211(33.0) | 0.013 |
| 糖尿病 | 455(28.5) | 263(27.6) | 192(30.3) | 0.323 |
| COPD | 100(6.3) | 39(4.1) | 61(9.5) | <0.001 |
| 实验室检测指标 | ||||
| 血尿酸(mg/dL) | 7.4(5.8,9.3) | 7.2(5.7,8.8) | 7.7(5.9,9.9) | <0.001 |
| ALT(U/L) | 21.0(14.0,34.0) | 23.0(16.0,36.0) | 18.0(12.0,32.0) | <0.001 |
| NT-proBNP(ng/L) | 1 773.0(828.0,3862.9) | 1 310.4(666.0,2776.9) | 2 694.8(1 328.8,5 495.2) | <0.001 |
| hs-CRP(mg/L) | 3.6(1.6,9.6) | 2.9(1.4,7.8) | 4.5(2.1,10.8) | <0.001 |
| 血钠(mmol/L) | 137.3(135.0,140.0) | 138.0(135.0,140.0) | 136.4(133.8,139.9) | <0.001 |
| 血钾(mmol/L) | 4.0(3.7,4.3) | 3.9(3.7,4.2) | 4.0(3.7,4.3) | 0.001 |
| Scr(μmol/L) | 93.7(78.4,114.9) | 90.5(76.0,109.4) | 100.7(81.9,126.3) | <0.001 |
| eGFR(mL·min-1·1.73m-2) | 107.2(78.5,137.6) | 106.0(78.5,136.4) | 111.6(77.9,141.2) | 0.198 |
| ALB(g/L) | 40.0(36.8,43.1) | 40.7(37.7,43.6) | 39.0(35.5,41.9) | <0.001 |
| WBC(×109 L-1) | 7.0(5.8,8.4) | 7.0(5.8,8.5) | 6.9(5.7,8.4) | 0.401 |
| 血红蛋白(g/L) | 139.0(124.0,153.0) | 142.0(127.0,155.0) | 136.0(119.0,149.0) | <0.001 |
| LDL-C(mmol/L) | 2.5(2.0,3.1) | 2.5(2.0,3.2) | 2.4(1.9,3.0) | <0.001 |
| 药物使用情况[例(%)] | ||||
| ACEI/ARB | 921(57.8) | 617(64.7) | 304(47.5) | <0.001 |
| β受体阻滞剂 | 1 343(84.3) | 830(87.0) | 513(80.2) | <0.001 |
| MRA | 1 178(73.9) | 713(74.7) | 465(72.7) | 0.385 |
| 利尿剂 | 1 348(84.6) | 808(84.7) | 540(84.4) | 0.918 |
| 地高辛 | 896(56.2) | 542(56.8) | 354(55.3) | 0.589 |
| 超声心动图指标 | ||||
| LVEF(%) | 36.0(28.0,50.0) | 37.0(29.0,50.0) | 35.0(27.0,49.0) | 0.003 |
| LAD(mm) | 45.0(40.0,50.0) | 44.0(39.0,49.0) | 46.0(41.0,52.0) | <0.001 |
| LVEDD(mm) | 62.0(54.0,71.0) | 62.0(54.0,69.0) | 64.0(54.0,73.0) | 0.001 |
注:ACEI/ARB为血管紧张素转换酶抑制剂/血管紧张素II受体阻滞剂;ALB为白蛋白;ALT为丙氨酸氨基转移酶;COPD为慢性阻塞性肺疾病;eGFR为估算的肾小球滤过率;hs-CRP为高敏C反应蛋白;LAD为左心房内径;LDL-C为低密度脂蛋白胆固醇;LVEDD为左心室舒张末期内径;LVEF为左心室射血分数;MRA为盐皮质激素受体拮抗剂;NT-proBNP为N末端B型利钠肽原;NYHA为纽约心脏协会;Scr为血清肌酐;WBC为白细胞;1 mmHg=0.133 kPa;1 mg/dL=88.4 μmol/L
2. 不同血尿酸水平与心衰患者预后:将血尿酸水平作为连续变量纳入不同终点事件的多因素分析,采用限制性立方样条函数拟合血尿酸水平与终点事件发生风险的趋势。如图1, 2, 3所示。根据图形的特点及临床意义,提示血尿酸在8 mg/dL以上时,全因死亡、心血管死亡、心血管死亡和心衰再住院复合终点随着血尿酸增加而增加。同时,在血尿酸水平较低时,全因死亡和心血管死亡终点事件风险可能随着血尿酸水平减少而有所增加。
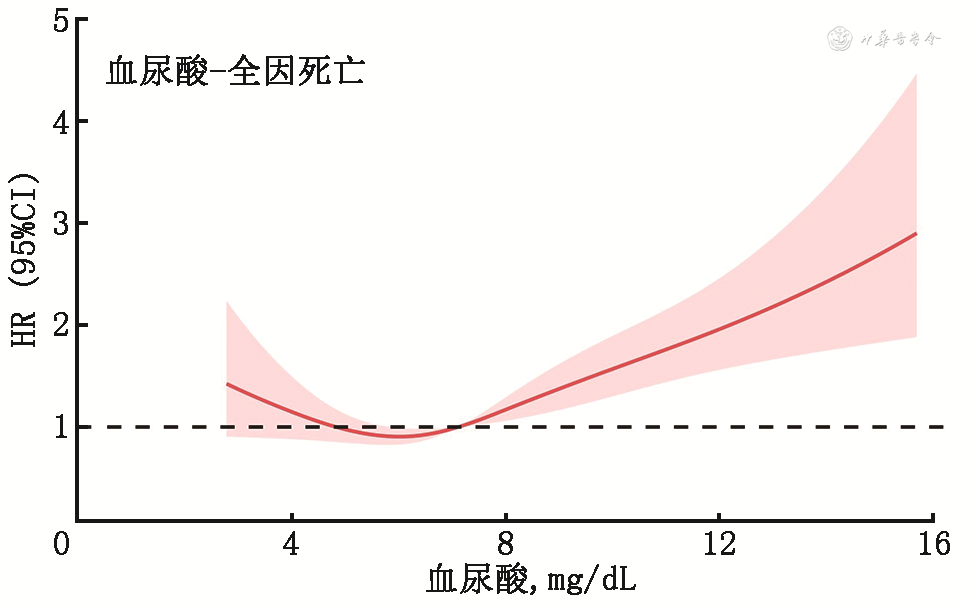

(注:CI为可信区间;HR为风险比)
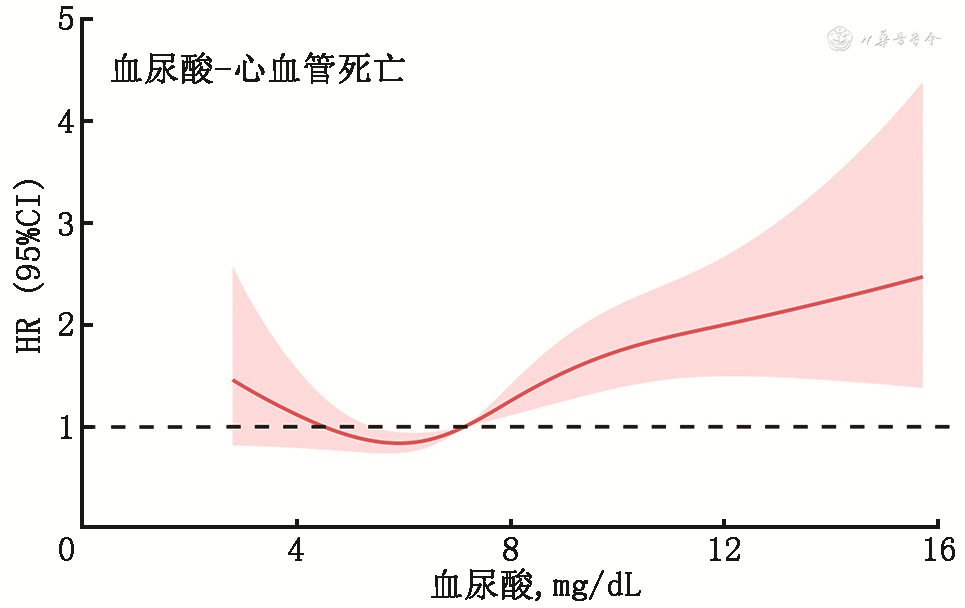

(注:CI为可信区间;HR为风险比)
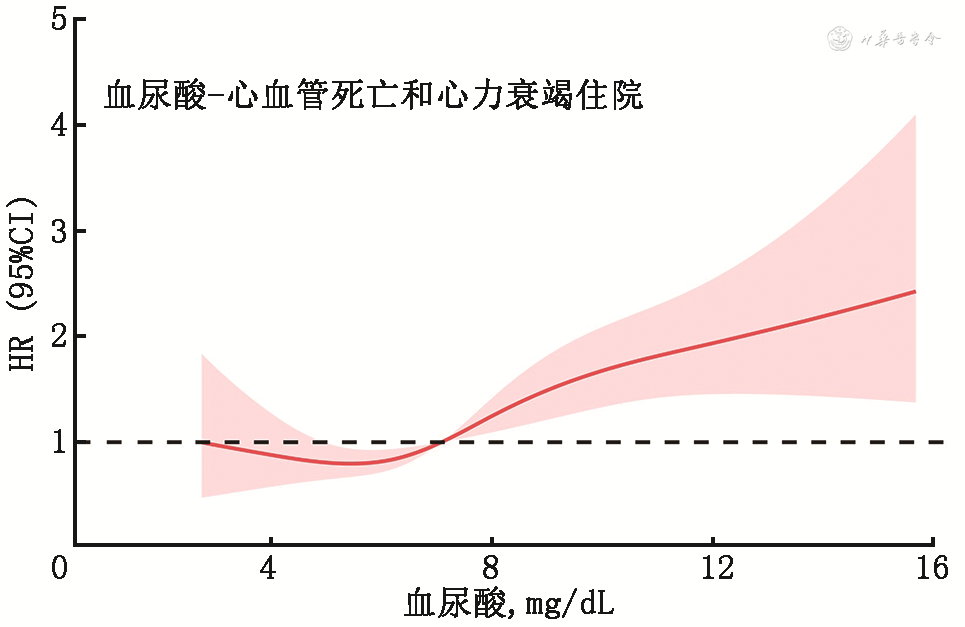

(注:CI为可信区间;HR为风险比)
按患者血尿酸水平的三分位数将患者分为3组,分别为第一三分位组(<6.3 mg/dL)、第二三分位组(6.3~8.5 mg/dL)、第三三分位组(>8.5 mg/dL)。如图4, 5, 6所示,Kaplan-Meier生存曲线显示,第三三分位组(>8.5 mg/dL)患者全因死亡、心血管死亡及心血管死亡和心衰住院的复合事件的发生率均较高(P<0.001),但是随着随访时间延长,第一三分位组(<6.3 mg/dL)相比第二三分位组(6.3~8.5 mg/dL)显示出全因死亡终点事件增加的趋势。
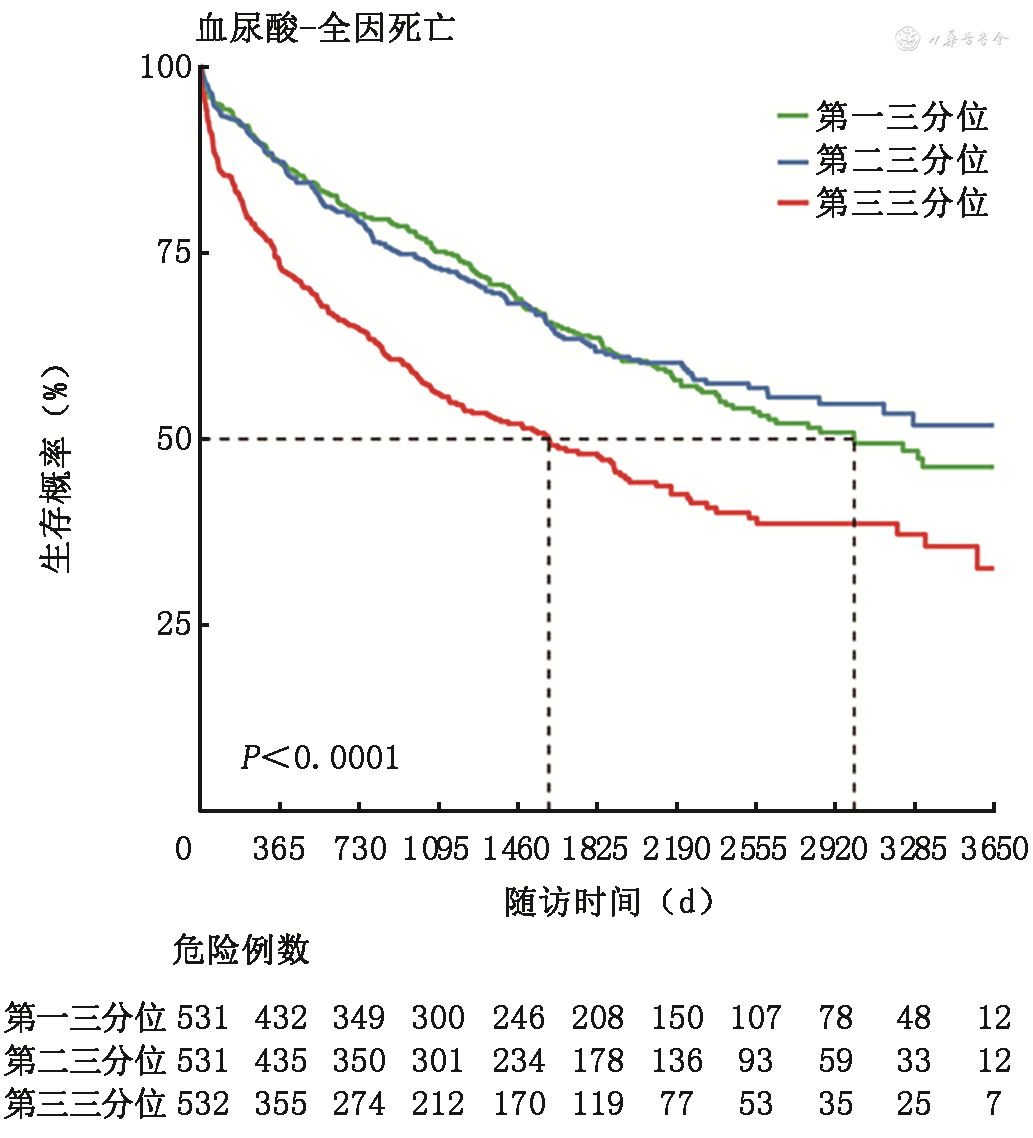

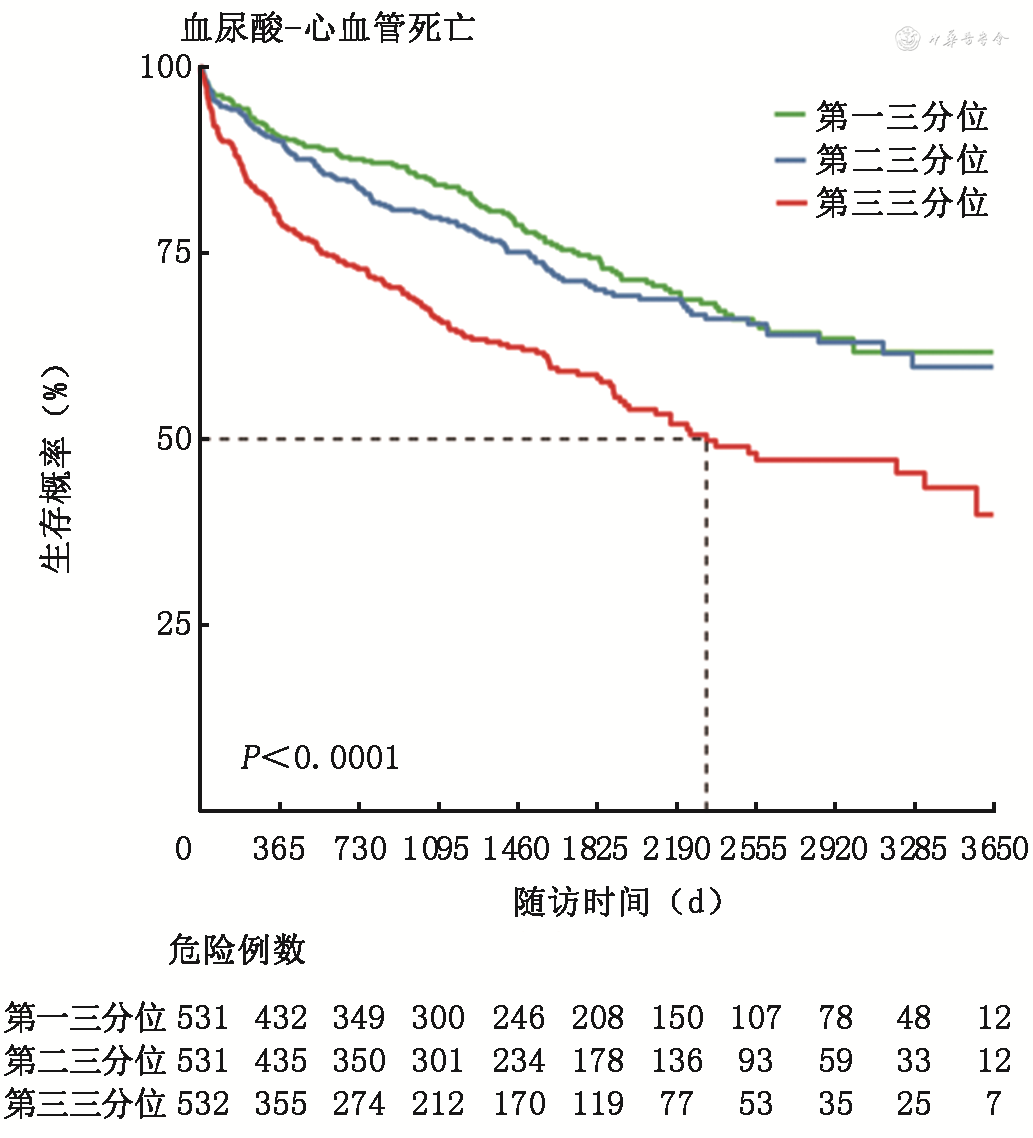

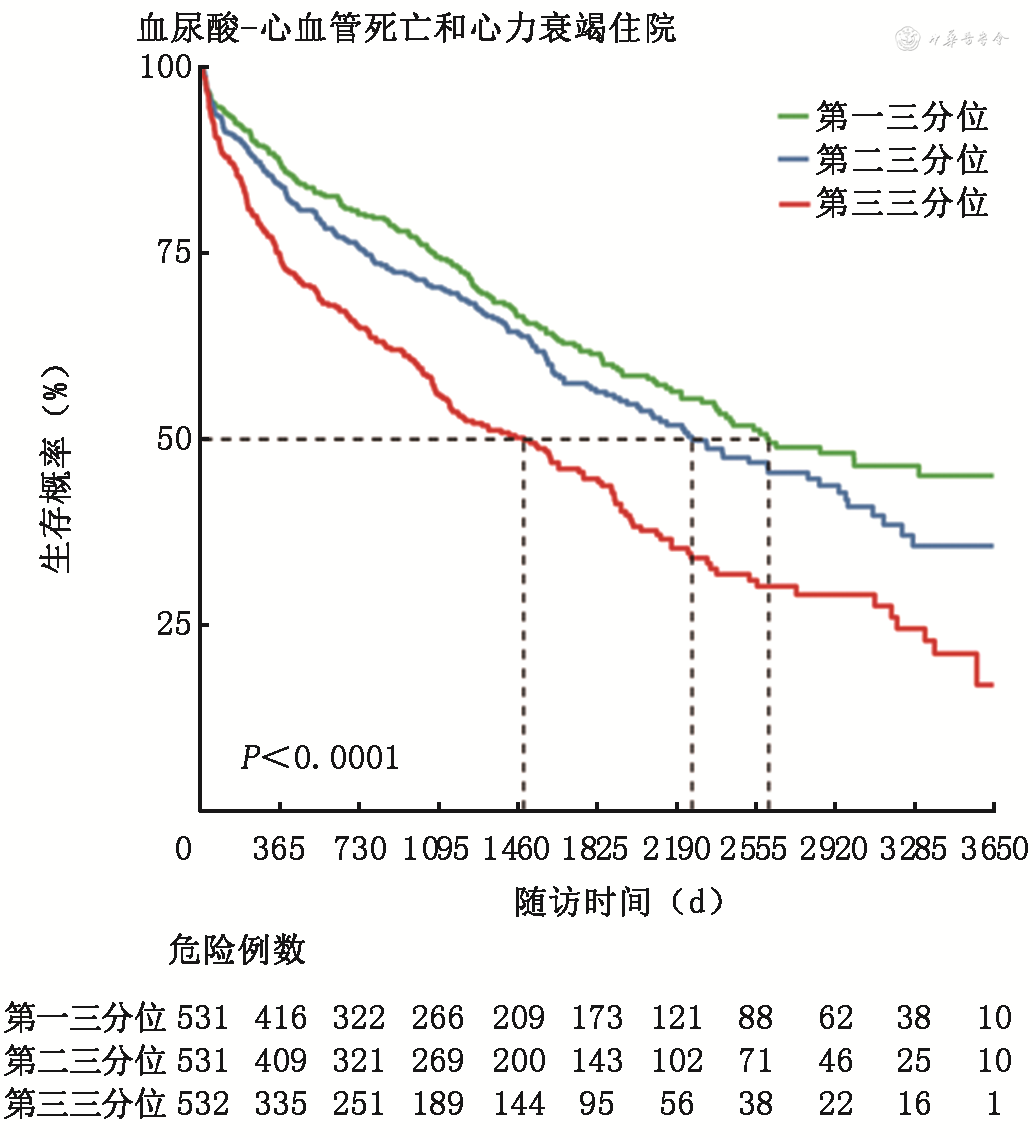

采用Cox回归分析评估不同血尿酸水平与心衰患者全因死亡等事件之间的关系,结果见表2。作为连续变量时,未校正的Cox分析显示单位血尿酸水平升高与全因死亡、心血管死亡、心血管死亡与心衰住院的复合终点风险增加均相关(P均<0.001);作为分类变量时,未经校正的Cox分析显示,与第一三分位组相比,第三三分位组全因死亡、心血管死亡、心血管死亡与心衰住院的复合终点风险均更高(P均<0.001)。进一步校正性别、年龄、BMI、收缩压、心率、冠心病、房颤、糖尿病、LVEF、eGFR、ACEI/ARB、β受体阻滞剂和对数转换后NT-proBNP因素后,作为连续变量时,校正的Cox分析显示,单位血尿酸水平升高与全因死亡、心血管死亡、心血管死亡与心衰住院的复合终点增加均相关(P均<0.05);作为分类变量时,校正的Cox分析显示,与第一三分位组比,第三三分位组全因死亡、心血管死亡、心血管死亡与心衰住院的复合终点风险均更高(P均<0.05);第二三分位组相比第一三分位组比,上述终点事件风险未见明显差异(P均>0.05)。提示血尿酸升高是心衰患者全因死亡、心血管死亡、心血管死亡与心衰住院的复合终点的独立危险因素之一。
不同血尿酸水平与终点事件风险分析
不同血尿酸水平与终点事件风险分析
| 项目 | 未校正 | 校正 | ||
|---|---|---|---|---|
| HR(95%CI) | P值 | HR(95%CI) | P值 | |
| 全因死亡 | ||||
| 血尿酸(每升高1单位) | 1.10(1.06~1.13) | <0.001 | 1.07(1.03~1.11) | <0.001 |
| 第一三分位 | 1.00(参考) | 1.00(参考) | ||
| 第二三分位 | 0.96(0.78~1.17) | 0.682 | 0.89(0.71~1.10) | 0.277 |
| 第三三分位 | 1.68(1.39~2.02) | <0.001 | 1.38(1.09~1.75) | 0.008 |
| 心血管死亡 | ||||
| 血尿酸(每升高1单位) | 1.11(1.07~1.14) | <0.001 | 1.07(1.02~1.12) | 0.005 |
| 第一三分位 | 1.00(参考) | 1.00(参考) | ||
| 第二三分位 | 1.11(0.87~1.41) | 0.409 | 0.96(0.74~1.25) | 0.767 |
| 第三三分位 | 1.92(1.53~2.39) | <0.001 | 1.47(1.11~1.96) | 0.008 |
| 心血管死亡与心力衰竭住院 | ||||
| 血尿酸(每升高1单位) | 1.10(1.07~1.13) | <0.001 | 1.07(1.03~1.11) | <0.001 |
| 第一三分位 | 1.00(参考) | 1.00(参考) | ||
| 第二三分位 | 1.19(0.98~1.44) | 0.087 | 1.03(0.83~1.27) | 0.802 |
| 第三三分位 | 1.84(1.53~2.22) | <0.001 | 1.44(1.14~1.82) | 0.003 |
注:CI为可信区间;HR为风险比
本研究显示,血尿酸>8.5 mg/dL的心衰患者全因死亡、心血管死亡、心血管死亡和心衰住院的复合事件的发生率均较高。Cox风险回归模型显示,血尿酸水平升高是心衰患者全因死亡、心血管死亡、心血管死亡和心衰住院复合终点增加的独立危险因素,心衰患者血尿酸每增加1 mg/dL,全因死亡、心血管死亡、心血管死亡和心衰住院复合终点发生的风险增加7%。本研究结果显示,血尿酸水平升高明显增加心衰患者不良终点事件的风险,强调了心衰患者血尿酸管理的重要性。
有多项在心衰患者中的研究表明,血尿酸升高对患者的预后具有不良影响,患者的全因死亡率与血尿酸升高显著相关。Miao等人[6]进行的一份荟萃分析发现血尿酸水平升高与慢性心衰患者的全因死亡、心血管死亡或心血管复合事件风险增加有关。Huang等人[7]研究证明,较高的血尿酸水平可独立预测急性心衰患者的全因死亡和再入院或死亡的复合终点。本研究结果与既往研究结果相符。
本研究还发现,血尿酸较低的第一三分位组(<6.3 mg/dL)比第二三分位组(6.3~8.5 mg/dL)显示出全因死亡终点事件增加的趋势。与本研究结果类似,CHART-2研究[8]根据心衰患者基线时血尿酸水平由低到高分为四分位组,与血尿酸第二四分位组相比,血尿酸最低与最高组全因死亡风险增加34%和28%,心衰住院风险增加39%和35%,表明血尿酸水平与慢性心衰患者心血管风险可能呈现U型或J型曲线关系。低尿酸水平与不良预后之间的机制仍有待阐明,可能与此类患者年龄较大,多合并营养不良、低体重指数和糖尿病有关。
尿酸在心衰发生和发展中的具体病理作用机制尚不十分明确[9]。尿酸是人体内嘌呤代谢即黄嘌呤氧化酶(xanthine oxidase,XO)催化的核苷酸代谢反应的终产物,XO将次黄嘌呤转化成尿酸,最终通过肾脏和消化道排出[10]。血尿酸水平升高反映XO活性增强。尿酸生成的过程中,XO利用氧作为电子受体形成活性氧(reactive oxygen species,ROS),当ROS的产生超过了内源性抗氧化防御能力时,细胞内发生氧化应激[11],诱导血管内皮细胞和平滑肌细胞炎症细胞因子激活[12]和内皮功能障碍[13]。ROS可能在心衰的发生发展过程中导致细胞损伤,参与心衰的病理生理过程如心室重构、心肌纤维化、心肌肥大和心肌收缩力受损[14, 15, 16]。心衰患者微循环氧化代谢受损和慢性缺氧,XO表达上调且活性增加,引起尿酸合成增多和氧化应激水平升高[11]。Fujiyama等人[17]研究了270例未服用降尿酸药物的心衰患者,发现患者左心室肥厚、低LVEF和高BNP水平与XO活性显著升高相关。此外,在心衰患者中,交感神经兴奋会增加儿茶酚胺的释放,儿茶酚胺使肾小球入球小动脉收缩,降低肾小球滤过率,减少尿酸排泄,增加血尿酸浓度。尿酸升高会进一步激活肾素-血管紧张素-醛固酮系统,导致心脏重构[18]。Ogino等人[19]发现促尿酸排泄药物苯溴马隆治疗的心衰患者,虽然血尿酸水平显著下降,但是患者的血流动力学参数包括LVEF及BNP等没有明显变化,侧面提示可能是上调的XO活性而不是尿酸本身参与了心衰的血液动力学损伤过程。
与其他心脏特异性生物标志物相比,血尿酸评估心血管风险的优势包括作为常规血生化测试的项目之一,血尿酸检测过程更简单便捷且价格低廉[4]。血尿酸水平可以在心脏特异性生物标志物如NT-proBNP和肌钙蛋白之外提供额外的包括血管内皮功能障碍和代谢异常的提示。将包括血尿酸在内的多种生物标志物结合起来,可以对心血管风险和预后进行更全面的评估。
本研究仍有一定的局限性。本研究是单中心观察性研究,由于存在未被记录的一些变量如患者是否服用降尿酸药物,可能存在选择偏倚而影响结果。此外,虽然血尿酸可以作为心衰发生和预后的危险因素,但是降尿酸治疗是否能作为心衰治疗的新靶点改善心衰患者预后仍存有较大争议[20]。需要进一步的前瞻性研究以评估降尿酸治疗对心衰患者预后的影响。
综上所述,血尿酸水平升高是心衰患者全因死亡、心血管死亡、心血管死亡和心衰住院复合终点事件的独立危险因素。
齐晨, 关敬元, 王锦溪, 等. 不同血清尿酸水平对心力衰竭患者的预后价值[J]. 中华心力衰竭和心肌病杂志, 2024, 8(1): 2-9. DOI: 10.3760/cma.j.cn101460-20231208-00050.
所有作者均声明不存在利益冲突



























