
总结14例临床及基因诊断的进行性假性类风湿性发育不良(PPRD)患儿临床特点,分析PPRD关节病变特征,为临床诊疗提供参考。
回顾性分析2017年12月至2023年9月于首都儿科研究所附属儿童医院及合作单位就诊的14例PPRD患儿资料,总结其临床及基因学检测资料。将住院和随访资料进行病例观察性回顾分析,采用Kendall相关性分析法进行相关因素分析。
14例患儿中,男6例,女8例,均为中国汉族儿童;平均起病年龄6.12岁(2~11岁),平均确诊年龄10.61岁(5~17岁),确诊时平均病程4.46年(0.5~6.0年)。关节受累个数为4~14个,平均9.20个,以跛行为首发症状者12例。14例患儿均有髋关节活动受限表现,无明显髋关节疼痛。髋关节影像学提示:间隙狭窄11例,股骨颈变短2例,股骨头外移4例,关节面硬化、囊变、骨质破坏8例。四肢关节以双手近端指间关节及掌指关节膨大为主要表现,其余关节按易受累顺序为:膝(11例)、肘(8例)、腕(7例)及踝(5例)关节,肩关节受累较少见(1例)。脊柱主要表现为曲度改变,活动受限8例,以胸、腰椎受累为主(13例),颈部受累少见(1例)。确诊时病程与关节受累数及关节活动受限数目呈正相关(r=0.584、0.671,P=0.007、0.002)。本组患儿8例误诊为幼年特发性关节炎,其中误诊最长时间达6年。14例患儿均存在CCN6基因突变,其中复合杂合突变10例,纯合突变4例;5例存在c.342T>G、c.667T>G,4例存在c.589+2(IVS4)T>C,3例存在c.866dup,2例存在c.136C>T、c.624dupA。
PPRD表现为多关节受累,髋关节受累最多见,病变严重,易误诊为幼年特发性关节炎。随着病程延长,受累关节数目逐渐增加。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
进行性假性类风湿性发育不良(progressive pseudorheumatoid dysplasia,PPRD)又称晚发型脊柱骨骺发育不良伴进行性骨关节病(spondyloepiphyseal dysplasia tarda with progressive arthropathy,SEDTPA),是一种遗传性骨疾病,其特征为关节软骨进行性退变,导致疼痛、僵硬和关节增大,甚至致残,是一类以进行性、非炎症性骨-软骨发育不良为特征的常染色体隐性遗传病[1,2],国外报道的发病率约为1/100万[3]。本病目前尚无确诊标准,主要依靠特征性影像学表现和/或CCN6(以前称为WISP3)双等位基因致病变异确诊[2]。本病多于3~6岁起病[3],临床表现为多关节肿胀,可伴有疼痛,外周大、小关节均易受累,其中常受累的关节依次为双手小关节、髋、膝、肘、腕、肩、踝、足,主要表现为骨关节膨大、僵硬及活动受限。由于软骨发育不良引起关节活动障碍,甚至关节畸形,严重影响预后,也易误诊为幼年特发性关节炎(juvenile idiopathic arthritis,JIA)等慢性关节炎,本研究通过总结14例PPRD患儿临床资料,旨在为临床诊疗提供参考。
病例系列总结。选择2017年12月至2023年9月于首都儿科研究所附属儿童医院及合作单位明确诊断PPRD的患儿,共14例。本研究通过首都儿科研究所医学伦理委员会批准(批准文号:SHERLLM2023031),患儿监护人均签署知情同意书。
纳入标准:0~18岁,符合以下表现:(1)特征性影像学表现:X线提示受累关节,如双手、足的掌骨、指趾骨关节及肘、膝、腕、肩、踝关节邻近干骺端或骨端膨大,椎体普遍变扁,上下缘形态不规则、前上下缘可见骨质缺损;(2)患儿均存在CCN6双等位基因致病变异[2]。排除标准:未行高通量测序以鉴定致病基因者。
回顾性分析14例PPRD患儿的临床资料,包括临床症状、体格检查、实验室检查、影像学资料、基因检测。
采用SPSS 27.0软件进行统计学处理。计量资料采用平均数(范围)表示,计量资料进行Kendall相关性分析,P<0.05为差异有统计学意义。
14患儿中,男6例,女8例,均为中国汉族儿童;平均起病年龄6.12岁(2~11岁);平均确诊年龄10.61岁(5~17岁)。易疲劳、乏力、运动能力差多为本组患儿的早期非特异性表现;以跛行为首发症状者共12例,多表现为走路不稳,站立时双足不能并拢,多伴有臀部上翘(图1),存在关节膨大14例,以关节活动受限为主要表现2例,表现为肘、髋关节活动受限。存在身材矮小者8例,2例在确诊前误诊为矮小症。


患儿均表现为双侧关节对称性受累,见表1。

进行性假性类风湿性发育不良14例患儿关节病变情况(例)
Arthropathy of 14 children with progressive pseudorheumatoid dysplasia(case)
进行性假性类风湿性发育不良14例患儿关节病变情况(例)
Arthropathy of 14 children with progressive pseudorheumatoid dysplasia(case)
| 关节 | 受累 | 活动受限 | 疼痛 | 膨大 |
|---|---|---|---|---|
| 掌指 | 14 | 7 | 1 | 13 |
| 近端指间 | 14 | 7 | 2 | 14 |
| 腕 | 7 | 6 | 2 | 6 |
| 肘 | 8 | 6 | 3 | 0 |
| 肩 | 1 | 1 | 1 | 0 |
| 髋 | 14 | 14 | 1 | 0 |
| 膝 | 11 | 0 | 0 | 8 |
| 踝 | 5 | 3 | 0 | 4 |
| 足趾 | 3 | 0 | 0 | 3 |
| 颈椎 | 1 | 1 | 0 | - |
| 胸腰椎 | 13 | 8 | 0 | - |
注:-:无数据 -:no data
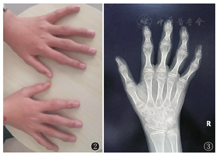
四肢关节:本组14例患儿均存在双手近端指间关节肿胀(图2),食指及中指显著,其中存在手关节活动受限7例;膝关节受累11例,2例膝内翻、1例膝外翻,关节膨大8例,无明显关节肿胀、疼痛及活动受限。

髋关节:本组14例患儿均存在双髋关节活动受限,髋关节疼痛1例,无明显关节肿胀。12例患儿存在走路姿势异常,多表现为鸭步步态,关节查体均存在关节活动度异常及"4"字征阳性。
脊椎:本组14例患儿脊柱影像学检查均存在异常,其中有活动受限表现者8例,3例表现为脊柱侧弯、2例表现为胸椎后凸,1例表现为胸椎前突,1例表现为颈椎活动受限,均有腰背部不适感,无明显关节疼痛表现。
患儿均有关节活动部分障碍。关节受累个数为4~14个,平均9.20个。14例患儿均有髋关节活动受限表现,无明显髋关节疼痛,四肢关节以双手近端指间关节及掌指关节膨大为主要表现,其余关节的受累顺序依次为膝关节11例、肘关节8例、腕关节7例、踝关节5例、肩关节1例。脊柱主要表现为脊柱曲度改变8例;活动受限较轻,均为查体发现,共8例,以胸腰椎受累为主,共6例,颈部受累少见,仅1例。
患儿均行血常规、尿常规、粪常规、血生化、凝血6项、红细胞沉降率(erythrocyte sedimentation rate,ESR)、C反应蛋白、类风湿因子、抗核抗体、抗核抗体谱、抗环瓜氨酸肽抗体、人类白细胞抗原B27(human leukocyte antigen B27,HLA-B27)抗体检查,均未见异常。
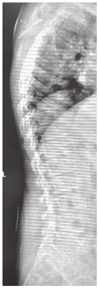
X线及CT检查:14例患儿影像学检查均存在异常,各部位X线检查均可见骨密度降低。长骨及手:干骺端明显膨大,其中以食指、中指掌指关节及近端指间关节远端受累显著(图3)。掌骨、指骨干骺端膨大14例、腕关节干骺端膨大7例、膝关节干骺端膨大8例;关节间隙狭窄6例,骨骺提前闭合及骨龄提前7例。骨盆平片表现为双髋关节间隙狭窄11例,股骨头骨骺扁平8例(图4A),股骨颈变短2例、股骨头外移4例,关节面硬化、囊变、骨质破坏8例。脊柱:椎体普遍变扁,上下缘形态不规则、前上下缘可见骨质缺损,椎间隙变窄、中后部明显,椎弓根变短(图5);颈椎受累1例,胸、腰椎受累13例。
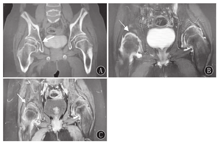


磁共振成像:髋关节磁共振成像检查表现除X线片中所见的关节间隙狭窄、关节面硬化、囊变、股骨头骨骺扁平外,还可见关节腔积液,增强扫描可见滑膜增厚、强化,以及关节面下骨髓水肿改变(图4B、图4C)。
14例患儿均行基因检测,均发现CCN6(WISP3)基因突变,其中复合杂合突变10例,纯合突变4例。14例患儿共有9种基因突变表型,其中5例存在c.342T>G、c.667T>G,4例存在c.589+2(IVS4)T>C,3例存在c.866dup,2例存在c.136C>T、c.624dupA。突变类型:错义突变10例、移码突变6例、无义突变4例、剪接突变4例。存在移码突变c.624dupA(p.C209Mfs*21)的2例患儿,起病年龄分别为11.0岁及11.5岁。14例患儿父母均为表型正常的基因突变携带者。
患儿确诊时平均病程4.46年(0.5~6.0年)。其中2例行肌肉活检,未见明显异常,诊断为骨软骨发育不良,行康复治疗3~6年。2例误诊为身材矮小症,生长激素治疗最长14个月。8例误诊为JIA,误诊最长时间达6年,其中5例接受非甾体抗炎药和甲氨蝶呤治疗6个月至3年,关节表现无改善。
2例患儿因关节疼痛,予非甾体抗炎药[双氯芬酸钠1 mg/(kg·d)]治疗,关节疼痛改善,1个月后停药。关节畸形及活动受限无效。
14例患儿平均随访6.08年(3个月至12年)。末次随访时平均年龄12.7岁(9~17岁)。10例病情缓慢进展,表现为受累关节增多、活动受限程度加重,1例生活学习基本正常,3例需要助步器协助步行,其中1例行膝关节翻修手术;无痊愈病例,无死亡病例。患儿目前均未接受特殊药物治疗。
将关节受累数目与起病年龄、确诊年龄、确诊时病程进行相关性分析显示,确诊时病程与关节受累数及关节活动受限数目呈正相关(r=0.584、0.671;P=0.007、0.002)。
WISP3基因突变是目前已知可导致PPRD的病因。WISP3基因位于6号染色体,编码Wnt-1可诱导分泌蛋白3(Wnt Ⅰ inducible signaling pathway protein 3,WISP3),属于结缔组织生长因子信号通路蛋白家族[4]。WISP3编码蛋白参与软骨形成和软骨骨发育信号通路,对于骨骼生长、维持软骨内稳态具有重要作用[5,6]。本研究14例患儿均存在CCN6基因突变,其中c.166C>T尚未见文献报道,其余突变文献数据库已报道过与PPRD相关[7,8,9,10]。与其他先天性骨代谢疾病不同,PPRD患儿多于3~6岁起病,在出生最初几年不出现临床表现。随年龄增长,关节症状逐渐出现,并进行性加重,甚至残疾。文献报道,携带CCN6 c.624dupA变异的PPRD患者发病年龄更晚[11,12]。本组病例中,平均发病年龄6.12岁。携带CCN6 c.624dupA变异的2例患儿最晚出现关节症状,发病年龄分别为11.0、11.5岁。PPRD与JIA高发年龄大致相当。临床上,PPRD表现为关节膨大和关节肿胀相似。放射学上,PPRD重症患儿可以出现关节滑膜增厚、关节腔积液、骨质破坏,甚至股骨头坏死,最终导致残疾,与JIA引起的关节病变相似。以上是PPRD容易误诊为JIA,尤其易误诊为多关节型JIA的主要原因[13,14,15,16]。本组病例中,8例曾误诊为JIA,加用甲氨蝶呤等药物治疗。JIA的典型表现为关节肿胀、关节触痛、皮温增高等,可伴有发热及虹膜睫状体炎等,ESR、C反应蛋白、类风湿因子等增高。本组病例患儿关节病变重,但白细胞、C反应蛋白及ESR等炎症指标均正常。PPRD无上述指标升高是重要鉴别点。
PPRD患儿未成熟的软骨细胞处于高增生状态,关节软骨提前退化而导致全身各关节畸形、运动障碍。本研究结果显示,髋关节是最早出现、最常受累、病变最严重的受累关节。12例有走路姿势异常,其中影像学提示关节间隙变窄11例、骨质破坏8例、股骨颈变短2例、股骨头外移4例。髋关节病变是引起PPRD预后不良的主要原因。手部关节受累也较常见,多表现为近端指间关节受累,此后可逐渐累及远端指间关节。随着病情进展,膝、腕、肘等关节逐渐受累。膝关节受累表现为膝内翻或膝外翻。肩关节受累不常见。本组病例大小关节均可以受累,均表现为多关节受累,平均受累关节数9.20个。而且随着病程逐渐延长,PPRD累及关节数量逐渐增加。关节受累以活动受限为主,也可出现关节疼痛,与JIA表现相似,但关节疼痛较少见。PPRD较少出现关节肿胀,多表现为长骨远端骨膨大,轻症患者磁共振成像提示关节积液量少且无明显滑膜增厚[17]。
由于髋部、膝及脊柱的变化导致身材矮小,病初患儿身高多正常,但终身高通常低于P3[2,18]。本研究有8例患儿表现为身材矮小。重症JIA特别是多关节型JIA,可以累及全身多个关节炎,导致残疾,合并生长发育障碍,导致身材矮小。故PPRD和JIA临床表现相似很难鉴别。PPRD患儿多存在脊柱受累表现,本研究中8例患儿有脊柱活动受限,3例表现为脊柱侧弯、2例表现为胸椎后凸,1例表现为胸椎前突,1例表现为颈椎活动受限,而多关节型JIA患儿脊柱受累较少见。脊柱骨骺发育不良影像学表现为椎体边缘粗糙,前端变扁变尖,呈子弹头样改变是PPRD最典型的影像学改变,也是和JIA最重要的鉴别点。因此对于以步态异常起病、髋关节受累严重的患儿应注意鉴别PPRD,完善影像学检查,特别是脊柱正侧位X线片,并行基因检测。根据典型的放射学改变和基因检测结果,诊断PPRD并不困难。
PPRD对患儿智力、寿命无显著影响,但可对其运动功能及生活质量造成严重影响,最终致残。目前本病尚无特异性治疗,主要为对症和支持治疗。如患儿存在关节疼痛可用非甾体抗炎药缓解,其余治疗效果欠佳。部分单中心、小样本研究提示,补充维生素D及双膦酸盐对改善骨量减少表型PPRD可能有益[19,20]。本病可以配合物理治疗和康复训练,部分患者可行外科干预,如肢具治疗、关节成形术和关节置换等[21]。早期识别,避免误诊后使用不必要的免疫抑制剂,早期康复干预有助于改善本病预后。
所有作者均声明不存在利益冲突



























