
为了更有针对性地指导临床医护人员对肠造瘘术后新生儿进行营养管理,制订本循证指南。本指南就肠内营养管理、肠外营养管理、随访与关瘘3个方面的10个临床问题,系统检索国内外相关文献,进行证据合成与评价,采用推荐意见分级的评估、制订及评价方法,对证据质量和推荐意见的推荐强度进行分级,最终形成22条推荐意见。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
部分日龄或校正日龄不足28 d的新生儿,由于先天发育异常、胎儿期及新生儿期腹部疾病等,接受肠造瘘手术治疗[1]。患儿术后短期需要依赖肠外营养,随后会逐渐过渡为肠内营养,少部分新生儿因短肠综合征而需要长期肠内肠外营养支持和多学科协作管理[2, 3]。新生儿生长快,对营养素的需求量大,但新生儿期接受肠造瘘手术的患儿可能存在不同程度的小肠长度不足、肠道本身功能欠佳、剩余肠管发育欠佳、肠造瘘口大量漏便造成营养素过度丢失等问题,容易出现营养素消化吸收障碍、水和电解质紊乱、体格生长缓慢,以及部分营养素缺乏等异常状况[4]。目前多个新生儿/婴儿肠内肠外营养指南均缺乏针对新生儿期接受肠造瘘手术患儿的建议[5, 6, 7]。2019年中华医学会肠外肠内营养学分会儿科学组发布的《儿童围手术期营养管理专家共识》[8]也没有涉及新生儿肠造瘘术后这一特殊人群。因此,为了更好地指导医护人员在新生儿肠造瘘术后进行营养管理,本工作组基于国内外临床证据,检索和评价循证学依据,结合临床实践经验,制订《新生儿肠造瘘术后营养支持实践指南(2024版)》(以下简称“本指南”),其中临床问题及其推荐意见按照“肠内营养管理-肠外营养管理-随访与关瘘”的顺序进行陈述。
本指南按照卫生保健实践指南的报告条目进行制订[9]。在国际实践指南注册与透明化平台(http://guidelines-registry.cn/index)完成注册(注册号:PREPARE-2023CN499)。涉及的名词定义见表1。

本指南涉及的名词定义
1.指南工作组与利益冲突管理:指南工作组由新生儿内科、新生儿外科、新生儿/儿科护理、营养科、消化科、影像科、检验科、循证医学、儿科质控、临床药学等专业的专家组成。所有参与者均签署书面的利益冲突声明。
2.适用人群和目标人群:适用人群为各等级医院从事新生儿内科/外科临床工作的医护人员。目标人群为在新生儿期接受了肠造瘘手术的新生儿及婴儿。
3.构建指南临床问题:指南制订工作组通过专家讨论、问卷调查、个人访谈等形式收集临床问题,再通过打分和多轮专家讨论,历时11个月,最终确定本指南的10个临床问题。
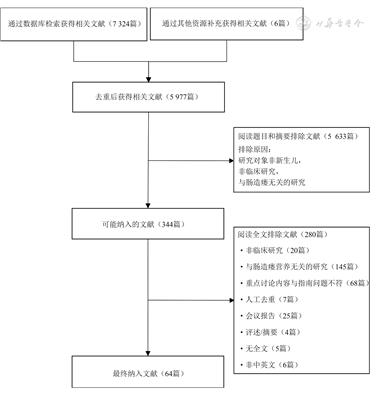
4.证据检索与评价:检索数据库为PubMed、Embase、the Cochrane Library、中国知网、中国生物医学文献服务系统、万方数据库和中华医学期刊全文数据库。中文检索词包括:营养、肠造瘘术、肠道手术、肠内、肠外、早产儿、初生婴儿、新生儿、新生儿重症监护病房;英文检索词包括:colostomy、enterostomy、enteral、enteral nutrition、extremely low birth weight、feeding methods、gastric feeding、immature、infant、intestinal failure、intravenous feeding、intestinal operation、lactose intolerance、low birth weight、neonatal、neonatal intensive care unit(NICU)、neonate、newborn、necrotizing enterocolitis、nutritional management、nutritional support、parental、parenteral nutrition、premature、preterm、refeeding、short bowel syndrome、small for gestational age、tube feeding、very low birth weight。采用主题词与自由词相结合的方式进行检索。纳入标准:(1)研究对象为新生儿期接受肠造瘘手术的患儿;(2)研究内容为营养管理相关临床研究。排除标准:(1)重复发表的文献;(2)系统评价计划书;(3)非临床研究(计划书、会议报告或摘要、述评、传统综述);(4)以中文或英文以外其他语种发表的文献。文献筛选由2名评价员独立、双盲完成,有任何分歧与第三人讨论确定。经过初筛及复筛,最终纳入64篇文献,见图1。

5.证据的评价:针对随机对照试验(randomized controlled trial,RCT)采用偏倚风险评估工具2进行偏倚风险评估[13],针对队列研究采用队列评价标准进行评价[14]。
6.推荐意见的形成:采用推荐意见分级的评估、制订及评价(grading of recommendations assessment,development and evaluation,GRADE)方法(http://www.gradeworkinggroup.org/)对证据体的证据质量和推荐意见的推荐强度分级[15],分为强推荐、弱推荐和良好实践声明(good practice statement,GPS)(表2)。所有推荐意见均经3轮德尔菲法投票表决。

GRADE证据质量与推荐强度分级
GRADE证据质量与推荐强度分级
| 分级 | 具体描述 |
|---|---|
| 证据质量分级 | |
| 高(A) | 对观察值非常有把握:观察值接近真实值 |
| 中(B) | 对观察值有中等把握:观察值有可能接近真实值,但也可能差别较大 |
| 低(C) | 对观察值的把握有限:观察值可能与真实值有很大差别 |
| 极低(D) | 对观察值几乎没有把握:观察值与真实值可能有极大差别 |
| 推荐强度分级 | |
| 强(1) | 明确显示干预措施利大于弊或弊大于利 |
| 弱(2) | 利弊不确定或无论质量高低的证据均显示利弊相当 |
| 良好实践声明(GPS) | 基于非直接证据或专家意见/经验形成的推荐 |
注:GRADE为推荐意见分级的评估
7.撰写和外审:2023年4月成立指南制订工作组。2023年7月完成临床问题收集,并开始基于这些问题进行文献检索、证据的评价与综合。2024年2月完成第1稿,历经指南工作组成员的多次研讨和修改形成初稿,于2024年3月8日送外审。
8.传播和更新:本指南拟依托国家儿童医学中心和《中华新生儿科杂志》的平台进行传播。并将根据证据和政策的改变,每3~5年予以适时更新。
临床问题1:肠造瘘术后可以开始肠内营养的时间
【推荐意见】
1.1 在肠道条件允许的前提下,尽早开始肠内营养。(1B)
1.2因坏死性小肠结肠炎(necrotizing enterocolitis,NEC)接受肠造瘘术的新生儿,开始肠内营养的时间通常晚于因肠道先天畸形接受肠造瘘术的新生儿。(1C)
1.3达到以下条件时,可考虑开始肠内营养:胃管引流液<15 ml/(kg·d),且造瘘口已开始排便,同时患儿不需或仅需低剂量血管活性药物维持循环。(2D)
【证据概述】
新生儿期接受肠造瘘手术的疾病种类较多[16],病情的个体差异大,术后开始肠内营养的时间需要根据不同病种分别对待,但“尽早开始肠内营养”的理念是可以提倡的。针对新生儿胃肠手术后早期肠内营养问题,指南证据组对3篇RCT和6篇队列研究(其中RCT研究n=282,队列研究n=1 034)[3,17, 18, 19, 20, 21, 22, 23, 24]进行系统评价,结果显示,早期肠内营养可缩短术后首次排便时间(MD=-22.26 h,95%CI -34.06~-10.45 h)及术后住院时间(MD=-4.57 d,95%CI -5.94~-3.2 d),差异有统计学意义(P<0.05),且不增加呕吐(RR=1.02,95%CI 0.64~1.63)、腹胀(RR=1.29,95%CI 0.87~1.93)、腹泻(RR=0.96,95%CI 0.31~2.98)、术后死亡(RR=0.74,95%CI 0.45~1.21)、吻合口漏(RR=0.52,95%CI 0.18~1.53)、术后二次NEC(RR=0.82,95%CI 0.32~2.09)的发生率(P均>0.05)。
针对因先天畸形接受肠造瘘术的新生儿,文献报道术后开始肠内营养的时间点为术后8~20 h[19]、术后24 h内且麻醉清醒后[18];因NEC接受肠造瘘术的新生儿,由于术前患儿肠道坏死、肿胀、炎症反应等病变较重,术后开始肠内营养的时间晚于因先天畸形接受肠造瘘术的新生儿。2021年英国一项NEC新生儿肠造瘘术后肠内营养的前瞻性队列研究(n=143)以术后7 d为时间点,结果显示术后7 d内开始肠内营养者与7 d之后开始肠内营养者相比,患儿术后28 d内死亡或依赖肠外营养率差异无统计学意义(OR=0.4,95%CI 0.2~1.1,P=0.07)[17]。但该文未提供术后早期开始肠内营养相关的胃肠道并发症和喂养不耐受等数据。这几项研究均为队列研究。2015年美国霍普金斯儿童医学中心的多学科团队建议,因小肠衰竭高危而行肠道手术的婴儿术后开始肠内营养指征为胃管引流液< 15 ml/(kg·d),且造瘘口已开始排便,同时患儿仅需5 μg/(kg·min)以下的多巴胺维持循环[25]。2020年的一项前瞻性队列研究(n=409)结果显示,采用该建议进行术后早期喂养后,患儿小肠衰竭相关肝病发生率(20%比32%,P=0.005)、达全肠内营养时间(21 d比28 d,P<0.001)、导管相关血流感染发生率(5%比25%,P<0.001)和平均住院日(53 d比70 d,P=0.03)均较前降低[3]。
临床问题2:肠造瘘术后肠内营养的起始奶量和加奶速度
【推荐意见】
2.1对于术前已开始肠内营养且体重>1 000 g患儿的起始奶量为15~20 ml/(kg·d),对于术前未开始肠内营养且体重<1 000 g患儿的起始奶量为10~15 ml/(kg·d),可根据患儿的喂养耐受情况给予Q2~4h的喂养频次。(GPS)
2.2按上述起始奶量开始肠内营养后观察3~7 d,若未出现喂养不耐受表现,则加奶速度为10~20 ml/(kg·d)。(GPS)
2.3对术前已开始肠内营养且体重<1 000 g、术前未开始肠内营养且体重>1 000 g的患儿,需根据具体情况,由主管医生决定其肠造瘘术后肠内营养的起始奶量和加奶速度。(GPS)
【证据概述】
未检索到关于该问题的系统综述或RCT研究。
2015年美国霍普金斯儿童医学中心的多学科团队推荐,对接受了肠道手术的小肠衰竭婴儿实施的开始肠内营养策略是[25]:(1)当婴儿具备肠内营养条件时,起始奶量根据术前是否开始肠内营养以及体重是否<1 000 g而定;若术前已开始肠内营养且体重>1 000 g,则起始奶量为20 ml/(kg·d),体重<1 500 g者可为15 ml/(kg·d);若术前未开始肠内营养且体重<1 000 g,体重800~1 000 g者起始奶量为2 ml Q4h[相当于12~15 ml/(kg·d)]且5 d不加奶,体重<800 g者1 ml Q4h且5 d不加奶。(2)不耐受肠内营养的标准是:腹围增加超过基线的10%,或24 h造瘘口漏便量较前一日翻倍或>50 ml/(kg·d),或24 h内大便次数>10次,或出现血便。(3)如没有上述不耐受肠内营养的表现,则加奶速度为每12~24 h加奶15~20 ml/(kg·d)。但上述推荐意见并非按照循证指南的方法总结制订,而是美国霍普金斯儿童医学中心对临床工作经验的总结;同时,该研究报道中未提及“术前已开始肠内营养且体重<1 000 g”和“术前未开始肠内营养且体重>1 000 g”的患儿,临床实际工作中只能根据具体情况,由主管医生决定这两类患儿肠造瘘术后肠内营养的起始奶量。该团队对比了实施上述策略前57例(含21例NEC、11例肠闭锁、9例腹壁裂、9例自发性肠穿孔、2例巨结肠、2例肠扭转、3例其他疾病)与实施后33例(含11例肠闭锁、9例腹壁裂、5例NEC、4例自发性肠穿孔、2例肠扭转、2例其他疾病)手术干预的肠衰竭婴儿结局,发现肠内营养的起始奶量从之前的10 ml/(kg·d)增加到了20 ml/(kg·d)(P<0.001),患儿耐受良好、达到50%全肠内营养的时间缩短了6 d,且未再发生NEC(P=0.012),肠外营养相关肝病(parental nutrition associated liver disease,PNALD)发生率从70%降至48%(P=0.046)、直接胆红素峰值从5.6 mg/dl降至2.3 mg/dl(P=0.011)。但该研究中患儿接受的手术干预并非全都是肠造瘘术,接受肠造瘘术的婴儿在上述策略实施前占51%(29例)、实施后占33%(11例)。欧洲儿科胃肠肝病和营养学会定义早期微量喂养的起始奶量为12~24 ml/(kg·d)且开始肠内营养的最初3~7 d不再增加奶量[6]。2020年Shakeel等[3]的队列研究对比了按照上述管理策略执行前后肠道手术婴儿的结局(n=409),发现实施该策略后,患儿PNALD发生率、导管相关血流感染发生率、达全肠内营养时间和平均住院日均显著降低,差异有统计学意义(P均<0.05)。
临床问题3:肠造瘘术后肠内营养的奶类选择
【推荐意见】
肠内营养首选母乳、次选捐赠人乳,在无法实现母乳或捐赠人乳喂养时,可根据新生儿基础状况和喂养耐受情况,酌情个体化选择水解蛋白配方奶或早产儿配方奶或标准婴儿配方奶。(GPS)
【证据概述】
母乳喂养对新生儿及婴儿的益处已毋庸置疑,在无法实现母乳喂养的情况下,应次选捐赠人乳,这是已经明确的临床共识。2018年Miller等[26]的系统评价证实母乳喂养可降低极低出生体重儿NEC发生率。同理,对曾经发生NEC并需要肠造瘘手术的患儿,母乳喂养同样有利于降低患儿NEC的再次发生率。但出于临床伦理学的考虑,目前无法对这类患儿术后进行母乳喂养与配方奶喂养对NEC再次发生率影响的RCT研究。接受肠道手术的围术期照护指南提出了“术后快速康复”(enhanced recovery after surgery,ERAS)理念,其前提条件是术后肠内营养首选母乳喂养,仅在无法实现母乳喂养时才选择配方奶喂养[27]。Picaud等[28]的探索性RCT研究显示,部分水解蛋白早产儿配方奶有助于早产儿顺利加奶,但没有证据显示其对早产儿远期预后的益处。2022年Li等[29]的系统评价显示,与整蛋白早产儿配方奶相比,水解蛋白配方奶有利于降低早产儿喂养不耐受的风险(RR=0.61,95%CI 0.42~0.90)及缩短达全肠内营养的时间(MD=-0.56,95%CI -1.03~-0.10)。对于术前已明确存在牛奶蛋白过敏的肠造瘘患儿,国内外指南均推荐术后可选用水解蛋白配方奶[30, 31]。一项RCT研究显示[32],对于腹部手术致短肠综合征的婴儿,采用水解蛋白配方奶并不提高肠造瘘术后患儿营养物质的吸收和能量摄入。2017年王敏等[33]的队列研究(n=64)结果显示,肠造瘘术后新生儿采用全程要素制剂、全程整蛋白制剂、要素转整蛋白制剂和整蛋白转要素制剂喂养,患儿的体重增长差异无统计学意义。
临床问题4:新生儿肠造瘘术后肠内营养添加含鱼油肠内脂肪乳的有效性和安全性
【推荐意见】
4.1在肠道可耐受的情况下,新生儿肠造瘘术后可在肠内营养中添加含鱼油的肠内脂肪乳,有利于患儿体重增长,减轻胆汁淤积程度和降低导管相关血流感染发生率。(2C)
4.2 在有经验的营养师指导和监督下,在肠内营养中添加含鱼油的肠内脂肪乳是安全的。(2C)
【证据概述】
共纳入1项RCT研究和2个病例系列报告。Yang等[34, 35, 36]的RCT(n=36,其中干预组和对照组各18例)研究结果显示,与对照组(常规肠内营养)相比,干预组早期在常规肠内营养的基础上,再口服添加由鱼油和微脂(微脂的主要成分为植物红花油,其脂肪乳浓度为50%)组成的复合口服脂肪乳剂,可提高造瘘口关闭后患儿体重、身长增长速率,干预组的脂肪吸收率、蛋白吸收率、肠内营养耐受量均高于对照组,中心静脉置管天数、静脉输注脂肪乳天数、抗生素使用天数均低于对照组,且差异有统计学意义,尤其有益于高位肠造瘘患儿。具体用法:(1)鱼油和微脂分别以不同剂量开始添加,然后以不同剂量进行增量,2种成分分别按照不同的剂量进行混合后,再口服补充;(2)鱼油的起始剂量为0.2 g Q12h(体重<1 000 g)或 0.25 g Q12h(体重>1 000 g),随体重的增加逐渐增加鱼油剂量直至最大量0.5 g Q6h;(3)微脂初始剂量为1 g/(kg·d),每日增加0.5 g/kg直至2.5 g/(kg·d),同时每日等比减少静脉脂肪乳的输注量,直至静脉脂肪乳剂量小于1 g/(kg·d)时停用静脉输注。病例系列报告结果显示,在肠内营养中添加鱼油,患儿造瘘口的漏便量显著减少,有助于患儿的体重增长[37]、促进肠造瘘术后合并PNALD婴儿肝功能恢复(特别是胆汁淤积的程度)和顺利达到全肠内营养[38]。上述文献未报告在肠内营养中添加口服鱼油的不良事件。值得注意的是,口服鱼油并非常规在奶类中添加的营养素,上述文献添加口服鱼油的前提条件均是患儿已开始肠内营养且可耐受,而口服鱼油的配制和添加均在有经验的营养师指导和监督下完成。从文献报道看,上述含鱼油肠内脂肪乳的添加时间始于术后开始肠内营养的初始阶段,且在有经验的营养师指导和监督下实施时,有较好的临床安全性。
临床问题5:新生儿肠造瘘术后进行肠液回输的适应证、有效性和安全性
【推荐意见】
5.1肠液回输适应证的前提是除外远端肠道梗阻,患儿至少出现下列情况之一:高流量肠瘘、体重增长差、高位肠造瘘、远端肠管细小。(GPS)
5.2 对于符合指征的新生儿,肠液回输有利于新生儿造瘘术后的体重增长和病情恢复。(2C)
5.3基于目前证据,对肠造瘘术后肠液回输的安全性未能形成推荐意见,临床实施前,需与新生儿外科医生一起对患儿实施肠液回输的安全性进行个体化评估。(GPS)
【证据概述】
未检索到关于新生儿肠造瘘术后进行肠液回输适应证的系统评价或RCT研究。文献报道新生儿肠造瘘术后进行肠液回输的指征包括高流量肠瘘[39, 40]、体重增长不佳[41, 42]、高位肠造瘘(含短肠综合征)[39,43]、远端肠管细小[43, 44],这些均是肠造瘘术后难以建立足量肠内营养、住院时间长、营养相关并发症发生率高的患儿,进行肠液回输前需除外远端肠管闭锁或完全梗阻。
关于肠液回输的有效性,共纳入1项系统评价(n=623,纳入的研究均为队列研究)和1项探索性RCT研究(n=15)。2023年Solís-García和Jasani[44]的系统评价显示,对于符合上述适应证的患儿进行肠液回输可缩短肠外营养时间(MD=-37.17 d,95%CI -63.91~-10.43 d),并降低胆汁淤积发生率(RR=0.46,95%CI 0.36~0.59),缩短造瘘术后(MD=-13.37 d,95%CI -24.61~-2.13 d)及关瘘后(MD=-14.76 d,95%CI -23.04~-6.48 d)达全肠内营养时间,缩短总住院时长(MD=-55.12 d,95%CI -102.21~-8.03 d),差异均有统计学意义。探索性RCT研究结果显示肠液回输可促进短肠综合征新生儿肠造瘘远端的肠管发育,从而有利于最终关瘘吻合[12]。
针对新生儿肠造瘘术后肠液回输安全性问题,对1篇探索RCT[12]和9篇队列研究[41, 42,45, 46, 47, 48, 49, 50, 51]进行系统评价(n=442),结果显示,共有23例(5.2%)发生不良事件,肠液回输未增加临床不良事件的总发生率(RR=0.69,95%CI 0.15~3.26,P=0.64)。这些文献中肠液回输使用的管路为胃管或导尿管(6 Fr或8 Fr或10 Fr),手动收集造瘘袋中的漏便(每4~6 h或3~4 h或每8 h收集一次)、用静脉推注泵或奶泵进行回输(速度为1~15 ml/h)。所有文献中均未将感染作为不良事件进行报告。日本1项病例对照研究(n=16)中,每3 h手动收集造瘘袋中的肠液进行远端肠管回输,同时进行回输肠液的常规细菌培养,最终所有患儿回输肠液中均未培养出致病菌[47]。对于远端肠管明显细小者,根据临床经验判断,肠液回输可能存在肠黏膜损伤的风险。有1项临床观察性研究(n=23)报告了3例新生儿在肠液回输后数日发生远端肠穿孔,其中1例在穿孔后死亡[39]。但该文未详细阐述导致肠穿孔或死亡的原因。由于新生儿肠造瘘病例数在全部住院新生儿中占比不高,其中需要进行肠液回输的病例数更少,多数医护人员缺乏临床实践经验,因此,为保证临床安全性,对于新生儿肠造瘘术后给予肠液回输的适应证、时机和安全性,新生儿科医生需与新生儿外科医生共同讨论决定。
临床问题6:新生儿肠造瘘术后静脉液体输注量和输注方式
【推荐意见】
遵循已发表的营养管理指南推荐意见进行静脉液体量的管理,需根据患儿出生胎龄、出生体重和日龄,结合临床病情及体重变化、血或尿液相关实验室检查结果、造瘘口排出量和尿量进行静脉液体量的动态调整。(GPS)
【证据概述】
中国[7, 8]、英国[5]及欧洲胃肠及营养协会[6]等多部中外指南已针对新生儿及儿童营养支持所需静脉液体量进行了推荐。新生儿出生胎龄、出生体重、日龄、并发症状况不同,每日需要的液体总量不同,肠外营养量和肠内营养量需根据病情不同进行调整。对于新生儿期接受肠造瘘术的患儿,由于肠道自身条件欠佳,甚至还存在短肠综合征[1,4],因此水和电解质易从近端造瘘口排出,特别是造瘘口位置高的患儿,易发生脱水、电解质紊乱和营养不良[52]。但肠造瘘口丢失的肠液和漏便在临床上属于液体疗法中的继续损失量,因此,可遵循现有临床指南的液体管理方案,在补液时适当补充这部分继续损失量和电解质,并需根据体格生长,在营养素补充方面进行调整及加强。新生儿肠造瘘术后的实际静脉液体输注量需根据患儿生命体征及体重、实时出入量、血或尿液实验室检查结果等动态调整。
有1篇病例报告对接受肠造瘘术并出现胆汁淤积的新生儿,将其原本的肠外营养恒定速度输注改为肠外营养循环输注,连续10周循环,患儿直接胆红素降至正常,期间未出现低血糖现象[10]。一项回顾性队列研究(n=14)对接受腹部外科手术的新生儿,在术后1周、患儿尚未出现胆汁淤积时即开始实施预防性的肠外营养循环输注,结果显示该方式可以缩短患儿依赖全肠外营养的时间,但该研究发现21%的患儿血糖监测值低于正常范围,有1例为症状性低血糖[11]。
临床问题7:新生儿肠造瘘术后肠外营养中脂肪乳和微量营养素的补充
【推荐意见】
7.1 长期依赖肠外营养的患儿,宜选择含鱼油的多种油复合脂肪乳。(1B)
7.2根据造瘘口位置、损失肠管长度及部位,有针对性地补充微量营养素(例如锌、铁、钙、维生素B12、脂溶性维生素A/D/K等)。(GPS)
【证据概述】
针对新生儿肠外营养中脂肪乳的输注,共纳入1项系统评价和队列研究。系统评价(含25项研究,n=2 429)结果显示,相比于以豆油为基质的脂肪乳,含鱼油的脂肪乳可同等程度地促进新生儿体重和头围增长,更有助于降低胆汁淤积发生率(RR=0.5,95%CI 0.27~0.92)[53]。中华医学会小儿外科学分会新生儿学组的专家共识[54]认为,肠切除术后剩余小肠长度不足该胎龄患儿预测小肠长度的25%或术后需42 d以上静脉营养支持者,均属于短肠综合征,术后易发生营养素缺乏和PNALD。队列研究(n=38)结果显示,在肠外营养中添加含有鱼油的ω-6/9脂质乳剂,可以降低短肠综合征患儿的死亡率及PNALD发生率,降低胆红素峰值[55]。由于微量元素(例如锌、铁等)和维生素(例如维生素B12、脂溶性维生素A/D/K等)的吸收主要发生在十二指肠和空肠,因此新生儿肠造瘘术后(特别是高位肠造瘘术后)易发生这些微量营养素不足甚至缺乏。有研究证实,87.5%的短肠综合征患儿存在至少一种微量营养素缺乏,其中维生素D缺乏(64.1%)最常见,其次是铁(48.7%)、维生素B12(34.2%)和维生素E(28.6%)缺乏[56]。但目前尚无高质量研究阐明肠造瘘术后补充微量元素的剂量和时间,可参照2018年欧洲儿科胃肠肝病和营养学会制订的新生儿/婴儿肠外营养指南中对于微量元素补充量的推荐意见[6]及中华医学会肠外肠内营养学分会制订的多种微量元素制剂临床应用专家共识[57]执行,并结合患儿临床表现和实验室检查结果有针对性地进行补充。铁剂补充以口服为主。由于机体缺乏有效的排铁机制,因此补充铁剂需要在严密监测血清铁的前提下进行。在新生儿/婴儿长期禁食的情况下,是否需要静脉补铁以及静脉补铁的剂量,临床决策需谨慎,对此,欧洲儿科胃肠肝病和营养学会谨慎地给出了7条推荐意见[6],且7条推荐意见对应的证据等级均为低或极低。
临床问题8:新生儿肠造瘘术后营养支持的监测指标
【推荐意见】
8.1常规监测指标包括体重及其增长速率、身长、头围、皮褶厚度,尿量、近端造瘘口漏便量,腹部张力,血糖、血红蛋白、肝肾功能(含胆红素和碱性磷酸酶)、甘油三酯和电解质(含钙磷镁)、25-羟基维生素D等。(GPS)
8.2特殊监测指标包括尿钠、部分微量元素及维生素(尤其是维生素A、维生素D、维生素B12、维生素K、锌及铁)。(GPS)
【证据概述】
多个国内外指南[5,7, 8]已针对新生儿肠外营养期间的常规监测指标进行了推荐,结合临床实际情况,新生儿肠造瘘术后营养支持的常规监测指标包括体重及其增长速率、身长、头围、皮褶厚度、近端造瘘口漏便量、腹部张力、血红蛋白、血清肝肾功能和电解质等。由于新生儿肠造瘘术后易发生肠外营养相关胆汁淤积和高直接胆红素血症、代谢性骨病,因此常规监测指标中需包含血清胆红素、碱性磷酸酶、血清钙磷镁、25-羟基维生素D等。
在高位肠造瘘术后,需要针对在十二指肠和空肠吸收的维生素和微量元素血清水平进行监测。2020年欧洲ERAS《新生儿肠道手术围手术期管理指南共识》建议对肠造瘘患儿常规监测尿钠,其目标监测值为>30 mmol/L[27]。但该推荐的证据等级和推荐强度均低,且个体差异大。对新生儿期接受肠造瘘术患儿进行微量元素和维生素监测的理由已在前一个临床问题的证据概述中描述。有研究证实,新生儿期后的肠衰竭儿童同样易发生维生素D、锌及铁的缺乏[58],但这些微量营养素的补充剂量和时间应根据监测结果进行个体化调整[59]。
临床问题9:新生儿期接受肠造瘘手术患儿的出院后随访
【推荐意见】
9.1出院后定期进行多学科团队随访。(1D)
9.2各医院可根据实际情况制订出院后营养管理流程。(GPS)
【证据概述】
由于新生儿期接受了肠造瘘术的患儿容易合并其他器官发育异常、感染和(或)神经系统发育异常[1, 2,60],这部分患儿住院期间的诊治需要多学科协作,出院后亦需要多学科随访。针对新生儿期接受肠造瘘术患儿出院后的多学科随访,共纳入3篇队列研究(n=342),其多学科随访团队由新生儿科、外科、营养、护理和保健等专科人员组成,并对患儿进行定期随访,研究结果显示,这种方式可降低患儿出院后死亡率[61, 62]及再次败血症发生率[61]。有研究报道,若患儿出院后多学科随访团队与住院期间的多学科诊治团队成员一致,可大大提高患儿家长出院后随访的依从性[63]。
针对新生儿期接受了肠造瘘术患儿的出院后营养管理和随访,各医院可以根据自身条件,并结合国家卫生健康委发布的早产儿保健工作规范中对于高危儿的随访建议,制订适应各自条件的随访策略。国内专科医院制订的新生儿期接受肠造瘘术患儿的院外营养管理方案[4]中,几条特殊医嘱值得借鉴:(1)嘱家长记录24 h造瘘口漏便性状和量,如果漏便性状为稀糊到糊状,漏便量不超过奶量的1/3,则按照20 ml/(kg·d)的速度逐渐递增奶量直至每日总奶量达150~180 ml/kg;如果漏便性状明显变稀,漏便量超过奶量的1/3,则不再加奶、观察2~3 d,或返院就诊。(2)鼓励母乳喂养,对于早产儿首选母乳和添加母乳强化剂或早产儿出院后配方奶粉,对于存在明显吸收不良者予以深度水解配方奶粉喂养,对于合并胆汁淤积或脂肪泻者选择强化中链甘油三酯配方奶粉,对于短肠综合征者首选深度水解配方奶粉。(3)明确为短肠综合征者,喂养间隔缩短至1.5~2 h,但夜间深睡时不唤醒。(4)出院后随访频率为每月1次,密切监测头围和体重变化。(5)对于关瘘术后肠道功能已恢复而体格发育仍落后者,可辅以高热量及高营养素密度(蛋白质供热比达8.9%~11.5%)的肠内营养制剂,以保持体重增长和线性生长。
临床问题10:新生儿肠造瘘术后的关瘘时间
【推荐意见】
10.1一般情况下,新生儿期接受肠造瘘术的患儿,关瘘时间不宜早于术后8周。(2C)
10.2 通常在新生儿肠造瘘术后12周左右进行关瘘。(2D)
10.3新生儿期接受肠造瘘术的患儿术后12周前提前关瘘的指征:高位小肠造瘘肠液丢失过多导致水电解质紊乱和(或)营养不良及体重不增、造瘘口狭窄或反复脱出等并发症、患儿依赖肠外营养胆汁淤积逐渐加重、中心静脉反复感染等。(GPS)
【证据概述】
关于新生儿肠造瘘术后的关瘘时间目前尚未统一。目前临床上相对公认的关瘘原则为:若患儿肠内营养建立顺利且体重增长良好,则尽可能在造瘘术后12周甚至更长时间后再关瘘。临床上早关瘘常由于某些客观原因被迫进行,主要原因包括:(1)高位小肠造瘘造成肠液丢失过多,导致严重脱水及电解质紊乱、体重不增和营养不良;(2)造瘘口并发症:狭窄或反复脱出;(3)依赖肠外营养但胆汁淤积逐渐加重或反复发生中心静脉相关血流感染[64]。目前,新生儿外科就什么时候关瘘算早关瘘或晚关瘘的问题并未形成统一意见。2017年一项针对NEC肠造瘘术后关瘘时间的系统评价结果显示,肠造瘘术后8周后关瘘组与术后8周内关瘘组相比,关瘘手术并发症(包括吻合口瘘、脓毒症、伤口愈合不良、切口疝、术后麻痹性肠梗阻)的发生率差异无统计学意义(P>0.05)[65]。在该系统评价基础上,在纳入几项新发表的队列研究后,针对9项队列研究[64,66, 67, 68, 69, 70, 71, 72, 73](n=440)重新进行系统评价,结果显示,以肠造瘘术后12周为时间节点,在12周之前关瘘的话,患儿的吻合口瘘、脓毒症、伤口愈合不良、切口疝等手术相关并发症发生率,与12周之后关瘘者比较差异无统计学意义(RR=1.94,95%CI 0.75~5.00),而以肠造瘘术后8周为关瘘时间点,在8周之前关瘘的话,患儿的吻合口瘘、脓毒症、伤口愈合不良、切口疝等手术相关并发症明显高于8周之后关瘘者(RR=2.48,95%CI 1.09~5.66)。Veenstra等[70]的研究以术后8周和术后12周为时间点,将新生儿期接受肠造瘘术的患儿根据关瘘时间分为3组(<8周、8~12周、>12周关瘘)进行比较,发现3组之间肠外营养时间、达全肠内营养时间、胆汁淤积发生率的差异均无统计学意义,即该研究未能得出关瘘时间点的明确结论。新生儿肠造瘘的病因较多,临床上部分患儿可能因全身状态不好、肠道条件不好等原因导致延长关瘘时间,本指南未能就“新生儿肠造瘘术后什么时间关瘘属于延迟关瘘”的问题搜集到有效的循证证据。
本指南纳入文献样本量偏小,且该领域缺乏高质量临床研究及国内研究证据。
(黑明燕 冯琪 刘雅莉 史源 林振浪 彭小明 容志惠 黄勋 刘仕祺 杜娟 执笔)
指南制订成员(按单位及姓氏汉语拼音排序)
指南指导委员会:北京大学第三医院(朴梅花);北京大学第一医院及《中华新生儿科杂志》编辑部(姜毅);北京协和医院(王丹华);福州市儿童医院(章丽燕);贵阳市妇幼保健院(刘玲);国家儿童医学中心/复旦大学附属儿科医院(陈超);国家儿童医学中心/首都医科大学附属北京儿童医院(彭晓霞);泉州市妇幼保健院(陈冬梅);深圳市妇幼保健院(杨传忠);首都儿科研究所附属儿童医院(李莉);四川大学华西第二医院(母得志);苏州大学附属儿童医院(冯星);天津市中心妇产医院(郑军);西北妇女儿童医院(李占魁);中国人民解放军总院第七医学中心(封志纯);中国医科大学附属盛京医院(富建华、李娟);中山医科大学第八医院(周晓光);浙江大学医学院附属儿童医院(杜立中);郑州大学第一附属医院(程秀永)
指南制订工作组:北京大学第三医院(韩彤妍);北京大学第一医院(冯琪、侯新琳);北京大学人民医院(刘捷);重庆妇幼保健院(李芳);重庆医科大学附属儿童医院(史源);电子科技大学医学院附属妇女儿童医院/成都市妇幼保健院(巨容);东南大学附属徐州医院(高翔羽);复旦大学附属儿科医院(张蓉);广西壮族自治区妇幼保健院(韦秋芬);国家儿童医学中心/首都医科大学附属北京儿童医院(黑明燕、黄金狮、刘敏、刘雅莉、梅冬、彭芸、齐宇洁、田晓怡、吴捷、闫洁、杨芹);河北省儿童医院(马莉);河南省儿童医院(康文清);湖北省妇幼保健院(夏世文);湖南省儿童医院(彭小明);华中科技大学同济医学院附属同济医院(容志惠);吉林大学白求恩第一医院(武辉);昆明医科大学附属医院(梁琨);南京医科大学附属妇产医院/南京市妇幼保健院(韩树萍);南京医科大学附属儿童医院(程锐);上海新华医院附属医院(张拥军);首都儿科研究所附属儿童医院(马立霜);苏州大学附属儿童医院(朱雪萍);温州医科大学附属第二医院(陈尚勤、林振浪);新乡医学院第一附属医院(唐成和);浙江大学医学院附属儿童医院(陈正);中国人民解放军总院第七医学中心(李秋平);中南大学湘雅三医院(何利);中南大学湘雅医院(黄勋);《Pediatric Investigation》编辑部(刘春艳);《中华新生儿科杂志》编辑部(刘卫华)。NICU患儿家长:高旭萌(北京)
指南证据合成与评价组:国家儿童医学中心/首都医科大学附属北京儿童医院(杜娟、何雯雯、李可悦、刘仕祺、刘瑶、罗婧洁、史明睿、杨子馨、郁洁、张远、郑旭、朱杏)
指南外部评审小组:北京大学第三医院(童笑梅);北京大学国际医院(张雪峰);重庆医科大学附属儿童医院(包蕾);湖南省儿童医院(高喜容);南方医科大学南方医院(杨杰);上海市儿童医院(龚小慧);首都医科大学附属北京友谊医院(崔红);天津儿童医院(郝丽红);武汉大学中南医院(靳英辉);郑州大学第三附属医院(徐发林);中南大学湘雅三医院(薄涛)
感谢国家儿童医学中心/首都医科大学附属北京儿童医院图书馆、临床流行病与循证医学中心老师们在文献检索、指南制订方法学方面的帮助和指导
国家儿童医学中心/首都医科大学附属北京儿童医院,《中华新生儿科杂志》编辑委员会, 中国医师协会新生儿科医师分会生命支持学组,等. 新生儿肠造瘘术后营养支持实践指南(2024版)[J]. 中华新生儿科杂志, 2024, 39(6): 321-331. DOI: 10.3760/cma.j.issn.2096-2932.2024.06.001.
所有作者声明无利益冲突



























