
了解全国临床分离碳青霉烯类耐药肺炎克雷伯菌对抗菌药物的敏感性、耐药机制和分子特征。
收集自我国31个省、市和自治区151所医疗机构2021年1—6月临床分离的碳青霉烯类耐药肺炎克雷伯菌,按区域统一运送至3个中心实验室。中心实验室按照统一的实验方案进行菌种复核鉴定,肉汤微量稀释法测定碳青霉烯类耐药肺炎克雷伯菌(CRKP)对抗菌药物的敏感性,所有菌株进行全基因组测序,分析菌株产生的碳青霉烯酶基因和多位点序列分型。
共收集CRKP菌株4 314株,CRKP57.7%(2 396/4 152)分离自呼吸道标本,其次为泌尿道标本(12.3%,510/4 152)和血液标本(10.40%,432/4 152)。药敏试验结果显示,氨曲南-阿维巴坦、黏菌素E、多黏菌素B和替加环素对CRKP具有高度抗菌活性(敏感率90.3%~96.4%)。头孢他啶-阿维巴坦及亚胺培南-瑞来巴坦在成人分离株中的敏感率高于儿童[分别为88.9%(3 399/3 822)和75.9%(2 902/3 822),51.4%(253/492)和50.4%(248/492)],而阿米卡星及复方磺胺甲基异噁唑在儿童分离株中的敏感率更高(65.2%,321/492和65.2%,321/492比25.5%,975/3 822和36.8%,1 407/3 822)。KPC-2基因(85.9%,3 705/4 314)仍是我国CRKP中主要流行的碳青霉烯酶基因类型,其次为NDM(7.8%,336/4 314)及OXA-48-like(1.3%,56/4 314)基因。此外,部分菌株携带KPC-3、KPC-12、KPC-21、KPC-33和 KPC-71等基因。虽然产KPC-2是成人与儿童分离CRKP的主要耐药机制,但检出率差别大,分别为90.2%(3 447/3 822)和52.2%(257/492),儿童患者中CRKP携带NDM基因的比例明显高于成人,分别为41.9%(206/492)和3.4%(130/3 822)。多位点序列分型结果显示,我国临床分离的CRKP仍以ST11克隆型流行为主。
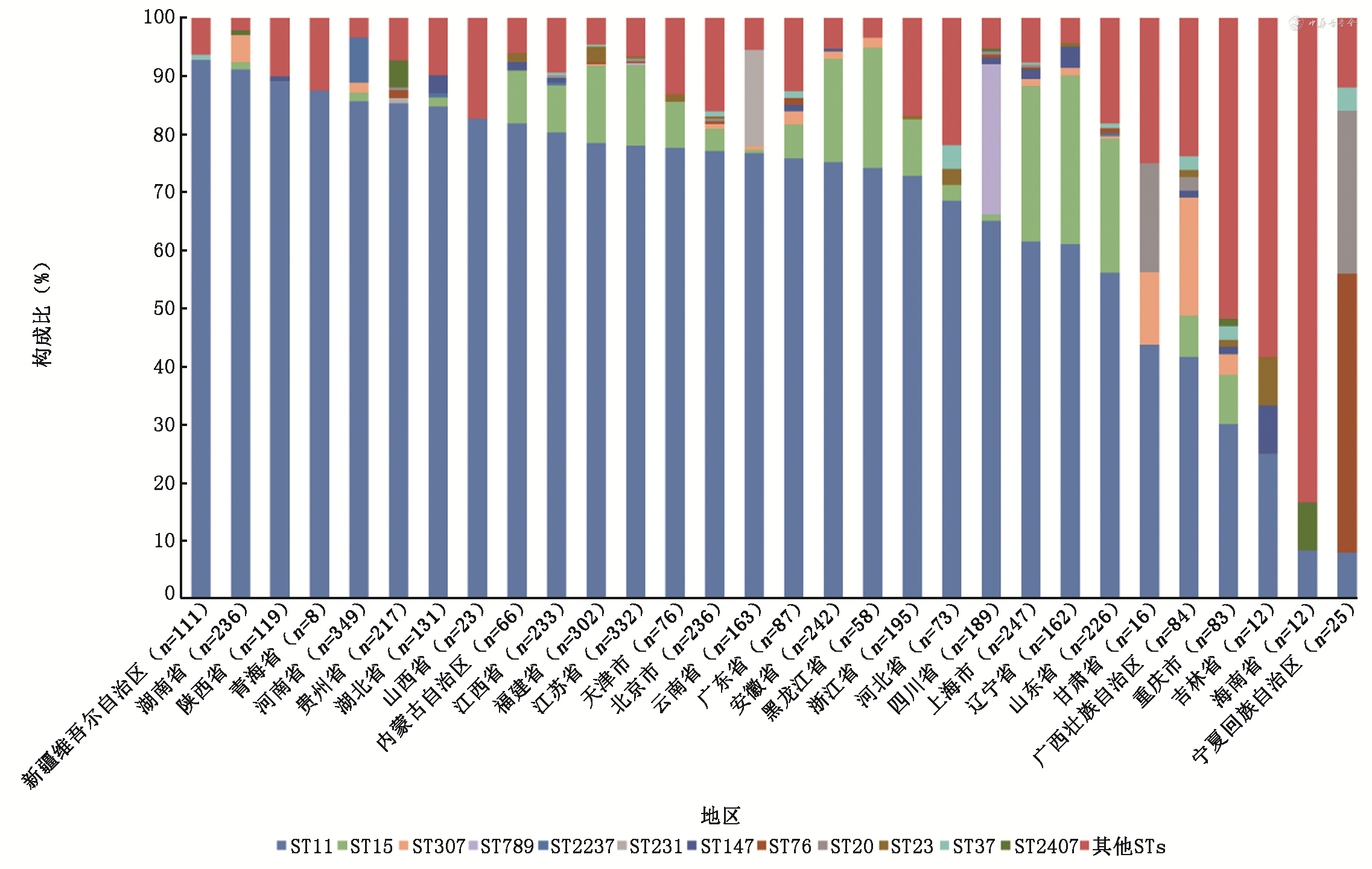
不同省市之间分离CRKP的耐药机制和多位点序列分型有所差异。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
碳青霉烯类耐药肺炎克雷伯菌(carbapenemase-resistant Klebsiella pneumoniae,CRKP)是目前全球临床抗感染治疗的重大挑战之一,世界卫生组织将该菌列为优先级最高的病原体之一[1],亟需开发新的有效抗菌药物以应对其所致感染,降低感染患者的病死率。历年CHINET(China Antimicrobial Surveillance Network)中国细菌耐药监测结果显示,肺炎克雷伯菌对亚胺培南及美罗培南的耐药率从 2005 年的 3% 上升到 2022 年的 26% 以上[2, 3]。现有研究结果显示,CRKP感染的死亡率显著高于碳青霉烯类敏感的肺炎克雷伯菌(carbapenem-sensitive Klebsiella pneumoniae,CSKP),其中重症监护室(intensive care unit,ICU)CRKP感染患者的发病率和死亡率均远高于非ICU患者[4]。由于产生不同碳青霉烯酶CRKP对应的抗感染治疗方案不同,因此,明确临床分离的CRKP产生的碳青霉烯酶种类及其流行传播特征,对于临床抗感染治疗和感染预防控制具有重要的参考价值。
本研究为我国针对耐药菌的主动监测研究工作,通过全国细菌耐药监测网组织收集自31个省、市和自治区134所医疗机构2021年1—6月临床分离的CRKP,以全面分析中国临床分离CRKP对抗菌药物的敏感性、耐药机制以及流行传播特征。
1.菌株来源:全国细菌耐药监测网(China Antimicrobial Resistance Surveillance System,CARSS)由国家卫生健康委员会建立,截止2020年成员单位覆盖31个省、自治区、直辖市的1 412家医疗机构。2020年10月,全国细菌耐药监测网启动了首个关于碳青霉烯类耐药肠杆菌流行病学调查研究的主动监测项目,参与研究的成员单位来自31个省、自治区和直辖市的151家医疗机构,其中综合性医院和儿童专科医院分别占85.1%(114/134)和14.9%(20/134)。2021年1—6月,共有134家医院参与这项主动检测项目,包括二、三级综合医院114家,儿童专科医院20家,涉及31个省、市和自治区。最终共收集4 954株肺炎克雷伯菌,经各医院常规药敏试验提示为CRKP菌株,随后各医院按区域分别运输至中心和分中心实验室(复旦大学附属华山医院、华中科技大学同济医学院附属同济医院和四川省医学科学院·四川省人民医院)进行菌种复核确认。经确认,640株存在污染、失活或复核为非CRKP,最终共纳入4 314株肺炎克雷伯菌进行后续研究。共收集完整感染/定植患者简要病例4 152份。
2.试剂与仪器:质谱仪购自法国生物梅里埃,基因组DNA提取试剂盒购自中国诺唯赞生物科技有限公司,二代测序采用美国Illumina HiSeq X测序平台。所有菌株测序工作由杭州杰毅生物技术有限公司完成。
1.菌株收集及抗菌药物敏感性试验:CRKP分离株由当地实验室按照常规方法进行菌种鉴定,所有分离菌株统一集中至3个中心或分中心实验室后采用基质辅助激光解吸电离飞行时间质谱法重新进行菌种复核鉴定,同一患者相同部位同一菌株只保留1株。参考2021年版美国临床和实验室标准化协会(Clinical and Laboratory Standard Institute,CLSI)文件要求,中心或分中心实验室采用肉汤微量稀释试验测定CRKP对抗菌药物的敏感性(定制药敏板由赛默飞世尔科技有限公司提供)[5]。替加环素判断标准参考美国食品和药物管理局(Food and Drug Administration,FDA)标准[6]。抗菌药物包括氨曲南-阿维巴坦、头孢他啶-阿维巴坦、亚胺培南-瑞来巴坦、头孢他啶、头孢吡肟、氨曲南、亚胺培南、美罗培南、阿米卡星、环丙沙星、复方磺胺甲噁唑、黏菌素E、多黏菌素B和替加环素。大肠埃希菌ATCC 25922、肺炎克雷伯菌ATCC BAA-1705(KPC型碳青霉烯酶阳性)和肺炎克雷伯菌ATCC BAA-2146(NDM型金属酶阳性)作为抗菌药敏试验的质量控制菌株。
2.全基因组测序和基因组分析:根据制造商的说明,使用基因组DNA提取试剂盒从过夜培养物中提取基因组DNA。提取后的细菌基因组DNA进行测序分析。使用“宏基因组DNA建库试剂盒(可逆末端终止测序法)”进行文库的组建,将多个文库等摩尔比例混合上机,通过Noveseq6000平台进行测序。对下机的原始数据采用fastp软件进行质控,使用SPAdes组装软件对短读数据进行组装生成长读片段文件(contigs和scaffolds),同时通过基因组评估软件(busco)评估,完整度大于95%。随后对组装完成的数据使用prokka软件进行基因预测和注释,生成注释好的核酸文件(ffn)和蛋白序列文件(faa)。使用diamond软件将蛋白序列文件分别比对到CARD和VFDB数据库,使用期望值e-23作为阈值获得耐药基因以及毒力基因等的注释结果。最后使用Kleborate 2.0.1版和Kaptive 0.7.3 版分析CRKP的ST型、wzi等位基因、荚膜(K基因座)、O基因座和获得性毒力基因座。核心基因组比对由Snippy 4.6.0版生成,最大似然系统发育树在 iTOL(http://itol2.embl.de)中构建。
药敏试验数据分析采用WHONET 5.6软件。百分率的比较采用χ2检验,双侧P<0.05为差异有统计学意义。
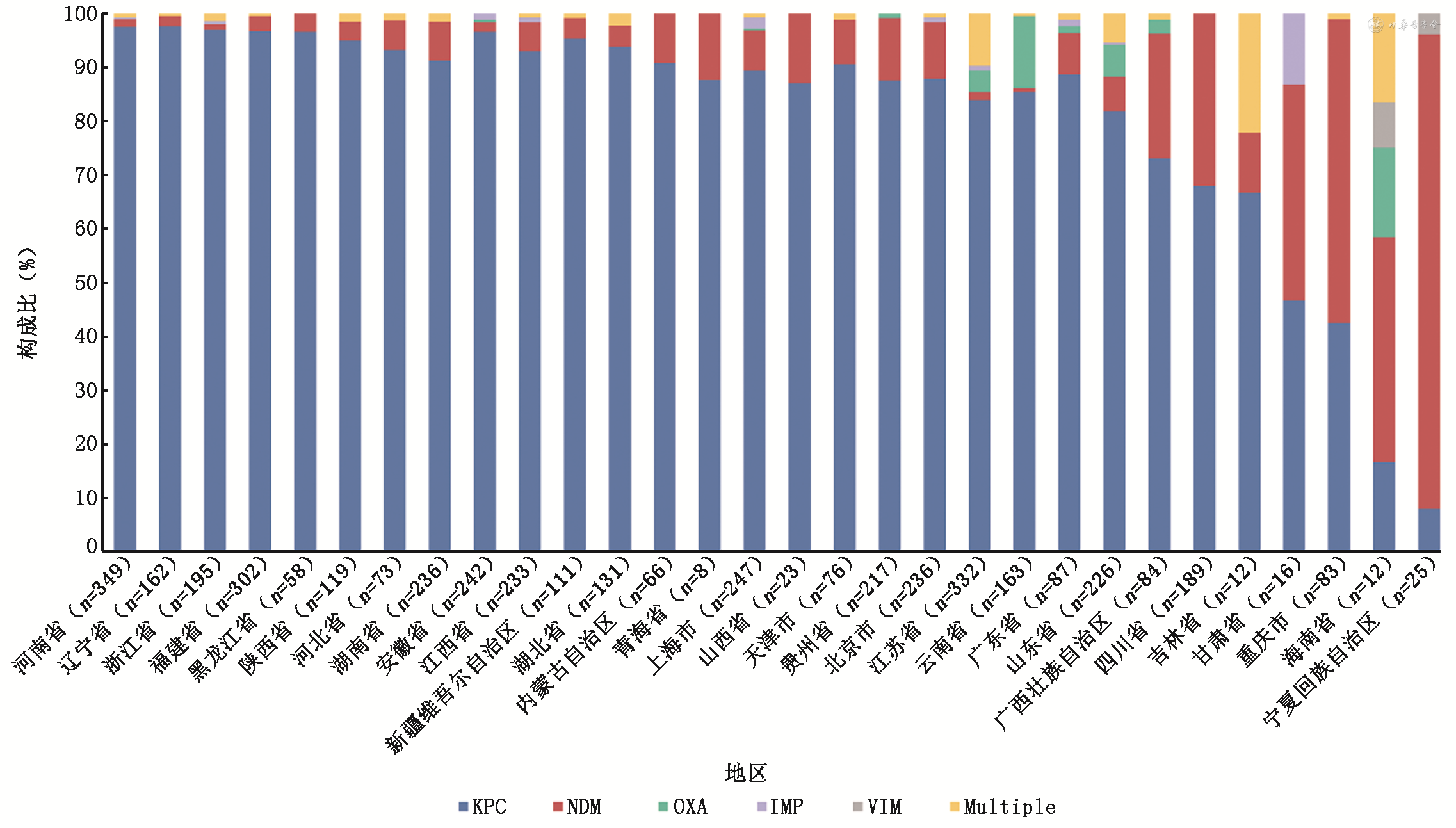
CRKP主要分离自河南省(8.1%,349/4 314),江苏省(7.7%,332/4 314),福建省(7.0%,302/4 314),上海市(5.7%,247/4 314)和安徽省(5.6%,242/4 314)。CRKP分离率较低的省市主要分在中国的北方及西北部地区包括山西省(0.5%,23/4 314)、甘肃省(0.4%,16/4 314)、吉林省(0.3%,12/4 314)和青海省(0.2%,8/4 314)。CRKP在成人患者与儿童患者(≤17岁)中的分离比例分别为88.7%(3 822/4 314)和11.4%(492/4 314)。4 152株CRKP来源分析显示,57.7%(2 396/4 152)CRKP分离自呼吸道标本,其次为泌尿道标本12.3%(510/4 152)、血液标本10.4%(432/4 152)、引流液标本3.1%(128/4 152)及分泌物标本2.9%(124/4 152)。66.4%(2 758/4 152)患者的第一临床诊断为呼吸道感染,20.6%(854/4 152)例患者为同时合并2种及以上感染,其中又以呼吸道感染合并其他感染类型最为常见(72.9%,623/854)。
肉汤微量稀释法药敏试验结果见表1、2,CRKP对氨曲南-阿维巴坦、黏菌素E、多黏菌素B和替加环素高度敏感,敏感率90.3%~96.4%,对头孢他啶-阿维巴坦、亚胺培南-瑞来巴坦、阿米卡星和复方磺胺甲噁唑的敏感率分别为83.9%(3 619/4 314)、71.9%(3 101/4 314)、29.8%(1 286/4 314)和39.2%(1 691/4 314)对其他抗菌药物均高度耐药(耐药率为94.4%~99.8%)。多序列型(sequence type,ST)11型肺炎克雷伯菌与非ST11型菌株对一些药物的敏感性存在差异:其中头孢他啶-阿维巴坦和亚胺培南-瑞来巴坦对ST11型菌株的敏感性更高[分别为91.2%(2 923/3 205)和77.7%(2 490/3 205),65.6%(728/1 109)和59.2%(657/1 109)]。而氨曲南、阿米卡星及环丙沙星对非ST11型菌株敏感性更好[分别为9.3%(103/1 109)、75.7%(840/1 109)和19.2%(213/1 109),0.3%(10/3 205)、14.2%(455/3 205)和0]。产不同碳青霉烯酶菌株对抗菌药物的敏感性有较大的差别,反映针对不同耐药类型菌株采取的治疗措施往往不同(表1)。氨曲南-阿维巴坦、黏菌素E、多黏菌素B和替加环素对所有CRKP菌株均具有高度抗菌活性,头孢他啶-阿维巴坦对肺炎克雷伯菌碳青霉烯酶碳青霉烯类耐药肺炎克雷伯菌(Klebsiella pneumoniae carbapenemases-CRKP,KPC-CRKP)(93.9%,3 479/3 705),产苯唑西林酶碳青霉烯类耐药肺炎克雷伯菌(oxacillinase-CRKP,OXA-CRKP)(100%,56/56)及非产碳青霉烯酶碳青霉烯类耐药肺炎克雷伯菌(non carbapenemase-CRKP,NP-CRKP)(90.4%,104/115)具有高度抗菌活性,但对产新德里金属β内酰胺酶肺炎克雷伯菌(New Delhi metallo-beta-lactamase-CRKP,NDM-CRKP)(2.7%,10/359)基本无抗菌活性。亚胺培南-瑞来巴坦对KPC-CRKP(81.8%,3 031/3 705)及NP-CRKP(76.5%,88/115)抗菌活性稍弱于头孢他啶-阿维巴坦,对OXA-CRKP(30.4%,17/56比100%,56/56)的抗菌效果则明显弱于头孢他啶-阿维巴坦,与头孢他啶-阿维巴坦一样,亚胺培南-瑞来巴坦对携带金属酶的CRKP基本无抗菌活性(2.7%,10/359)。其他药物方面,KPC-CRKP对复方磺胺甲噁唑和阿米卡星的敏感率分别为41%(1 519/3 705)和23.5%(871/3 705),NDM-CRKP对阿米卡星、复方磺胺甲噁唑、环丙沙星和氨曲南的敏感率分别为78.5%(282/359)、42.5%(153/359)、37.0%(133/359)和23.5%(84/359)。OXA-CRKP菌株对其他抗菌药物均高度耐药,而NP-CRKP对阿米卡星和亚胺培南的敏感率分别为62.6%(72/115)和34.8%(40/115)。儿童患者中分离的CRKP对除头孢他啶-阿维巴坦及亚胺培南-瑞来巴坦以外药物的敏感率均高于成人分离株(51.4%,253/492和50.4%,248/492比88.9%,3 399/3 822和75.9%,2 902/3 822)。儿童与成人对以下药物的敏感率不同:氨曲南(12.6%,62/492比1.4%,54/3 822),阿米卡星(65.2%,321/492比25.5%,975/3 822),环丙沙星(29.3%比1.8%)及复方磺胺甲噁唑(65.2%,321/492比36.8%,1 407/3 822)。
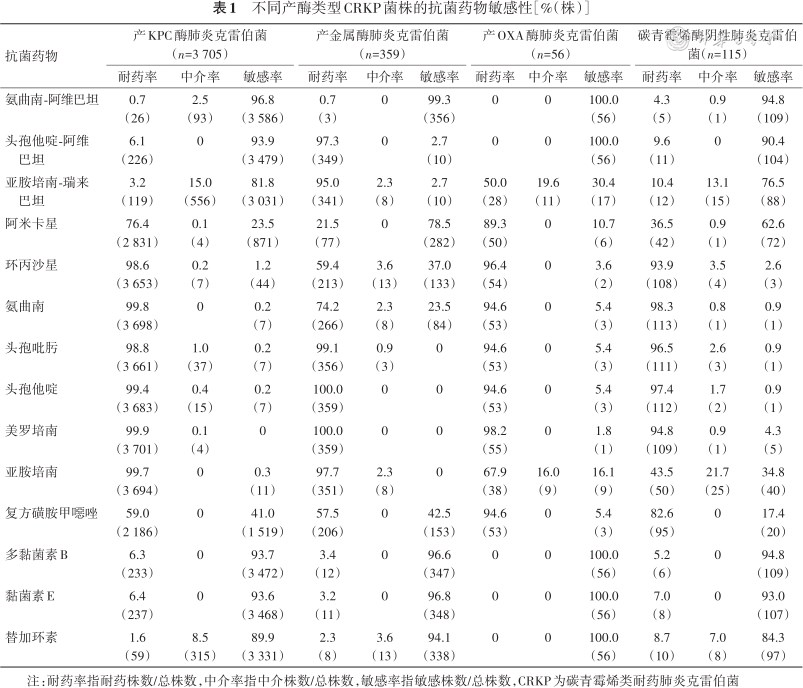
不同产酶类型CRKP菌株的抗菌药物敏感性[%(株)]
不同产酶类型CRKP菌株的抗菌药物敏感性[%(株)]
| 抗菌药物 | 产KPC酶肺炎克雷伯菌(n=3 705) | 产金属酶肺炎克雷伯菌(n=359) | 产OXA酶肺炎克雷伯菌(n=56) | 碳青霉烯酶阴性肺炎克雷伯菌(n=115) | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 耐药率 | 中介率 | 敏感率 | 耐药率 | 中介率 | 敏感率 | 耐药率 | 中介率 | 敏感率 | 耐药率 | 中介率 | 敏感率 | |
| 氨曲南-阿维巴坦 | 0.7(26) | 2.5(93) | 96.8(3 586) | 0.7(3) | 0 | 99.3(356) | 0 | 0 | 100.0(56) | 4.3(5) | 0.9(1) | 94.8(109) |
| 头孢他啶-阿维巴坦 | 6.1(226) | 0 | 93.9(3 479) | 97.3(349) | 0 | 2.7(10) | 0 | 0 | 100.0(56) | 9.6(11) | 0 | 90.4(104) |
| 亚胺培南-瑞来巴坦 | 3.2(119) | 15.0(556) | 81.8(3 031) | 95.0(341) | 2.3(8) | 2.7(10) | 50.0(28) | 19.6(11) | 30.4(17) | 10.4(12) | 13.1(15) | 76.5(88) |
| 阿米卡星 | 76.4(2 831) | 0.1(4) | 23.5(871) | 21.5(77) | 0 | 78.5(282) | 89.3(50) | 0 | 10.7(6) | 36.5(42) | 0.9(1) | 62.6(72) |
| 环丙沙星 | 98.6(3 653) | 0.2(7) | 1.2(44) | 59.4(213) | 3.6(13) | 37.0(133) | 96.4(54) | 0 | 3.6(2) | 93.9(108) | 3.5(4) | 2.6(3) |
| 氨曲南 | 99.8(3 698) | 0 | 0.2(7) | 74.2(266) | 2.3(8) | 23.5(84) | 94.6(53) | 0 | 5.4(3) | 98.3(113) | 0.8(1) | 0.9(1) |
| 头孢吡肟 | 98.8(3 661) | 1.0(37) | 0.2(7) | 99.1(356) | 0.9(3) | 0 | 94.6(53) | 0 | 5.4(3) | 96.5(111) | 2.6(3) | 0.9(1) |
| 头孢他啶 | 99.4(3 683) | 0.4(15) | 0.2(7) | 100.0(359) | 0 | 0 | 94.6(53) | 0 | 5.4(3) | 97.4(112) | 1.7(2) | 0.9(1) |
| 美罗培南 | 99.9(3 701) | 0.1(4) | 0 | 100.0(359) | 0 | 0 | 98.2(55) | 0 | 1.8(1) | 94.8(109) | 0.9(1) | 4.3(5) |
| 亚胺培南 | 99.7(3 694) | 0 | 0.3(11) | 97.7(351) | 2.3(8) | 0 | 67.9(38) | 16.0(9) | 16.1(9) | 43.5(50) | 21.7(25) | 34.8(40) |
| 复方磺胺甲噁唑 | 59.0(2 186) | 0 | 41.0(1 519) | 57.5(206) | 0 | 42.5(153) | 94.6(53) | 0 | 5.4(3) | 82.6(95) | 0 | 17.4(20) |
| 多黏菌素B | 6.3(233) | 0 | 93.7(3 472) | 3.4(12) | 0 | 96.6(347) | 0 | 0 | 100.0(56) | 5.2(6) | 0 | 94.8(109) |
| 黏菌素E | 6.4(237) | 0 | 93.6(3 468) | 3.2(11) | 0 | 96.8(348) | 0 | 0 | 100.0(56) | 7.0(8) | 0 | 93.0(107) |
| 替加环素 | 1.6(59) | 8.5(315) | 89.9(3 331) | 2.3(8) | 3.6(13) | 94.1(338) | 0 | 0 | 100.0(56) | 8.7(10) | 7.0(8) | 84.3(97) |
注:耐药率指耐药株数/总株数,中介率指中介株数/总株数,敏感率指敏感株数/总株数,CRKP为碳青霉烯类耐药肺炎克雷伯菌
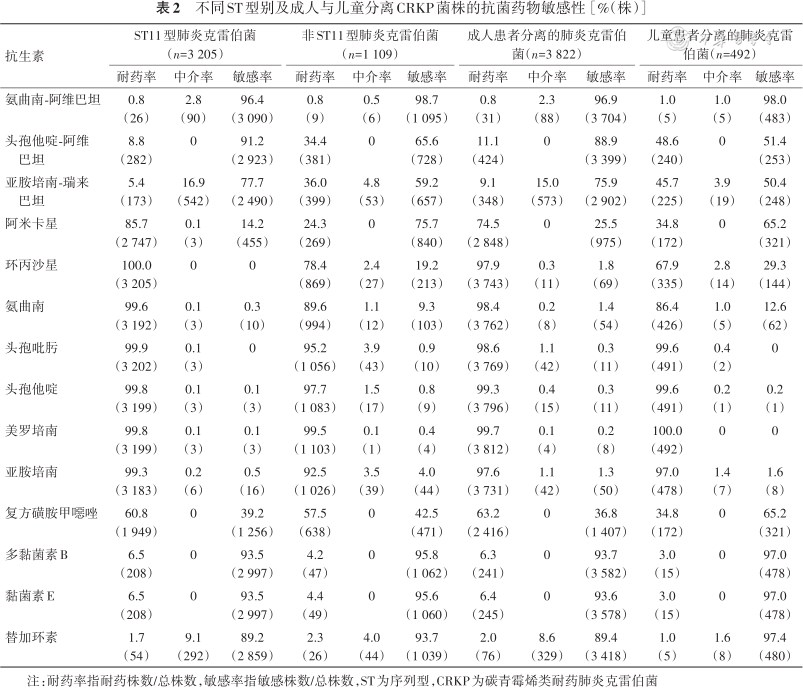
不同ST型别及成人与儿童分离CRKP菌株的抗菌药物敏感性[%(株)]
不同ST型别及成人与儿童分离CRKP菌株的抗菌药物敏感性[%(株)]
| 抗生素 | ST11型肺炎克雷伯菌(n=3 205) | 非ST11型肺炎克雷伯菌(n=1 109) | 成人患者分离的肺炎克雷伯菌(n=3 822) | 儿童患者分离的肺炎克雷伯菌(n=492) | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 耐药率 | 中介率 | 敏感率 | 耐药率 | 中介率 | 敏感率 | 耐药率 | 中介率 | 敏感率 | 耐药率 | 中介率 | 敏感率 | |
| 氨曲南-阿维巴坦 | 0.8(26) | 2.8(90) | 96.4(3 090) | 0.8(9) | 0.5(6) | 98.7(1 095) | 0.8(31) | 2.3(88) | 96.9(3 704) | 1.0(5) | 1.0(5) | 98.0(483) |
| 头孢他啶-阿维巴坦 | 8.8(282) | 0 | 91.2(2 923) | 34.4(381) | 0 | 65.6(728) | 11.1(424) | 0 | 88.9(3 399) | 48.6(240) | 0 | 51.4(253) |
| 亚胺培南-瑞来巴坦 | 5.4(173) | 16.9(542) | 77.7(2 490) | 36.0(399) | 4.8(53) | 59.2(657) | 9.1(348) | 15.0(573) | 75.9(2 902) | 45.7(225) | 3.9(19) | 50.4(248) |
| 阿米卡星 | 85.7(2 747) | 0.1(3) | 14.2(455) | 24.3(269) | 0 | 75.7(840) | 74.5(2 848) | 0 | 25.5(975) | 34.8(172) | 0 | 65.2(321) |
| 环丙沙星 | 100.0(3 205) | 0 | 0 | 78.4(869) | 2.4(27) | 19.2(213) | 97.9(3 743) | 0.3(11) | 1.8(69) | 67.9(335) | 2.8(14) | 29.3(144) |
| 氨曲南 | 99.6(3 192) | 0.1(3) | 0.3(10) | 89.6(994) | 1.1(12) | 9.3(103) | 98.4(3 762) | 0.2(8) | 1.4(54) | 86.4(426) | 1.0(5) | 12.6(62) |
| 头孢吡肟 | 99.9(3 202) | 0.1(3) | 0 | 95.2(1 056) | 3.9(43) | 0.9(10) | 98.6(3 769) | 1.1(42) | 0.3(11) | 99.6(491) | 0.4(2) | 0 |
| 头孢他啶 | 99.8(3 199) | 0.1(3) | 0.1(3) | 97.7(1 083) | 1.5(17) | 0.8(9) | 99.3(3 796) | 0.4(15) | 0.3(11) | 99.6(491) | 0.2(1) | 0.2(1) |
| 美罗培南 | 99.8(3 199) | 0.1(3) | 0.1(3) | 99.5(1 103) | 0.1(1) | 0.4(4) | 99.7(3 812) | 0.1(4) | 0.2(8) | 100.0(492) | 0 | 0 |
| 亚胺培南 | 99.3(3 183) | 0.2(6) | 0.5(16) | 92.5(1 026) | 3.5(39) | 4.0(44) | 97.6(3 731) | 1.1(42) | 1.3(50) | 97.0(478) | 1.4(7) | 1.6(8) |
| 复方磺胺甲噁唑 | 60.8(1 949) | 0 | 39.2(1 256) | 57.5(638) | 0 | 42.5(471) | 63.2(2 416) | 0 | 36.8(1 407) | 34.8(172) | 0 | 65.2(321) |
| 多黏菌素B | 6.5(208) | 0 | 93.5(2 997) | 4.2(47) | 0 | 95.8(1 062) | 6.3(241) | 0 | 93.7(3 582) | 3.0(15) | 0 | 97.0(478) |
| 黏菌素E | 6.5(208) | 0 | 93.5(2 997) | 4.4(49) | 0 | 95.6(1 060) | 6.4(245) | 0 | 93.6(3 578) | 3.0(15) | 0 | 97.0(478) |
| 替加环素 | 1.7(54) | 9.1(292) | 89.2(2 859) | 2.3(26) | 4.0(44) | 93.7(1 039) | 2.0(76) | 8.6(329) | 89.4(3 418) | 1.0(5) | 1.6(8) | 97.4(480) |
注:耐药率指耐药株数/总株数,敏感率指敏感株数/总株数,ST为序列型,CRKP为碳青霉烯类耐药肺炎克雷伯菌
全基因组测序分析结果显示,4 314株细菌均被复核确认为肺炎克雷伯菌,其中97.33%(4 199/4 314)的菌株携带碳青霉烯酶基因,以blaKPC最常见(85.9%,3 705/4 314),其次为blaNDM(7.8%,336/4 314)及blaOXA-48-like(1.3%,56/4 314)。在大部分省份均保持着这一流行病学趋势。本次检出的KPC型碳青霉烯酶基因表现出多样性:4 314株中,以blaKPC-2基因(85.4%,3 686株)为主,同时也出现blaKPC-33(0.1%,6株)、blaKPC-12(0.07%,3株)、blaKPC-71(0.05%,2株)、blaKPC-21(0.02%,1株)以及blaKPC-147(0.05%,2株)、blaKPC-116(0.02%,1株)、blaKPC-134(0.02%,1株)、blaKPC-135(0.02%,1株)基因;2株CRKP携带目前主要在欧美地区流行的blaKPC-3(2,0.05%)基因;blaNDM(7.8%,336/4 314)为第2常见的,并且是重庆市(45株)、海南省(7株)和宁夏回族自治区(22株)主要的碳青霉烯酶基因类型(图1)。blaNDM基因亚型以blaNDM-1(4.4%,189/4 314)为主,其次为blaNDM-5(3.2%,137/4 314),blaNDM-41及blaNDM-9各检出4例(0.09%,4/4 314),blaNDM-7与blaNDM-4各检出1例(0.02%,1/4 314)。分别在56株(1.3%)、21株(0.5%)及2株(0.05%)CRKP中检出blaOXA-like、blaIMP 及 blaVIM 编码基因,基因亚型相对单一,包括51株(1.2%)blaOXA-232、5株(0.1%)blaOXA-181、16株(0.4%)blaIMP-4、3株(0.07%)blaIMP-26、2株(0.05%)blaIMP-8及2株(0.05%)blaVIM-1。

注:KPC、NDM、IMP、VIM为基因
1.8%(78/4 314)的CRKP分别同时携带2种和3种碳青霉烯酶基因,以KPC与NDM基因的组合出现最为常见,包括KPC-2+NDM-1(1.5%,63株),KPC-2+NDM-5(0.07%,3株),KPC-2+NDM-9(0.02%,1株)基因;KPC与其他金属酶的组合包括KPC-2+IMP-4(0.09%,4株),KPC-2+IMP-8(0.02%,1株),KPC-2+SIM-1(0.02%,1株)。其次为2种金属酶的组合及金属酶与OXA酶的组合,包括两株携带NDM-1+IMP-4(0.05%),2株携带NDM-1+OXA-48(0.05%),1株同时携带NDM-1+OXA-232(0.02%)。另有1株CRKP同时携带3种碳青霉烯酶基因:KPC-2+NDM-1+IMP-4。成人患者与儿童患者中分离的CRKP在碳青霉烯酶编码基因的流行性特征上有差异:成人患者中碳青霉烯酶基因的流行率与整体流行情况基本一致,仅KPC基因检出率略增高[90.2%(3 447/3 822),85.9%(3 705/4 314)]及NDM基因的检出率略下降[3.4%(130/3 822)比7.8%(336/4 314)]。
在超广谱β内酰胺酶基因中,以CTX-M、TEM与SHV的检出为主,3类基因也同样呈现了基因亚型的多样性:CTX-M中以CTX-65为主(53.5%,2 306/4 314),其他还包括CTX-M-15、CTX-M-3、CTX-M-55和CTX-M-14等。TEM中以TEM-1(75.1%,3 240/4 314)为主,其他还包括TEM-206、TEM-47、TEM-34和TEM-192等。SHV中以SHV-64(28.6%,1 235/4 314)为主,其他的包括SHV-11、SHV-28、SHV-182和SHV-1等。共3 55株CRKP携带16s甲基化酶基因,介导氨基糖苷类耐药性。其中以rmtB(64.8%,2 796/4 314)为主;其次为armA(4.5%,195/4 314)及 rmtF(1.5%,64/4 314)。在本次分离的4 314株CRKP中,质粒介导的喹诺酮类耐药基因以QnrS1(49.5%,2 135/4 314)为主,其次为aac(6′)-Ib-cr(12.1%,523/4 314)及QnrB4(3.8%,163/4 314)。
多位点序列分型(multilocus sequence typing,MLST)结果显示,不同省份之间几乎没有观察到序列变异的存在。ST11是中国最主要的序列类型(74.3%,3 205/4 314),其次为ST15(9.2%,398/4 314)及ST307(1.3%,55/4 314),其余ST型所占比例为15.2%,具体型别见表3、图1, 2。一些少见序列型呈现地域性分布特点,如海南省以ST17为主,宁夏回族自治区以ST76分布为主以及西藏的ST485,与这些地区KPC-2基因分离率较低相对应。其他少见ST型在中国呈现散在分布(图2)。
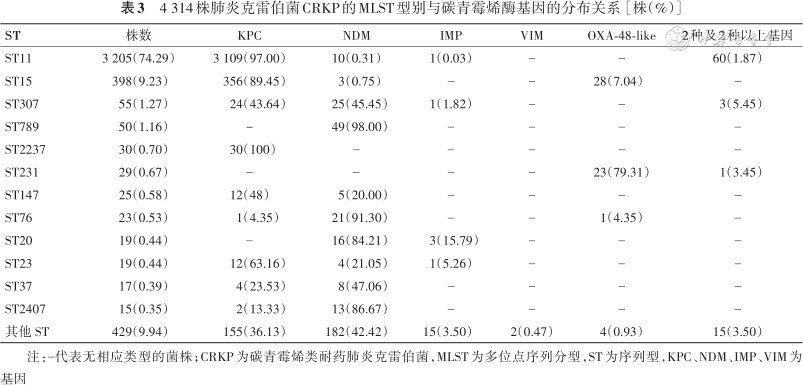
4 314株肺炎克雷伯菌CRKP的MLST型别与碳青霉烯酶基因的分布关系[株(%)]
4 314株肺炎克雷伯菌CRKP的MLST型别与碳青霉烯酶基因的分布关系[株(%)]
| ST | 株数 | KPC | NDM | IMP | VIM | OXA-48-like | 2种及2种以上基因 |
|---|---|---|---|---|---|---|---|
| ST11 | 3 205(74.29) | 3 109(97.00) | 10(0.31) | 1(0.03) | ‒ | ‒ | 60(1.87) |
| ST15 | 398(9.23) | 356(89.45) | 3(0.75) | ‒ | ‒ | 28(7.04) | ‒ |
| ST307 | 55(1.27) | 24(43.64) | 25(45.45) | 1(1.82) | ‒ | ‒ | 3(5.45) |
| ST789 | 50(1.16) | - | 49(98.00) | ‒ | ‒ | ‒ | ‒ |
| ST2237 | 30(0.70) | 30(100) | ‒ | ‒ | ‒ | ‒ | ‒ |
| ST231 | 29(0.67) | ‒ | ‒ | ‒ | ‒ | 23(79.31) | 1(3.45) |
| ST147 | 25(0.58) | 12(48) | 5(20.00) | ‒ | ‒ | ‒ | ‒ |
| ST76 | 23(0.53) | 1(4.35) | 21(91.30) | ‒ | ‒ | 1(4.35) | ‒ |
| ST20 | 19(0.44) | ‒ | 16(84.21) | 3(15.79) | ‒ | ‒ | ‒ |
| ST23 | 19(0.44) | 12(63.16) | 4(21.05) | 1(5.26) | ‒ | ‒ | ‒ |
| ST37 | 17(0.39) | 4(23.53) | 8(47.06) | ‒ | ‒ | ‒ | ‒ |
| ST2407 | 15(0.35) | 2(13.33) | 13(86.67) | ‒ | ‒ | ‒ | ‒ |
| 其他 ST | 429(9.94) | 155(36.13) | 182(42.42) | 15(3.50) | 2(0.47) | 4(0.93) | 15(3.50) |
注:‒代表无相应类型的菌株;CRKP为碳青霉烯类耐药肺炎克雷伯菌,MLST为多位点序列分型,ST为序列型,KPC、NDM、IMP、VIM为基因

注:ST为序列型
不同的ST型别与碳青霉烯酶基因之间的分析结果显示(表3):大多数 ST11 肺炎克雷伯菌分离株(97.0%)携带 KPC 碳青霉烯酶,ST789、ST76、ST20、ST2407、ST17 分离株更多的携带NDM 型碳青霉烯酶(>80%),而在 ST307 中,携带KPC的菌株数量与携带NDM的菌株数量基本相同(表3)。而在每种基因型的克隆群分布方面,KPC型碳青霉烯酶中以ST11分布为主,OXA-48家族ST型分布也较集中,以ST15(50%,28/56)与ST231(41.1%,23/56)作为优势克隆型。相比之下,NDM和 IMP 分布在更广泛的克隆型中,并没有显性克隆型。成人与儿童中的KPC-CRKP均主要分布于ST11(83.2%,3 180/3 822比93%,457/492)、ST15(10.1%,386/3 822比3.5%,17/492)克隆型。而在NDM-CRKP中,成人与儿童分离株表现了较大程度的差异:成人中分离的NDM-CRKP主要分离ST307(16.2%,21/130)、ST11(7.7%,10/130)及ST147(3.9%,5/130),而儿童中分离的NDM-CRKP则主要分离自ST789(23.8%,49/206)、ST76(10.2%,21/130)及ST20(7.3%,15/130)。
碳青霉烯类抗菌药物包括亚胺培南、美罗培南和厄他培南等,是目前临床上治疗多重耐药肠杆菌目细菌所致重症感染最有效的抗菌药物之一。随着抗菌药物耐药性的传播,尤其是碳青霉烯类耐药性,正逐渐成为世界范围内新出现的问题。CHINET中国细菌耐药监测网的数据显示,肺炎克雷伯菌对亚胺培南或美罗培南的耐药率正在迅速上升:从2005年的3%上升到2022年的26%以上[2, 3]。在本研究之前,针对中国CRKP大规模的流行病学与基因组学数据是有限的。本研究的横向监测数据结合了全基因组测序与药敏监测来大规模系统地反映中国住院患者中CRKP的流行病学与基因组学特点。CRKP感染患者中的死亡率不容忽视,感染CRKP的患者尤其是血流感染的患者,死亡率较高[7, 8]。在中国,ICU仍是CRKP主要的分离科室,明显高于其他临床科室,这与ICU空间较大,患者密集,更易引起CRKP大规模的克隆传播有关[9, 10]。而这种大范围的克隆传播对免疫抑制或有多种合并症的患者会构成更巨大的威胁,采取一些积极有效的控制措施包括入院前筛查CRKP,改变病房布局及特殊患者单间隔离等措施是需要被积极考虑的[11]。
CRKP感染的治疗具有挑战性,除头孢他啶-阿维巴坦外,目前包括中国在内的许多国家尚无其他新的β内酰胺类-β内酰胺酶抑制剂复合制剂,如亚胺培南-瑞来巴坦和氨曲南-阿维巴坦等。CRE 感染必须根据体外药敏试验、分子类型、感染严重程度和患者健康状况进行个体化治疗。本研究详细描述了中国CRKP的抗菌药物敏感性和分子流行病学特征,可能为治疗方法的选择提供依据。例如,氨曲南-阿维巴坦、黏菌素E、多黏菌素B、替加环素(敏感率>90%)在所有CRKP中,均表现了极佳的体外抗菌活性,其次为头孢他啶-阿维巴坦(敏感率83.9%)和亚胺培南-瑞来巴坦(敏感率71.9%),这与美国及很多欧洲国家的监测结果一致[12]。在临床应用上,头孢他啶-阿维巴坦与亚胺培南-瑞来巴坦具有一定的指向性:两者主要应用于KPC-CRKP及OXA-CRKP感染的治疗,而对NDM-CRKP基本没有临床效果。在包括我国在内的很多国家并没有氨曲南-阿维巴坦及亚胺培南-瑞来巴坦的临床应用权限,黏菌素E、多黏菌素B及替加环素由于高昂的价格及肝肾毒性使其在临床应用十分受限[13]。面对多药耐药及临床抗菌药物受限的情况下,联合一种及多种抗菌药物(包括头孢他啶-阿维巴坦、氨曲南及氨基糖苷类药物等)正逐渐成为一种最优选择。研究也提示,在针对成人与儿童CRKP患者治疗时,治疗方案应存在针对性:氨曲南-阿维巴坦、黏菌素E、多黏菌素B及替加环素对成人与儿童CRKP患者敏感性基本相当,在儿童CRKP感染时,复方磺胺甲噁唑及阿米卡星是一种更好的辅助选择。头孢他啶-阿维巴坦及亚胺培南-瑞来巴坦在儿童患者中的效果不及成人患者,这可能与儿童患者中NDM基因检出率较高相关,携带金属酶相关基因往往导致菌株对头孢他啶-阿维巴坦及亚胺培南-瑞来巴坦耐药[14]。也正因NDM基因在儿童与成人中分离比例的差异(41.9%,206/492比3.4%,130/3 822),使得在NDM中广泛流行的序列类型:ST789及ST76比例上升(分列升至儿童患者中序列类型的第2位与第3位)。
携带碳青霉烯酶基因(尤其是KPC及NDM)的元件及质粒在细菌之间的转移传递是医院和社区CRKP感染增加的一个重要原因。在世界大部分地区如美国、以色列、罗马尼亚、希腊、意大利和地中海区域的某些地区均存在KPC-CRKP的广泛流行。首先,本研究显示,blaKPC与blaNDM是介导中国CRKP中碳青霉烯类耐药表型发展的关键碳青霉烯酶基因,其中尤以产KPC型碳青霉烯酶为主要机制。同时目前在一些地区如重庆市、宁夏回族自治区,海南省和西藏自治区已出现以NDM流行为主的情况。其次,在检测的4 314株CRKP菌株中,发现79株携带2种及以上碳青霉烯酶编码基因,特别是KPC-2与NDM-1的组合。这些观察结果促使临床开发新的治疗方法来对抗CRKP感染。目前包括中国在内很多以KPC流行为主的国家,头孢他啶-阿维巴坦常是治疗KPC-CRKP感染的首要选择。然而随着其临床应用增加,在KPC-CRKP中对酶抑制剂复合制剂耐药菌株开始出现并逐渐增多。KPC-CRKP中头孢他啶-阿维巴坦敏感性降低的主要耐药机制为:KPC 变异型及孔蛋白缺失的合并KPC 表达增加[14]。本研究数据也反映了这一情况:来源于KPC-2点突变的KPC-33、KPC-71、KPC-116、KPC-134及KPC-135均表现为对头孢他啶-阿维巴坦耐药,加剧了目前的耐药形势。这对在多数国家以头孢他啶/阿维巴坦作为治疗CRKP感染的最后手段的临床应用提出了重大挑战,从这个意义上讲,与头孢他啶-阿维巴坦相比,亚胺培南-瑞来巴坦及氨曲南-阿维巴坦已被证明是一种临床上更有效的抗携带 KPC-2/3的肠杆菌目细菌分离株的替代品,同样也可以是新型 KPC 变体[15]。此外,本研究还有2株携带KPC-3基因的ST11CRKP在中国的出现,KPC-3主要在美国与欧洲国家检出,表现为与KPC-2相似的流行率。虽然我国是KPC的广泛流行地区,但KPC-3在我国只是零星报道[16, 17, 18]。研究中的2株携带KPC-3基因菌株分别分离自广东省与北京市,均属ST11克隆型,目前我国尚未见携带KPC-3的ST11型肺炎克雷伯菌的出现,而KPC-3对头孢菌素和碳青霉烯类抗菌药物往往显示出更高的水解效率[19],ST11克隆型与KPC-3基因的结合无论在传播还是耐药性方面与KPC-2相比似乎会带来更大威胁。明确KPC-3 ST11-CRKP在中国的起源及与是否会如KPC-2基因一样引起大规模流行需要后续持续的监测与研究。在本次分离的4 314株CRKP中,115株为非产碳青霉烯酶菌株,对碳青霉烯类的耐药性可能在很大程度上与膜孔蛋白缺失和其他机制的联合作用有关。
值得注意的是,与先前在中国进行的一项纵向(2012—2016)大规模CRE研究结果中的CRKP数据相比[7],在排名前10的ST型中,除ST11型肺炎克雷伯菌仍保持第1的检出率外,其他ST型别的检出率均发生了较大程度的变化:包括ST15由先前的第3位(2.8%)转为第2位(9.2%)。以往排名前5的ST17、ST48、ST37由ST15、ST307、ST789替代等。成人患者中的ST型别分布于整体基本一致,以ST11(77.4%,2 959/3 822)为主,其次为ST15(10.2%,388/3 822)及ST307(1.3%,48/3 822)。儿童患者中流行的克隆型别中发生了较大程度的改变,与成人相比,排名第1的ST11(50%,246/492)比例明显下降(50%对77.4%),排名第2、第3则分别是一些相对少见克隆型:ST789(9.9%,47/492)及ST76(4.3%,21/492)。
由于本次监测几乎覆盖了中国每个省市,数据具有代表性。ST11型肺炎克雷伯菌仍是目前中国的优势克隆,它是 ST258 的单基因座变体,ST258 是在美国和欧洲部分地区(意大利和希腊)广泛传播的 KPC-2/3 克隆[20]。同时,本研究强调了几个值得注意的高风险谱系的出现。ST231 是一种新兴的 CRKP 流行克隆,已在包括印度、泰国、文莱、新加坡、法国和瑞士多个国家/地区报道[21, 22],印度的一些报告将该谱系描述为该地区主要的ST型别之一,中国目前尚未有ST231的报告。本次的ST231分离株与这些先前描述的 ST231 菌株具有共同的基因组特征;它们均为多重耐药细菌,主要携带blaOXA-181/232,同时也经常观察到 blaNDM 的共同携带。在这个新兴的 CRKP 高风险克隆中,毒力和抗性元件(包括具有水解新氨基糖苷类药物能力的 16S甲基化酶以及金属酶等)的融合需要高度警惕,因为其可以水平转移到其他谱系,造成大范围的转移播散。
其次为ST789,在中国其是一种在儿童中出现并播散的流行性克隆,能够传播多种抗性元件。该克隆可能在2006年左右出现于南美洲,主要与CTX-M-2/15/27相关,在传播后期(2016后),根据特定碳青霉烯酶盛行的地理区域(例如我国的KPC与NDM等),该克隆开始与各种碳青霉烯酶相关联,从而使其成为这些地区的流行性病原体。本研究中的ST789菌株主要以NDM型碳青霉烯酶为主。以往研究显示携带blaKPC-2的ST789 CRKP偶有报道[23, 24]。该谱系在新生儿中引起多种感染,多年来一直在多家当地医院中传播,并导致数次暴发。新的CRKP谱系不断出现,新生儿的CRKP谱系可能与成人不同,提示对新生儿的 CRKP 进行严格监测也是必要的。
全国细菌耐药监测网. 全国碳青霉烯类耐药肺炎克雷伯菌对抗菌药物的敏感性、耐药机制和分子特征研究[J]. 中华检验医学杂志, 2024, 47(6): 629-638. DOI: 10.3760/cma.j.cn114452-20231212-00350.
所有作者声明无利益冲突


























