
总结反向体肺分流术(Potts分流术)治疗儿童重度肺动脉高压的经验。
回顾2022年9月至2023年9月间上海交通大学医学院附属上海儿童医学中心收治的10例接受反向Potts分流术的重度肺动脉高压患儿的临床资料。其中男1例,女9例,年龄为(8.1±4.2)岁,初次确诊年龄为(6.2±3.2)岁,体重为(27.5±16.5)kg。世界卫生组织心功能分级Ⅲ级6例,Ⅳ级4例。患儿术前均接受右心导管检查和核磁共振检查,术前接受三联药物治疗1~8个月,均在体外循环下实施反向Potts分流术。存活患儿随访均接受超声心动图和心脏核磁共振检查。
所有患儿术前肺血管阻力指数为(24.2±6.0)WU×m2,肺动脉和主动脉收缩压力比为(1.1±0.2),术后均拔除气管插管,早期死亡3例,7例存活。出院时上下肢氧饱和度差为(13.3±7.7)%。随访1~11个月,氨基末端脑钠肽前体较术前下降46.3%,核磁共振下右室舒张末期容积指数提高了10.9%,超声心动图下三尖瓣环收缩期位移上升15.3%。随访期间均为靶向药物二联应用。
反向Potts分流术治疗重度肺动脉高能够改善患儿术后的心功能状态,是一种可行、有效的非药物治疗手段。但手术实施有一定的死亡率,需进一步积累经验。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
近年来,随着靶向药物的研发以及治疗理念的更新,肺动脉高压(pulmonary arterial hypertension,PAH)患儿的5年生存率显著提高。但心脏功能已下降的,尤其是世界卫生组织(World Health Organization,WHO)心功能分级Ⅳ级的患儿,即便使用肺动脉高压靶向药物治疗,其中位生存时间仍只有2年[1,2]。肺移植是目前可选择的唯一外科治疗手段,但儿童肺移植后中位生存时间为7年[3]。同时,肺移植术受制于供体短缺、需终生免疫抑制治疗等因素,很难在国内得到广泛开展。2004年,反向体肺分流术(Potts分流术)被首次用于治疗复杂先天性心脏病术后重度PAH,并取得了良好的效果[4]。2021年,本中心报道了国内首例外科和经皮反向Potts分流术治疗特发性PAH的病例[5,6]。本中心在该手术的流程及围手术期临床多学科治疗团队合作等方面做了一些探索和实践。
收集上海交通大学医学院附属上海儿童医学中心在2022年9月至2023年9月间收治的10例重度PAH患儿的临床资料,其中男1例,女9例;年龄为(8.1±4.2)岁,初次确诊年龄为(6.2±3.2)岁;体重为(27.5±16.5)kg。5例合并先天性心脏病,其中2例房间隔缺损,1例右肺动脉缺如,1例室间隔缺损术后重度肺动脉高压,1例部分型肺静脉异位引流(表1)。WHO心功能分级Ⅲ级6例,Ⅳ级4例。2例出现咯血,1例出现晕厥症状,术前接受三联药物治疗1~8个月。
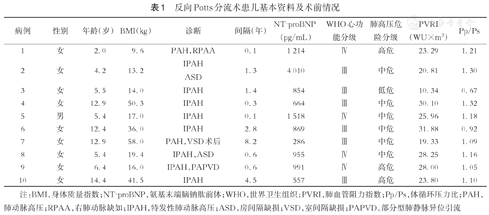
反向Potts分流术患儿基本资料及术前情况
反向Potts分流术患儿基本资料及术前情况
| 病例 | 性别 | 年龄(岁) | BMI(kg) | 诊断 | 间隔(年) | NT-proBNP(pg/mL) | WHO心功能分级 | 肺高压危险分级 | PVRI(WU×m2) | Pp/Ps |
|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 女 | 2.0 | 9.6 | PAH,RPAA | 0.1 | 1 214 | Ⅳ | 高危 | 23.29 | 1.21 |
| 2 | 女 | 4.2 | 13.2 | IPAH | 1.3 | 4 010 | Ⅲ | 中危 | 20.81 | 1.30 |
| ASD | ||||||||||
| 3 | 女 | 5.5 | 14.0 | IPAH | 1.4 | 854 | Ⅲ | 低危 | 10.34 | 0.67 |
| 4 | 女 | 12.9 | 50.3 | IPAH | 0.3 | 664 | Ⅲ | 中危 | 30.10 | 1.32 |
| 5 | 男 | 5.4 | 17.0 | IPAH | 0.1 | 1 518 | Ⅳ | 中危 | 25.96 | 1.18 |
| 6 | 女 | 12.4 | 36.0 | IPAH | 2.8 | 869 | Ⅲ | 中危 | 31.88 | 0.92 |
| 7 | 女 | 12.9 | 58.0 | PAH,VSD术后 | 8.2 | 286 | Ⅲ | 中危 | 19.33 | 1.09 |
| 8 | 女 | 5.4 | 19.4 | IPAH,ASD | 0.6 | 955 | Ⅳ | 中危 | 28.25 | 1.16 |
| 9 | 女 | 6.4 | 16.0 | IPAH,PAPVD | 0.6 | 991 | Ⅳ | 高危 | 28.00 | 1.05 |
| 10 | 女 | 14.4 | 41.5 | IPAH | 4.5 | 557 | Ⅲ | 高危 | 23.80 | 1.10 |
注:BMI,身体质量指数;NT-proBNP,氨基末端脑钠肽前体;WHO,世界卫生组织;PVRI,肺血管阻力指数;Pp/Ps,体循环压力比;PAH,肺动脉高压;RPAA,右肺动脉缺如;IPAH,特发性肺动脉高压;ASD,房间隔缺损;VSD,室间隔缺损;PAPVD,部分型肺静脉异位引流
本研究符合赫尔辛基宣言和国际医学科学组织理事会与WHO颁布的涉及人的生物医学研究的国际伦理准则等伦理原则,经上海交通大学医学院附属上海儿童医学中心伦理委员会审核批准(SCMCIRB-K2023188-1)。患儿家属知情同意。
①属于世界肺高压研讨会(World Symposium on Pulmonary Hypertension,WSPH)第一大类肺动脉高压:动脉性肺高压,包括特发性肺高压及先天性心脏病引起的肺高压,肺循环、体循环压力比>0.7。②术前接受最大剂量的5-磷酸胆碱酯酶抑制剂、内皮素受体拮抗剂治疗1个月以上,已使用最大剂量前列环素类药物治疗。③WHO心功能分级Ⅲ级以上或最大程度药物治疗后仍病情恶化。④无明显外科手术禁忌证。
①存在明显心内外畸形。②存在明显外科手术禁忌证。③术前状况差,ICU抢救或体外膜肺氧合(extracorporeal membrane oxygenation,ECMO)辅助中。
10例患儿术前接受6分钟步行实验(6MWT);氨基末端脑钠肽前体(N terminal pro brain natriuretic peptide,NT-proBNP)检测;超声心动图检查,采集指标包括右心室面积变化率(fractional area change,RVFAC)、三尖瓣环收缩期位移(tricuspid annular plane systolic excursion,TAPSE);心脏磁共振增强检查,采集指标包括左室舒张末期容积指数(left ventricular end-diastolic volume index,LVEDVI)、左心室射血分数(left ventricle ejection fraction,LVEF)、右室舒张末期容积指数(right ventricular end-diastolic volume index,RVEDVI)、右心室射血分数(right ventricle ejection fraction,RVEF);右心导管造影术检查,采集指标包括心脏指数、平均右房压、肺动脉平均压、体循环平均压、肺血管阻力指数、肺动脉楔压,并进行肺高压综合风险评估分级[7]。
9例患儿采用侧胸入路,先取仰卧位颈动静脉插管转流。然后右侧卧位,单肺通气,左后外侧第4肋间进胸。游离暴露降主动脉及左肺动脉,取降主动脉过膈肌位置直径50%~70%的Goretex管道连接左肺动脉近分支处及与之距离最近的降主动脉。吻合完成后止血关胸,撤离体外循环装置并留置肺动脉测压漂浮导管。
1例患儿采用正中进胸入路,股动静脉转流,正中进胸,升主动脉插管,取合适大小Goretex管道连接主动脉弓下缘左锁骨下动脉远端与肺总动脉。
记录呼吸机通气时间、监护室时间、住院时间、有无死亡及严重并发症、出院时上下肢经皮氧饱和度(pulse oxygen saturation,SpO2)差值、出院时复查NT-proBNP及超声心动图、出院时肺动脉高压靶向药物使用情况。
出院后随访1~11个月,第1、3、6个月随访评估WHO心功能等级,采集6MWT、NT-proBNP、上下肢SpO2差值,复查超声心动图及心脏增强核磁共振。
10例患儿术前资料见表1。患儿6MWT结果为(448±51.7)m,超声心动图示RVFAC为(20.8±4.8)%,TAPSE为(13.7±2.4)mm,TAPSE z值为(-2.8±2)。心脏磁共振检查示LVEDVI为(58.6±12.2)mL/m2,LVEF为(67.6±6.1)%,RVEDVI为(144.5±37.7)mL/m2,RVEF(36.6±6.8)%。
患儿均在体外循环下完成手术,体外循环时间为(98.7±18.8)min。9位患儿行左侧进胸反向Potts分流术,1例患儿为先天性心脏病术后行正中进胸反向Potts分流术。术后均顺利撤离体外循环,静脉维持小剂量血管活性药物(多巴酚丁胺、去甲肾上腺素)及曲前列尼尔,至监护室早期予以小剂量iNO吸入。术后监护室动态监测体循环压力比及上下肢SpO2,调整血管活性药物及曲前列尼尔剂量,维持于0.8~1.1。1例患儿术后2 d出现出血,补充凝血因子后好转,术后3 d出现肺部感染,调整抗感染药物后好转。1例患儿术后3 d出现肺出血,予气管镜探查并止血药物治疗后好转(表2)。所有患儿均顺利拔除气管插管,第1次拔管时间为术后(44.8±14.5)h。4例二次插管,二次插管患儿死亡3例。
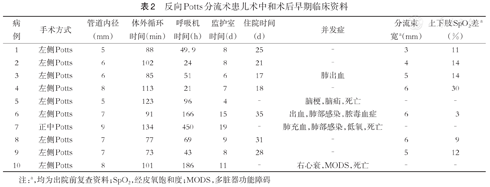
反向Potts分流术患儿术中和术后早期临床资料
反向Potts分流术患儿术中和术后早期临床资料
| 病例 | 手术方式 | 管道内径(mm) | 体外循环时间(min) | 呼吸机时间(h) | 监护室时间(d) | 住院时间(d) | 并发症 | 分流束宽a(mm) | 上下肢SpO2差a(%) |
|---|---|---|---|---|---|---|---|---|---|
| 1 | 左侧Potts | 5 | 88 | 49.9 | 8 | 25 | - | 3 | 11 |
| 2 | 左侧Potts | 6 | 102 | 24 | 8 | 21 | - | 4 | 14 |
| 3 | 左侧Potts | 6 | 85 | 51 | 6 | 17 | 肺出血 | 5 | 14 |
| 4 | 左侧Potts | 8 | 113 | 21 | 7 | 18 | - | 6 | 30 |
| 5 | 左侧Potts | 5 | 123 | 96 | 4 | - | 脑梗,脑疝,死亡 | - | - |
| 6 | 左侧Potts | 7 | 91 | 166 | 15 | 35 | 出血,肺部感染,脓毒血症 | 6 | 3 |
| 7 | 正中Potts | 9 | 134 | 450 | 19 | - | 肺充血,肺部感染,低氧,死亡 | - | - |
| 8 | 左侧Potts | 7 | 77 | 69 | 9 | 31 | - | 6 | 9 |
| 9 | 左侧Potts | 7 | 73 | 43 | 8 | 28 | - | 5 | 12 |
| 10 | 左侧Potts | 8 | 101 | 186 | 11 | - | 右心衰,MODS,死亡 | - | - |
注:a,均为出院前复查资料;SpO2,经皮氧饱和度;MODS,多脏器功能障碍
早期死亡3例患儿中,1例于术后2 d发现瞳孔对光反射消失,头颅CT提示右脑梗死,右脑弥漫性水肿,脑疝。格拉斯哥昏迷评分3分,告知家属后放弃治疗死亡;1例为室缺术后正中进胸行Potts分流术患儿出现严重、肺部感染,因低氧于床边部分钳夹管道并安置体外膜肺氧合(V-V ECMO),后肺部感染仍控制不佳,ECMO撤离困难,术后20 d死亡;第3例因术后严重下半身低氧,术后11 d出现严重心律失常而死亡。
存活的7例患儿,监护室时间为8.5(6~15)d,住院时间24(17~35)d;出院前上肢SpO2为(95.9±3.3)%,下肢SpO2为(82.6±7.8)%,上下肢SpO2差为(13.3±7.7)%。7例患儿出院后随访1~11个月,均口服波生坦+西地那非二联用药,未使用前列腺素类药物。
患儿分别于出院后第1、3、6个月入院随访,复查超声心动图及心脏核磁共振增强检查。随访期间无死亡,无严重并发症,无咯血、晕厥及运动障碍等症状。评估WHO心功能分级均为Ⅱ级,上肢SpO2为(96.7±1.9)%,下肢SpO2为(84.4±6.6)%,上下肢SpO2差为(12.3±6.8)%。超声心动图检查提示Potts分流术通畅,均为双向分流,左向右为主。7例出院患儿随访期间主要心功能指标折线图与术前对比见图1,术后NT-proBNP及TAPSE有明显改善,RVEF及LVEF术后早期略有下降后在术后3~6个月均有好转,RVEDVI及部分患儿的LVEDVI也较术前改善。另取随访患儿最近一次随访结果,NT-proBNP为(660.1±578.7)pg/ml,较术前降低46.3%;6MWT为(384.3±70.4)m;RVFAC为(23.7±2.0)%,较术前上升13.9%;TAPSE为(15.8±2.9)mm,较术前上升15.3%。心脏磁共振检查提示LVEDVI为(68±8.7)mL/m2,LVEF(60±5.8)%,RVEDVI为(160.3±37.2)mL/m2,RVEF为(33.3±6.7)%(上述数据按图1折线表达)。与术前比较,NT-proBNP、RVFAC、TAPSE、LVEF等均较术前有明显改善,RVEDVI较术前提高了10.9%。6MWT虽较术前有所降低,但考虑患儿仍处于术后康复期,运动耐量恢复有限,有待日后长期随访结果再次比较。
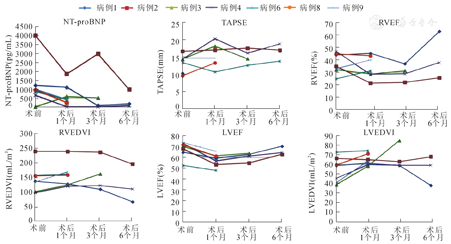

注:NT-proBNP,氨基末端前脑钠肽前体;TAPSE,三尖瓣环收缩期位移;RVEF,右室射血分数;RVEDVI,右室舒张末期容积指数;LVEF,左室射血分数;LVEDVI,左室舒张末期容积指数
存在心内解剖性分流的艾森曼格综合征(Eisenmenger syndrome)患者的生存时间优于特发性肺动脉高压患者[8]。这提示在出现难以控制的肺高压时,增加体-肺循环交通可能改善疾病预后,降低病死率。目前增加体-肺循环交通的治疗手段主要包括房隔造口术以及反向Potts分流术。对于患儿,反向Potts分流术相较于房隔造口术更具有优点,可以更有效降低右室后负荷和保证脑、冠脉系统的氧合[9]。如今,反向Potts分流术应用于治疗特发性肺高压及先天性心脏病术后艾森曼格综合征的领域,作为肺移植前延长患者生命、改善生存质量的桥梁,已经被纳入治疗指南[10]。但由于该术式仍具有较高的手术死亡率,以及对围手术期处理有较高的要求,目前国内鲜有报道。本中心首次报道了外科和介入手段完成反向体肺分流术[5,6]。
本研究纳入了过去1年内针对重度PAH实施反向Potts手术的病例,是迄今为止国内最大组反向Potts手术的报道。目前国际上例数最多的报道跨越20年,覆盖西方5个国家、13个中心,110例重度肺高压患儿,其早期死亡17例(15%),平均随访3.1年,出院患儿1年的生存/免移植率为92%,5年生存/免移植率为68%;相对于术前56%三联药物应用比例,术后随访期间均停用了前列环素类靶向药物[11]。可见,反向Potts分流术能有效改善重度PAH患儿的症状,延后患儿肺移植的时限。在我国,肺动脉高压靶向药物昂贵的费用也是患儿及其家庭面临的一大难题。粗略估计1例青春期PAH患儿,每个月仅三联靶向药物的费用就超过1.5万元(目前我国靶向药物中仅有波生坦分散片获批进入医保目录)[12]。所以,对于无法耐受或没有条件接受三联药物应用的患儿,可考虑放宽反向Potts手术的适应证[6]。由此也可见,开展有效的非药物治疗方式已经成为我国儿童PAH治疗的迫切需要。
国际上实施反向Potts分流术的适应证主要包括WSPH第一大类PAH、接受最大剂量抗肺高压靶向药物治疗但仍有进行性肺动脉压力增高及右心衰竭表现[11]。一项多中心儿童第一大类PAH注册登记研究显示,我国PAH患儿的诊断延迟较长,与发达国家相比,我国PAH患儿的平均肺动脉压和肺血管阻力指数显著升高[12]。本组10例患儿的术前平均肺动脉压力大多超过体循环压力,右心功能甚至是左心功能指标也已经出现下降。考虑到儿童肺移植术在我国的实际状况,反向Potts分流术成为较好的一个选择。
术前评估对反向Potts分流术后的预后起着至关重要的作用。Grady等[11]的多中心报道中指出:术前需入ICU,特别是术前依赖抢救性ECMO辅助;WSPH第三类肺动脉高压(肺部疾病、低氧引起的肺动脉高压)等都是术后早期死亡的危险因素。Bobhate等[13]总结了预后不良的术前指标:年龄>16岁;右房压>8 mmHg(1 mmHg=0.133 kPa);TAPSE<13 mm。本组实施手术的患儿中,均右房压>8(8~14)mmHg,TAPSE均在13(9.5~17.8)mm左右,再次印证我国PAH患儿的诊断及干预延迟,病情较重。3例死亡患儿中,除因脑梗死、脑疝死亡1例,另2例年龄均>12岁,且确诊后至手术间隔分别为4.5年及8.2年,远超2年的平均值。所以,符合手术指征后尽早实施反向Potts分流术能有效改善手术预后。患儿年龄增大、药物治疗效果丧失、心功能显著下降后再选择手术,则手术风险极大。
本组反向Potts分流术均在体外循环下实施,因为仍处于该术式开展早期且患儿普遍年龄大,考虑到肺动脉血管壁变性僵硬,缝合困难,而体外循环出现状况后利于补救,因此本组患儿均在体外循环下实施分流管道的吻合操作。本组出现1例脑梗死死亡的病例,因是右侧脑梗死,考虑可能是患儿Willis环不完整加之右侧颈部插管导致右脑急性缺血。有文献显示有50%以上的人群存在Wills环的变异,而Wills环不完整加之颈动脉狭窄易引起急性脑卒中的发生[14]。建议所有患儿术前常规进行头颅磁共振血管成像检查明确Wills环变异情况,并在颈部置管前行颈动脉压迫实验观察两侧脑氧变化,避免术后出现严重的神经系统并发症。
关于管道直径的选择,Gorbachevsky等[15]选择了60%~70%降主动脉过膈肌水平直径的管道,Lancaster等[16]及Rosenzweig等[17]选择的管道比值为70%~80%。本团队的管道选择为50%~70%降主动脉过膈肌水平直径大小。对于肺血管阻力大,肺动脉压力远超降主动脉压力的患儿,建议选用较小管径(降主动脉直径50%)的管道,防止过度肺-体分流。若管道直径偏大,一部分患儿会表现为下肢严重缺氧,本组1例在气管插管拔管后出现持续严重的下肢缺血,导致在术后11 d突发室性心律失常同时伴有肝脏功能损害;另外一部分管道直径偏大者表现为全身严重缺氧,因为过度的肺动脉血流经管道向降主动脉"泄洪",将导致经肺动脉到肺脏的血流量绝对不足,从而引起全身缺氧。本组1例经正中开胸后吻合于主肺动脉融合部和降主动脉管道术后出现全身严重缺氧,虽经VV-ECMO等辅助治疗,但仍无法缓解而最终死亡。
重度PAH患儿的治疗需要依赖多学科的紧密配合。术前以心脏内科为主导的多学科团队对患儿术前状况及手术指征的评估;术中以心脏外科为主导反向Potts术的实施及术中麻醉、体外循环管理、监测;术后早期监护室根据体-肺循环压力比,动态调整降肺高压药物联合便携式一氧化氮发生器[18]的一氧化氮吸入剂量与血管活性药物的剂量,以防止术后早期不可控分流导致的各种严重并发症;术后早期的监测、镇静、抗感染、抗凝、多脏器功能评估;出院后定期的心功能、运动耐量、实验室指标评估、降肺高压药物的调整等,治疗过程中这些环节的环环相扣都依赖于多学科间的高效沟通、通力合作。
本研究仍存在若干的不足:第一,本文为回顾性研究;第二,样本量仍较小,将来可能开展多中心的临床研究,积累更多经验;第三,术后随访时间仍较短,无法对该手术术后的远期预后做出评价,有待更长远的病例随访及分析。
所有作者均声明不存在利益冲突



























