
探讨午夜1 mg地塞米松抑制试验联合促肾上腺皮质激素(ACTH)兴奋试验在原发性醛固酮增多症(PA)分型诊断中的价值。
横断面研究。回顾性分析2020年1月至2022年9月解放军总医院第一医学中心确诊为PA并完成午夜1 mg地塞米松抑制试验联合ACTH兴奋试验患者的临床资料,分析比较醛固酮瘤(APA)和特发性醛固酮增多症(IHA)患者的临床特征及试验结果。通过绘制受试者工作特征(ROC)曲线评估午夜1 mg地塞米松抑制试验联合ACTH兴奋试验对鉴别APA和IHA的效能,以约登指数最大确定诊断指标的cut-off值。
共纳入82例PA患者,男43例,女39例,年龄(50.8±11.4)岁。根据PA类型分为APA组(n=49)和IHA组(n=33)。两组的体质指数、收缩压及舒张压差异均无统计学意义(均P>0.05)。APA组血钾、立位肾素均低于IHA组,差异均有统计学意义(均P<0.001);APA组立位血浆醛固酮浓度(PAC)、立位醛固酮与肾素比值(ARR)、卡托普利试验(CCT)前和后PAC、CCT后ARR、盐水输注试验(SIT)前和后PAC、单侧病变比例均大于IHA组,差异均有统计学意义(均P<0.001)。午夜1 mg地塞米松抑制试验联合ACTH兴奋试验后30、60、90、120 min APA组PAC及PAC/皮质醇均高于IHA组,差异均有统计学意义(均P<0.05)。试验后90 min PAC的ROC曲线下面积(AUC)最大,0.930(95%CI:0.874~0.986),PAC的cut-off值为39.05 ng/dl时约登指数最大(0.766),鉴别APA与IHA的灵敏度和特异度分别为91.8%和84.8%。
午夜1 mg地塞米松抑制试验联合ACTH兴奋试验在PA分型中具有一定临床价值,能够较好鉴别APA和IHA,其中90 min PAC及PAC/皮质醇的诊断效能最佳。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
原发性醛固酮增多症(primary aldosteronism,PA)在难治性高血压中占比高达20%[1],会造成严重靶器官损伤[2]。PA分型是临床诊断的难点,主要包括醛固酮瘤(aldosterone-producing adenoma,APA)和特发性醛固酮增多症(idiopathic hyper aldosteronism,IHA),分别占35%和60%[3]。由于APA常为单侧腺瘤,IHA为双侧病变,因此单双侧的鉴别有助于APA和IHA的区分[4]。2020年欧洲高血压学会共识推荐肾上腺静脉采血(adrenal venous sampling,AVS)作为区分单侧和双侧病变的金标准,但此操作为有创操作、受技术影响大、失败率高(1%~60%),而且结果难以标准化[5, 6]。因此,临床需要简单易行、无创和可普及性高的替代方法。
近年来,国内外学者采用促肾上腺皮质激素(adrenocorticotropic hormone,ACTH)兴奋试验鉴别经典APA和IHA[7, 8],显示出较好的结果。但ACTH使用剂量不同、选择血浆醛固酮浓度(plasma aldosterone concentration,PAC)还是PAC与皮质醇比值、切点值均不统一、灵敏度和特异度存在差异以及随访时间较短,因此值得进一步研究。本研究旨在探讨午夜1 mg地塞米松抑制试验联合ACTH兴奋试验在PA分型诊断中的价值,分析其在鉴别APA和IHA的最佳切点值。
横断面研究。回顾性分析2020年1月至2022年9月解放军总医院第一医学中心内分泌代谢科确诊的PA患者的临床资料。在门诊就诊期间详细询问患者降压药种类,尽量调整为钙离子拮抗剂或者α受体阻滞剂或者两者联合。纳入标准:确诊为PA并完成午夜1 mg地塞米松抑制试验及ACTH兴奋试验的患者。PA的诊断标准为[6,9]:(1)PA初筛试验阳性:即立位PAC(ng/dL)/肾素浓度(direct rennin concentration,DRC)(mU/L)比值(ARR)>3.7(当检测项目为PAC和DRC时,其单位分别为ng/dL和mU/L,ARR切点为3.7[9]),且DRC<5 mU/L或PAC>10 ng/dL。确诊试验:卧位盐水输注试验(saline infusion test,SIT),输注生理盐水后PAC>10 ng/dl;卡托普利抑制试验(captopril challenge test,CCT),服药后2 h PAC>11 ng/dl。(2)低钾合并DRC低于可检测下限且PAC>20 ng/dl可不行确诊试验。排除标准:(1)难治性高血压[使用3种常规降压药包括利尿剂无法控制血压(>140/90 mmHg,1 mmHg=0.133 kPa)的患者;使用≥4种降压药才能控制血压(<140/90 mmHg)的患者][9];(2)严重心功能衰竭及心律失常者;(3)年龄>80岁不宜行ACTH兴奋试验者;(4)肾上腺醛固酮-皮质醇共分泌瘤:1 mg地塞米松过夜抑制试验后次日清晨皮质醇>1.8 μg/dl(从μg/dl到nmol/L换算方式为×27.7,本文皮质醇作为校正指标,单位均采用μg/dl)者。PA分型诊断检查:所有患者住院期间完善肾上腺薄层CT增强扫描或者肾上腺MRI检查,肾上腺CT表现不典型或分型困难者行AVS检查。本研究通过解放军总医院第一医学中心伦理委员会批准(S2024-016-01号),所有受试者均签署知情同意书。
1. 收集患者临床数据:年龄、性别、病程、收缩压及舒张压、ACTH兴奋试验结果、血钾、立卧位DRC及PAC、ARR、确诊试验(CCT及SIT)结果、肾上腺CT或MRI、出院诊断、AVS结果、手术及病理诊断资料等。
2. APA诊断标准[1,6,9]:确诊PA且肾上腺影像学提示一侧存在典型肾上腺腺瘤且满足以下任意一条:(1)AVS提示腺瘤侧优势分泌PAC;(2)手术后病理明确提示腺瘤;单侧肾上腺切除术后患者生化结果完全缓解符合PA手术结局标准(血钾及ARR正常;若ARR升高,确诊试验中PAC被抑制)[10]。IHA诊断标准[1,6,9]:确诊PA且影像学提示双侧肾上腺正常或者双侧/单侧肾上腺结节样增生且满足以下任意一条:(1)AVS检查提示无优势分泌;(2)口服醛固酮受体拮抗剂后较前血压控制良好、血钾恢复正常,并且DRC超过8.2 mU/L[11]。
3. 肾上腺功能评估:肾上腺功能评估包括糖皮质激素自主分泌情况、甲氧基儿茶酚胺系列、立位肾素-血管紧张素-醛固酮系统检测。皮质醇及ACTH测定、DRC、PAC测定均采用化学发光法。血尿儿茶酚胺测定包括中间代谢产物甲氧基肾上腺素、甲氧基去甲肾上腺素等指标送北京金域检测中心,采用高效液相色谱-串联质谱法。
4. 午夜1 mg地塞米松联合ACTH兴奋试验流程:所有患者确诊PA后均行1 mg地塞米松抑制试验联合25 U或者50 U ACTH兴奋试验。试验开始当天午夜12点使用1 mg地塞米松(广东南国药业有限公司,国药准字H44024276)抑制内源性ACTH分泌;在尽量避免应激因素的前提下,于次晨8点检测基础PAC和皮质醇后,静脉注射ACTH(上海第一生化药业有限公司,国药准字H31022101)25 U或者50 U,留取0 min及注射后每30分钟患者血液标本,观察PAC及同步皮质醇的变化直至120 min,共5个点标本。
5. AVS操作流程:行ACTH刺激非同步双侧肾上腺静脉采血。插管前30 min内注入ACTH,速度为50 μg/h持续整个操作过程。选择指数:肾上腺皮质醇/外周静脉皮质醇≥3判断插管成功;侧向指数:比较两侧肾上腺静脉血PAC/肾上腺皮质醇≥4判断为单侧优势分泌[12]。
应用SPSS 25.0统计软件对数据进行分析,GraphPad Prism 8作图。正态分布的计量资料采用表示,组间比较采用独立样本t检验;非正态分布的计量资料以M(Q1,Q3)表示,组间比较采用Wilcoxon秩和检验;计数资料以例(%)表示,组间比较采用χ2检验。采用受试者工作特征(receiver operating characteristic,ROC)曲线评估午夜1 mg地塞米松抑制试验联合ACTH兴奋试验鉴别APA和IHA的效能,以约登指数最大确定诊断指标的cut-off值。双侧检验,检验水平取α=0.05
90例患者完成午夜1 mg地塞米松抑制试验和ACTH兴奋试验,排除数据不完整的病例;排除分型不确定例如肾上腺CT提示双侧腺瘤但未行AVS检查,或者AVS失败的病例[行AVS操作20例,其中失败5例(25.0%)]。最终纳入82例PA患者,男43例,女39例,年龄(50.8±11.4)岁,随访时间(12.4±5.2)个月。根据PA类型分为APA组(n=49),IHA组(n=33)。两组的体质指数、收缩压及舒张压差异均无统计学意义(均P>0.05);APA组血钾、立位DRC低于IHA组,差异均有统计学意义(均P<0.001);APA组立位PAC、ARR、CCT前和后PAC、CCT后ARR、SIT前和后PAC、单侧病变比例均大于IHA组,差异均有统计学意义(均P<0.001),见表1。
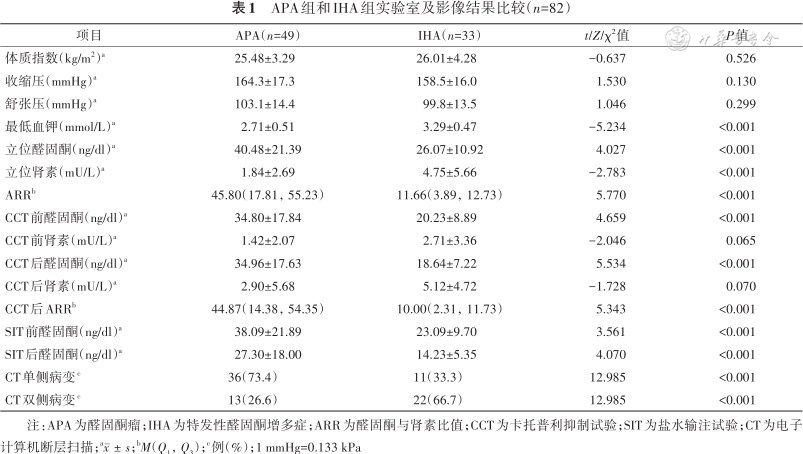
APA组和IHA组实验室及影像结果比较(n=82)
APA组和IHA组实验室及影像结果比较(n=82)
| 项目 | APA(n=49) | IHA(n=33) | t/Z/χ2值 | P值 |
|---|---|---|---|---|
| 体质指数(kg/m2)a | 25.48±3.29 | 26.01±4.28 | -0.637 | 0.526 |
| 收缩压(mmHg)a | 164.3±17.3 | 158.5±16.0 | 1.530 | 0.130 |
| 舒张压(mmHg)a | 103.1±14.4 | 99.8±13.5 | 1.046 | 0.299 |
| 最低血钾(mmol/L)a | 2.71±0.51 | 3.29±0.47 | -5.234 | <0.001 |
| 立位醛固酮(ng/dl)a | 40.48±21.39 | 26.07±10.92 | 4.027 | <0.001 |
| 立位肾素(mU/L)a | 1.84±2.69 | 4.75±5.66 | -2.783 | <0.001 |
| ARRb | 45.80(17.81,55.23) | 11.66(3.89,12.73) | 5.770 | <0.001 |
| CCT前醛固酮(ng/dl)a | 34.80±17.84 | 20.23±8.89 | 4.659 | <0.001 |
| CCT前肾素(mU/L)a | 1.42±2.07 | 2.71±3.36 | -2.046 | 0.065 |
| CCT后醛固酮(ng/dl)a | 34.96±17.63 | 18.64±7.22 | 5.534 | <0.001 |
| CCT后肾素(mU/L)a | 2.90±5.68 | 5.12±4.72 | -1.728 | 0.070 |
| CCT后ARRb | 44.87(14.38,54.35) | 10.00(2.31,11.73) | 5.343 | <0.001 |
| SIT前醛固酮(ng/dl)a | 38.09±21.89 | 23.09±9.70 | 3.561 | <0.001 |
| SIT后醛固酮(ng/dl)a | 27.30±18.00 | 14.23±5.35 | 4.070 | <0.001 |
| CT单侧病变c | 36(73.4) | 11(33.3) | 12.985 | <0.001 |
| CT双侧病变c | 13(26.6) | 22(66.7) | 12.985 | <0.001 |
注:APA为醛固酮瘤;IHA为特发性醛固酮增多症;ARR为醛固酮与肾素比值;CCT为卡托普利抑制试验;SIT为盐水输注试验;CT为电子计算机断层扫描;a;bM(Q1,Q3);c例(%);1 mmHg=0.133 kPa
午夜1 mg地塞米松抑制试验联合25 U或50 U ACTH兴奋试验结果显示,APA组无论基线还是ACTH刺激后各点PAC显著高于IHA组,差异均有统计学意义(均P<0.05),其中APA组PAC从30 min即明显升高,一直持续到120 min维持较高水平。APA组PAC峰值主要出现在90 min及120 min两点;IHA组中PAC 峰值在30 min出现,而90 min和120 min呈下降趋势;APA组刺激后各时间点PAC/皮质醇亦显著高于IHA组,差异均有统计学意义(均P<0.05),见表2。
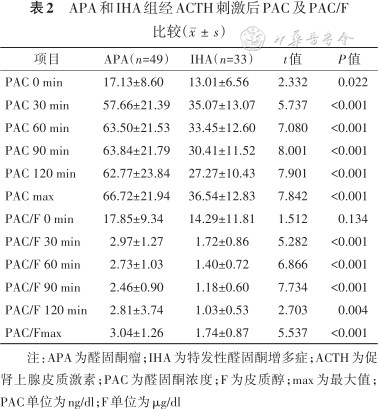
APA和IHA组经ACTH刺激后PAC及PAC/F比较()
APA和IHA组经ACTH刺激后PAC及PAC/F比较()
| 项目 | APA(n=49) | IHA(n=33) | t值 | P值 |
|---|---|---|---|---|
| PAC 0 min | 17.13±8.60 | 13.01±6.56 | 2.332 | 0.022 |
| PAC 30 min | 57.66±21.39 | 35.07±13.07 | 5.737 | <0.001 |
| PAC 60 min | 63.50±21.53 | 33.45±12.60 | 7.080 | <0.001 |
| PAC 90 min | 63.84±21.79 | 30.41±11.52 | 8.001 | <0.001 |
| PAC 120 min | 62.77±23.84 | 27.27±10.43 | 7.901 | <0.001 |
| PAC max | 66.72±21.94 | 36.54±12.83 | 7.842 | <0.001 |
| PAC/F 0 min | 17.85±9.34 | 14.29±11.81 | 1.512 | 0.134 |
| PAC/F 30 min | 2.97±1.27 | 1.72±0.86 | 5.282 | <0.001 |
| PAC/F 60 min | 2.73±1.03 | 1.40±0.72 | 6.866 | <0.001 |
| PAC/F 90 min | 2.46±0.90 | 1.18±0.60 | 7.734 | <0.001 |
| PAC/F 120 min | 2.81±3.74 | 1.03±0.53 | 2.703 | 0.004 |
| PAC/Fmax | 3.04±1.26 | 1.74±0.87 | 5.537 | <0.001 |
注:APA为醛固酮瘤;IHA为特发性醛固酮增多症;ACTH为促肾上腺皮质激素;PAC为醛固酮浓度;F为皮质醇;max为最大值;PAC单位为ng/dl;F单位为μg/dl
同时,本研究比较了25 U(29例,35.4%)和50 U(53例,64.6%)ACTH对APA和IHA的差异,显示不同剂量ACTH刺激后两组PAC、皮质醇、PAC/皮质醇差异均无统计学意义(均P>0.05)。
绘制午夜1 mg地塞米松抑制试验联合ACTH兴奋试验后PAC 30、60、90、120 min、最大值及PAC/皮质醇30、60、90、120 min、最大值鉴别APA和IHA的ROC曲线,计算曲线下面积(AUC)。ACTH刺激后30~120 min各点PAC及PAC/皮质醇均显示较好的鉴别诊断效能,AUC从大到小依次为90 min PAC(0.930)、120 min PAC(0.924)、90 min PAC/皮质醇(0.910)、120 min PAC/皮质醇(0.901)。90 min PAC cut-off值为39.05 ng/dl,约登指数最大(0.766),灵敏度91.8%,特异度84.8%,见图1、表3。
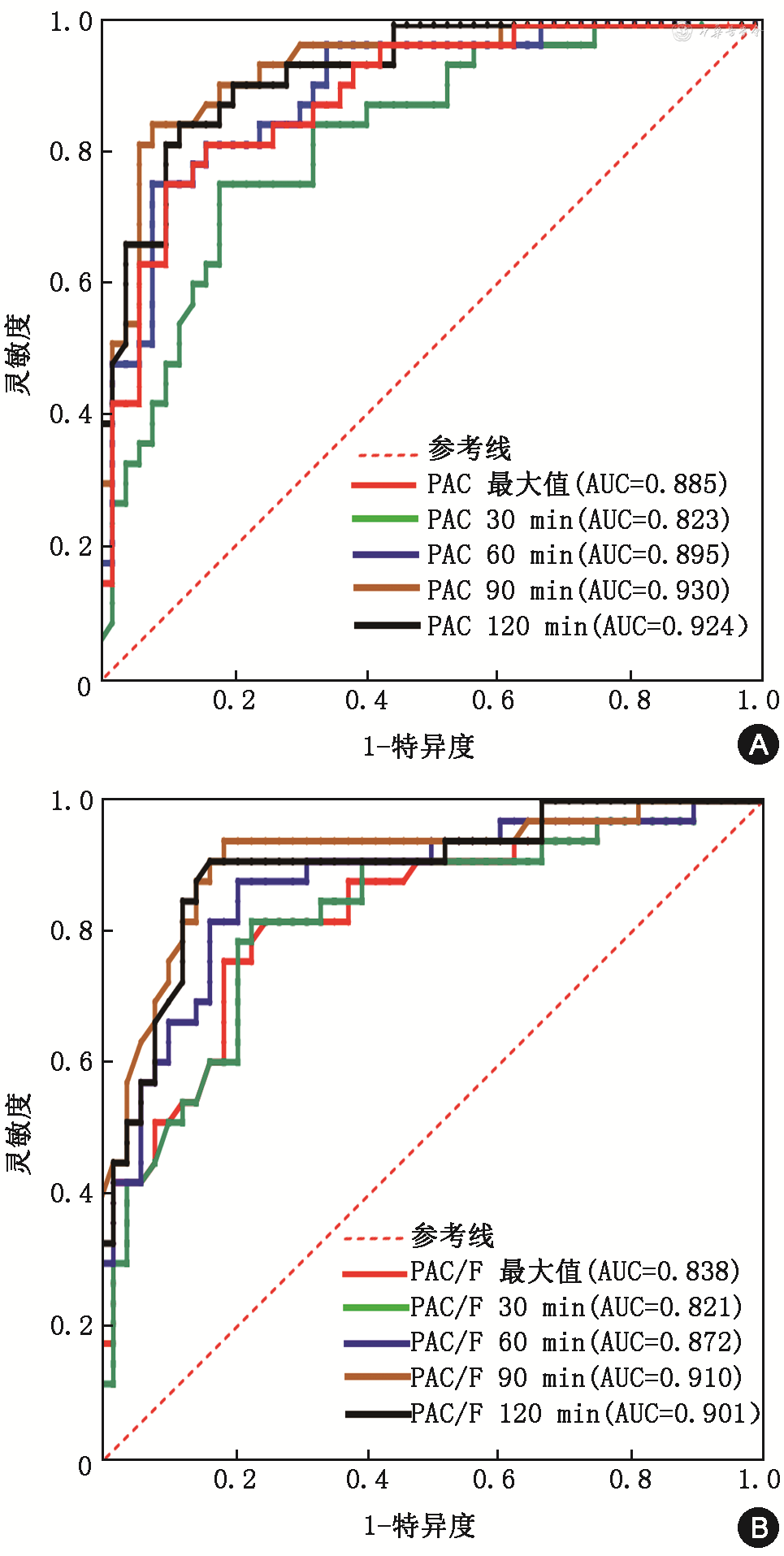

注:ACTH为促肾上腺皮质激素;PAC为醛固酮浓度;F为皮质醇;APA为醛固酮瘤;IHA为特发性醛固酮增多症;ROC曲线为受试者工作特征曲线;AUC为曲线下面积
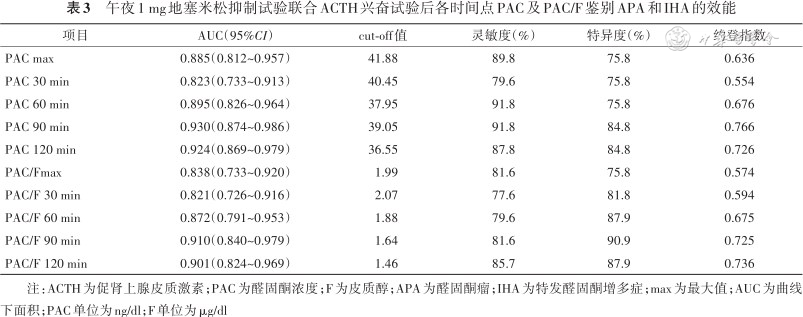
午夜1 mg地塞米松抑制试验联合ACTH兴奋试验后各时间点PAC及PAC/F鉴别APA和IHA的效能
午夜1 mg地塞米松抑制试验联合ACTH兴奋试验后各时间点PAC及PAC/F鉴别APA和IHA的效能
| 项目 | AUC(95%CI) | cut-off值 | 灵敏度(%) | 特异度(%) | 约登指数 |
|---|---|---|---|---|---|
| PAC max | 0.885(0.812~0.957) | 41.88 | 89.8 | 75.8 | 0.636 |
| PAC 30 min | 0.823(0.733~0.913) | 40.45 | 79.6 | 75.8 | 0.554 |
| PAC 60 min | 0.895(0.826~0.964) | 37.95 | 91.8 | 75.8 | 0.676 |
| PAC 90 min | 0.930(0.874~0.986) | 39.05 | 91.8 | 84.8 | 0.766 |
| PAC 120 min | 0.924(0.869~0.979) | 36.55 | 87.8 | 84.8 | 0.726 |
| PAC/Fmax | 0.838(0.733~0.920) | 1.99 | 81.6 | 75.8 | 0.574 |
| PAC/F 30 min | 0.821(0.726~0.916) | 2.07 | 77.6 | 81.8 | 0.594 |
| PAC/F 60 min | 0.872(0.791~0.953) | 1.88 | 79.6 | 87.9 | 0.675 |
| PAC/F 90 min | 0.910(0.840~0.979) | 1.64 | 81.6 | 90.9 | 0.725 |
| PAC/F 120 min | 0.901(0.824~0.969) | 1.46 | 85.7 | 87.9 | 0.736 |
注:ACTH为促肾上腺皮质激素;PAC为醛固酮浓度;F为皮质醇;APA为醛固酮瘤;IHA为特发醛固酮增多症;max为最大值;AUC为曲线下面积;PAC单位为ng/dl;F单位为μg/dl
PA的分型诊断是临床上的难点,探索无创、有效的PA分型诊断方法仍然是内分泌医师的重要任务。本研究回顾性分析解放军总医院第一医学中心临床确诊为APA或IHA患者的午夜1 mg地塞米松抑制试验联合ACTH兴奋试验数据,发现90 min PAC AUC 最大(AUC=0.930),PAC切点为39.05 ng/dl,敏感性91.8%,特异性84.8%,适合在怀疑APA患者中开展筛查,可望略过AVS直接手术,具有一定临床指导价值。
本研究并未将AVS作为鉴别IHA和APA的“金标准”。伴有极端侧向指数的严重PA实际上可能是长期的、多灶性疾病,而适度的侧化指数可能是由早期的单一APA引起的[13],AVS无法识别这些临床问题,而且AVS也无法排除不对称双侧PA[14]。
研究证实APA过表达ACTH受体信使RNA,APA对血浆ACTH刺激的微小变化比对血管紧张素Ⅱ或血钾变化更敏感,而IHA的ACTH受体表达与正常肾上腺组织相似[15]。本研究发现ACTH刺激后APA组PAC、PAC/皮质醇均显著高于IHA组(均P<0.05),证实了APA和IHA对ACTH刺激后的不同反应。本研究结果显示,AUC在90 min PAC最大,PAC切点值为39.05 ng/dl,这与Takuhiro等[7](25 U ACTH)试验结果较为相似(90 min PAC切点值定为37.90 ng/dl,诊断APA灵敏度为91.3%,特异度为80.6%)。确诊PA且PAC 90 min低于39.05 ng/dl最有可能为IHA。当PAC 90 min高于39.05 ng/dl结合典型肾上腺CT,不必要行AVS可选择直接手术;当CT表现不典型时,可选择AVS。国内Jiang等[8]使用50 U ACTH刺激后,显示120 min的PAC作为诊断单侧PA的准确度最高,切点值为77.90 ng/dl(显著高于本研究39.05 ng/dl),其灵敏度为76.8%(本研究91.8%),特异度为87.2%(本研究84.8%)。由于Jiang等[8]使用了较大剂量的ACTH,且该研究分型时纳入较多原发性肾上腺皮质增生(primary adrenal hyperplasia,PAH)患者(APA33例,PAH19例,IHA39例),导致切点存在明显差异。本研究采用两种不同剂量(25和50 U)ACTH,结果显示25 U ACTH可表现出足够醛固酮刺激作用,这与后来的系列研究结果一致[16, 17, 18]。
本研究的结果显示,90 min PAC/皮质醇AUC为0.910,最佳切点为1.635,灵敏度81.6%,特异度90.9%。Kita等[17](25 U ACTH)研究显示120 min时间点PAC/皮质醇切点值为≥1.2时,对确定PA为单侧病变的灵敏度为95.5%,特异度为88.9%,其灵敏度高于本研究,特异度相似。Moriya等[18]同样采用25 U ACTH,结果显示PAC最大值/皮质醇以18.3(PAC单位使用pg/ml)作为切点其灵敏度为83%,特异度为88%。上述PAC/皮质醇切点差异主要来自AVS判断侧向指数不同及选择性偏倚(样本量及分型比例不同)所致。与PAC相比,PAC/皮质醇对鉴别APA和IHA特异度升高、灵敏度降低,但总体效能并不比PAC更高,因此PAC仍是较好的指标。肾上腺醛固酮-皮质醇共分泌瘤可能在APA中占比为10%以上[19],过量皮质醇在PA中具有潜在影响,本研究认为午夜1 mg地塞米松抑制基础皮质醇分泌再联合ACTH刺激试验较为重要。
本研究局限性为单中心研究、样本量较小、随访时间较短,目前的切点是否进一步推广需要多中心临床研究、更大样本量、更长时间随访来验证。由于本研究并非所有患者行AVS,故IHA诊断标准存在缺陷。在今后研究中,可纳入更多行AVS的IHA患者或者借鉴双侧病变预测模型[20]辅助诊断IHA。
综上,本研究探索了午夜1 mg地塞米松抑制试验联合ACTH兴奋试验对PA分型的诊断价值,考虑目前PA患病率较高,AVS又难以推广的情况下,可根据肾上腺CT、午夜1 mg地塞米松抑制试验联合ACTH兴奋试验、长期随访等临床综合数据判断PA分型,具有一定借鉴及指导意义。
邱平, 张丽, 姜得悦, 等. 午夜1 mg地塞米松抑制试验联合ACTH兴奋试验在原发性醛固酮增多症分型诊断中的价值探讨[J]. 中华医学杂志, 2024, 104(24): 2242-2248. DOI: 10.3760/cma.j.cn112137-20231115-01104.
所有作者声明不存在利益冲突































