
通过监测全国血流感染革兰阳性菌病原谱分布及其耐药趋势,为临床革兰阳性菌血流感染提供更为合理的防控方案。
收集全国血流感染细菌耐药监测联盟(BRICS)成员单位2022年1至12月所有分离自血培养的革兰阳性菌,按美国临床和实验室标准化研究所(CLSI)推荐的稀释法进行抗菌药物敏感性测定。采用WHONET 5.6和SPSS 25.0软件进行统计分析。
共收集51家成员单位3 163株革兰阳性菌,分离菌株数排在前5位的病原菌为金黄色葡萄球菌1 147株(36.3%)、凝固酶阴性葡萄球菌928株(29.3%)、屎肠球菌369株(11.7%)、粪肠球菌296株(9.4%)和α-溶血链球菌192株(6.1%)。其中耐甲氧西林金黄色葡萄球菌(methicillin-resistant Staphylococcus aureus,MRSA)和耐甲氧西林凝固酶阴性葡萄球菌(methicillin-resistant coagulase-negative Staphylococci,MRCNS)流行率分别为26.4%(303/1 147)和66.7%(619/928),未检测到对糖肽类和达托霉素耐药的葡萄球菌属;金黄色葡萄球菌对头孢比罗、利福平、复方磺胺甲噁唑、利奈唑胺、米诺环素及替加环素的敏感率均>95.0%。屎肠球菌分离率高于粪肠球菌,屎肠球菌对万古霉素及替考拉宁的耐药率均为0.5%(2/369),未检测到耐万古霉素粪肠球菌。我国南部地区的MRSA检出率低于其他地区(χ2=14.578,P=0.002),而北部地区的MRCNS检出率高于其他地区(χ2=15.195,P=0.002)。省级医院的MRSA和MRCNS检出率均高于地市级医院(χ2=13.519和12.136,P<0.001)。人均GDP≥92 059元地区的MRSA和MRCNS检出率均高于人均GDP<92 059元地区(χ2=9.969和7.606,P=0.002和0.006)。
我国引起血流感染的革兰阳性菌中,以葡萄球菌属为主,MRSA整体流行率呈进一步下降趋势;屎肠球菌检出率超过粪肠球菌,耐万古霉素肠球菌仍然处于较低水平;我国不同地域的革兰阳性菌构成比和耐药谱略有不同,MRSA和MRCNS在省级医院和人均GDP≥92 059元地区更为突出。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
血流感染是临床严重感染之一,是导致患者高病死率的危险因素,对患者安全和医疗保健系统产生重要影响。美国每年血流感染导致死亡人数超过20万[1]。我国血流感染病原菌中革兰阳性菌占比不高,但耐药较为严重,如耐甲氧西林金黄色葡萄球菌(methicillin-resistant Staphylococcus aureus,MRSA)、耐甲氧西林凝固酶阴性葡萄球菌(methicillin-resistant coagulase-negative Staphylococci,MRCNS)处于较高流行水平[2]。早期、正确选择治疗药物可以提高血流感染的治疗有效率,而临床经验性治疗的抗菌药物选择主要依据感染指征以及感染病原体流行病学数据。同时,不同地区、抗菌药物使用状况、经济发展水平和医疗服务等都可能影响血流感染的病原体构成和耐药变迁[3]。因此,细菌耐药监测结果对指导正确的抗感染治疗具有十分重要的价值。
全国血流感染细菌耐药监测联盟(bacterial resistant investigation collaborative system,BRICS)自2014年成立以来,至今已覆盖18个省市区,有63家成员单位参与,连续开展的血流感染细菌耐药监测,为我国血流感染治疗与控制提供了重要数据。本文报告了2022年BRICS血流感染革兰阳性菌构成及耐药情况,以期为临床治疗及细菌耐药防控提供参考。
2022年报送菌株单位涵盖15个省28家省级医院和23家地市级医院。参加单位均有独立的微生物实验室和固定微生物检验人员,拥有血培养仪、微生物鉴定和药敏仪器,采用规范化微生物检验流程,室间和室内质控合格。
收集2022年1月1日至12月31日成员单位分离自血流感染的细菌,具体按照《全国临床检验操作规程》(第四版)[4]及BRICS血流感染细菌耐药监测方案进行标本采集、培养及菌株鉴定,包括常规生化鉴定和自动化仪器鉴定;单瓶培养阳性的凝固酶阴性葡萄球菌、芽孢杆菌属、草绿色链球菌、棒状杆菌属、丙酸杆菌属、气球菌属及微球菌属等结合临床判断,排除污染菌;剔除所有布鲁菌,并剔除同一患者重复菌株。成员单位将临床分离自血流感染的菌株按季度统一转送至传染病重症诊治全国重点实验室,实验室收到菌种后进行复苏、纯化及复核鉴定后保存入库,菌株统一保存于Microbank®冻存管并于-80℃贮存。
青霉素G(批号:130437-201707,效价:94.1%)购自中国食品药品生物制品检定研究院;头孢呋辛(批号:S0909A,浓度:98%)、头孢曲松(批号:M0325A,效价:98%)、头孢吡肟(批号:N118A,效价:82.5%)、头孢西丁(批号:S0916A,效价:90.1%)、环丙沙星(批号:J0718A,效价:99%)、左氧氟沙星(批号:J0622A,效价:99%)、美罗培南(批号:S0922B,效价:98%)、甲氧苄啶(批号:M0318B,效价:99%)、复方磺胺甲噁唑(批号:A0724B,效价:99.5%)、庆大霉素(批号:J011BS,浓度:590 IU/mg)、米诺环素(批号:N1130A,效价:98%)、红霉素(批号:D1229CS,效价:100%)、克林霉素(批号:M0506A,效价:95%)、苯唑西林(批号:M0511AS,效价:98%)、四环素(批号:01015AS,效价:98%)、利福平(批号S0908A,效价:97%)、莫西沙星(批号:J0716A,效价:99%)、利奈唑胺(批号:J0710A,效价:99%)、氨苄西林(批号:M0621AS,效价:98%)为大连美仑生物技术有限公司商品;头孢比罗(批号:YF-BAL9141-000-211209-01,效价:91.3%)为华润九新药业有限公司产品;替加环素、替考拉宁、万古霉素、达托霉素肉汤稀释法药敏测定板为温州康泰生物科技有限公司定制产品,抗菌药物纸片(头孢西丁、青霉素、红霉素和克林霉素纸片)为英国Oxoid公司商品。
按照美国临床和实验室标准化研究所(CLSI)推荐[5],药物敏感性测定采用金黄色葡萄球菌ATCC29213、金黄色葡萄球菌ATCC25923、粪肠球菌ATCC29212、肺炎链球菌ATCC49619为质控菌株。上述菌株均为本实验室常备菌株。
Mueller-Hinton(MH)琼脂为英国Oxoid公司产品,液体培养基经钙离子调节的Mueller-Hinton肉汤(CAMHB)为Sigma公司产品,CaCl2、NaOH、NaCl均为生工生物工程(上海)股份有限公司产品,脱脂羊血为南京茂捷微生物科技有限公司产品,磷酸盐缓冲液(PBS)为吉诺生物医药技术有限公司产品。微量肉汤稀释法肉汤为温州康泰贸易有限公司产品。
按CLSI推荐的头孢西丁(30 μg)纸片法进行,培养温度(35±2)℃,判断标准:对于金黄色葡萄球菌培养16~18 h判读结果,头孢西丁纸片扩散法的抑菌圈直径≥22 mm,判读为甲氧西林敏感金黄色葡萄球菌(methicillin-susceptible Staphylococcus aureus,MSSA);直径≤21 mm,判读为MRSA。对于凝固酶阴性葡萄球菌(伪中间葡萄球菌、施氏葡萄球菌和路邓葡萄球菌除外)培养24h判读结果,头孢西丁纸片扩散法的抑菌圈直径≥25 mm,判读为甲氧西林敏感凝固酶阴性葡萄球菌(methicillin-susceptible coagulase-negative Staphylococci,MSCNS);直径≤24 mm,判读为MRCNS。伪中间葡萄球菌和施氏葡萄球菌采用苯唑西林(1 μg)纸片法,培养16~18 h判读结果,纸片扩散法的抑菌圈直径≥18 mm,判读为甲氧西林敏感葡萄球菌。路邓葡萄球菌的检测和判读方法同金黄色葡萄球菌。替加环素、替考拉宁和万古霉素采用肉汤稀释法,(35±2)℃培养16~20 h判读结果,其中万古霉素需要培养24 h方能判读结果。
按CLSI推荐的红霉素(15 μg)和克林霉素(2 μg)纸片法对红霉素耐药且克林霉素非耐药的葡萄球菌属、肺炎链球菌和β-溶血链球菌进行克林霉素诱导试验,细菌对克林霉素耐药率及最低抑菌浓度(minimal inhibitory concentration,MIC)均按照诱导试验结果计算。
葡萄球菌及肠球菌中的万古霉素、替考拉宁、替加环素及达托霉素采用微量肉汤稀释法进行药敏测定,其他药物采用琼脂稀释法进行药敏测定;链球菌所有药物均采用微量肉汤稀释法进行药敏测定。按照CLSI推荐的操作指南实验,结果判读抗菌药物折点参照CLSI为主;若在CLSI尚无折点,判读结果参照欧洲抗菌药物敏感性试验委员会(EUCAST)标准(https://www.eucast.org);替加环素的折点参照美国食品和药品监督管理局(FDA)标准(https://www.fda.gov)。肺炎链球菌、α-溶血链球菌和β-溶血链球菌的肉汤稀释法使用含有细胞裂解马血(2.5%~5%,v/v LHB)的CAMHB;在检测达托霉素时添加钙离子浓度至50 mg/L;葡萄球菌进行苯唑西林药敏试验时,需在MH琼脂中加入终浓度为2%的NaCl。药敏试验结果采用MIC、MIC50/90表述,计算细菌对药物的敏感率和耐药率。
根据菌株来源的不同,将15个省区根据地理位置分为东部地区(江苏、山东、浙江、福建、安徽和江西)、中部地区(河南、湖北)、北部地区(陕西、辽宁、内蒙古和甘肃)及南部地区(广东、四川和云南)。基于上述地理位置分组,对2022年血流感染革兰阳性菌构成和耐药流行情况进行空间差异性分析。
根据医院等级分为省级医院及地市级医院,对2022年不同等级医院血流感染革兰阳性菌构成和耐药流行情况进行差异性分析。同时,为了分析我国经济发展不同地区医院血流感染革兰阳性菌构成及耐药流行情况,根据国家统计局网站(www.stats.gov.cn)公布的数据,按2022年人均GDP 92 059元为分界点,将成员单位所在省份分为人均GDP≥92 059元地区及人均GDP<92 059元地区。
采用WHONET 5.6进行药敏统计分析。采用SPSS 25.0软件进行数据分析,计数资料采用株(百分数)表示,采用χ2检验。以P<0.05为差异具有统计学意义。
2022年共收集到51家成员单位分离的13 379株细菌,经复核,删除1 181株不符合要求的菌株,包括599株经复核后有误,582株其他微生物(包括真菌、厌氧菌和少见病原菌等);革兰阳性菌为3 163株(25.9%),其中葡萄球菌占65.6%(2 075/3 163),肠球菌占22.9%(723/3 163),链球菌占11.4%(362/3 163)。金黄色葡萄球菌、凝固酶阴性葡萄球菌、屎肠球菌、粪肠球菌和α-溶血链球菌为前5位主要分离的革兰阳性菌(图1)。
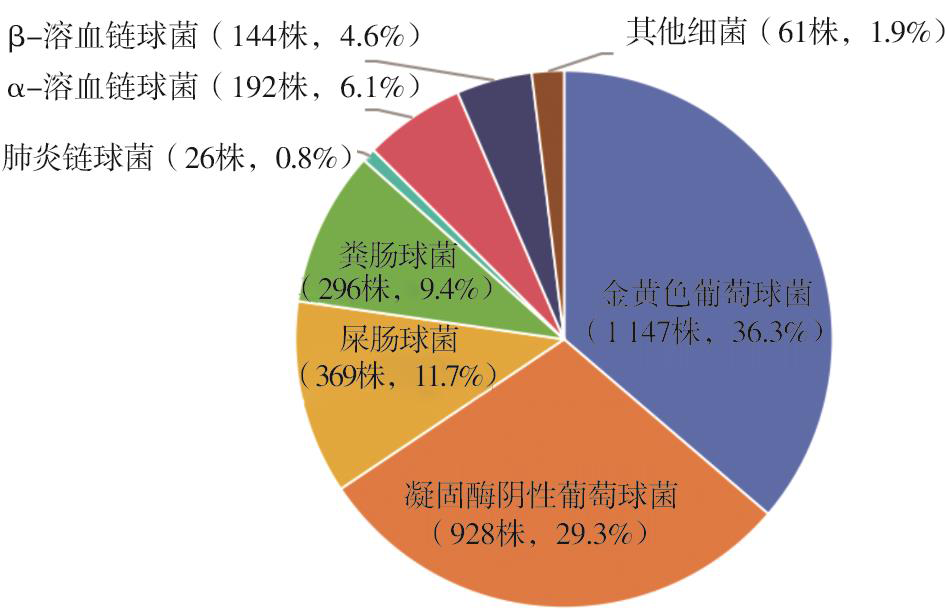

共分离2 075株,其中金黄色葡萄球菌1 147株,凝固酶阴性葡萄球菌928株;MRSA检出率为26.4%(303/1 147),MRCNS检出率为66.7%(619/928)。未分离到对万古霉素、替考拉宁、达托霉素和利奈唑胺耐药的金黄色葡萄球菌,但有5.6%(64/1 147)的金黄色葡萄球菌对万古霉素MIC为2 mg/L。金黄色葡萄球菌对青霉素G的敏感率为4.4%,对头孢比罗、利福平、复方磺胺甲噁唑、米诺环素和替加环素的敏感率较高(>95.0%)(表1)。
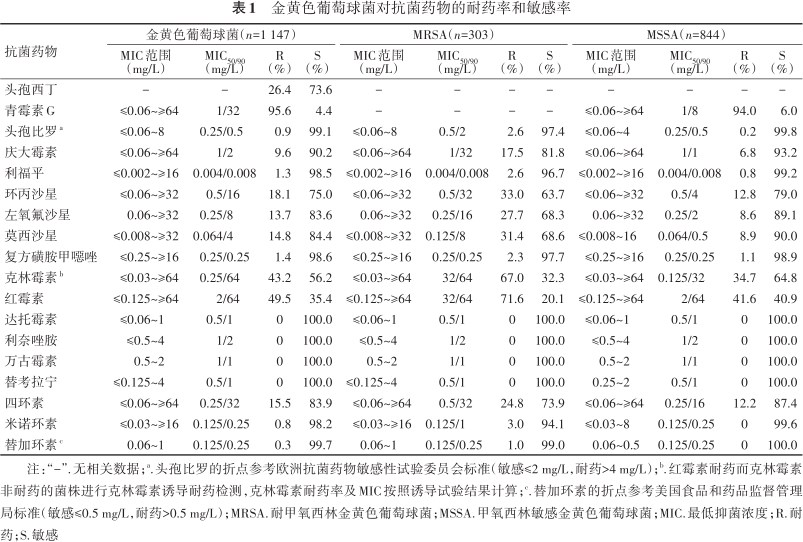
金黄色葡萄球菌对抗菌药物的耐药率和敏感率
金黄色葡萄球菌对抗菌药物的耐药率和敏感率
| 抗菌药物 | 金黄色葡萄球菌(n=1 147) | MRSA(n=303) | MSSA(n=844) | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
MIC范围 (mg/L) | MIC50/90 (mg/L) | R (%) | S (%) | MIC范围 (mg/L) | MIC50/90 (mg/L) | R (%) | S (%) | MIC范围 (mg/L) | MIC50/90 (mg/L) | R (%) | S (%) | |
| 头孢西丁 | - | - | 26.4 | 73.6 | - | - | - | - | - | - | - | - |
| 青霉素G | ≤0.06~≥64 | 1/32 | 95.6 | 4.4 | - | - | - | - | ≤0.06~≥64 | 1/8 | 94.0 | 6.0 |
| 头孢比罗a | ≤0.06~8 | 0.25/0.5 | 0.9 | 99.1 | ≤0.06~8 | 0.5/2 | 2.6 | 97.4 | ≤0.06~4 | 0.25/0.5 | 0.2 | 99.8 |
| 庆大霉素 | ≤0.06~≥64 | 1/2 | 9.6 | 90.2 | ≤0.06~≥64 | 1/32 | 17.5 | 81.8 | ≤0.06~≥64 | 1/1 | 6.8 | 93.2 |
| 利福平 | ≤0.002~≥16 | 0.004/0.008 | 1.3 | 98.5 | ≤0.002~≥16 | 0.004/0.008 | 2.6 | 96.7 | ≤0.002~≥16 | 0.004/0.008 | 0.8 | 99.2 |
| 环丙沙星 | ≤0.06~≥32 | 0.5/16 | 18.1 | 75.0 | ≤0.06~≥32 | 0.5/32 | 33.0 | 63.7 | ≤0.06~≥32 | 0.5/4 | 12.8 | 79.0 |
| 左氧氟沙星 | 0.06~≥32 | 0.25/8 | 13.7 | 83.6 | 0.06~≥32 | 0.25/16 | 27.7 | 68.3 | 0.06~≥32 | 0.25/2 | 8.6 | 89.1 |
| 莫西沙星 | ≤0.008~≥32 | 0.064/4 | 14.8 | 84.4 | ≤0.008~≥32 | 0.125/8 | 31.4 | 68.6 | ≤0.008~16 | 0.064/0.5 | 8.9 | 90.0 |
| 复方磺胺甲噁唑 | ≤0.25~≥16 | 0.25/0.25 | 1.4 | 98.6 | ≤0.25~≥16 | 0.25/0.25 | 2.3 | 97.7 | ≤0.25~≥16 | 0.25/0.25 | 1.1 | 98.9 |
| 克林霉素b | ≤0.03~≥64 | 0.25/64 | 43.2 | 56.2 | ≤0.03~≥64 | 32/64 | 67.0 | 32.3 | ≤0.03~≥64 | 0.125/32 | 34.7 | 64.8 |
| 红霉素 | ≤0.125~≥64 | 2/64 | 49.5 | 35.4 | ≤0.125~≥64 | 32/64 | 71.6 | 20.1 | ≤0.125~≥64 | 2/64 | 41.6 | 40.9 |
| 达托霉素 | ≤0.06~1 | 0.5/1 | 0 | 100.0 | ≤0.06~1 | 0.5/1 | 0 | 100.0 | ≤0.06~1 | 0.5/1 | 0 | 100.0 |
| 利奈唑胺 | ≤0.5~4 | 1/2 | 0 | 100.0 | ≤0.5~4 | 1/2 | 0 | 100.0 | ≤0.5~4 | 1/2 | 0 | 100.0 |
| 万古霉素 | 0.5~2 | 1/1 | 0 | 100.0 | 0.5~2 | 1/1 | 0 | 100.0 | 0.5~2 | 1/1 | 0 | 100.0 |
| 替考拉宁 | ≤0.125~4 | 0.5/1 | 0 | 100.0 | ≤0.125~4 | 0.5/1 | 0 | 100.0 | 0.25~2 | 0.5/1 | 0 | 100.0 |
| 四环素 | ≤0.06~≥64 | 0.25/32 | 15.5 | 83.9 | ≤0.06~≥64 | 0.5/32 | 24.8 | 73.9 | ≤0.06~≥64 | 0.25/16 | 12.2 | 87.4 |
| 米诺环素 | ≤0.03~≥16 | 0.125/0.25 | 0.8 | 98.2 | ≤0.03~≥16 | 0.125/1 | 3.0 | 94.1 | ≤0.03~8 | 0.125/0.25 | 0 | 99.6 |
| 替加环素c | 0.06~1 | 0.125/0.25 | 0.3 | 99.7 | 0.06~1 | 0.125/0.25 | 1.0 | 99.0 | 0.06~0.5 | 0.125/0.25 | 0 | 100.0 |
注:“-”.无相关数据;a.头孢比罗的折点参考欧洲抗菌药物敏感性试验委员会标准(敏感≤2 mg/L,耐药>4 mg/L);b.红霉素耐药而克林霉素非耐药的菌株进行克林霉素诱导耐药检测,克林霉素耐药率及MIC按照诱导试验结果计算;c.替加环素的折点参考美国食品和药品监督管理局标准(敏感≤0.5 mg/L,耐药>0.5 mg/L);MRSA.耐甲氧西林金黄色葡萄球菌;MSSA.甲氧西林敏感金黄色葡萄球菌;MIC.最低抑菌浓度;R.耐药;S.敏感
凝固酶阴性葡萄球菌中,以表皮葡萄球菌和人型葡萄球菌为主,分别占40.0%(371/928)和30.1%(279/928),其他葡萄球菌属合计占30.0%(278/928)。未分离到对达托霉素、万古霉素和替加环素耐药的凝固酶阴性葡萄球菌,但42.8%(397/928)凝固酶阴性葡萄球菌对万古霉素的MIC≥2 mg/L(均≤4 mg/L),而表皮葡萄球菌对万古霉素MIC≥2 mg/L(均≤4 mg/L)的菌株数比例为83.0%(308/371)。凝固酶阴性葡萄球菌对头孢比罗、利福平、利奈唑胺、替考拉宁和米诺环素保持较高的敏感性(>90.0%);有8株(0.9%,8/928)对利奈唑胺耐药,均为MRCNS,包括5株头葡萄球菌,2株表皮葡萄球菌和1株溶血葡萄球菌(表2和表3)。
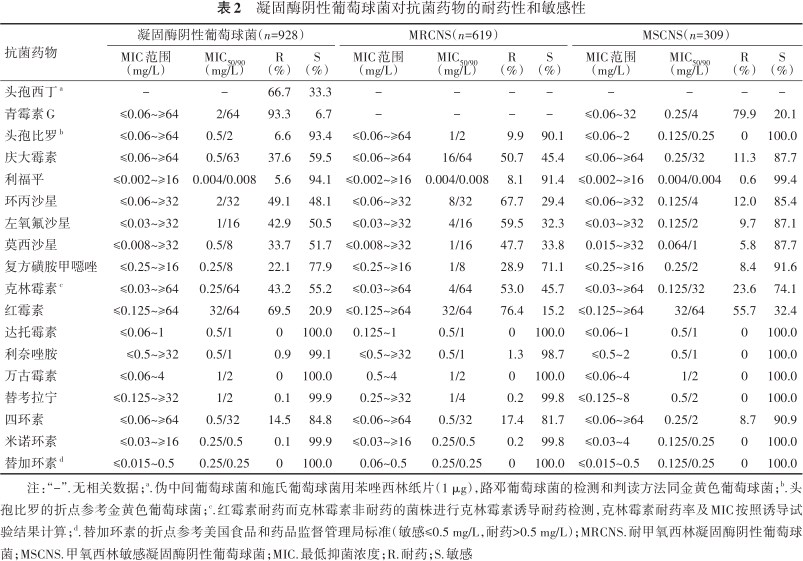
凝固酶阴性葡萄球菌对抗菌药物的耐药性和敏感性
凝固酶阴性葡萄球菌对抗菌药物的耐药性和敏感性
| 抗菌药物 | 凝固酶阴性葡萄球菌(n=928) | MRCNS(n=619) | MSCNS(n=309) | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
MIC范围 (mg/L) | MIC50/90 (mg/L) | R (%) | S (%) | MIC范围 (mg/L) | MIC50/90 (mg/L) | R (%) | S (%) | MIC范围 (mg/L) | MIC50/90 (mg/L) | R (%) | S (%) | |
| 头孢西丁a | - | - | 66.7 | 33.3 | - | - | - | - | - | - | - | - |
| 青霉素G | ≤0.06~≥64 | 2/64 | 93.3 | 6.7 | - | - | - | - | ≤0.06~32 | 0.25/4 | 79.9 | 20.1 |
| 头孢比罗b | ≤0.06~≥64 | 0.5/2 | 6.6 | 93.4 | ≤0.06~≥64 | 1/2 | 9.9 | 90.1 | ≤0.06~2 | 0.125/0.25 | 0 | 100.0 |
| 庆大霉素 | ≤0.06~≥64 | 0.5/63 | 37.6 | 59.5 | ≤0.06~≥64 | 16/64 | 50.7 | 45.4 | ≤0.06~≥64 | 0.25/32 | 11.3 | 87.7 |
| 利福平 | ≤0.002~≥16 | 0.004/0.008 | 5.6 | 94.1 | ≤0.002~≥16 | 0.004/0.008 | 8.1 | 91.4 | ≤0.002~≥16 | 0.004/0.004 | 0.6 | 99.4 |
| 环丙沙星 | ≤0.06~≥32 | 2/32 | 49.1 | 48.1 | ≤0.06~≥32 | 8/32 | 67.7 | 29.4 | ≤0.06~≥32 | 0.125/4 | 12.0 | 85.4 |
| 左氧氟沙星 | ≤0.03~≥32 | 1/16 | 42.9 | 50.5 | ≤0.03~≥32 | 4/16 | 59.5 | 32.3 | ≤0.03~≥32 | 0.125/2 | 9.7 | 87.1 |
| 莫西沙星 | ≤0.008~≥32 | 0.5/8 | 33.7 | 51.7 | ≤0.008~≥32 | 1/16 | 47.7 | 33.8 | 0.015~≥32 | 0.064/1 | 5.8 | 87.7 |
| 复方磺胺甲噁唑 | ≤0.25~≥16 | 0.25/8 | 22.1 | 77.9 | ≤0.25~≥16 | 1/8 | 28.9 | 71.1 | ≤0.25~≥16 | 0.25/2 | 8.4 | 91.6 |
| 克林霉素c | ≤0.03~≥64 | 0.25/64 | 43.2 | 55.2 | ≤0.03~≥64 | 4/64 | 53.0 | 45.7 | ≤0.03~≥64 | 0.125/32 | 23.6 | 74.1 |
| 红霉素 | ≤0.125~≥64 | 32/64 | 69.5 | 20.9 | ≤0.125~≥64 | 32/64 | 76.4 | 15.2 | ≤0.125~≥64 | 32/64 | 55.7 | 32.4 |
| 达托霉素 | ≤0.06~1 | 0.5/1 | 0 | 100.0 | 0.125~1 | 0.5/1 | 0 | 100.0 | ≤0.06~1 | 0.5/1 | 0 | 100.0 |
| 利奈唑胺 | ≤0.5~≥32 | 0.5/1 | 0.9 | 99.1 | ≤0.5~≥32 | 0.5/1 | 1.3 | 98.7 | ≤0.5~2 | 0.5/1 | 0 | 100.0 |
| 万古霉素 | ≤0.06~4 | 1/2 | 0 | 100.0 | 0.5~4 | 1/2 | 0 | 100.0 | ≤0.06~4 | 1/2 | 0 | 100.0 |
| 替考拉宁 | ≤0.125~≥32 | 1/2 | 0.1 | 99.9 | 0.25~≥32 | 1/4 | 0.2 | 99.8 | ≤0.125~8 | 0.5/2 | 0 | 100.0 |
| 四环素 | ≤0.06~≥64 | 0.5/32 | 14.5 | 84.8 | ≤0.06~≥64 | 0.5/32 | 17.4 | 81.7 | ≤0.06~≥64 | 0.25/2 | 8.7 | 90.9 |
| 米诺环素 | ≤0.03~≥16 | 0.25/0.5 | 0.1 | 99.9 | ≤0.03~≥16 | 0.25/0.5 | 0.2 | 99.8 | ≤0.03~4 | 0.125/0.25 | 0 | 100.0 |
| 替加环素d | ≤0.015~0.5 | 0.25/0.25 | 0 | 100.0 | 0.06~0.5 | 0.25/0.25 | 0 | 100.0 | ≤0.015~0.5 | 0.125/0.25 | 0 | 100.0 |
注:“-”.无相关数据;a.伪中间葡萄球菌和施氏葡萄球菌用苯唑西林纸片(1 μg),路邓葡萄球菌的检测和判读方法同金黄色葡萄球菌;b.头孢比罗的折点参考金黄色葡萄球菌;c.红霉素耐药而克林霉素非耐药的菌株进行克林霉素诱导耐药检测,克林霉素耐药率及MIC按照诱导试验结果计算;d.替加环素的折点参考美国食品和药品监督管理局标准(敏感≤0.5 mg/L,耐药>0.5 mg/L);MRCNS.耐甲氧西林凝固酶阴性葡萄球菌;MSCNS.甲氧西林敏感凝固酶阴性葡萄球菌;MIC.最低抑菌浓度;R.耐药;S.敏感
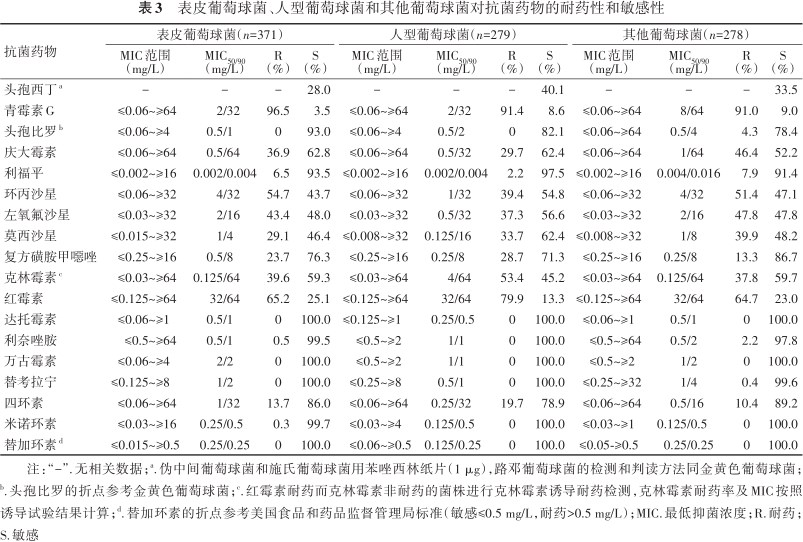
表皮葡萄球菌、人型葡萄球菌和其他葡萄球菌对抗菌药物的耐药性和敏感性
表皮葡萄球菌、人型葡萄球菌和其他葡萄球菌对抗菌药物的耐药性和敏感性
| 抗菌药物 | 表皮葡萄球菌(n=371) | 人型葡萄球菌(n=279) | 其他葡萄球菌(n=278) | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
MIC范围 (mg/L) | MIC50/90 (mg/L) | R (%) | S (%) | MIC范围 (mg/L) | MIC50/90 (mg/L) | R (%) | S (%) | MIC范围 (mg/L) | MIC50/90 (mg/L) | R (%) | S (%) | |
| 头孢西丁a | - | - | - | 28.0 | - | - | - | 40.1 | - | - | - | 33.5 |
| 青霉素G | ≤0.06~≥64 | 2/32 | 96.5 | 3.5 | ≤0.06~≥64 | 2/32 | 91.4 | 8.6 | ≤0.06~≥64 | 8/64 | 91.0 | 9.0 |
| 头孢比罗b | ≤0.06~≥4 | 0.5/1 | 0 | 93.0 | ≤0.06~≥4 | 0.5/2 | 0 | 82.1 | ≤0.06~≥64 | 0.5/4 | 4.3 | 78.4 |
| 庆大霉素 | ≤0.06~≥64 | 0.5/64 | 36.9 | 62.8 | ≤0.06~≥64 | 0.5/32 | 29.7 | 62.4 | ≤0.06~≥64 | 1/64 | 46.4 | 52.2 |
| 利福平 | ≤0.002~≥16 | 0.002/0.004 | 6.5 | 93.5 | ≤0.002~≥16 | 0.002/0.004 | 2.2 | 97.5 | ≤0.002~≥16 | 0.004/0.016 | 7.9 | 91.4 |
| 环丙沙星 | ≤0.06~≥32 | 4/32 | 54.7 | 43.7 | ≤0.06~≥32 | 1/32 | 39.4 | 54.8 | ≤0.06~≥32 | 4/32 | 51.4 | 47.1 |
| 左氧氟沙星 | ≤0.03~≥32 | 2/16 | 43.4 | 48.0 | ≤0.03~≥32 | 0.5/32 | 37.3 | 56.6 | ≤0.03~≥32 | 2/16 | 47.8 | 47.8 |
| 莫西沙星 | ≤0.015~≥32 | 1/4 | 29.1 | 46.4 | ≤0.008~≥32 | 0.125/16 | 33.7 | 62.4 | ≤0.008~≥32 | 1/8 | 39.9 | 48.2 |
| 复方磺胺甲噁唑 | ≤0.25~≥16 | 0.5/8 | 23.7 | 76.3 | ≤0.25~≥16 | 0.25/8 | 28.7 | 71.3 | ≤0.25~≥16 | 0.25/8 | 13.3 | 86.7 |
| 克林霉素c | ≤0.03~≥64 | 0.125/64 | 39.6 | 59.3 | ≤0.03~≥64 | 4/64 | 53.4 | 45.2 | ≤0.03~≥64 | 0.125/64 | 37.8 | 59.7 |
| 红霉素 | ≤0.125~≥64 | 32/64 | 65.2 | 25.1 | ≤0.125~≥64 | 32/64 | 79.9 | 13.3 | ≤0.125~≥64 | 32/64 | 64.7 | 23.0 |
| 达托霉素 | ≤0.06~≥1 | 0.5/1 | 0 | 100.0 | ≤0.125~≥1 | 0.25/0.5 | 0 | 100.0 | ≤0.06~≥1 | 0.5/1 | 0 | 100.0 |
| 利奈唑胺 | ≤0.5~≥64 | 0.5/1 | 0.5 | 99.5 | ≤0.5~≥2 | 1/1 | 0 | 100.0 | ≤0.5~≥64 | 0.5/2 | 2.2 | 97.8 |
| 万古霉素 | ≤0.06~≥4 | 2/2 | 0 | 100.0 | ≤0.5~≥2 | 1/1 | 0 | 100.0 | ≤0.5~≥2 | 1/2 | 0 | 100.0 |
| 替考拉宁 | ≤0.125~≥8 | 1/2 | 0 | 100.0 | ≤0.25~≥8 | 0.5/1 | 0 | 100.0 | ≤0.25~≥32 | 1/4 | 0.4 | 99.6 |
| 四环素 | ≤0.06~≥64 | 1/32 | 13.7 | 86.0 | ≤0.06~≥64 | 0.25/32 | 19.7 | 78.9 | ≤0.06~≥64 | 0.5/16 | 10.4 | 89.2 |
| 米诺环素 | ≤0.03~≥16 | 0.25/0.5 | 0.3 | 99.7 | ≤0.03~≥4 | 0.125/0.5 | 0 | 100.0 | ≤0.03~≥1 | 0.125/0.5 | 0 | 100.0 |
| 替加环素d | ≤0.015~≥0.5 | 0.25/0.25 | 0 | 100.0 | ≤0.06~≥0.5 | 0.125/0.25 | 0 | 100.0 | ≤0.05-≥0.5 | 0.25/0.25 | 0 | 100.0 |
注:“-”.无相关数据;a.伪中间葡萄球菌和施氏葡萄球菌用苯唑西林纸片(1 μg),路邓葡萄球菌的检测和判读方法同金黄色葡萄球菌;b.头孢比罗的折点参考金黄色葡萄球菌;c.红霉素耐药而克林霉素非耐药的菌株进行克林霉素诱导耐药检测,克林霉素耐药率及MIC按照诱导试验结果计算;d.替加环素的折点参考美国食品和药品监督管理局标准(敏感≤0.5 mg/L,耐药>0.5 mg/L);MIC.最低抑菌浓度;R.耐药;S.敏感
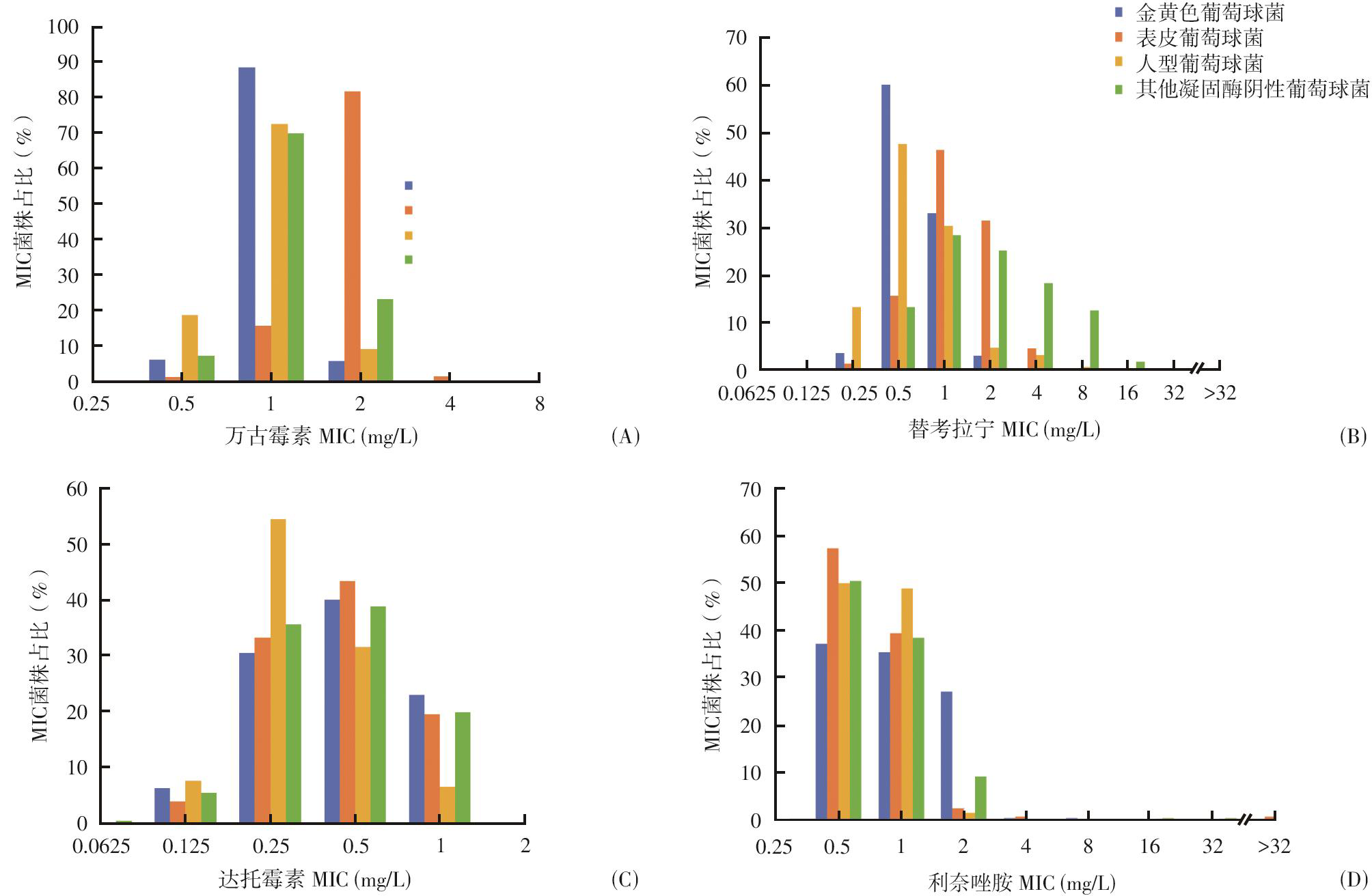
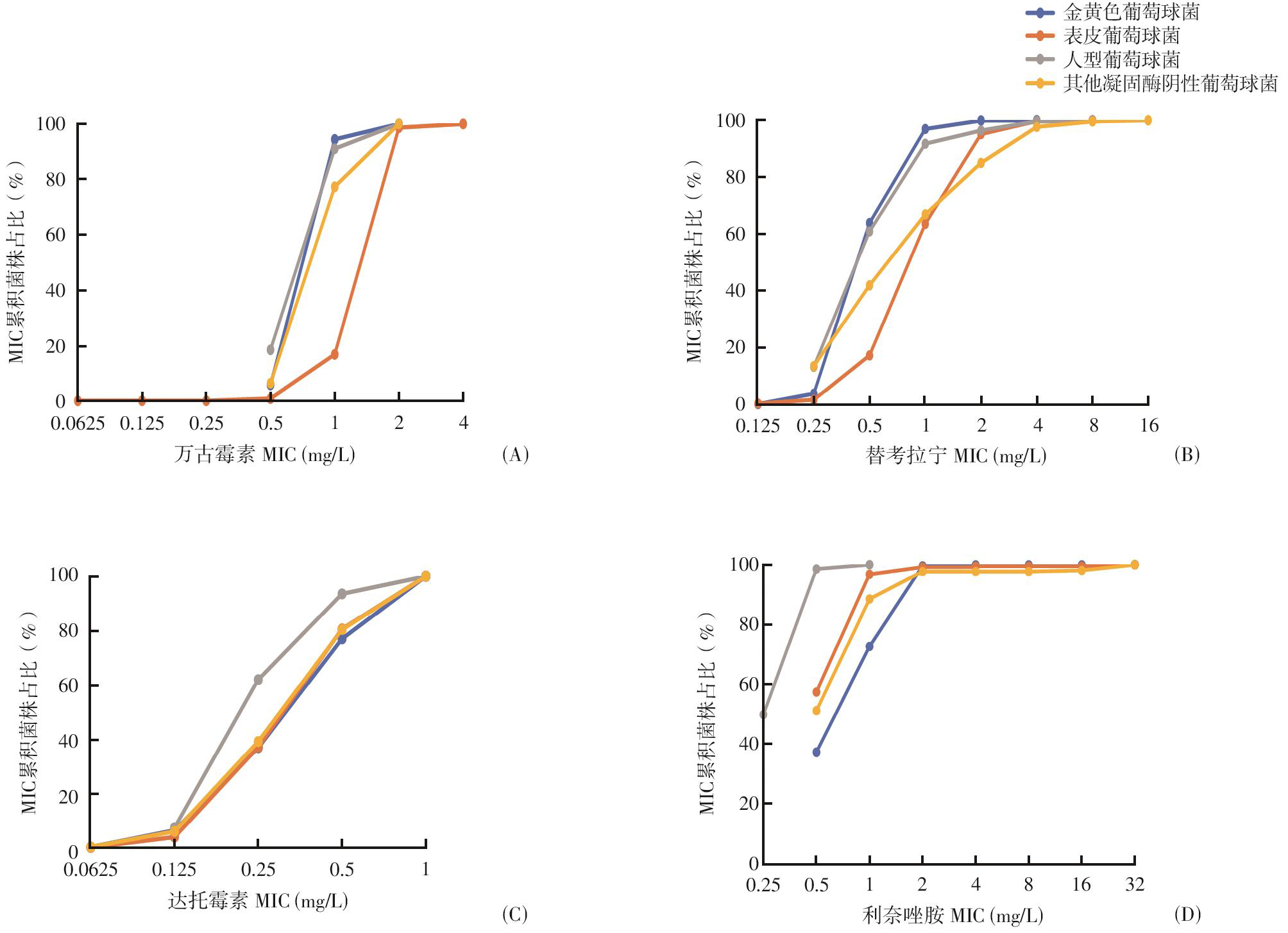
金黄色葡萄球菌、表皮葡萄球菌、人型葡萄球菌和其他凝固酶阴性葡萄球菌对万古霉素的MIC主要分布在1 mg/L、2 mg/L、1 mg/L和1 mg/L(图2A、3A);对替考拉宁的MIC主要分布在0.5 mg/L 和1 mg/L,1 mg/L和2 mg/L,0.5 mg/L和1 mg/L,以及1 mg/L、2 mg/L和4 mg/L(图2B、3B);对达托霉素的MIC均主要分布在0.25 mg/L和0.5 mg/L(图2C、图3C);对利奈唑胺的MIC均主要分布在0.5 mg/L和1 mg/L(图2D、图3D)。


共分离到肠球菌723株,其中屎肠球菌分离率为51.0%(369/723),高于粪肠球菌(40.9%,296/723),未检出对万古霉素、替考拉宁、替加环素耐药粪肠球菌及其他肠球菌,未检出对利奈唑胺耐药肠球菌。屎肠球菌中对万古霉素及替考拉宁耐药的菌株均占0.5%(2/369)。12株(3.3%)屎肠球菌、17株(5.7%)粪肠球菌及2株(3.4%)其他肠球菌对利奈唑胺中介。屎肠球菌对青霉素G、氨苄西林、利福平、氟喹诺酮类及红霉素的耐药率均高于粪肠球菌及其他肠球菌。屎肠球菌对米诺环素的敏感性高于粪肠球菌(表4)。
肠球菌对抗菌药物的耐药性和敏感性
肠球菌对抗菌药物的耐药性和敏感性
| 抗菌药物 | 屎肠球菌(n=369) | 粪肠球菌(n=296) | 其他肠球菌(n=58) | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
MIC范围 (mg/L) | MIC50/90 (mg/L) | R (%) | S (%) | MIC范围 (mg/L) | MIC50/90 (mg/L) | R (%) | S (%) | MIC范围 (mg/L) | MIC50/90 (mg/L) | R (%) | S (%) | |
| 青霉素G | ≤0.5~≥64 | 64/64 | 85.1 | 14.9 | ≤0.5~≥64 | 2/4 | 4.1 | 95.9 | ≤0.5~≥64 | 1/16 | 12.1 | 87.9 |
| 氨苄西林 | ≤0.5~≥64 | 64/64 | 82.1 | 17.9 | ≤0.5~≥64 | 1/2 | 5.7 | 94.3 | ≤0.5~≥64 | 0.5/32 | 13.8 | 86.2 |
| 头孢比罗 | ≤0.06~≥64 | 64/64 | - | - | ≤0.06~≥64 | 0.125/0.5 | - | - | ≤0.06~≥64 | 0.5/8 | - | - |
| 利福平 | ≤0.25~≥16 | 4/16 | 75.6 | 12.7 | ≤0.25~≥16 | 4/16 | 56.4 | 25.0 | ≤0.25~≥16 | 1/16 | 25.9 | 55.2 |
| 环丙沙星 | ≤0.125~≥32 | 32/32 | 86.2 | 10.6 | ≤0.125~≥32 | 1/32 | 30.4 | 63.9 | ≤0.125~≥32 | 1/16 | 20.7 | 67.2 |
| 左氧氟沙星 | ≤0.125~≥32 | 32/32 | 84.0 | 14.1 | 0.25~≥32 | 1/32 | 28.7 | 69.6 | 0.25~≥32 | 1/16 | 20.7 | 75.9 |
| 红霉素 | ≤0.125~≥64 | 64/64 | 79.7 | 8.1 | ≤0.12~≥64 | 32/64 | 53.7 | 21.3 | ≤0.125~≥64 | 2/64 | 37.9 | 32.8 |
| 达托霉素 | 0.125~≥8 | 4/4 | 0.5 | 99.5 | 0.03~≥8 | 2/2 | 4.7 | 95.3 | 0.03~8 | 2/4 | 6.9 | 86.2 |
| 利奈唑胺 | 0.5~4 | 1/2 | 0 | 96.7 | 0.5~4 | 2/2 | 0 | 94.3 | 0.5~4 | 1/2 | 0 | 96.6 |
| 万古霉素 | 0.5~≥128 | 1/2 | 0.5 | 98.6 | ≤0.25~8 | 2/2 | 0 | 99.3 | 0.5~8 | 1/4 | 0 | 98.3 |
| 替考拉宁 | ≤0.25~≥64 | 1/2 | 0.5 | 99.5 | ≤0.25~4 | 1/1 | 0 | 100.0 | ≤0.25~2 | 1/2 | 0 | 100.0 |
| 米诺环素 | ≤1~32 | 1/16 | 23.6 | 67.5 | ≤1~32 | 16/32 | 55.1 | 32.4 | ≤1~32 | 1/16 | 22.4 | 67.2 |
| 替加环素a | ≤0.06~2 | 0.125/0.25 | 1.4 | 98.6 | ≤0.06~0.5 | 0.125/0.25 | 0 | 100.0 | ≤0.06~0.25 | 0.125/0.25 | 0 | 100.0 |
注:“-”.无相关数据;a.替加环素的折点参考美国食品和药品监督管理局(敏感≤0.5 mg/L,耐药>0.5 mg/L);MIC.最低抑菌浓度;R.耐药;S.敏感
11株β-溶血链球菌的耐药表型为红霉素耐药而克林霉素敏感,经克林霉素诱导耐药检测后发现,诱导型耐药占6株。按注射青霉素G非脑膜炎折点,未发现耐青霉素的肺炎链球菌及β-溶血链球菌。未发现对美罗培南、利奈唑胺和万古霉素耐药链球菌。肺炎链球菌、β-溶血链球菌和α-溶血链球菌对头孢曲松及头孢吡肟保持较高的敏感性。α-溶血链球菌及β-溶血链球菌对复方磺胺甲噁唑敏感性较肺炎链球菌高(表5)。
链球菌对抗菌药物的耐药性和敏感性
链球菌对抗菌药物的耐药性和敏感性
| 抗菌药物 | 肺炎链球菌(n=26) | α-溶血链球菌(n=192) | β-溶血链球菌(n=144) | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 折点 | MIC范围 (mg/L) | MIC50/90 (mg/L) | R (%) | S (%) | MIC范围 (mg/L) | MIC50/90 (mg/L) | R (%) | S (%) | MIC范围 (mg/L) | MIC50/90 (mg/L) | R (%) | S (%) | |
| 青霉素G | 非脑膜炎(注射) | ≤0.06~2 | 0.125/1 | 0 | 100.0 | ≤0.06~≥16 | 0.125/0.5 | 4.7 | 75.0 | 0.03~0.125 | 0.064/0.125 | 0 | 100.0 |
| 非脑膜炎(口服) | ≤0.06~2 | 0.125/1 | 7.7 | 46.2 | - | - | - | - | - | - | - | - | |
| 脑膜炎 | ≤0.06~2 | 0.125/1 | 53.8 | 46.2 | - | - | - | - | - | - | - | - | |
| 头孢呋辛 | 注射 | 0.06~8 | 0.25/8 | 30.8 | 61.5 | - | - | - | - | - | - | - | - |
| 口服 | 0.06~8 | 0.25/8 | 15.4 | 69.2 | - | - | - | - | - | - | - | - | |
| 头孢曲松 | 脑膜炎 | ≤0.06~2 | 0.125/2 | 15.4 | 80.8 | - | - | - | - | - | - | - | - |
| 非脑膜炎 | ≤0.06~2 | 0.125/2 | 0 | 84.6 | ≤0.06~8 | 0.125/1 | 6.8 | 90.1 | ≤0.06~0.5 | 0.064/0.5 | 0 | 100.0 | |
| 头孢吡肟 | 脑膜炎 | ≤0.06~8 | 0.25/4 | 19.2 | 65.4 | - | - | - | - | - | - | - | - |
| 非脑膜炎 | ≤0.06~8 | 0.25/4 | 15.4 | 80.8 | ≤0.06~8 | 0.25/2 | 5.7 | 91.1 | ≤0.06~0.5 | 0.064/0.5 | 0 | 100.0 | |
| 头孢比罗 | ≤0.015~0.5 | 0.064/0.5 | - | - | ≤0.015~0.5 | 0.064/0.5 | - | - | ≤0.015~0.5 | 0.032/0.125 | - | - | |
| 美罗培南 | ≤0.015~0.5 | 0.032/0.25 | 0 | 92.3 | ≤0.015~0.5 | 0.032/0.5 | 0 | 100.0 | ≤0.015~0.5 | 0.032/0.032 | 0 | 100.0 | |
| 左氧氟沙星 | 0.5~16 | 1/4 | 3.8 | 88.5 | ≤0.25~≥32 | 1/16 | 14.1 | 78.6 | ≤0.25~≥32 | 1/32 | 28.5 | 66.0 | |
| 复方磺胺甲噁唑a | 0.06~8 | 0.25/8 | 23.1 | 65.4 | 0.03~8 | 0.25/2 | 15.1 | 84.9 | ≤0.015~2 | 0.125/0.5 | 0.7 | 99.3 | |
| 克林霉素b | 0.03~≥8 | 4/8 | 73.1 | 23.1 | 0.03~≥8 | 4/8 | 56.3 | 42.2 | 0.03~≥8 | 4/8 | 75.7 | 22.9 | |
| 红霉素 | 0.06~≥8 | 4/8 | 80.8 | 19.2 | ≤0.03~≥8 | 4/8 | 68.2 | 31.3 | ≤0.03~≥8 | 4/8 | 81.9 | 18.1 | |
| 达托霉素 | 0.06~0.5 | 0.25/0.5 | - | - | 0.06~1 | 0.5/1 | 0 | 100.0 | 0.06~1 | 0.25/0.5 | 0 | 100.0 | |
| 利奈唑胺 | 0.25~1 | 0.5/0.5 | 0 | 100.0 | 0.25~2 | 0.5/1 | 0 | 100.0 | 0.25~2 | 1/1 | 0 | 100.0 | |
| 万古霉素 | 0.5~1 | 0.5/1 | 0 | 100.0 | 0.03~1 | 0.5/1 | 0 | 100.0 | ≤0.015~1 | 0.5/1 | 0 | 100.0 | |
| 四环素 | ≤0.125~≥32 | 8/32 | 57.7 | 38.5 | ≤0.125~≥32 | 1/32 | 41.7 | 55.2 | ≤0.125~≥32 | 8/32 | 57.6 | 29.2 | |
注:“-”.无相关数据;a. α、β-溶血链球菌对复方磺胺甲噁唑的折点参考欧洲抗菌药物敏感性试验委员会标准(敏感≤1 mg/L,耐药>2 mg/L);b.红霉素耐药而克林霉素非耐药的菌株进行克林霉素诱导耐药检测,克林霉素耐药率及MIC按照诱导试验结果计算;MIC.最低抑菌浓度;R.耐药;S.敏感
不同地区血流感染革兰阳性菌构成存在差异,如凝固酶阴性葡萄球菌和屎肠球菌占比差异均有统计学意义(χ2=40.145和46.668,P<0.001)。在重要耐药菌检出率上,不同地区的MRSA及MRCNS检出率亦存在差异(χ2=14.578和15.195,P<0.01),其中南部地区的MRSA流行率为9.4%(5/53),低于东部(28.4%,231/812)、中部(20.8%,44/212)和北部地区(32.9%,23/70),而北部地区的MRCNS流行率(80.6%,29/36)显著高于东部(69.3%,459/662)、中部(56.1%,88/157)和南部地区(58.9%,43/73)(表6)。
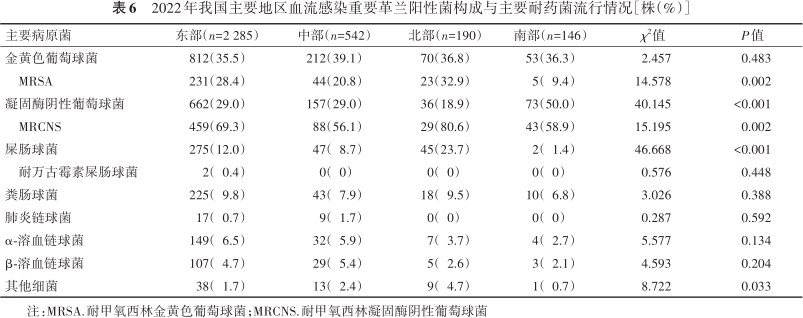
2022年我国主要地区血流感染重要革兰阳性菌构成与主要耐药菌流行情况[株(%)]
2022年我国主要地区血流感染重要革兰阳性菌构成与主要耐药菌流行情况[株(%)]
| 主要病原菌 | 东部(n=2 285) | 中部(n=542) | 北部(n=190) | 南部(n=146) | χ2值 | P值 |
|---|---|---|---|---|---|---|
| 金黄色葡萄球菌 | 812(35.5) | 212(39.1) | 70(36.8) | 53(36.3) | 2.457 | 0.483 |
| MRSA | 231(28.4) | 44(20.8) | 23(32.9) | 5(9.4) | 14.578 | 0.002 |
| 凝固酶阴性葡萄球菌 | 662(29.0) | 157(29.0) | 36(18.9) | 73(50.0) | 40.145 | <0.001 |
| MRCNS | 459(69.3) | 88(56.1) | 29(80.6) | 43(58.9) | 15.195 | 0.002 |
| 屎肠球菌 | 275(12.0) | 47(8.7) | 45(23.7) | 2(1.4) | 46.668 | <0.001 |
| 耐万古霉素屎肠球菌 | 2(0.4) | 0(0) | 0(0) | 0(0) | 0.576 | 0.448 |
| 粪肠球菌 | 225(9.8) | 43(7.9) | 18(9.5) | 10(6.8) | 3.026 | 0.388 |
| 肺炎链球菌 | 17(0.7) | 9(1.7) | 0(0) | 0(0) | 0.287 | 0.592 |
| α-溶血链球菌 | 149(6.5) | 32(5.9) | 7(3.7) | 4(2.7) | 5.577 | 0.134 |
| β-溶血链球菌 | 107(4.7) | 29(5.4) | 5(2.6) | 3(2.1) | 4.593 | 0.204 |
| 其他细菌 | 38(1.7) | 13(2.4) | 9(4.7) | 1(0.7) | 8.722 | 0.033 |
注:MRSA.耐甲氧西林金黄色葡萄球菌;MRCNS.耐甲氧西林凝固酶阴性葡萄球菌
地市级医院的金黄色葡萄球菌分离率高于省级医院(41.5%比32.1%,χ2=30.235,P<0.001),而凝固酶阴性葡萄球菌在省级医院占比更高(31.8% 比26.2%,χ2=11.918,P<0.001)。省级医院屎肠球菌的分离率略高于地市级医院(13.2%比9.8%,χ2=8.922,P=0.003),地市级医院肺炎链球菌的分离率稍高于省级医院(1.3%比0.5%,P=0.016)。重要革兰阳性耐药菌检出率在不同级别医院间也存在差异性,省级医院的MRSA和MRCNS检出率均高于地市级医院(分别为34.0%比24.2%,71.1%比60.1%,χ2=13.519和12.136,P值均<0.001)。根据人均GDP划分地区经济发展水平,除金黄色葡萄球菌在人均GDP<92 059元地区的分离率高于人均GDP≥92 059元外(42.9%比32.7%,χ2=31.995,P<0.001),MRSA、凝固酶阴性葡萄球菌、MRCNS、屎肠球菌及α-溶血链球菌均在人均GDP≥92 059元地区有更高检出率(P<0.01或<0.05)(表7)。
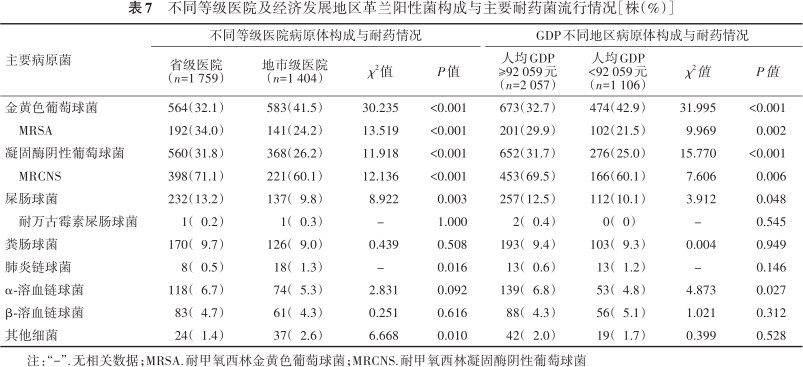
不同等级医院及经济发展地区革兰阳性菌构成与主要耐药菌流行情况[株(%)]
不同等级医院及经济发展地区革兰阳性菌构成与主要耐药菌流行情况[株(%)]
| 主要病原菌 | 不同等级医院病原体构成与耐药情况 | GDP不同地区病原体构成与耐药情况 | ||||||
|---|---|---|---|---|---|---|---|---|
| 省级医院(n=1 759) | 地市级医院(n=1 404) | χ2值 | P值 | 人均GDP≥92 059元(n=2 057) | 人均GDP<92 059元(n=1 106) | χ2值 | P值 | |
| 金黄色葡萄球菌 | 564(32.1) | 583(41.5) | 30.235 | <0.001 | 673(32.7) | 474(42.9) | 31.995 | <0.001 |
| MRSA | 192(34.0) | 141(24.2) | 13.519 | <0.001 | 201(29.9) | 102(21.5) | 9.969 | 0.002 |
| 凝固酶阴性葡萄球菌 | 560(31.8) | 368(26.2) | 11.918 | <0.001 | 652(31.7) | 276(25.0) | 15.770 | <0.001 |
| MRCNS | 398(71.1) | 221(60.1) | 12.136 | <0.001 | 453(69.5) | 166(60.1) | 7.606 | 0.006 |
| 屎肠球菌 | 232(13.2) | 137(9.8) | 8.922 | 0.003 | 257(12.5) | 112(10.1) | 3.912 | 0.048 |
| 耐万古霉素屎肠球菌 | 1(0.2) | 1(0.3) | - | 1.000 | 2(0.4) | 0(0) | - | 0.545 |
| 粪肠球菌 | 170(9.7) | 126(9.0) | 0.439 | 0.508 | 193(9.4) | 103(9.3) | 0.004 | 0.949 |
| 肺炎链球菌 | 8(0.5) | 18(1.3) | - | 0.016 | 13(0.6) | 13(1.2) | - | 0.146 |
| α-溶血链球菌 | 118(6.7) | 74(5.3) | 2.831 | 0.092 | 139(6.8) | 53(4.8) | 4.873 | 0.027 |
| β-溶血链球菌 | 83(4.7) | 61(4.3) | 0.251 | 0.616 | 88(4.3) | 56(5.1) | 1.021 | 0.312 |
| 其他细菌 | 24(1.4) | 37(2.6) | 6.668 | 0.010 | 42(2.0) | 19(1.7) | 0.399 | 0.528 |
注:“-”.无相关数据;MRSA.耐甲氧西林金黄色葡萄球菌;MRCNS.耐甲氧西林凝固酶阴性葡萄球菌
2022年的BRICS监测发现,血流感染的革兰阳性菌占25.9%,与2021年监测结果类似[6];与历年BRICS监测结果相比,革兰阳性菌的检出率由2014年的41.6%逐渐降低至2022年的25.9%[7]。葡萄球菌属仍然是引起血流感染最主要的革兰阳性菌,但MRSA整体流行率呈进一步下降趋势;耐万古霉素肠球菌(VRE)则处于较低流行水平;我国不同地域的血流感染革兰阳性菌构成和耐药谱略有不同,特别是省级医院和经济发展水平高的地区,耐药菌的问题较为突出。
历年BRICS监测显示[2],金黄色葡萄球菌是引起血流感染的主要革兰阳性菌,占所有血流感染病原菌的8.1%~11.4%,但MRSA的流行率则呈逐年下降趋势,从2014年的33.9%下降至26.4%,这与SENTRY监测结果相似[8]。MRSA的下降趋势可能与近年来我国抗菌药物专项整治、院感防控加强等措施的良好实施有关[9]。值得注意的是,国外监测显示,虽然MRSA流行率在下降,但金黄色葡萄球菌引起的血流感染数量则在增加[10, 11],目前认为社区获得性金黄色葡萄球菌血流感染的增加是重要原因,这主要与预期寿命的延长、人口老龄化,以及社会群体对医疗保健机构接触需求的增加有关,而这往往容易引起MSSA[12]。我国当下也正在面临跟国外同样的人口日趋老龄化和城镇化等社会问题,因此在我国是否也会出现类似现象需要继续跟踪监测。同时,另一个现象亦值得引起重视,在新型冠状病毒流行前,美国引起血流感染的MRSA呈逐年下降趋势,而在2020年下半年,MRSA引起的血流感染占金黄色葡萄球菌感染中的比例上升了近25%[13]。因此,在后疫情时期,我国MRSA血流感染是否具有类似现象也需要进一步监测。本监测及历年监测结果显示,万古霉素对金黄色葡萄球菌MIC主要分布在1 mg/L,MIC50/90均为1 mg/L,5.6%的金黄色葡萄球菌对万古霉素MIC为2 mg/L;而Soriano等[14]研究认为,当金黄色葡萄球菌对万古霉素的MIC>1 mg/L时,患者感染治疗失败和死亡风险增加。因此在今后监测中需要继续关注金黄色葡萄球菌的耐药谱变迁,特别是对万古霉素的MIC分布,为临床治疗提供必要的支撑。本监测中未发现对利奈唑胺耐药的金黄色葡萄球菌,但其MIC值为0.5~4 mg/L,临床用药需加以关注。
凝固酶阴性葡萄球菌血流感染主要与手术和导管相关性感染有关,其中最常见和最主要的是表皮葡萄球菌[15]。历年的BRICS监测数据显示,尚未检测到凝固酶阴性葡萄球菌对万古霉素不敏感菌株,且MIC主要集中在0.5~2 mg/L。但已有的研究表明,对万古霉素MIC≥2 mg/L的凝固酶阴性葡萄球菌引起的感染,尽管对万古霉素表型为敏感,但使用万古霉素治疗的患者病死率高[16]。在本监测中有83.0%的表皮葡萄球菌对万古霉素MIC≥2 mg/L,其中有5株表皮葡萄球菌对万古霉素的MIC为4 mg/L,这需要加以关注[17, 18]。高MIC值导致治疗效果不佳,可能与常规剂量万古霉素PK/PD的AUC/MIC达标不足、产生生物膜及对万古霉素异质性耐药有关[19, 20, 21]。目前CLSI推荐的凝固酶阴性葡萄球菌对万古霉素药敏试验无法检测异质性耐药,同时也缺少明确的分子检测手段,需要在今后工作中加以关注和研究。在本年度监测中,发现5株耐利奈唑胺的头葡萄球菌。有研究表明,在利奈唑胺治疗头葡萄球菌感染过程中,容易在23S rRNA的V区发生G2576T突变,进而对利奈唑胺产生耐药[22]。因此,治疗头葡萄球菌等凝固酶阴性葡萄球菌感染时,应更为谨慎且合理使用利奈唑胺,以避免可能出现的耐药。
与国外肠球菌属血流感染中以粪肠球菌为主不同[23],我国血流感染以屎肠球菌为主,且对万古霉素的耐药率仅为0.3%~0.7%[2,6],远低于SENTRY监测,同时VRE在欧美国家呈增长趋势[8]。根据欧洲抗菌药物耐药监测网2022年监测研究表明,万古霉素耐药屎肠球菌(VREM)分离率达到17.6%。我国VRE低分离率的具体原因尚不清楚,但推测可能与万古霉素口服制剂不常用有关。与我国其他VRE监测研究类似[24],本监测中2株VREM为VanA-型(对万古霉素和替考拉宁同时耐药),除了对利奈唑胺、达托霉素和替加环素保持敏感外,对其他抗菌药物均耐药。研究表明,引起肠球菌耐万古霉素的vanA基因位于转座子Tn1546上[25],并可通过水平转移方式在不同的肠球菌之间进行传递,导致敏感菌株获得Tn1546转座子后对万古霉素产生耐药。因此,尽管目前我国VRE的流行率较低,但进一步的监测十分必要。
β-溶血链球菌包括A群链球菌(化脓性链球菌)、B群链球菌(无乳链球菌)及C/G群链球菌(主要为停乳链球菌似马亚种和停乳链球菌停乳亚种),是引起包括血流感染在内侵袭性感染的主要链球菌属[26]。在BRICS监测中,β-溶血链球菌所占比例不高,但多项监测发现,β-溶血链球菌引起的血流感染呈上升趋势[27, 28]。尽管未发现对青霉素G和头孢菌素类耐药的β-溶血链球菌,但与欧美国家相比,本监测中分离到的β-溶血链球菌对克林霉素、左氧氟沙星的敏感性较低[29]。目前β-内酰胺类抗菌药物仍然是治疗链球菌侵袭性感染的首选[30],但非β-溶血链球菌对此类药物敏感性降低,而对万古霉素、达托霉素和利奈唑胺等抗菌药物保持了较高的敏感性,可作为替代药物进行治疗[31]。β-溶血链球菌通过erm基因对大环内酯类、林可胺类和链霉素B可同时产生交叉耐药,即MLSB耐药表型,而该表型可分为结构型和诱导型[32]。在本监测中,11株β-溶血链球菌诱导型MLSB占6株,可见临床上对分离到的β-溶血链球菌有必要进行克林霉素诱导耐药检测,以减少临床治疗失败。
我国幅员辽阔,人口构成及迁徙频度、气候条件、地区经济发展水平、地区居民的健康状况、患者来源及医疗水平等因素均可影响血流感染病原菌构成及耐药谱[33]。本研究发现,不同地区在血流感染革兰阳性菌构成比及重要阳性菌耐药率的检出率上存在差异。Zhen等[34]研究发现,东部MRSA分离率高于中部和西部,而在本研究中,北部地区MRSA的分离高于其他地区。这可能与不同地区划分有关。此外,本研究还发现省级医院的重要耐药菌检出率均高于地市级医院,其中省级医院的MRSA分离率是地市级医院1.5倍左右。在我国,地市级医院往往是患者的首诊单位,而省级医院更多地收治由地市级医院转诊而来的、疑难和危重患者,因此患者的住院时间更长、使用的抗菌药物更多,同时更容易发生院内感染以及面临更大的抗菌药物选择压力[35]。经济发展较快地区的MRSA流行率高出经济发展中地区近50%;同时,Zhen等[34]研究认为,经济发展水平与部分重要耐药菌的流行呈正相关。推其原因,可能人口的密集程度影响耐药菌的感染[33]。因此,为有效遏制抗菌药物的滥用和减少细菌耐药性的发生,需要综合多方因素,采取针对性的措施。
综上所述,我国血流感染革兰阳性菌占比持续下降,金黄色葡萄球菌占首位,MRSA较前监测呈下降态势,VRE仍然处于低水平状态。革兰阳性菌整体耐药率呈逐步下降趋势,说明我国近十年来全国抗菌药物合理使用与耐药控制行动取得一定成效,但仍须持续监测,同时强化院感措施减少院内血流感染的发生,不同地区按照监测结果采取针对性耐药防控措施。
应超群,陈云波,嵇金如,等. 2022年全国血流感染细菌耐药监测报告:革兰阳性菌[J]. 中华临床感染病杂志,2024,17(2):99-112. DOI:10.3760/cma.j.issn.1674-2397.2024.02.003.
所有作者均声明不存在利益冲突



























