
胃肠胰神经内分泌肿瘤(GEP-NENs)是一类具有神经内分泌系统标志物,并且能够合成生物活性胺和/或多肽类激素的异质性较高的肿瘤。近十年来,GEP-NENs临床诊治取得了明显进展,不论是流行病学、诊断方法、治疗手段均取得长足进步。目前,围绕GEP-NENs仍有不少问题需要未来进一步研究解决。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
胃肠胰神经内分泌肿瘤(gastroenteropancreatic neuroendocrine neoplasms,GEP-NENs)是一类具有神经内分泌系统标志物,并且能够合成生物活性胺和/或多肽类激素的异质性较高的肿瘤。部分GEP-NENs产生并分泌功能性激素(如胰岛素、胃泌素、生长抑素等),并继发激素相关临床症状。近十年,随着诊断技术及医疗工作者对疾病认识不断提高,GEP-NENs检出率及诊疗水平显著提升。根据美国国家癌症研究所监测、流行病学和最终结果数据库,2005年至2015年十余年间神经内分泌肿瘤(NENs)发病率增加了1.72倍,其中GEP-NENs发病率最高达到5.45/10万人年,常见发病部位分别为直肠、小肠、胰腺、胃和阑尾等[1]。亚洲人群GEP-NENs发病率也呈上升趋势[2],但与欧美人群相比,好发部位存在不同,直肠、胰腺和胃是亚洲人群最常见的受累部位[3]。
近十年来,GEP-NENs临床诊治取得了明显进展。从疾病诊断角度来讲,除了传统实验室检查标志物,如嗜铬素A、神经元特异性烯醇化酶、24 h尿5-羟吲哚乙酸、功能性激素等,近些年研究了一些新型生物标志物。NETest是以肿瘤转录组学为基础的液体活检,通常是检测血液中NENs相关mRNA水平来反映肿瘤实时情况。未来可能有循环肿瘤DNA、miRNA、脑肠肽O酰基转移酶等更多指标纳入其中,促进GEP-NENs的诊断、疗效评估更为精准[4, 5]。常规影像学方法包括超声、CT及MRI,CT适用于肺部病变的诊断及治疗效果评估,胃肠道病变优选增强CT,小肠病变推荐CT/MRI小肠造影,MRI对于实质脏器(如肝脏、胰腺、脑等)和骨骼评估更有优势。其中钆塞酸二钠注射液(普美显)增强MRI对GEP-NENs肝脏转移灶诊断敏感度约为85%,诊断特异度约为94%[6]。消化内镜在GEP-NENs诊治中发挥着重要作用。超声内镜对胰腺神经内分泌肿瘤,特别是微小病灶(直径2~5 mm)检出优于常规影像学,且超声内镜引导下细针穿刺可以获取组织标本[7]。细针穿刺与手术切除获得的病理标本,细胞学及组织病理学同时一致率将近90%,其中直径<2 cm病灶一致率高达 88.9%[8]。分子影像学方面,除了18F-FDG PET/CT、18F-DOPA PET/CT等,68Ga-生长抑素类似物(SSA,somatostatin analog)和68Ga-标记胰高血糖素样肽-1类似物艾塞纳肽等放射性核素显像对GEP-NENs诊断灵敏度高达95%~97%[9, 10]。病理诊断方面,2019年世界卫生组织更新了GEP-NENs的病理分级标准(表1),将预后明显不同的神经内分泌瘤(neuroendocrine tumor,NET)和神经内分泌癌(neuroendocrine carcinoma,NEC)分类/分级标准分别列出。并且推荐除上皮标记(如CK、CK8/18等)、Syn、CgA,建议选做INSM1、SSTR2、MGMT、p53、RB1、DAXX和ATRX等免疫组化标志物[11]。
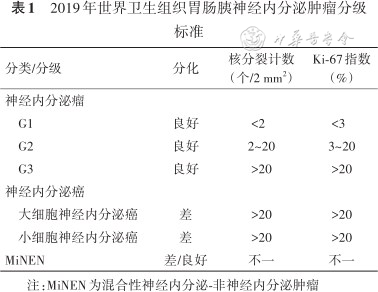
2019年世界卫生组织胃肠胰神经内分泌肿瘤分级标准
2019年世界卫生组织胃肠胰神经内分泌肿瘤分级标准
| 分类/分级 | 分化 | 核分裂计数(个/2 mm2) | Ki-67指数(%) |
|---|---|---|---|
| 神经内分泌瘤 | |||
| G1 | 良好 | <2 | <3 |
| G2 | 良好 | 2~20 | 3~20 |
| G3 | 良好 | >20 | >20 |
| 神经内分泌癌 | |||
| 大细胞神经内分泌癌 | 差 | >20 | >20 |
| 小细胞神经内分泌癌 | 差 | >20 | >20 |
| MiNEN | 差/良好 | 不一 | 不一 |
注:MiNEN为混合性神经内分泌-非神经内分泌肿瘤
治疗方面,对局灶性GEP-NENs,首选根治性手术或内镜切除。对于局部进展期和转移性GEP-NENs可选择新辅助治疗和转化治疗,争取手术机会。除手术外,若为功能性GEP-NENs,临床按需选用SSA(如奥曲肽、兰瑞肽等)、干扰素、二氮嗪、质子泵抑制剂、美替拉酮、米非司酮、米托坦、特罗司他乙酯等协助控制症状,也可以选用靶向药物[7,10,12]。对于合并手术危险因素或进展期肿瘤无法切除,SSA、化疗、靶向治疗药物(包括mTOR抑制剂和酪氨酸激酶抑制剂)、免疫检查点抑制剂(如纳武利尤单抗、帕博利珠单抗)甚至放射性核素治疗均是控制肿瘤生长的手段。肝脏是GEP-NENs最常见远处转移器官,肝转移灶局部治疗方案包括射频消融和经动脉途径治疗,后者包括肝动脉栓塞、肝动脉化疗栓塞和肝动脉放射性微球栓塞[12]。
目前,围绕GEP-NENs仍有不少问题需要未来进一步研究解决。例如GEP-NENs发病机制尚不明确,目前广泛认为1型胃NENs发生于自身免疫性萎缩性胃炎背景,因为胃壁细胞破坏,胃酸缺乏,导致胃窦G细胞增生分泌胃泌素,刺激嗜铬细胞增生所致。以壁细胞特异性SLC26A9敲除小鼠作为自身免疫性胃炎动物模型,研究发现Slc26a9表达缺失引发Wnt信号通路异常激活,导致胃黏膜肠上皮化生及胃癌发生,并且观察到神经内分泌细胞异常增生[13]。但在1型胃NENs患者中为什么很少同时合并胃癌仍有待后续研究解答。诊断方面,发现敏感度和特异度均较高的生物标志物实现GEP-NENs早期诊断、病情监测及治疗效果评估一直都是医疗工作者努力的方向。病理诊断方面,发现ATRX、DAXX、Rb1、KRAS、SMARCB2、SMARCA2、MAPK等分子标志物有助于帮助寻找NENs来源[14, 15],但上述分子标志物对于临床良恶性分类、治疗方案选择、预后评估有何意义仍未可知。
治疗方面,虽然GEP-NENs目前的治疗方式包括化疗、靶向治疗、免疫检查点抑制剂、放射性核素治疗及局部治疗等多种手段,但根治性切除仍是唯一可能达到治愈目的的治疗方式。直径<1 cm的直肠NENs淋巴侵犯率约0.7%,远处转移率不足2%,而直径>2 cm诊断时合并淋巴结转移率达60%左右。因此,对于直径<1 cm且局限于黏膜或黏膜下层的病灶,可考虑内镜下黏膜切除术/内镜黏膜下剥离术。但因为直肠NENs较小时即可能合并转移,原则上建议完善直肠超声或直肠MRI排除转移后经内镜彻底切除。直径10~19 mm的病灶,目前治疗方式仍存在争议[16]。一项研究共纳入669例结肠NEC患者,发现无论原发灶位于左半结肠还是右半结肠,切除原发病灶均有利于延长生存时间[17]。对于合并远处转移的GEP-NENs患者是否可接受手术治疗、术前如何全面准确地对患者进行分级诊疗及肿瘤负荷评估、是否需要新辅助化疗、如何选择最佳外科治疗策略及外科干预时机、如何确定减瘤手术最佳获益人群都是未来需要进一步解答的问题。GEP-NENs肝转移首选方案为根治性切除,但如果肝转移灶不可切除、合并肝外转移或手术禁忌,介入治疗可作为一线治疗方案。Entezari等[18]的研究纳入531例直肠NEC肝转移患者,入组患者转移灶无法切除且存在化疗抵抗,选用钇90微球选择性内放射作为挽救性治疗取得了平均10.6个月的总生存期。但是对不同血供来源的肝脏转移灶选择何种介入策略,经导管动脉化疗栓塞时何种化疗药物/方案最优、微球粒径大小选择、装载药物与载球微粒如何实现最佳匹配也是需要更多探索才能解答的问题。在药物治疗方面,免疫检查点抑制剂开始应用于NEC的治疗。多项Ⅰb和Ⅱ期关于免疫检查抑制剂的研发发现,NEC的客观应答率为3.7%~22.2%[19, 20],其中致死性免疫相关治疗不良反应发生率0.36%~1.23%,如何在常规临床实践中使用免疫检查点抑制剂及如何筛选最佳使用人群还有很长的路要走。
过去十年是GEP-NENs诊治飞速发展的十年,不论是流行病学、诊断方法、治疗手段均取得了长足进步。但我们也要看到未来面临的巨大挑战,如何在进步中创新,如何为患者制定更为个体化、综合性的治疗方案是未来前进的方向。
徐天铭, 李景南. 胃肠胰神经内分泌肿瘤领域近十年的研究进展和热点问题[J]. 中华内科杂志, 2024, 63(7): 641-644. DOI: 10.3760/cma.j.cn112138-20231229-00415.
所有作者声明无利益冲突



























