
胃肠内分泌细胞(enteroendocrine cell, EEC)是一种由肠隐窝干细胞逐步分化形成的特殊激素分泌细胞,在调节机体代谢的过程中发挥至关重要的作用。伴随着生物学技术的进步,多种转录因子及信号通路在EEC分化各阶段中的调控作用也愈发清晰。此外,EEC的激素分泌还具有可塑性,机体内不同营养状态和肠道菌群更替也会影响EEC的分化和功能调控。类器官作为新型体外培养模型,有助于进一步推动EEC的功能研究。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
胃肠内分泌细胞(enteroendocrine cell, EEC)沿着隐窝-绒毛轴散在分布于整个胃肠道黏膜上皮中,占胃肠上皮细胞数不足1%,但因肠内分泌细胞总数多且释放激素的广度大,肠道被认为是体内重要的内分泌器官。EEC感知管腔侧和基底侧的信号从而触发肽类或胺类激素的分泌。这些胃肠激素能以内分泌途径作用于远处的靶器官,或以旁分泌途径作用于邻近的EEC或其他细胞。EEC还能形成神经足类突触样结构,分泌谷氨酸作用于肠内迷走神经元,将刺激迅速从肠道转导到大脑[1,2]。通过靶向不同的组织,EEC具有调控食物摄入、肠道运动、营养吸收、胰岛素分泌等多种生理功能。
当前,基于胰升糖素样肽(glucagon-like peptide, GLP)-1和葡萄糖依赖性促胰岛素多肽(glucose-dependent insulinotropic polypeptide, GIP)功能研发的新型降糖药物,已成为2型糖尿病的重要治疗手段[3,4]。代谢手术缓解糖尿病的同时伴随有多种胃肠激素的显著变化,以上均提示胃肠内分泌激素的代谢调节作用不容小觑。深入了解EEC在正常和病理环境中的发育过程和功能特点,有助于为代谢性疾病的诊疗提供新的思路。
由于EEC在胃肠道内占比少且一直缺乏研究EEC的相应体外模型,对EEC各亚型及其分泌产物的研究困难重重。近年来,随着基因编辑技术、类器官模型、单细胞测序等生物学技术的进步,参与调节EEC命运的转录因子及分化路径已取得了重要进展。本文着重介绍了近年来利用新的生物学技术,对EEC分化和功能方面的最新研究结果,特别是转录因子与信号通路调控网络在EEC亚型发育及分化的作用。
根据其主要的分泌激素,EEC通常可分为10多种不同的细胞类型,分泌大约20种活性激素(表1)。胃肠内分泌激素包括5-羟色胺(5-hydroxytryptamine, 5-HT)、生长抑素(somatostatin, SST)、神经肽Y(neuropeptide Y, NPY)、血管活性肠肽(vasoactive intestinal peptide, VIP)、P物质(substance P, SP)、胆囊收缩素(cholecystokinin, CCK)、GLP-1/2和胃饥饿素(ghrelin, GHRL)等。其中,肠嗜铬(enterochromaffin, EC)细胞是肠道中最大的EEC群体,可以合成和分泌5-HT,占全身5-HT的95%以上。
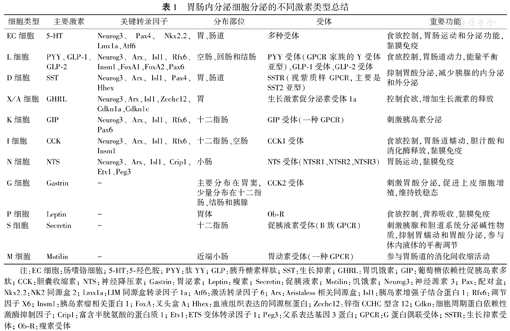
胃肠内分泌细胞分泌的不同激素类型总结
胃肠内分泌细胞分泌的不同激素类型总结
| 细胞类型 | 主要激素 | 关键转录因子 | 分布部位 | 受体 | 重要功能 |
|---|---|---|---|---|---|
| EC细胞 | 5-HT | Neurog3、Pax4、Nkx2.2、Lmx1a、Atf6 | 胃、肠道 | 多种受体 | 食欲控制,胃肠运动和分泌功能,黏膜免疫 |
| L细胞 | PYY、GLP-1、GLP-2 | Neurog3、Arx、Isl1、Rfx6、Insm1、FoxA1、FoxA2、Pax6 | 空肠、回肠和结肠 | PYY受体(GPCR家族的Y受体亚型)、GLP-1受体、GLP-2受体 | 食欲控制,胃肠道动力,能量平衡 |
| D细胞 | SST | Neurog3、Arx、Isl1、Pax4、Hhex | 胃、肠道 | SSTR(视紫质样GPCR,主要是SST2亚型) | 抑制胃酸分泌,减少胰腺的内分泌和外分泌 |
| X/A细胞 | GHRL | Neurog3、Arx、Isl1、Zcchc12、Cdkn1a、Cdkn1c | 胃 | 生长激素促分泌素受体1a | 控制食欲,增加生长激素的释放 |
| K细胞 | GIP | Neurog3、Arx、Isl1、Rfx6、Pax6 | 十二指肠 | GIP受体(一种GPCR) | 刺激胰岛素分泌 |
| I细胞 | CCK | Neurog3、Arx、Isl1、Rfx6、Insm1 | 十二指肠、空肠 | CCK1受体 | 食欲控制,胃肠道蠕动,胆汁酸和消化酶释放,黏膜免疫 |
| N细胞 | NTS | Neurog3、Arx、Isl1、Crip1、Etv1、Peg3 | 小肠 | NTS受体(NTSR1、NTSR2、NTSR3) | 胃肠运动,黏膜免疫 |
| G细胞 | Gastrin | - | 主要分布在胃窦,少量分布在十二指肠、结肠和胰腺 | CCK2受体 | 刺激胃酸分泌,促进上皮细胞增殖,维持铁稳态 |
| P细胞 | Leptin | - | 胃体 | Ob-R | 食欲控制、营养吸收、黏膜免疫 |
| S细胞 | Secretin | - | 十二指肠 | 促胰液素受体(B族GPCR) | 刺激胰腺和胆道系统分泌碱性物质,抑制胃蠕动和胃酸分泌,参与体内液体的平衡调节 |
| M细胞 | Motilin | - | 近端小肠 | 胃动素受体(一种GPCR) | 参与胃肠道的消化间收缩活动 |
注:EC细胞:肠嗜铬细胞;5-HT:5-羟色胺;PYY:肽YY; GLP:胰升糖素样肽;SST:生长抑素;GHRL:胃饥饿素;GIP:葡萄糖依赖性促胰岛素多肽;CCK:胆囊收缩素;NTS:神经降压素;Gastrin:胃泌素;Leptin:瘦素;Secretin:促胰液素;Motilin:饥饿素;Neurog3:神经源素3; Pax:配对盒;Nkx2.2:NK2同源盒2; Lmx1a:LIM同源盒转录因子1a; Atf6:激活转录因子6; Arx:Aristaless相关同源盒;Isl1:胰岛素增强子结合蛋白1; Rfx6:调节因子X6; Insm1:胰岛素瘤相关蛋白1; FoxA:叉头盒A; Hhex:血液组织表达的同源框蛋白;Zcchc12:锌指CCHC型含12; Cdkn:细胞周期蛋白依赖性激酶抑制因子;Crip1:富含半胱氨酸的蛋白质1; Etv1:ETS变体转录因子1; Peg3:父系表达基因3蛋白;GPCR:G蛋白偶联受体;SSTR:生长抑素受体;Ob-R:瘦素受体
近年来,借助单细胞测序及细胞谱系追踪技术,研究者发现一种EEC所分泌的激素可能远不止一种,甚至可以发生改变,这对EEC传统的分类方法提出了挑战。例如,L细胞除表达GLP和肽YY(peptide YY, PYY)外,还表达GIP、CCK、神经降压素(neurotensin, NTS)和SST。Egerod等[5]的研究显示,表达CCK的EEC还同时表达GLP-1、GIP、NTS和PYY。Gehart等[6]的研究显示,EEC产生的激素具有可塑性,当EEC沿着隐窝-绒毛轴分化和成熟时,其分泌的激素会发生改变。例如,回肠L细胞在肠隐窝时表达GLP-1和PYY,但当这些细胞到达绒毛时,胰升糖素原转录下调,促胰液素转录上调。
胃肠道激素参与调节多种生理功能,例如胰岛素分泌、营养吸收、食欲调控、脂质回收、上皮屏障防御、维持肠道干性等。
多种空腹和餐后释放的胃肠内分泌激素可直接影响循环中葡萄糖稳态。GLP-1和GIP被称为肠促胰素,可促进胰腺β细胞葡萄糖依赖性胰岛素分泌,GHRL和SST则抑制胰岛素分泌[7]。
EEC通过感觉转运体、离子通道和表面受体感知肠道内营养和非营养刺激,调节胃肠道激素反应。
EEC可以调控食欲来改变机体代谢水平。GHRL是一种促进食欲的激素,增加摄食量而引发肥胖与增重,而餐后释放的GLP-1、CCK和PYY则会诱发饱腹感。
EEC参与脂质吸收,GLP-1和GLP-2在餐后共同分泌,GLP-1抑制乳糜微粒的合成和分泌,而GLP-2通过CD36促进脂质吸收的同时,与餐后血脂异常密切相关[8]。尽管二者分泌量相似,但GLP-2的半衰期比GLP-1长,这使得GLP-2作用超过GLP-1,进而促进膳食脂肪的吸收。
EEC还与肠道黏膜免疫存在关联。EEC可表达肠道菌群代谢物受体,在受到刺激时分泌细胞因子并产生激素可直接作用于免疫细胞,如GLP-2因此被称为肠道免疫的哨兵和协调者。
研究显示,胃肠激素在营养剥夺期间可以发挥局部作用,以维持肠道平衡[9]。在营养丰富时,主要以内分泌方式促进营养物质的消化、吸收及肠道增殖;而在营养剥夺期间,NTS通过Wnt/β-连环蛋白通路(Wnt/β-catenin)发出信号以保持胃肠干细胞(intestinal stem cells, ISC)功能。
肠上皮细胞拥有强大的再生能力,平均每3~5 d会完全自我更新,这种高再生能力来源于一群驻留在隐窝基底部的富含亮氨酸重复序列的G蛋白偶联受体5+(Leucine-rich repeat-containing G-protein coupled receptor 5+,Lgr5+)ISC。利用遗传谱系追踪技术,Basak等[10]的研究显示,Lgr5+干细胞可以发育为从胃、十二指肠到结肠的所有肠上皮细胞类型。随后,Clevers研究团队发现,从肠道隐窝分离的Lgr5+细胞在含有表皮生长因子(epidermal growth factor, EGF)、Noggin和R-spondin(ENR)的三维凝胶培养体系中能形成类似于肠的微型结构,且具有自我更新能力。该团队利用这种类器官技术结合单细胞转录组测序和细胞谱系追踪,过表达神经源素3(Neurog3)绘制EEC转录因子和分泌产物表达图谱,建立了一个全面调控EEC发育的转录因子和调控因子网络,为深入了解EEC的发育和功能提供了宝贵资料[6]。
由ISC分化为EEC的过程需要多种转录因子。其中,在内分泌祖细胞中瞬时表达的Neurog3是胰腺内分泌谱系最早的特异性标志物之一,是由ISC分化为EEC的关键驱动因素[11]。此外,其他转录因子在EEC分化过程中也起重要作用,包括肠道L细胞和D细胞的叉头盒A(forkhead box A, FoxA)蛋白以及S和I细胞系的分化神经元1(neuronal differentiation 1, Neurod1)[12,13,14,15,16,17,18]。目前,已知Neurog3下游的调控因子包括调节因子X6(regulatory factor X6, Rfx6)、Aristaless相关同源盒(aristaless-related homeobox, Arx)1、NK2同源盒2(NK2 homeobox 2, Nkx2.2)、FoxA1、FoxA2、配对盒(paired box, Pax)4、Pax6、Neurod1、胰岛素增强子结合蛋白1(insulin gene enhancer binding protein-1, Isl1)和胰岛素瘤相关蛋白1(insulinoma-associated protein 1, Insm1),以上转录因子作用于EEC分化过程的不同阶段(表2,图1)。


注:Wnt:Wnt信号通路;Notch:Notch信号通路;BMP:骨形态发生蛋白信号通路;Neurog3:神经源素3; Rfx6:调节因子X6; Neurod1:分化神经元1; FoxA:叉头盒A; EC细胞:肠嗜铬细胞;5-HT:5-羟色胺;PYY:肽YY; GLP:胰升糖素样肽;CCK:胆囊收缩素;GIP:葡萄糖依赖性促胰岛素多肽

胃肠内分泌细胞分化的重要转录因子
胃肠内分泌细胞分化的重要转录因子
| 转录因子 | 功能 | 表达特征 | 缺陷表型 |
|---|---|---|---|
| Atoh1 | 调节肠内分泌细胞、杯状细胞和帕内特细胞谱系的初始命运 | 启动了祖细胞的分化,随后被下游转录因子Neurog3归入EEC细胞谱系 | 缺失后,肠分泌型细胞谱系急剧减少,吸收型细胞谱系大量增加 |
| Neurog3 | 是内分泌谱系形成所必需的核心转录因子 | 在内分泌祖细胞中瞬时表达,后续EEC分化中以脉冲式表达。过表达Neurog3会增加EEC数量 | 缺失后,导致EEC的耗竭和杯状细胞的增加,所有肠道激素表达丧失 |
| Neurod1 | 肠内分泌祖细胞分化和成熟所必需的,对胰岛β细胞成熟和维持至关重要 | 表达仅限于胰岛、肠内分泌、胃和神经元细胞,可调节胰腺β细胞中胰岛素基因的表达 | 缺失后,导致杯状细胞数量增加,同时EEC减少 |
| Rfx6 | Mitchell-Riley综合征的病因,在肠内分泌祖细胞向EC细胞和肽类EEC分化中起差异调控作用 | 在肠内分泌祖细胞中高度表达,后续仅在成熟K细胞中维持 | 缺失后,表达肽类激素的EEC数量减少,但Neurog3+内分泌祖细胞和EC细胞数量增加,黏膜5-HT含量增加 |
| Sox4 | ISC基因组特征相关,与结肠癌的转移增加和生存率降低相关 | 独立于Atoh1分化,促进簇状细胞和肠内分泌细胞谱系的分配 | 缺失后,ISC功能和分泌分化受损,肠簇状细胞和EEC数量减少 |
| FoxA1/FoxA2 | 肠道上皮细胞分化的关键调节因素 | 在胃肠道的所有上皮细胞中表达 | 缺失后,杯状细胞数量减少,同时L细胞与D细胞数量减少 |
| Arx | 在胰腺和前脑发育过程中决定细胞分化命运,EEC亚群分化的必需转录因子 | 在肠内分泌祖细胞和未成熟激素表达细胞中出现,分化的迁移过程中,表达逐渐减弱至消失 | 缺失后,L细胞、K细胞、I细胞、N细胞几乎完全丢失,D细胞数量增加 |
| Pax4 | 与Arx一起协调肠内分泌细胞的分化 | D细胞发育所必需,通过抑制Arx来控制EEC亚型的分化,EEC谱系分布受两者的对立调节 | 缺失后,产生血清素和D细胞分化受损,但L细胞数量随着Arx的上调而增加 |
| Nkx2.2 | 主要在十二指肠和结肠的肠内分泌细胞谱系发育和维持中发挥作用 | 在胚胎发育过程中,调节除GHRL和GCG前体细胞外所有EEC类型;在肠内分泌谱系发育中,调节EC细胞的相关谱系 | 缺失后,十二指肠和结肠中产生5-HT的EC细胞减少最严重,但不影响CCK、GHRL、NPY、SST、VIP等相关激素的释放 |
注:Atoh1:蛋白质无调性同源物1; Neurog3:神经源素3; Neurod1:分化神经元1; Rfx6:调节因子X6; Sox4:性别决定区Y框4; FoxA:X叉头盒A; Arx:Aristaless相关同源盒;Pax4:配对盒4; Nkx2.2:NK2同源盒2; Mitchell-Riley综合征:史密斯-马吉利综合征;EC细胞:肠嗜铬细胞;EEC:胃肠内分泌细胞;ISC:胃肠干细胞;CCK:胆囊收缩素;GHRL:胃饥饿素;GCG:胰升糖素;5-HT:5-羟色胺;NPY:神经肽Y; SST:生长抑素;VIP:血管活性肠肽
除了转录因子,还有一些信号通路在EEC分化中发挥作用。ISC活性受生态位信号通路的调节,特别是Wnt(wingless/integrated, Wnt)、骨形态发生蛋白(bone morphogenetic protein, BMP)、Notch和表皮生长因子(epidermal growth factor, EGF)信号通路。Wnt通路是控制肠道内环境稳定和ISC增殖的主要力量,其抑制剂可使隐窝细胞停止增殖,而激活Wnt通路则会诱导肠道上皮细胞的快速生长,甚至出现结直肠癌[19,20]。BMP通路则与之相反,限制肠道隐窝细胞增殖、抑制ISC更新和促进终末分化[21]。Wnt/BMP的表达梯度会影响肠道隐窝-绒毛轴平衡,因为Wnt信号可以维持ISC的增殖活性,同时BMP信号则对ISC分化过程至关重要(图1)。ISC在分化为多种肠道细胞类型的过程中,由隐窝底部向上移动,中途产生过渡增殖细胞(transit amplifying cell, TA细胞)。当ISC过渡到转运放大区时,细胞会暴露于Wnt或Notch信号促进其增殖,然后由BMP和Notch调节ISC分化。其中Notch信号起驱动作用,使TA细胞进入吸收谱系,最终形成肠上皮细胞。最近,Hibdon等[22]在小鼠及类器官模型中发现,神经母细胞特异性转移因子1(achaete-scute family basic helix-loop-helix transcription factor 1, ASCL1)是促进胃上皮向EEC分化的Notch途径关键下游效应子。综上所述,Wnt、Notch和BMP信号通路可促进ISC的生态位和TA细胞的转化,影响分泌型祖细胞的分化,决定EEC的命运。
此外,还有其他信号通路也共同参与EEC功能调节,如Ras同源物家族成员A(Ras homolog family member A, RHOA)信号通路可以调节小鼠肠道中EEC的数量和GLP-1的分泌[23]。Lund等[24]的研究显示,G蛋白偶联胆汁酸受体1(G-protein-coupled bile acid receptor, GPBAR1)是肠道L细胞的选择性调节因子,GPBAR1激动剂(L3740)可提升小鼠和人肠道类器官中L细胞的数目和GLP-1的分泌,诱导胰升糖素和转录因子Neurog3、Neurod1的表达。此项研究用5-HT4受体来模拟L3740作用的血清素信号通路,揭示了通过GLP-1旁分泌途径来促进L细胞分化的机制。这进一步说明,胃肠激素还能以旁分泌方式向邻近EEC发出信号,影响EEC谱系和激素分泌。
EEC激素分泌主要由G蛋白偶联受体(G protein-coupled receptor, GPCR)介导,该受体受到肠道菌群代谢产物和营养素的刺激,如单糖、短链脂肪酸(short chain fatty acids, SCFAs)、次级胆汁酸和吲哚等。GPCR信号的激活促进胞内Ca2+释放和蛋白激酶C(protein kinase C, PKC)信号活化,诱导激素的释放。
小肠黏膜的增殖和分化对营养状况高度敏感,如高脂饮食会导致EEC数量改变,血浆GLP-1水平升高,5-HT和GHRL降低,进而影响全身的代谢水平[25,26]。Richards等[27]利用转基因小鼠模型,发现高脂饮食喂养小鼠的L细胞中,许多L细胞特异性基因的表达减少,小肠GLP-1释放降低,进一步说明长期饮食变化会影响肠道内分泌系统的功能。最近,Nagai等[28]利用果蝇成虫中肠,鉴定了一个EEC亚群,该细胞亚群在饥饿后重新喂养时会转变为ISC。EEC衍生的ISC优先产生吸收性肠细胞,有效促进肠道生长,以此适应特殊营养环境。其中,膳食葡萄糖和氨基酸通过激活Janus酪氨酸激酶(Janus tyrosine kinase,JAK)-信号转导及转录激活因子(signal transducer and activator of transcription,STAT)通路,诱导特殊的EEC亚群转化为具有功能的ISCs,这表明机体内肠道系统会发生适应性改变来迎合营养环境的变化。
代谢手术治疗糖尿病已获得临床普遍认可并广泛开展。垂直袖状胃切除术(Roux-en-Y gastric bypass, RYGB)后,人体血浆中GLP-1、PYY和胃泌酸调节素浓度升高至10倍,而GIP等其他肠道激素的浓度没有改变[29]。此过程不伴有EEC数量或功能的变化,激素分泌提升更可能的原因是大量营养物质被输送到L细胞数量丰富的回肠中。近期在小鼠研究中发现,RYGB同样可以增加GLP-1、PYY的分泌量,并且可通过胆汁酸信号通路诱导Lgr5+ISC的基因表达谱转向EEC分化[30]。以上研究结果提示,未来可以模拟减重手术后胃肠激素变化情况,重新思考2型糖尿病及肥胖治疗的新策略。
胃肠道拥有丰富且高度多样化的微生物种群,在肠道中形成一个复杂的生态系统,其组成变化与人类健康的各种生理过程有关,包括免疫调节、机体代谢甚至大脑功能。EEC是一类高度敏感的化学感觉肠细胞群,能通过GPCR来感知肠道环境的变化[31,32]。此外,EEC中GPCR表达模式具有空间特异性,在近端肠道细胞上主要是营养受体,而远端肠道细胞主要表达脂肪酸和肠道菌群代谢产物的相关感应受体。因此,肠道菌群代谢产物与EEC相互作用以刺激或抑制激素分泌,通过内分泌和旁分泌信号转导途径,调节局部肠道反应和多种生理功能。
EEC通常呈"开放型",顶端杆状膜向肠腔突出,少数呈"封闭型"[33]。肠道菌群及其代谢物可以调节EEC细胞数量和表达谱,以及激素的生物合成和刺激-分泌偶合过程(图2)。这些肠道菌群产物包括SCFAs、吲哚、次级胆汁酸、色氨酸衍生物、氧化三甲胺(trimethylamine N-oxide, TMAO)、硫化氢、多胺类物质以及脂多糖[34]。


注:EEC:胃肠内分泌细胞;LCFAs:长链脂肪酸;FFAR:游离脂肪酸受体;SCFAs:短链脂肪酸;GPCR:G蛋白偶联受体;CaSR:钙敏感受体;GPRC6A:G蛋白偶联受体C类第6组成员A; GPR142:G蛋白偶联受体142; Taste Rs:味觉敏感受体;GPR93:G蛋白偶联受体93; LPS:脂多糖
Tulika团队发现,肠道微生物群显著抑制了回肠L细胞中与囊泡定位和突触囊泡循环相关的生物过程,使得囊泡数量减少,激素分泌量下降,证明了微生物群对L细胞基因转录有显著的影响[35]。肠道的微生物菌群可以将食物中的碳水化合物转化为SCFAs,主要产生在远端肠道中,少量在回肠中[36]。SCFAs可诱导PYY和GLP-1的分泌增多,通过肠-脑轴减少葡萄糖的产生,调节机体的食欲与血糖水平,是肠道菌群发酵的重要产物。
EEC种类繁多而散在分布于胃肠道,研究模型的匮乏一直制约着该领域的发展。新型体外工具——类器官技术,可以模拟细胞间的相互作用,反映干细胞复杂的分化模式,对EEC的分化途径及可塑性调节提供了更为直观的平台。类器官可以通过成体ISC培养产生,也可以通过多能干细胞(induced pluripotent stem cells, iPSC)或胚胎干细胞(embryonic stem cell, ESC)定向分化而成[37]。RNA干扰、表达突变蛋白以及CRISPR-Cas9等基因编辑技术揭示了EEC的功能、形态以及对刺激的反应机制。例如,Neurog3功能缺失突变的部分患者会患新生儿糖尿病和吸收不良性腹泻,需要全肠外营养才能生存。Zhang等[38]使用人iPSC衍生的类器官模型来模拟Neurog3中致病突变的胰腺和肠道表型,加以生化结构功能研究,由此确定了基因突变与表型的关系。后续研究中,McCauley等[39]使用EEC缺乏的小鼠模型来探究PYY在调节葡萄糖和二肽离子偶合吸收中的作用,探究EEC缺失后患者产生严重吸收不良性腹泻的具体机制。研究结果提示,PYY能够在体外恢复离子耦合营养吸收,提高Neurog3缺陷小鼠的营养吸收水平而加大实验动物存活率,这说明PYY有可能在临床上被用于治疗患有肠吸收障碍的患者。
Clevers研究团队发现,干预某种特定的转录因子或信号通路,可调控人类EEC数量。比如胃肠类器官中诱导Neurog3过表达,可生成所有EEC亚型,将EEC的相对比例从1%提高到25%,这使得EEC功能性激素分泌研究成为可能。本研究组近期在人源性ISC的二维和三维体外培养体系上,通过Neurog3过表达,建立了EEC的体外培养模型(图3),其激素表达和分泌仍能保持其来源组织的激素分布特异性。初步研究显示,二甲双胍具有抑制EEC分化的直接作用。
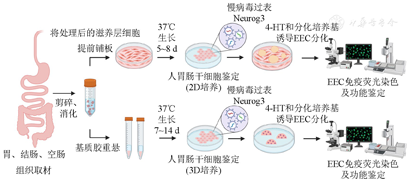

注:EEC:胃肠内分泌细胞;Neurog3:神经源素3; 4-HT:4-羟基他莫昔芬
胃肠内分泌激素在代谢性疾病,特别是糖尿病和肥胖症的发病中起着重要作用。EEC在维持肠内稳态以及ISC复杂分化过程中的作用也越来越受到关注。伴随着类器官模型以及测序技术的迅猛发展,对EEC的分化与功能有了更进一步的了解,其中包括对新转录因子和信号通路的探索。未来,还需要进一步研究了解单个EEC亚型如何进行定向分化,特别是处于胃肠道的近端-远端轴上不同位置的细胞的比较。以往体外模型系统在研究肠腔内物质如何影响肠内激素这一方面尚存局限性,但最近随着新的工程流体系统的发展,已经可以利用该系统控制肠腔内容物来进行深入探索。此外,将来也需要进一步探索EECs与周围生态位细胞、肠道神经系统和肠道微生物群的相互作用,全方位模拟机体内真实环境,从而正确复制EEC激素的发育、分化和分泌过程。对EEC动力学和可塑性改变有更全面的了解后,针对吸收和代谢过程的新型改进药物可以更快地运用到临床中。随着对患者来源的活检组织和iPSCs的使用增加,由EEC介导的控制营养稳态和特异性药物的相关研究将得以进一步发展,有助于未来实现针对患者的精准医疗。
所有作者均声明不存在利益冲突
1.关于胰升糖素样肽(GLP)-1受体激动剂作用机制,下列说法错误的是( )
A. GLP-1的促胰效应为葡萄糖浓度依赖性的,效应强度与血糖水平关联,因此不易诱发低血糖
B.短效的GLP-1受体激动剂主要影响餐后血糖,而长效的GLP-1受体激动剂对空腹和餐后血糖均有影响
C.除降糖效应外,GLP-1受体激动剂还可增加饱腹感、减少摄食、减轻体重
D.天然GLP-1半衰期较长,主要经由二肽基肽酶-4(DPP-4)降解和肾脏排泄
2.下列胃肠道激素的作用功能,正确的是( )
A.胃泌素的主要功能是刺激胰腺和胆道系统分泌碱性物质,抑制胃蠕动和胃酸分泌
B.促胰液素的主要功能是刺激胃酸分泌、上皮细胞的增殖以及参与维持铁稳态
C. GLP-2可发挥肠促胰素效应,减少食物摄入,抑制胃排空和消化道分泌
D.食物摄取(主要是蛋白质和脂肪)能刺激胆囊收缩素的分泌
3.肥胖的病因与发病机制,错误的是( )
A.基因变异导致肥胖
B.某些激素促进食欲并诱发肥胖
C.能量消耗过多引起肥胖
D.疾病和药物促发肥胖
4.GLP-1受体激动剂可用于哪种人群治疗( )
A.血糖控制不佳合并肥胖患者
B.肾功能严重受损患者
C.急性胰腺炎患者
D. 2型糖尿病合并炎症性肠病患者
5.以下哪个胃肠道内分泌细胞分泌的激素是正确的( )
A.肠嗜铬细胞——胃饥饿素
B. I细胞——葡萄糖依赖性促胰岛素多肽(GIP)
C. K细胞——胆囊收缩素(CCK)
D. L细胞——GLP-1



























