
应用近红外光谱技术(NIRS)监测极低出生体重儿(VLBW)肝区氧饱和度(rStO2-liv)和肠区氧饱和度(rStO2-abd),探讨两者的差异及临床意义。
前瞻性研究。纳入南京医科大学附属妇产医院2022年10月1日至2023年3月31日出生体重<1 500 g的新生儿,在出生第7天进行GutcheckNEC评分后接受连续8 h的NIRS测量,收集临床数据并对NIRS测量值进行对比分析。采用独立样本t检验、单因素方差分析比较组间差异;采用受试者工作特征曲线分析NIRS的诊断价值。
共纳入VLBW患儿42例,rStO2-liv与rStO2-abd差异无统计学意义(P=0.117)。GutcheckNEC评分低风险组7例,中风险组29例,高风险组6例,不同风险组的rStO2-liv差异无统计学意义(F=2.145,P=0.131),rStO2-abd随着风险的提高明显下降(F=5.127,P=0.011)。Bland-Altman图提示rStO2-liv和rStO2-abd不存在一致性(P=0.024)。受试者工作特征曲线提示rStO2-abd诊断GutcheckNEC评分高风险的曲线下面积(AUC)为0.800,截断值为41.41%,敏感度为85.70%,特异度为48.60%。
在VLBW患儿中,利用NIRS同时测量rStO2-liv和rStO2-abd是安全可行的,但两者不可互相替代,其中rStO2-abd<41.41%时,提示患儿罹患坏死性小肠结肠炎的风险较高。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
近红外光谱(near infrared spectroscopy,NIRS)是一种测量区域组织氧饱和度(regional tissue oxygen saturation,rStO2)的技术,依据朗伯比尔定律,利用近红外光监测局部区域的氧合情况,具有无创、简单、安全等优点[1,2,3]。
极低出生体重儿(very low birth weight infant,VLBW)指出生体重<1 500 g的新生儿,坏死性小肠结肠炎(necrotizing enterocolitis,NEC)多发病于VLBW,其发病率和致死率较高[4]。GutcheckNEC(<1 500 g)是根据VLBW的出生胎龄、喂养史、感染史、药物使用情况等风险因素评价NEC风险的工具[5]。具有易于评分、使用方便等特点[6]。目前,尚缺乏可靠的诊断方法来明确NEC的早期阶段并预测进一步的进展。
既往研究表明,肠黏膜缺血坏死是NEC中的重要一环,有无肠道缺血VLBW的NIRS测量值存在明显差异[7,8,9]。由此推测NIRS的应用可能有助于早期识别NEC的风险,所以本课题组设计本研究,旨在评价NIRS在VLBW监测不同部位腹部氧饱和度的可行性及预测NEC高风险的可能性。
前瞻性研究。选取南京市妇幼保健院2022年10月1日至2023年3月31日出生体重<1 500 g的新生儿作为研究对象。排除标准:(1)合并腹壁缺陷、腹腔内畸形或其他严重疾病不能耐受NIRS测量的患儿;(2)因哭闹、活动造成数据测量不完整的患儿;(3)无法获得父母或监护人同意的患儿;(4)同期参与其他临床研究的患儿。本研究通过南京市妇幼保健院医学伦理委员会的批准(批准文号:2022KY-163号),患儿监护人均签署知情同意书。
所有患儿出生第7天经过GutcheckNEC评分后接受连续8 h的测量,NIRS的测量使用美敦力柯惠脑氧饱和度监护仪INVOS 5100C,专用的新生儿传感器被分别放置在右肋弓下方和脐下方的中腹部,用来测量肝区氧饱和度(the liver oxygen saturation,rStO2-liv)和肠区氧饱和度(the intestinal oxygen saturation,rStO2-abd)。传感器每30 s自动记录一组数据,测量结果保存在INVOS 5100C近红外光谱仪上。测量期间每1 h检查探头位置并评估局部皮肤情况,确保数据的完整性。对导出的数据进行处理时,剔除基线稳定前的数据,选取稳定数值的平均值作为患儿的组织氧饱和度。
GutcheckNEC评分(图1)采用针对VLBW的版本[10,11]。在出生72 h进行第1次评估,每12~24 h重新评分,本研究以出生第7天的评分为标准,低风险≤20分,中风险21~32分,高风险33~36分,极高风险≥36分。所有评分由2名新生儿重症监护病房(neonatal intensive care unit,NICU)医师及1名小儿外科医师彼此独立评分,评分存在误差时由3人讨论并得出统一评分。
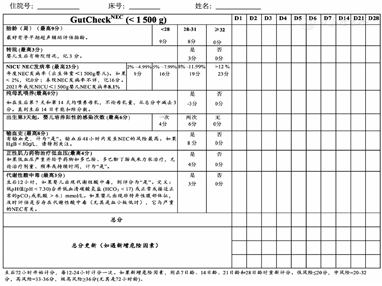

采用SPSS 26.0软件进行数据处理,计量资料以 ±s表示,对组间符合正态分布的数据采用t检验,不满足正态分布的进行转换后再采用t检验分析。两组独立定量资料采用独立样本t检验分析,多组独立定量资料采用单因素方差分析。计数资料采用频数(%)表示,组间比较采用χ2检验。采取受试者工作特征(receiver operating characteristic,ROC)曲线分析rStO2-liv、rStO2-abd对诊断GutcheckNEC评分高风险的价值,计算曲线下面积(area under curve,AUC)、灵敏度、特异度和截断值等指标。Bland-Altman图被用于评估rStO2-liv和rStO2-abd的一致性。P<0.05为差异有统计学意义。
±s表示,对组间符合正态分布的数据采用t检验,不满足正态分布的进行转换后再采用t检验分析。两组独立定量资料采用独立样本t检验分析,多组独立定量资料采用单因素方差分析。计数资料采用频数(%)表示,组间比较采用χ2检验。采取受试者工作特征(receiver operating characteristic,ROC)曲线分析rStO2-liv、rStO2-abd对诊断GutcheckNEC评分高风险的价值,计算曲线下面积(area under curve,AUC)、灵敏度、特异度和截断值等指标。Bland-Altman图被用于评估rStO2-liv和rStO2-abd的一致性。P<0.05为差异有统计学意义。
排除不合格的数据后,共纳入患儿42例,男20例(47.62%),女22例(52.38%),胎龄(30.33±2.13)周(26.00~35.42周),出生体重(1 224.76±201.85) g(770~1 500 g)。测得rStO2-liv(47.54±8.79)%,rStO2-abd(44.25±10.15)%,rStO2-liv与rStO2-abd比较差异无统计学意义(t=1.584,P=0.117)。其余一般资料见表1,测量过程中无患儿出现皮肤损害或其他不良影响。低风险、中风险、高风险组在性别、分娩方式、胎数、动脉导管未闭、胎粪延迟等一般资料上差异均无统计学意义(均P>0.05)(表2),而出生胎龄、出生体重、血红蛋白随着风险程度的增加而明显下降(均P<0.05)(表3)。各风险组组内rStO2-liv与rStO2-abd比较差异均无统计学意义(均P>0.05),不同风险组组间rStO2-liv差异无统计学意义(P=0.131),rStO2-abd随着风险的提高明显下降(P=0.011)(表3)。

纳入极低出生体重儿的一般资料
The basic information of included very low birth weight infants
纳入极低出生体重儿的一般资料
The basic information of included very low birth weight infants
| 指标 | 数据 |
|---|---|
| 性别(例) | |
| 男 | 20 |
| 女 | 22 |
出生胎龄(周, ±s) ±s) | 30.33±2.13 |
出生体重(g, ±s) ±s) | 1 224.76±201.85 |
| 分娩方式(例) | |
| 顺产 | 14 |
| 剖宫产 | 28 |
| 胎数(例) | |
| 单胎 | 24 |
| 多胎 | 18 |
| 动脉导管未闭(例) | 12 |
| 胎粪延迟(例) | 13 |
| 呼吸支持(例) | |
| 同步间歇指令通气 | 8 |
| 持续正压通气 | 14 |
| 高频振荡通气 | 8 |
| 无 | 12 |
血红蛋白(g/L, ±s) ±s) | 135.07±30.47 |
肝区氧饱和度(%, ±s) ±s) | 47.54±8.79 |
肠区氧饱和度(%, ±s) ±s) | 44.25±10.15 |
| GutcheckNEC评分分组(例) | |
| 低风险组 | 7 |
| 中风险组 | 29 |
| 高风险组 | 6 |
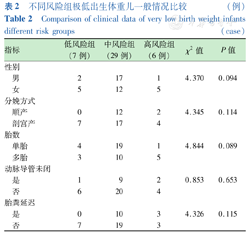
不同风险组极低出生体重儿一般情况比较 (例)
Comparison of clinical data of very low birth weight infants different risk groups (case)
不同风险组极低出生体重儿一般情况比较 (例)
Comparison of clinical data of very low birth weight infants different risk groups (case)
| 指标 | 低风险组(7例) | 中风险组(29例) | 高风险组(6例) | χ2值 | P值 |
|---|---|---|---|---|---|
| 性别 | |||||
| 男 | 2 | 17 | 1 | 4.370 | 0.094 |
| 女 | 5 | 12 | 5 | ||
| 分娩方式 | |||||
| 顺产 | 0 | 12 | 2 | 4.345 | 0.114 |
| 剖宫产 | 7 | 17 | 4 | ||
| 胎数 | |||||
| 单胎 | 4 | 19 | 1 | 4.844 | 0.089 |
| 多胎 | 3 | 10 | 5 | ||
| 动脉导管未闭 | |||||
| 是 | 1 | 9 | 2 | 0.853 | 0.653 |
| 否 | 6 | 20 | 4 | ||
| 胎粪延迟 | |||||
| 是 | 0 | 10 | 3 | 4.326 | 0.115 |
| 否 | 7 | 19 | 3 |
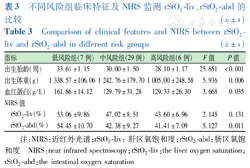
不同风险组临床特征及NIRS监测rStO2-liv、rStO2-abd的比较 ( ±s)
±s)
Comparison of clinical features and NIRS between rStO2-liv and rStO2-abd in different risk groups ( ±s)
±s)
不同风险组临床特征及NIRS监测rStO2-liv、rStO2-abd的比较 ( ±s)
±s)
Comparison of clinical features and NIRS between rStO2-liv and rStO2-abd in different risk groups ( ±s)
±s)
| 指标 | 低风险组(7例) | 中风险组(29例) | 高风险组(6例) | F值 | P值 |
|---|---|---|---|---|---|
| 出生胎龄(周) | 33.61±1.15 | 30.00±1.50 | 28.10±1.17 | 25.651 | <0.001 |
| 出生体重(g) | 1 338.57±106.06 | 1 242.76±179.70 | 1 005.00±248.58 | 5.936 | 0.006 |
| 血红蛋白(g/L) | 161.86±14.12 | 129.79±31.28 | 129.33±26.30 | 3.668 | 0.035 |
| NIRS值 | |||||
| rStO2-liv(%) | 53.06±9.86 | 47.02±8.51 | 43.60±6.96 | 2.145 | 0.131 |
| rStO2-abd(%) | 54.45±10.70 | 42.38±9.27 | 41.41±7.09 | 5.127 | 0.011 |
注:NIRS:近红外光谱;rStO2-liv:肝区氧饱和度;rStO2-abd:肠区氧饱和度 NIRS:near infrared spectroscopy;rStO2-liv:the liver oxygen saturation;rStO2-abd:the intestinal oxygen saturation
Bland-Altman图提示在rStO2-liv和rStO2-abd之间存在着平均3.282%(标准差9.11%)的差值(图2),且2组数据之间不存在一致性(P=0.024)。
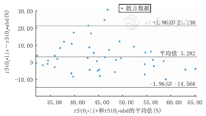

注:rStO2-liv:肝区氧饱和度;rStO2-abd:肠区氧饱和度 rStO2-liv:the liver oxygen saturation;rStO2-abd:the intestinal oxygen saturation
以GutcheckNEC评分中风险及以上为NEC高风险,rStO2-liv诊断GutcheckNEC评分高风险的AUC为0.722,截断值为53.92%,此时敏感度为71.40%,特异度为80.00%。rStO2-abd诊断GutcheckNEC评分高风险的AUC为0.800,截断值为41.41%,此时敏感度为85.70%,特异度为48.60%(图3)。
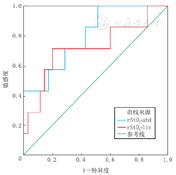

注:rStO2-liv:肝区氧饱和度;rStO2-abd:肠区氧饱和度;NEC:坏死性小肠结肠炎 rStO2-liv:the liver oxygen saturation;rStO2-abd:the intestinal oxygen saturation;NEC:necrotizing enterocolitis
随着现代医学科学的发展,针对新生儿诊疗技术和监测护理技术的进步,存活的VLBW逐步增多,这类患儿往往罹患NEC的风险很高。研究显示NEC会影响约5%的早产儿,并且有高达30%的死亡率。即使存活的NEC患儿后续也容易发生肠狭窄、胆汁淤积症、短肠综合征、生长发育及神经系统发育落后等严重并发症[12]。NEC的最初症状主要包括腹胀、喂养不耐受、便血等,这些症状在临床上相对常见,是提示NEC发生及进展的重要信息。临床上目前主要依靠腹部X线片显示的气体来诊断NEC,但在疾病的早期阶段,这种症状往往并不明显,并且在NEC发生后,只能依赖反复的影像学检查和临床医师的经验评估NEC的进展[13]。目前尚缺乏可靠的诊断方法来明确NEC的早期阶段并预测进一步的进展,NIRS的应用可能有助于早期识别NEC的风险。
NIRS是一种无创的监测方式,用于监测局部的组织氧饱和度,在VLBW中可能有较为广阔的使用前景[14,15]。临床上,肝区和腹部都是常用监测部位[16,17]。肠道和肝脏本身的解剖学差异可能影响NIRS的数值。既往研究发现肝区和腹部的组织氧饱和度变异率均较高[18]。腹腔内的肠管为空腔脏器且位置不固定,腹腔内肠管的运动可能会改变反射信号。此外,造成这种高变异性的另一个可能原因是绝大部分NIRS测量时没有考虑到粪便的吸收,而新生儿中粪便广泛存在于腹部。肝脏是实质性的器官,位置相对固定,约75%的血供依赖于门静脉,剩余25%来源于肝动脉。2条血管对肝脏血液供应之间没有直接的线性关系,从而限制了NIRS在监测肝脏氧合的应用[19]。因此,收集并分析VLBW的NIRS,可能有助于早期识别NEC的发生和进展,有效降低NEC发生风险及危害。
本研究证实了在VLBW中,同时监测rStO2-liv和rStO2-abd是可行的,本研究中最小出生体重仅有770 g,腹部的空间仍可以分别放置肝区和脐下的传感器。本研究中所有受试患儿无皮肤损害或其他严重的并发症发生,证实了监测的安全性,既往研究中有报道出现皮肤损害的症状[20],这种差异可能来源于监测时间的长短。
本研究比较了VLBW rStO2-liv和rStO2-abd,测得的rStO2-liv为(47.54±8.79)%,rStO2-abd为(44.25±10.15)%,肝区拥有更高的平均值。这可能与肝脏属于实质性器官和肝脏独特的供血有关,潜在的病理生理学也不可忽视,肠道面临的缺血风险较肝脏更加敏感。rStO2-abd较文献报道中的足月儿数据明显偏低,国内外研究也有类似的差异,足月儿rStO2-abd较早产儿高[21,22]。本研究认为引起该差异的原因主要有以下几个方面,首先,不同研究中使用的不同的测量仪器与探头,各家不同的测量深度和算法会影响测量结果;其次,胎龄是重要的影响因素之一,早产儿的微循环本身较足月儿发育差,相比之下,足月儿肠道对缺氧的调节能力更强;并且,足月儿和早产儿的腹壁厚度会影响测量的深度,足月儿肠道中含有更多的粪便,粪便会增加NIRS光谱的吸收,从而改变测量值;最后是喂养带来的差异,研究发现进食会使肠系膜上动脉血流显著增加,早产儿和足月儿之间的喂养量的区别可能是潜在的影响因素。除了上述原因外,测量的时间点也是不容忽视的变量,不同的时间点会影响NIRS的数值。既往研究针对VLBW进行了1周的NIRS的监测,发现早产儿的rStO2-abd呈单峰分布,峰值出现在第3天[23]。然而Cortez等[20]对早产儿的研究却显示rStO2-abd在出生的前9 d逐渐下降,在随后的5 d里表现出了上升趋势。这可能与出生后胎儿由宫内的缺氧环境逐步向新生儿期过渡有关,也可能与出生后经口喂养后肠系膜上动脉的血流逐步增加有关。
遗憾的是,在本研究中并未发现rStO2-liv与rStO2-abd的相关性,这可能与上述几个影响因素同样有关。尽管不同部位氧组织饱和度存在互相替代的潜力,在未来的实验研究或临床工作中,rStO2-liv和rStO2-abd的应用仍值得进一步的研究。本研究的ROC曲线分析提示rStO2-abd在诊断NEC高风险具有一定的意义,本研究结果发现当rStO2-abd低于41.41%,应怀疑患儿罹患NEC的风险较高。本研究纳入的患儿中,最终只有1例诊断NEC并接受了手术,无法按照NEC的发生与否对红外光谱的数值进行分析,遂引入GutcheckNEC评分对VLBW进行风险评估分级,这是本研究的一个重要不足。尽管目前针对NIRS预测NEC高风险的研究较多,国内外仍缺乏统一的标准,有研究显示,针对VLBW测量第1周的平均rStO2-abd,结果显示rStO2-abd≤56%时,提示罹患NEC的风险增加[24]。荷兰和瑞典的一项队列研究显示,对<28周的早产儿测量出生2~6 d的rStO2-abd,设定rStO2-abd的临界值为30%[19]。因此,针对NIRS诊断NEC高风险的具体标准,仍需要大样本量的前瞻性研究。
综上所述,NIRS作为一种无创且可以进行床边操作、动态连续的监测手段,对VLBW发生NEC早期预测具有一定的指导意义,本课题组也将在更多的病例中进行总结和分析,期望获得更准确的预测指标。
所有作者均声明不存在利益冲突



























