
A族链球菌(GAS)又称化脓性链球菌,是导致全球儿童死亡的十大感染性疾病病原体之一,最常见的感染性疾病是GAS咽炎,高发于学龄期,可导致并发症。在发展中国家及低收入国家,GAS咽炎的并发症风湿热及其后遗症风湿性心脏病仍然是一个重要的公共卫生问题,亟需引起重视。本文旨在通过综述国内外关于GAS咽炎的指南及相关文献,供国内临床医师参考,希望大家更加关注GAS咽炎的诊治,提升GAS咽炎的诊治水平。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
A族链球菌(Group A Streptococcus,GAS)是一种引起多种感染性疾病的病原体,最常见的是GAS咽炎,通常被称为链球菌性咽炎。在美国,5%~15%的成人和15%~35%的咽炎儿童患有GAS感染[1,2,3]。但GAS咽炎的症状与病毒性咽炎及其他细菌感染咽炎的症状相似,这给GAS咽炎的诊治带来了挑战[4]。同时,GAS咽炎还可能导致化脓性并发症,如中耳炎、扁桃体周围脓肿、细菌性皮肤感染等[5],但需特别关注的是非化脓性并发症,也称免疫后遗症,最常见的是风湿热和急性链球菌感染后肾小球肾炎[4,6,7]。因此,在实际临床工作中,需要规范GAS咽炎的诊治。然而,由于对其并发症的担忧和减轻患者症状的迫切需求,也出现了一些问题,例如过度治疗导致的抗菌药物耐药问题等。
GAS咽炎的诊治已受到许多国家的重视,一些与GAS咽炎相关的诊治指南陆续发表,常包含于咽炎/扁桃体炎/咽喉痛的实践指南中。国内于2013年发表了一篇《A组乙型溶血性链球菌的诊治》[8]的综述文章,2016年中国医师协会制定了《儿童急性扁桃体炎诊疗——临床实践指南(2016年制定)》[9],2022年禹定乐等[10]发表了《中国儿童A族链球菌感染相关疾病的诊断、治疗与预防专家共识》。在此之前,2002年美国传染病学会制定了《A族链球菌咽炎的治疗指南》,并于2012年更新了修订版《A族链球菌咽炎诊断和管理的临床实践指南》[11],2014年又进行了勘误。2012年欧洲临床微生物学和传染病学会编写了《急性咽痛管理指南:ESCMID喉咙痛指南组》[12];同年意大利儿童咽炎管理小组制定了《儿童急性咽炎的管理:意大利国立卫生研究院指南总结》[13],德国耳鼻喉头颈外科学会于2016年制定了《临床实践指南:扁桃体炎Ⅰ.诊断和非手术治疗》[14],并于2020年更新了《德国临床实践指南:喉咙痛》,该指南考虑了新开发的临床评分以及延迟开处方的原则,提出了修订后的治疗算法,并于2021年修订[5]。现就GAS咽炎的流行病学、临床特点、诊断、治疗和预防等方面进行综述,并比较各指南在GAS咽炎诊治中的异同,旨在为临床实践提供更多的参考依据。
GAS咽炎是最常见的由细菌引起的咽炎,约占咽炎病例的20%~30%[10,15]。GAS咽炎在学龄期发病率最高,主要在5~15岁[7],特别是7~8岁[3],在3岁之前不常见。GAS通过接触感染者的呼吸道分泌物传播,一般潜伏期为2~5 d。该疾病在冬季和春季发病最为常见。在少数未经抗菌药物治疗的患者(0.3%~3.0%),GAS咽炎有可能引发急性风湿热。急性风湿热及其后遗症风湿性心脏病在发达国家相对不常见,但在发展中国家和低收入国家仍然是一个重要的公共卫生问题,并在发达国家的土著少数民族中持续存在,特别是在拥挤和杂乱的环境中高发[7,16,17,18]。可见,GAS感染主要影响资源匮乏环境中的儿童和年轻人(包括孕妇)[19]。
GAS咽炎的临床表现在各国指南均有详细描述,无太大差异。GAS咽炎的常见症状包括突然出现的咽痛、发热(>38.0℃)、扁桃体渗出物、颈前淋巴结大、软腭和咽后瘀点[1];在较大的儿童,可能出现腹痛、头痛、肌痛、恶心和呕吐等症状,体征包括伴或不伴渗出的咽喉部红斑、扁桃体充血肿大,软腭瘀斑、悬雍垂充血水肿、颈前淋巴结大以及猩红热样皮疹[10,13,17,20]。值得注意的是,在<3岁的儿童中,GAS咽炎可能出现不典型的临床表现,包括鼻炎和低热等[13]。同时,目前存在许多临床评分系统可帮助医师用于诊断GAS咽炎,其中常用的是Centor评分系统、McIsaac评分系统(修改后的Centor评分系统)[14,20]。临床评分系统有2个优点:(1)不需要专门设备,容易由临床医师实施;(2)可与其他辅助诊断工具结合使用[4]。现在最流行的是Centor标准[1,4,21,22]。在该评分系统中,最高分为4分的个体,GAS培养阳性率为56.00%;最低分为0分的个体,GAS培养阳性率仅为2.50%[21]。在不同环境中它具有合理的敏感性和较高的特异性,但在儿童中的适用性不如成人,且仅在严重病例中进行评估,仅靠评分系统不能明确诊断GAS咽炎[12]。McIsaac评分为3分或更高,对预测GAS感染具有较高的敏感性(92.11%),但特异性极低(12.62%)[23]。McIsaac评分系统在儿童中得到验证[24]。欧洲指南提出,Centor临床评分系统有助于针对性使用抗菌药物,可帮助识别GAS感染可能性较高的患者[12]。美国指南提出,Centor标准和McIsaac标准对识别链球菌感染风险低的患者有帮助,但即使在特定评分系统中具有所有临床特征的受试者也只有35%~50%被确认患有GAS咽炎,特别是在儿童中,则不认可使用临床评分系统作为诊断GAS的唯一手段[11]。国内对临床评分标准应用较少。
GAS咽炎的症状与非GAS咽炎相似,这增加了临床诊断的复杂性[4]。详细的病史询问和细致的体格检查是准确诊断GAS咽炎的重要步骤,但病原学诊断通常需相关检查来辅助。目前,国内外的实践指南与专家共识推荐的临床诊断方法有快速抗原检测(rapid antigen detection tests,RADTs)、咽拭子培养(throat culture)、核酸扩增测试(nucleic acid amplification techniques,NAATs)、机器学习和人工智能(machine learning and artificial intelligence)等[4,21]。然而,各指南在GAS咽炎的管理方面有不同的建议,尤其在使用临床评分系统、RADTs或咽拭子培养的建议不同[13]。
RADTs通过使用化学提取和通过以下3种方法测定细胞壁碳水化合物来检测GAS抗原:乳胶凝集法、酶免疫测定法和光学免疫测定法(optic immunoassays)[13]。其中光学免疫测定法优于乳胶凝集法[11,14]。对于链球菌感染可能性高的患者(例如Centor标准评分3~4分),医师可考虑使用RADTs;对于链球菌感染可能性较低的患者(例如Centor标准评分0~2分),通常不常规使用RADTs[12,14]。其优点:(1)检测结果快,5~15 min即可出结果;(2)成本较低;(3)临床使用方便;(4)特异性高(≥95%),即大多数RADTs阴性者无需抗菌药物治疗。因此,采用RADTs可减少门诊急性咽炎患者的抗菌药物过度处方[25]。其缺点:(1)敏感性较低(64%~90%)[23,24,26],但有研究表明虽RADTs敏感性较低、McIsaac评分对儿童的特异性较低,但二者联合使用可降低儿童急诊中的抗菌药物处方率[23];(2)无法区分感染和携带状态[4,21]。另外,一方面,RADTs的敏感性和特异性受采集拭子执行者的技能和经验的影响[13];另一方面,大量使用RADTs可能会导致检测出更多的定植微生物,从而导致抗菌药物的过度处方,因此在临床实际中,应酌情评估RADTs结果,以确定抗菌药物治疗的适应证[25]。指南一般建议针对RADTs阳性者,因其特异性高,无需重复检测;不建议常规治疗后进行RADTs。欧洲指南提出,考虑到RADTs的高特异性及进行咽拭子培养所需的额外成本和时间[13],RADTs阴性者无需进一步完善咽拭子培养[5,12];同时也更倾向于建议不使用RADTs,因为其敏感性不高,无法区分携带者和活动性感染者[4]。而美国指南建议在儿童和青少年中,RADTs检测阴性应辅以咽拭子培养;然而,在同样情况下,成人不应进行咽拭子培养,因为成人该病的并发症风湿热的发病率和风险低[11,27]。国内学者更推崇美国指南,但相关研究较少。同时由于国内相关研究以及培训较少,导致RADTs的特异性(<95%)低于国外[8,28]。
咽拭子培养是诊断GAS咽炎的金标准方法[6,20,29]。咽拭子培养一般有2种方法:(1)37 ℃室内空气中,在5%哥伦比亚血琼脂上进行过夜培养;(2)34~36 ℃及含4%~6%二氧化碳的室内空气中,在含有5%去纤维化马血或羊血和20 mg/L β-烟酰胺腺嘌呤二核苷酸的米勒-辛顿(Mueller-Hinton)琼脂上培养16~20 h[11,13,14,20]。第1种较常用。其优点:(1)敏感性高(90%~95%)、特异性强(≥95%);(2)成本低;(3)可分离出细菌并进行抗菌药物敏感性试验[13,20,21]。其缺点:(1)检测时间长,需24~48 h;(2)无法区分急性感染和携带者状态,从而产生假阳性诊断[21,30]。在抗菌药物治疗之前或之后,不推荐常规进行微生物培养检测[5,13]。其中,欧洲指南未明确推荐使用咽拭子培养来诊断GAS咽炎,因其倾向于认为GAS咽炎是自限性疾病,无需过多诊疗。相比之下,美国指南更重视对GAS的诊治。
核酸检测GAS特有的核酸序列(例如来自speB或sda基因)。在过去9年,一些NAATs已获得美国食品与药品监督管理局批准[31]。基于PCR的方法主要包括环介导等温扩增法和实时荧光定量PCR法。前者是illumigene测定,这是一种通过环介导的等温扩增过程进行的诊断测试,具有高特异性(≥99%)和高敏感性(≥99%),可作为诊断GAS感染的有用工具;后者尚无可靠评价依据。其优点是相较于RADTs,敏感性更高。其缺点:(1)成本高,一般在实验室环境进行,限制了其广泛使用;(2)不能区分感染和携带状态[3,4,21]。国外某些机构提出NAATs可取代RADTs和/或联合咽拭子培养策略[3,4]。
近年来,随着技术的发展,出现了新的诊断方法——机器学习和人工智能技术,以帮助医师诊断GAS咽炎。一种新型的链球菌咽喉部检测方法是利用智能手机内置的摄像头和手电筒获取咽喉部图像,使用附加工具控制照明条件,通过色彩转换和色彩校正算法处理获取的图像,最后利用机器学习技术将GAS咽炎咽喉与健康咽喉进行分类[4,32]。另外,目前也应用人工智能软件(PhenoMATRIX色原检测模块软件)自动化检测咽喉标本中的GAS,其结果优于实验室技术人员作出的分类决策,可进一步提高诊断的准确性[4,33]。
在许多GAS胞外产物抗体中,以抗链球菌溶血素O(anti-streptococcal hemolysin O,ASO)、脱氧核糖核酸酶B最敏感[8]。然而,一般不推荐将ASO抗体滴度用于急性咽炎的常规诊断,因其在GAS感染后2~4周才能在血浆中检测出[20],且持续时间较长。然而,为了帮助诊断其非化脓性后遗症,则需对疑似患有非化脓性并发症(如风湿热或链球菌感染后肾小球肾炎)的儿童进行ASO等抗体检测[11,13,14]。国内存在对ASO等抗体检测结果过度解读的问题,导致过度使用抗菌药物[34]。值得注意的是,ASO升高并不一定就需要抗感染治疗[35,36],若存在以下情况,可考虑使用抗菌药物:(1)出现咽痛、扁桃体化脓、发热,且咽拭子培养提示GAS感染;(2)曾有GAS感染史;(3)红细胞沉降率或者C反应蛋白升高。
GAS咽炎的治疗旨在缓解症状、缩短病程、降低传染风险、预防非化脓和化脓性并发症,减少不必要的抗菌药物使用,以及减缓抗菌药物耐药性的发展进程[4,10]。
一旦确诊为急性GAS咽炎,患者应使用适当的抗菌药物进行抗感染治疗。青霉素或阿莫西林的治疗窗口窄,不良反应发生率低,费用适中,截至目前,尚未见有明确耐药问题的报道[3]。因此,对于无青霉素过敏史的患者,一线治疗是口服青霉素V钾、阿莫西林、阿莫西林克拉维酸钾10 d,或者肌内注射1剂苄星青霉素G;对于青霉素过敏患者,优选口服第三代头孢菌素、第二代头孢菌素10 d,次选口服第一代头孢菌素10 d;对青霉素和头孢等β-内酰胺类抗菌药物过敏者,可选大环内酯类抗菌药物,口服克林霉素或克拉霉素10 d、阿奇霉素5 d;在我国大环内酯类和克林霉素耐药率高,选择其有治疗失败的风险,必要时可选静脉滴注万古霉素或口服/静脉滴注利奈唑胺10 d[1,3,10,11]。具体治疗方案见表1。欧洲国家的最新指南建议使用5~7 d的抗菌药物疗程,有危险因素或考虑根除的患者除外,因为有研究证明较短的抗菌药物疗程并不会比10 d疗程效果差或不安全,且随着抗菌药物使用时间的增加,药物不良反应和耐药性发展的风险也增加[5,37]。使用抗菌药物的好处:(1)适当使用抗菌药物可将病程缩短约1 d,在治疗第3天症状减轻最多,症状的改善程度可能取决于抗菌药物使用的及时程度;(2)有研究指出,在症状出现48 h内给予治疗可提供最佳的缓解机会;(3)使用抗菌药物可降低扁桃体周围脓肿等化脓性并发症及风湿热等非化脓性并发症的发生率;(4)使用抗菌药物可将GAS的传染性控制在24 h内[4,10]。
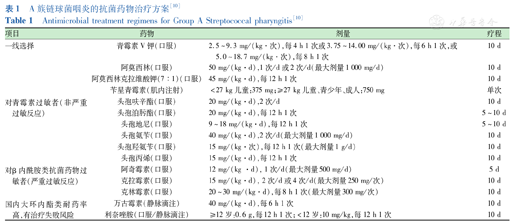
A族链球菌咽炎的抗菌药物治疗方案[10]
Antimicrobial treatment regimens for Group A Streptococcal pharyngitis[10]
| 项目 | 药物 | 剂量 | 疗程 |
|---|---|---|---|
| 一线选择 | 青霉素V钾(口服) | 2.5~9.3 mg/(kg·次),每4 h 1次或3.75~14.00 mg/(kg·次),每6 h 1次,或5.0~18.7 mg/(kg·次),每8 h 1次 | 10 d |
| 阿莫西林(口服) | 50 mg/(kg·d),1次/d或2次/d(最大剂量1 000 mg/d) | 10 d | |
| 阿莫西林克拉维酸钾(7∶1)(口服) | 45 mg/(kg·d),每12 h 1次 | 10 d | |
| 苄星青霉素(肌内注射) | <27 kg儿童:375 mg;≥27 kg儿童、青少年、成人:750 mg | 单次 | |
| 对青霉素过敏者(非严重过敏反应) | 头孢呋辛酯(口服) | 20 mg/(kg·d),2次/d | 10 d |
| 头孢泊肟酯(口服) | 20 mg/(kg·d),每12 h 1次 | 5~10 d | |
| 头孢地尼(口服) | 9~18 mg/(kg·d),每12 h 1次 | 5~10 d | |
| 头孢氨苄(口服) | 40 mg/(kg·d),2次/d(最大剂量1 000 mg/d) | 10 d | |
| 头孢羟氨苄(口服) | 15 mg/(kg·次),每12 h 1次(最大剂量1 g/d) | 10 d | |
| 头孢丙烯(口服) | 15 mg/(kg·d),每12 h 1次 | 10 d | |
| 对β内酰胺类抗菌药物过敏者(严重过敏反应) | 阿奇霉素(口服) | 12 mg/(kg ·d), 1次/d(最大剂量500 mg/d) | 5 d |
| 克拉霉素(口服) | 15 mg/(kg·d), 2次/d或4次/d(最大剂量250 mg/次) | 10 d | |
| 克林霉素(口服) | 20~30 mg/(kg·d),每8 h 1次(最大剂量300 mg/次) | 10 d | |
| 国内大环内酯类耐药率高,有治疗失败风险 | 万古霉素(静脉滴注) | 40 mg/(kg·d),每6 h 1次 | 10 d |
| 利奈唑胺(口服/静脉滴注) | ≥12岁:0.6 g,每12 h 1次;<12岁:10 mg/kg,每12 h 1次 | 10 d |
然而,GAS咽炎患者是否使用抗菌药物以及何时使用抗菌药物仍存在争议。欧洲指南倾向于认为抗菌药物治疗是不必要的,因为GAS咽炎是一种并发症发生率较低的自限性疾病,尤其在发达国家。这样的做法虽可减少抗菌药物的使用和减缓抗菌药物耐药性的发展[31],但在一定程度上出现了治疗不足、增加并发症的发生风险。近年来,猩红热和侵袭性A族链球菌(invasive group A Streptococcus,iGAS)感染在英国和欧洲其他国家卷土重来[7,30],引起了国外学者的关注,但在中国,与GAS相关的疾病还未得到足够的关注[10,38]。此外,各国对GAS相关疾病的管理并不统一。猩红热和GAS咽炎均是由GAS引起的咽喉感染,但仅猩红热在英国和中国被列为传染病,并需要报告和管理,GAS咽炎则不需要[39]。另外,在国内,有部分文献中误解了GAS对青霉素和头孢等β-内酰胺类抗菌药物"中介"或"耐药"情况,导致非一线抗菌药物的过多使用。然而,根据现有研究,我国对克林霉素和大环内酯类抗菌药物有很高的耐药率(≥90%),故不推荐其作为β-内酰胺类抗菌药物过敏者的替代治疗[34,39,40,41]。
在全球范围内,GAS感染及其并发症是一个重要的公共卫生挑战,特别是在经济落后地区。因此,公共卫生政策应重点关注预防GAS的传播。
GAS咽炎会引起并发症甚至导致死亡,临床应予以重视,可通过临床表现、临床评分系统、辅助检查(RADTs、咽拭子培养、NAATs、机器学习与人工智能、ASO滴度等)来识别GAS咽炎,并给予抗感染和对症治疗。值得注意的是,在临床表现和临床评分标准是否足以做出诊断、是否应该用RADTs、对RADTs阴性结果是否应该备用咽喉分泌物培养、GAS咽炎患者是否使用抗菌药物以及何时用何种抗菌药物治疗等,各指南之间存在分歧。这些分歧可能与国家医学教育和国家卫生系统结构、护理和资源水平、对GAS咽炎重视程度以及抗菌药物耐药性等方面的差异有关。总之,仍需更多有威信和可靠的临床研究学会完善指南,尽可能标准化诊疗流程,以进一步改善全世界范围的诊疗效果[30]。
对于我国来说,与GAS咽炎相关的研究较少,对GAS的关注度不够,存在以下不足之处[10,34,39,44]:(1)忽略了GAS感染的危害性,GAS引起的疾病与多学科相关且是全球传染病十大死因之一;(2)辅助诊断工具的临床应用还不够普及;(3)国内较多文献报道误认为GAS对青霉素和头孢等β-内酰胺类抗菌药物耐药,导致过多使用非一线抗菌药物,但中国对大环内酯类和克林霉素的耐药率相当高,故在国内如选用其作为青霉素过敏患者的替代治疗,有治疗失败的风险;(4)与GAS相关的疾病中,国内只要求上报猩红热,其他GAS相关疾病不需要上报。因此,呼吁国内学者更加关注GAS,并遵循相关指南的诊治流程,合理应用抗菌药物,以规范GAS咽炎的诊断和治疗。同时,扩大对GAS相关疾病的监测和监管范围,以及加强推动开发能覆盖多个GAS血清型抗原的多价疫苗。
所有作者均声明不存在利益冲突



























