
探讨射波刀治疗非小细胞肺癌(NSCLC)脑转移的近期临床效果和安全性及此类患者预后影响因素。
回顾性病例系列研究。回顾性分析2020年7月至2022年1月在吉林省肿瘤医院接受射波刀治疗脑转移瘤的58例NSCLC患者临床资料。射波刀治疗后3个月,依据头部增强磁共振成像(MRI)检查的脑转移瘤变化评价放疗疗效。采用Kaplan-Meier法对58例患者进行总生存(OS)和局部无复发生存(LRRFS)分析;以患者随访期间生存状态为金标准,采用受试者工作特征(ROC)曲线分析依据累计脑转移瘤体积判断射波刀治疗的NSCLC脑转移患者生存情况的效果,并获得累计脑转移瘤体积最佳临界值;通过单因素和多因素Cox比例风险模型分析影响射波刀治疗的NSCLC脑转移患者OS和LRRFS的临床因素;评估射波刀治疗相关不良反应。
58例患者中,男性26例(44.8%),女性32例(55.2%),中位年龄[M(Q1,Q3)]64岁(56岁,70岁);每例患者有1~7个脑转移病灶,58例患者共有98个脑转移病灶。射波刀治疗后3个月内死亡2例(3.4%);其余56例患者治疗后3个月,完全缓解3例(5.4%),部分缓解36例(64.3%),疾病稳定13例(23.2%),疾病进展4例(7.1%);ROC曲线分析显示,依据累计脑转移瘤体积判断射波刀治疗的NSCLC脑转移患者生存的曲线下面积为0.593(95% CI:0.423~0.763),累计脑转移瘤体积最佳临界值为15 cm3。中位随访时间12.6个月(7.5个月,17.9个月)。6、12个月的OS率分别为91.3%、79.5%,6、12个月的LRRFS率分别为93.0%、89.2%。多因素Cox回归分析显示,Karnofsky功能状态评分(>70分比≤ 70分,HR=0.103,95% CI:0.019~0.545,P=0.007)、颅外肿瘤控制情况(已控制比未控制,HR=0.145,95% CI:0.049~0.429,P<0.001)、累计脑转移瘤体积(≤15 cm3比>15 cm3,HR=0.105,95% CI:0.028~0.399,P=0.001)是OS不良的独立影响因素,颅外肿瘤控制情况(已控制比未控制,HR=0.062,95% CI:0.006~0.616,P=0.018)、累计脑转移瘤体积(≤15 cm3比>15 cm3,HR=0.440,95% CI:0.007~0.292,P=0.001)、靶区总生物等效剂量(BED)(≤60 Gy比>60 Gy,HR=5.299,95% CI:1.020~27.530,P=0.047)是LRRFS不良的独立影响因素。治疗后仅出现1~2级头痛[53.5%(31/58)]、恶心呕吐[36.2%(21/58)]等不良反应,无≥3级不良反应发生。
射波刀治疗NSCLC脑转移具有较高的局部控制率和近期生存率,不良反应轻微。Karnofsky功能状态评分、颅外肿瘤控制情况、累计脑转移瘤体积可能影响射波刀治疗的NSCLC脑转移患者的OS,颅外肿瘤控制情况、累计脑转移瘤体积、总BED可能影响局部复发。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
脑转移瘤是最常见的颅内恶性肿瘤[1],20%~40%颅外恶性肿瘤患者会发生脑转移,其中60%~75%患者有临床症状。有较多肺癌患者发生脑转移,病情进展较快,预后较差,对其治疗也越来越受到关注[2]。立体定向放疗(SRT)是近年来备受关注的放疗技术,可用于治疗单个或多个颅内肿瘤转移灶,具有较高的局部控制率[3]。射波刀治疗能够通过精确的影像追踪技术向脑转移瘤灶施以高剂量放射线,同时最大限度地使正常组织免受辐射损伤,能较好实现SRT。本研究回顾性分析了射波刀治疗的58例非小细胞肺癌(NSCLC)脑转移患者的临床资料,评价了近期临床效果和安全性,并分析了预后影响因素,为临床诊断和治疗提供参考。
本研究为回顾性病例系列研究。回顾性选取2020年7月至2022年1月于我科行射波刀SRT的NSCLC脑转移患者。入组标准:(1)明确诊断为NSCLC脑转移[4];(2)所有患者肺原发病灶均经病理证实,脑转移病灶均经头颅增强磁共振成像(MRI)检查确诊;(3)预期生存时间>3个月;(4)无严重基础疾病;(5)美国东部肿瘤协作组(ECOG)功能状态评分0~2分;(6)取得患者、家属知情同意。排除标准:(1)生存时间<3个月;(2)行脑转移手术治疗;(3)有其他肿瘤病史;(4)有其他严重内科疾病及精神疾病。最终58例入组,共98个脑转移病灶。本研究经吉林省肿瘤医院伦理委员会批准(批准文号:202007-18-01),患者、家属均知情同意并签署知情同意书,放疗方式最终由患者、家属和临床医生共同决定。
患者仰卧位,用热塑头罩固定头部。使用大孔径CT及MRI模拟定位机(均为荷兰Philips公司产品)进行增强扫描(颅顶至第2颈椎下缘,层厚1.5 mm)。扫描图像传输至MIM融合勾画系统,将CT与MRI图像融合后勾画靶区。肿瘤靶区(GTV)为CT增强图像与MRI T1增强序列融合后强化的除水肿外的区域;计划靶区(PTV)为GTV外扩2 mm。正常组织的勾画包括视神经、视交叉、眼球、晶状体、垂体及脑干。
靶区勾画完成后将靶区图像分别传输至CK计划系统,治疗计划由物理师应用MutiPlan 4.6计划系统完成,要求处方剂量覆盖95%的靶区体积。根据射波刀治疗计划的剂量显示习惯,所有计划均以相对剂量表示,以照射范围内的最大剂量进行归一,且处方剂量均控制在65%~80%。参考美国肿瘤放疗协作组(RTOG)90-05研究[5,6],制订个体化放射剂量分割模式。通过线性二次(LQ)模型公式将物理剂量换算成生物等效剂量(BED)[7]。射波刀(美国Accuray公司)治疗时所有患者采用颅骨追踪方式定位。58例患者脑转移瘤分割剂量模式见表1。
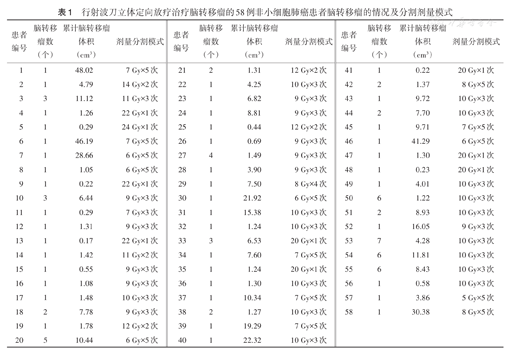
行射波刀立体定向放疗治疗脑转移瘤的58例非小细胞肺癌患者脑转移瘤的情况及分割剂量模式
行射波刀立体定向放疗治疗脑转移瘤的58例非小细胞肺癌患者脑转移瘤的情况及分割剂量模式
| 患者编号 | 脑转移瘤数(个) | 累计脑转移瘤体积(cm3) | 剂量分割模式 | 患者编号 | 脑转移瘤数(个) | 累计脑转移瘤体积(cm3) | 剂量分割模式 | 患者编号 | 脑转移瘤数(个) | 累计脑转移瘤体积(cm3) | 剂量分割模式 |
|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 1 | 48.02 | 7 Gy×5次 | 21 | 2 | 1.31 | 12 Gy×2次 | 41 | 1 | 0.22 | 20 Gy×1次 |
| 2 | 1 | 4.79 | 14 Gy×2次 | 22 | 1 | 4.25 | 10 Gy×3次 | 42 | 2 | 1.37 | 8 Gy×5次 |
| 3 | 3 | 11.12 | 11 Gy×3次 | 23 | 1 | 6.82 | 9 Gy×3次 | 43 | 1 | 9.72 | 10 Gy×3次 |
| 4 | 1 | 1.26 | 22 Gy×1次 | 24 | 1 | 8.81 | 9 Gy×3次 | 44 | 2 | 7.70 | 10 Gy×3次 |
| 5 | 1 | 0.29 | 24 Gy×1次 | 25 | 1 | 0.44 | 12 Gy×2次 | 45 | 1 | 9.71 | 7 Gy×5次 |
| 6 | 1 | 46.19 | 7 Gy×5次 | 26 | 1 | 0.69 | 9 Gy×3次 | 46 | 1 | 41.29 | 6 Gy×5次 |
| 7 | 1 | 28.66 | 6 Gy×5次 | 27 | 4 | 1.49 | 9 Gy×3次 | 47 | 1 | 1.30 | 20 Gy×1次 |
| 8 | 1 | 1.05 | 6 Gy×5次 | 28 | 1 | 3.90 | 9 Gy×3次 | 48 | 1 | 0.23 | 20 Gy×1次 |
| 9 | 1 | 0.22 | 22 Gy×1次 | 29 | 1 | 7.50 | 8 Gy×4次 | 49 | 1 | 4.01 | 10 Gy×3次 |
| 10 | 3 | 6.44 | 9 Gy×3次 | 30 | 1 | 21.92 | 6 Gy×5次 | 50 | 6 | 1.22 | 10 Gy×3次 |
| 11 | 1 | 0.29 | 7 Gy×3次 | 31 | 1 | 15.38 | 10 Gy×3次 | 51 | 2 | 8.93 | 10 Gy×3次 |
| 12 | 1 | 1.31 | 9 Gy×3次 | 32 | 1 | 1.24 | 10 Gy×3次 | 52 | 1 | 16.05 | 9 Gy×3次 |
| 13 | 1 | 0.17 | 22 Gy×1次 | 33 | 3 | 6.53 | 20 Gy×1次 | 53 | 7 | 4.28 | 10 Gy×3次 |
| 14 | 1 | 1.42 | 11 Gy×2次 | 34 | 1 | 7.60 | 7 Gy×5次 | 54 | 6 | 11.81 | 10 Gy×3次 |
| 15 | 1 | 0.55 | 9 Gy×3次 | 35 | 1 | 1.24 | 20 Gy×1次 | 55 | 6 | 8.43 | 10 Gy×3次 |
| 16 | 1 | 1.08 | 9 Gy×3次 | 36 | 1 | 1.30 | 10 Gy×3次 | 56 | 1 | 0.58 | 10 Gy×3次 |
| 17 | 1 | 1.48 | 10 Gy×3次 | 37 | 1 | 10.34 | 7 Gy×5次 | 57 | 1 | 3.86 | 5 Gy×5次 |
| 18 | 2 | 7.78 | 9 Gy×3次 | 38 | 2 | 1.27 | 10 Gy×3次 | 58 | 1 | 30.38 | 8 Gy×5次 |
| 19 | 1 | 1.78 | 12 Gy×2次 | 39 | 1 | 19.29 | 7 Gy×5次 | ||||
| 20 | 5 | 10.44 | 6 Gy×5次 | 40 | 1 | 22.32 | 10 Gy×3次 |
BED=nd[1+d/(α/β)](n为放疗的分割次数;d为分割剂量;α/β值为常数,脑转移瘤α/β取值为10 Gy)
患者射波刀治疗后每2~3个月采用门诊复查、电话回访、查阅病历资料等方式随访1次,随访时间≥1年。放疗后3个月对生存患者行头部增强MRI检查,依据实体肿瘤疗效评价标准(RECIST)评价临床疗效[8],评估患者近期脑转移瘤局部控制效果,包括完全缓解(CR)、部分缓解(PR)、疾病稳定(SD)、疾病进展(PD)。末次随访日期为2023年8月20日。总生存(OS)时间为从确诊脑转移开始至任何原因导致死亡的时间。局部无复发生存(LRRFS)时间为射波刀治疗第1天开始至局部复发或因脑转移死亡的时间。失访、死于其他疾病或突发事件、随访截止时仍生存均定为删失数据。放疗损伤评价依据美国RTOG放射性损伤分级标准[9]。
采用SPSS 25.0软件进行统计学分析。计数资料以频数(%)表示。计量资料偏态分布,以M(Q1,Q3)表示。采用Kaplan-Meier法对58例患者进行OS、LRRFS分析。以患者随访结束时生存状态为金标准,绘制依据累计脑转移瘤体积判断患者生存的受试者工作特征(ROC)曲线,获得累计脑转移瘤体积最佳临界值,以此界值将累计脑转移瘤体积作为预后分析的二分类变量。采用单因素Cox比例风险模型分析与58例患者OS和LRRFS相关的因素;OS分析中,任何原因的死亡赋值为1,其余事件均赋值为0;脑LRRFS分析中,局部复发或因脑转移死亡赋值为1,其余事件赋值为0;将其中P<0.05的变量纳入多因素Cox比例风险模型,分析OS和LRRFS的独立影响因素。以P<0.05为差异有统计学意义。
58例患者中,男性26例(44.8%),女性32例(55.2%);中位年龄64岁(56岁,70岁),范围:35~81岁,其中≥60岁36例(62.1%),<60岁22例(37.9%);Karnofsky功能状态(KPS)评分>70分44例(75.9%),≤70分14例(34.1%);病理类型为腺癌44例(75.9%),鳞状细胞癌10例(17.2%),未进一步分型4例(6.9%);颅外肿瘤已控制23例(39.7%),颅外肿瘤未控制35例(60.3%);58例患者共98个脑转移病灶,每例患者有1~7个脑转移病灶;脑转移病灶≥4个6例(10.3%),1~3个52例(89.7%);无症状27例(46.6%),有症状31例(53.4%)。
依据MRI检查,98个脑转移病灶中位体积4.25 cm3(1.24 cm3,10.34 cm3)。ROC曲线分析显示,依据累计脑转移瘤体积判断患者生存的曲线下面积为0.593(95% CI:0.423~0.763),累计脑转移瘤体积的最佳临界值为15 cm3。脑转移瘤体积>15 cm3 9例(15.5%),≤15 cm3 49例(84.5%)。脑转移瘤射波刀治疗单次剂量5~24 Gy,行1~5次治疗;单次放疗中位BED为20.0 Gy(14.4 Gy,20.8 Gy),中位总BED为59.75 Gy(51.3 Gy,60.0 Gy)。总BED>60 Gy患者8例(13.8%),总BED≤60 Gy患者50例(86.2%)。
射波刀治疗后3个月内死亡2例(3.4%)。其余56例患者在射波刀治疗后3个月时通过头部增强MRI评价射波刀治疗效果显示,CR 3例(5.4%),PR 36例(64.3%),SD 13例(23.2%),PD 4例(7.1%)。
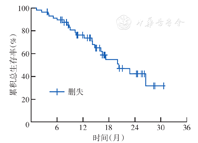
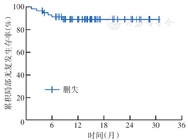
至末次随访,无失访患者,随访率100%(58/58),中位随访时间12.6个月(7.5个月,17.9个月),范围:1.2~30.7个月。Kaplan-Meier生存分析显示,6、12个月OS率分别为91.3%、79.5%(图1),6、12个月LRRFS率分别为93.0%、89.2%(图2)。


单因素Cox回归分析显示,KPS评分、颅外肿瘤控制情况、累计脑转移瘤体积与OS相关,差异均有统计学意义(均P<0.05);颅外肿瘤控制情况、累计脑转移瘤体积、总BED与LRRFS相关,差异均有统计学意义(均P<0.05)(表2)。多因素Cox回归分析显示,KPS评分、颅外肿瘤控制情况、累计脑转移瘤体积是患者OS不良的独立影响因素(均P<0.01);颅外肿瘤控制情况、累计脑转移瘤体积、总BED是LRRFS不良的独立影响因素(均P<0.05)(表2)。
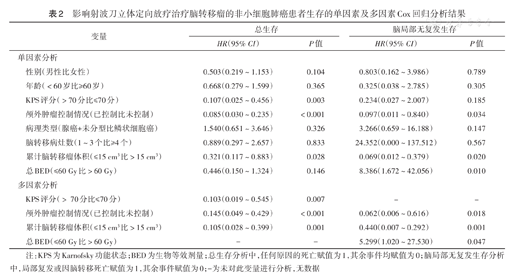
影响射波刀立体定向放疗治疗脑转移瘤的非小细胞肺癌患者生存的单因素及多因素Cox回归分析结果
影响射波刀立体定向放疗治疗脑转移瘤的非小细胞肺癌患者生存的单因素及多因素Cox回归分析结果
| 变量 | 总生存 | 脑局部无复发生存 | ||
|---|---|---|---|---|
| HR(95% CI) | P值 | HR(95% CI) | P值 | |
| 单因素分析 | ||||
| 性别(男性比女性) | 0.503(0.219~1.153) | 0.104 | 0.803(0.162~3.986) | 0.789 |
| 年龄(<60岁比≥60岁) | 0.668(0.279~1.599) | 0.365 | 0.325(0.038~2.785) | 0.305 |
| KPS评分(>70分比≤70分) | 0.107(0.025~0.456) | 0.003 | 0.234(0.027~2.007) | 0.185 |
| 颅外肿瘤控制情况(已控制比未控制) | 0.085(0.030~0.235) | <0.001 | 0.097(0.011~0.840) | 0.034 |
| 病理类型(腺癌+未分型比鳞状细胞癌) | 1.540(0.651~3.646) | 0.326 | 3.266(0.659~16.188) | 0.147 |
| 脑转移病灶数(1~3个比≥4个) | 0.889(0.297~2.657) | 0.833 | 24.352(0.000~137.512) | 0.567 |
| 累计脑转移瘤体积(≤15 cm3比>15 cm3) | 0.321(0.117~0.883) | 0.028 | 0.069(0.012~0.379) | 0.020 |
| 总BED(≤60 Gy比>60 Gy) | 0.446(0.150~1.324) | 0.146 | 8.386(1.672~42.056) | 0.010 |
| 多因素分析 | ||||
| KPS评分(>70分比≤70分) | 0.103(0.019~0.545) | 0.007 | - | - |
| 颅外肿瘤控制情况(已控制比未控制) | 0.145(0.049~0.429) | <0.001 | 0.062(0.006~0.616) | 0.018 |
| 累计脑转移瘤体积(≤15 cm3比>15 cm3) | 0.105(0.028~0.399) | 0.001 | 0.440(0.007~0.292) | 0.001 |
| 总BED(≤60 Gy比>60 Gy) | - | - | 5.299(1.020~27.530) | 0.047 |
注:KPS为Karnofsky功能状态;BED为生物等效剂量;总生存分析中,任何原因的死亡赋值为1,其余事件均赋值为0;脑局部无复发生存分析中,局部复发或因脑转移死亡赋值为1,其余事件赋值为0;-为未对此变量进行分析,无数据
58例患者射波刀治疗后,头痛31例(53.5%),恶心呕吐21例(36.2%),且均为1~2级,给予甘露醇、激素等对症治疗后均缓解;未发生≥3级不良反应。
近年来因全身治疗的不断进步,患者生存时间不断延长,脑转移瘤的发生率呈上升趋势[10]。肺癌患者常出现脑转移,严重影响患者生命质量,且预后较差。放疗是脑转移瘤的主要局部治疗方式,包括全脑放疗(WBRT)和SRT。WBRT比SRT更有可能导致神经认知方面的不良反应,绝大多数患者只能应用1次,限制了补救性治疗的选择。而SRT具有创伤小、剂量分布精确、靶区外剂量跌落迅速等优势,已逐渐成为脑转移瘤患者优选治疗方法[11],使脑转移瘤患者获得了更长的生存期。射波刀治疗具有治疗范围精确、不良反应发生率低、治疗周期短的优点,是实现SRT的非常好的方式。
大多临床试验对不超过3个或4个脑转移病灶的患者评估SRT的疗效。既往美国国立综合癌症网络(NCCN)NSCLC指南对颅内寡转移的定义是≤3个转移病灶,多发转移的定义是≥4个转移病灶。2021年第6版NCCN指南将有限的脑转移定义为只要SRT治疗能够替代WBRT并更好地保护认知功能的脑转移[12]。这一定义基于日本学者的JLGK0901研究[13],该研究纳入了1 194例接受SRT治疗的脑转移患者,结果显示,单个脑转移病灶患者的生存期延长,但2个和5~10个脑转移病灶患者的生存期没有差异,2~4个和5~10个脑转移病灶患者间的局部控制也没有明显差异;尽管SRT治疗后5~10个脑转移病灶的患者新发脑转移概率略高(69%比63%),但差异没有统计学意义。Nichol等[14]对SRT治疗的1~10个脑转移病灶患者研究发现,1~3个与4~10个脑转移病灶患者OS没有差异;1~3个和4~10个脑转移病灶患者中治疗后新发脑转移患者比例分别为19%和49%。Chang等[15]对323例接受SRT治疗的脑转移患者进行回顾性分析,1~5、6~10、11~15、>15个脑转移病灶患者在OS方面没有差异,但与1~15个病灶组相比,>15个病灶组治疗后新发脑转移的概率更高。本研究单因素和多因素Cox回归分析射波刀治疗1~7个脑转移病灶NSCLC患者预后影响因素显示,脑转移1~3个病灶和≥4个病灶对患者OS和LRRFS均无影响,与上述研究结果一致。SRT治疗是局限性脑转移患者的首选治疗方法,根据2021年发布的欧洲肿瘤内科学会实体肿瘤脑转移临床实践指南[16],对于脑转移病灶数有限(1~4个)的患者,推荐SRT治疗(ⅠA级证据),对于脑转移病灶数较多(4~10个)且累计肿瘤体积<15 ml的患者,可以考虑应用SRT治疗(ⅠB级证据)。Sahgal等[17]报道了SRT对比SRT+WBRT治疗1~4个脑转移病灶患者的Ⅲ期临床研究结果,发现累计脑转移瘤体积≤15 ml时两组间认知神经功能损害发生率差异无统计学意义。关于多发性脑转移患者从SRT治疗中获益的研究正在进行中,如HipSter(NCT04277403)Ⅲ期临床试验。
Romano等[18]对134例共374个脑转移病灶行SRT治疗的患者进行回顾性分析,结果显示患者的中位OS时间为8.7个月,1年局部控制率为88.7%。另一项纳入250例行SRT治疗的有1~14个脑转移病灶患者的回顾性分析结果显示,患者中位OS时间为7.1个月,1年局部控制率为91.5%[19]。本研究随访了58例射波刀治疗脑转移瘤的NSCLC患者,6个月OS率为91.3%,12个月为79.5%,患者6个月LRRFS率93.0%,12个月为89.2%,与上述研究结果相似。
研究显示,对于脑转移瘤体积<100 mm3或长径<6 mm的患者,SRT治疗后局部控制率接近100%,而对于体积<250 mm3或长径<10 mm的患者,OS时间延长,证实累计脑转移瘤体积是脑转移患者预后的重要影响因素,反映了脑转移瘤的负荷和增殖能力[20]。此外,较大的颅内累计肿瘤体积会限制患者接受高剂量SRT治疗,可能导致不良预后[20]。本研究结果显示,颅内累计脑转移瘤体积≤15 cm3是OS不良的独立保护因素(P=0.001),与上述研究结果一致。
董兰兰和饶智国[21]、Navarria等[22]的研究指出,KPS评分和颅外肿瘤控制情况是影响脑转移患者生存的独立因素。本研究结果与之相似,本研究中KPS评分>70分和颅外肿瘤已控制是射波刀治疗的NSCLC脑转移患者OS不良的独立保护因素。原因可能是体力状态较好的患者能更好地耐受放疗,并能接受更及时、系统的治疗。对于治疗前KPS评分低于70分且颅外肿瘤未控制的患者,有2~4个脑转移病灶者的局部脑转移复发率及全身远处转移率更高。颅外肿瘤未控制的患者通常一般状态较差,肿瘤恶性程度高,治疗耐受性差,治疗预期效果也较差,因此通常会选择相对较低的放疗剂量,导致脑转移瘤的局部控制效果差。本研究结果显示颅外肿瘤控制情况与脑转移瘤患者的局部控制相关。
RTOG 90-05研究中采用LQ模型计算不同剂量分割模式的BED,长径为≤20 mm、21~30 mm和31~40 mm的脑转移瘤SRT最大耐受剂量分别为24、18、15 Gy[5,6]。Vogelbaum等[23]根据RTOG 90-05研究的分割模式,应用SRT治疗长径≤20 mm、21~30 mm和31~40 mm脑转移瘤,分别获得了85%、49%和45%的1年局部控制率。Baliga等[24]分析了10项SRT相关研究的数据,包括720个病灶,发现当BED分别为40、50、60 Gy时,1年局部控制率分别为73%、78%、84%,2年局部控制率分别为62%、69%、81%,提示BED与局部控制率可能相关。本研究参考了上述分割模式,采用LQ模型计算BED,单因素和多因素Cox回归分析显示总BED为影响LRRFS不良的独立因素(P=0.047),与Baliga等[24]的研究结果一致。临床工作中往往因肿瘤邻近重要器官而无法给予更高的BED,影响了疗效,而射波刀可有效克服这一难题。射波刀治疗脑转移瘤具有高效、安全的特点,其原因一是射波刀治疗能够精确地给予肿瘤高BED,二是射波刀治疗能够使靶区外剂量迅速跌落,从而尽可能降低对周围重要器官的损害。本研究58例患者中仅部分患者出现了1~2级不良反应,无≥3级不良反应发生,验证了这一优势。
综上所述,射波刀SRT提高了NSCLC脑转移瘤局部控制率,延长了患者生存期,射波刀治疗是实现SRT的安全、有效手段。但本研究为回顾性研究,样本量较小,可能存在一定的选择偏倚,还需要扩大样本量,行随机对照试验来进行验证,以得到更可靠的结论。
李新迪,岳丹,全晓月,等.射波刀治疗非小细胞肺癌脑转移的近期临床效果和安全性及预后影响因素[J].肿瘤研究与临床,2024,36(6):409-415. DOI:10.3760/cma.j.cn115355-20230907-00087.
所有作者声明无利益冲突



























