
肝细胞癌(HCC)是一种常见且预后较差的恶性肿瘤,手术切除是治疗早期HCC的首选方法,然而不足30%的肝癌患者在初诊时适合根治性治疗。系统治疗在中晚期HCC患者的治疗过程中发挥重要的作用,可有效延长患者的生存时间。归纳近5年国内外关于中晚期HCC系统治疗的最新进展,包括晚期HCC的一线免疫联合治疗、二线治疗的选择、系统治疗围手术期应用以及系统治疗与局部治疗的联合疗法,并重点阐述了系统治疗在HCC的全程管理中的地位和作用,以期为HCC系统治疗提供思路。对于,联合局部治疗的治疗模式已成为治疗晚期HCC新的研究热点,未来将进一步探索个体化、精准化的系统治疗策略。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
肝细胞癌(HCC)是我国常见的恶性肿瘤,每年新发患者约为36.77万人[1],发病率和病死率分别位列我国恶性肿瘤第4位和第2位,其中HCC占75%~85%[2]。HCC的常用治疗手段包括手术切除、肝移植、消融、经动脉栓塞化疗和系统治疗等。其中手术和消融等局部治疗是早期HCC最有效的治疗手段,然而不足30%的HCC患者初诊时适合行根治性治疗。中期HCC以介入治疗为主[3]。近年来,HCC系统治疗取得了一系列突破性进展,分子靶向药物和免疫药物的出现大大提高了晚期HCC患者的疗效,延长了患者生存,特别是在IMbrave150研究成功后,靶向联合免疫的系统治疗方案已成为晚期HCC一线治疗的新标准[4,5]。系统治疗的进步也改变了HCC的治疗格局。鉴于此,笔者主要针对HCC的系统治疗,尤其对其在中晚期HCC、围手术期以及系统联合局部治疗方面进行综述,旨在为同行提供参考。
近年来,随着靶向治疗与免疫治疗的快速发展,HCC的系统治疗迎来了巨大变革。随着对临床疗效的不断追求,靶向或免疫单药带来的有限的客观缓解率(objective response rate,ORR)、无进展生存期(progression-free survival,PFS)以及总生存期(overall survival ,OS)指标已无法满足晚期HCC治疗的临床需求,HCC的治疗已不再局限于单个药物作战,免疫联合治疗已成为国内外各指南的优选方案。
免疫联合治疗,特别是免疫检查点抑制剂(immune checkpoint inhibitors,ICIs)联合大分子抗血管生成药物,已取得里程碑式进展。全球多中心Ⅲ期临床IMBrave-150研究结果显示,ICIs药物阿替利珠单抗联合抗血管生成药物贝伐珠单抗("T+A"方案)治疗晚期HCC的中位总生存期(mOS)显著优于索拉非尼(19.2个月与13.4个月,P < 0.001)[6]。同时研究也指出,OS获益主要在于病毒性肝炎相关HCC患者,而在甲胎蛋白(α-feto protein,AFP)> 400 ng/ml的患者接受"T+A"方案后的OS获益较少。在基线情况较差的中国亚组,"T+A"治疗组主要终点mOS和中位无进展生存期(mPFS)获益更为显著,应该与乙型肝炎病毒(hepatitis B virus,HBV)感染比例更高相关。由此,国内外各指南均推荐"T+A"组合为一线治疗的优选方案[3,4,5],拉开了HCC一线免疫联合治疗的序幕。随后,国内多中心ORIENT-32研究结果显示,信迪利单抗联合贝伐珠单抗类似物一线治疗晚期HCC显著优于索拉非尼(HR = 0.57,95%CI:0.43~0.75,P < 0.000 1)[7],在《原发性肝癌诊疗指南(2024年版)》中同样推荐为一线治疗方案[3]。
小分子酪氨酸激酶抑制剂(tyrosine kinase inhibitors,TKIs)为抗血管生成药物,通过选择性的抑制血管内皮生长因子受体(vascular endothelial growth factor,VEGFR)的激活,抑制肿瘤的生长和转移。目前,在ICIs联合小分子TKIs探索方面,虽有一定进展,但临床试验结果并不理想。一项卡瑞利珠单抗联合阿帕替尼治疗晚期肝细胞癌(RESCUE)Ⅱ期研究结果显示,卡瑞利珠单抗联合TKIs药物阿帕替尼("双艾"组合)一线治疗晚期HCC的mOS和ORR分别为20.1个月和34.3%[8]。随后的国际多中心Ⅲ期CARES-310研究结果显示,卡瑞利珠单抗联合阿帕替尼治疗晚期HCC和索拉非尼治疗的mOS分别为22.1个月和15.2个月(HR = 0.62,95% CI:0.49~0.80, P < 0.000 1),mPFS分别为5.6个月和3.7个月(HR = 0.52,95% CI:0.41~0.65, P < 0.000 1)。进一步的亚组分析显示,亚洲或非亚洲人群、不同AFP水平人群、BCLC B期或C期、有无肝外转移或大血管侵犯和既往局部治疗情况等不同关键亚组,均可从"双艾"组合的治疗中获益[9]。基于1b期临床试验KEYNOTE-524研究结果显示,帕博利珠单抗联合仑伐替尼("可乐"组合)治疗晚期HCC的mOS和ORR分别达22.0个月和36.0%[10]。"可乐"组合的一线Ⅲ期研究(LEAP 002)以单药仑伐替尼作为对照单药组,结果显示,联合组和单药组的mOS分别为21.1个月和19.0个月(HR = 0.84,95%CI:0.71~1.00,P = 0.023),PFS分别为8.2个月和8.0个月(HR = 0.87,95%CI:0.73~1.02,P = 0.047),ORR分别为26.1%和17.5%[11]。虽然OS和PFS、ORR等都提示获益,但未达到研究预期。亚组分析显示联合组对于大血管侵犯/肝外转移(HR = 0.78)、肝外转移(HR = 0.78)、HBV相关(HR = 0.75)、AFP>400 ng/ml(HR = 0.67)的HCC患者比单药组获益更高。2024年亚太肝病年会(APSAL)公布了国际多中心的大型Ⅲ期LEAP-002中国人群数据,共纳入了150例中国患者,联合组的mOS为32.3个月,对照组的mOS为26.0个月(HR = 0.76,95%CI 0.50~1.17),提示中国HCC患者对"可乐"组合敏感性可能优于全球人群[12]。此外,也有诸多小样本的ICIs联合小分子TKIs研究报道,如CS1003(PD-1单抗)联合仑伐替尼、特瑞普利单抗联合安罗替尼、派安普利单抗联合安罗替尼、帕博利珠单抗联合瑞戈非尼等,均体现了靶免联合治疗在晚期HCC中的抗肿瘤活性[13,14,15,16]。以期陆续有更多一线免疫联合治疗的Ⅲ期临床试验结果公布(表1)。
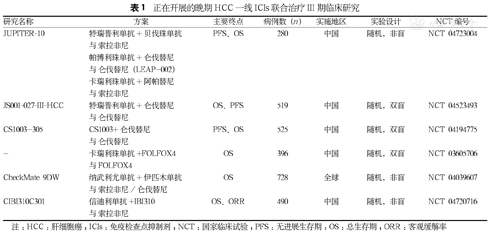
正在开展的晚期HCC一线ICIs联合治疗III期临床研究
正在开展的晚期HCC一线ICIs联合治疗III期临床研究
| 研究名称 | 方案 | 主要终点 | 病例数(n) | 实施地区 | 实验设计 | NCT编号 |
|---|---|---|---|---|---|---|
| JUPITER-10 | 特瑞普利单抗+贝伐珠单抗与 索拉非尼帕博利珠单抗+仑伐替尼与 仑伐替尼(LEAP-002)卡瑞利珠单抗+阿帕替尼与索拉非尼 | PFS、OS | 280 | 中国 | 随机,非盲 | NCT 04723004 |
| JS001-027-III-HCC | 特瑞普利单抗+仑伐替尼与仑伐替尼 | OS、PFS | 519 | 中国 | 随机,双盲 | NCT 04523493 |
| CS1003-305 | CS1003+仑伐替尼与仑伐替尼 | PFS、OS | 525 | 中国 | 随机,双盲 | NCT 04194775 |
| - | 卡瑞利珠单抗+FOLFOX4与 FOLFOX4 | OS | 396 | 中国 | 随机,双盲 | NCT 03605706 |
| CheckMate 9DW | 纳武利尤单抗+伊匹木单抗与 索拉非尼/仑伐替尼 | OS | 728 | 全球 | 随机,非盲 | NCT 04039607 |
| CIBI310C301 | 信迪利单抗+IBI310与 索拉非尼 | OS、ORR | 490 | 中国 | 随机,非盲 | NCT 04720716 |
注:HCC:肝细胞癌;ICIs:免疫检查点抑制剂;NCT:国家临床试验;PFS:无进展生存期;OS:总生存期;ORR:客观缓解率
近期有研究指出,并非所有的PD-1/PD-L1单抗与抗血管药物组合都能够成为一线治疗方案的选择,如在全球性、多中心Ⅲ期COSMIC-312研究中,虽然卡博替尼联合阿替利珠单抗对比索拉非尼的取得了1个主要终点PFS的阳性结果,但另一研究没有达到终点OS(15.4个月与15.5个月,P = 0.438)[17]。综上所述,笔者认为对照组的选择在临床试验中比较重要,但研究对象为HBV相关HCC患者的比例(CARES 310占比74.6%,LEAP-002占比48.6%,COSMIC-312占比29.0%)可能与研究成败具有一定相关性。因此,在选择ICIs联合TKIs的组合应该根据III期临床研究的结果进行分析。而联合治疗的III期注册研究如何设置对照组、设计临床研究终点、纳入更多优势人群以及如何平衡后续治疗对结果的影响同样值得关注[18]。
基于Ⅲ期临床HIMALAYA研究结果显示,度伐利尤单抗(PD-L1单抗)联合替西木单抗(CTLA-4单抗)的双免组合方案一线治疗晚期HCC达到阳性研究终点,双免组与索拉非尼组的mOS分别为16.4个月和13.8个月(P < 0.05),该方案在2022年BCLC分期指南中更新为晚期HCC一线治疗的优选方案[4,19]。此外,我国研发的靶向PD-1和CTLA-4的双特异性抗体AK104和KN046分别联合仑伐替尼治疗晚期一线HCC的Ⅱ期临床研究结果显示ORR分别达44.4%和57.1%,其疾病控制率(disease control rate,DCR)分别为77.8%和95%,初步结果显示出较好的疗效以及可耐受的安全性[20,21]。提示这一类组合也有望成为晚期HCC新的治疗方案。
免疫联合化疗在肺癌、头颈部鳞癌等肿瘤中已取得一线治疗的地位。既往基础研究结果显示,适当化疗可重塑肝癌微环境以及调节抗肿瘤免疫反应[22]。化疗在我国获批一线治疗HCC,但疗效有限。奥沙利铂+亚叶酸钙+5-氟尿嘧啶(FOLFOX4方案)化疗联合ICIs(NCT 03605706)能否为HCC带来生存获益,有待相关研究结果公布。更多晚期一线免疫联合治疗的Ⅲ期研究结果有望在近年公布(表1)。
对于中晚期HCC的治疗,ICIs联合抗血管生成药物、免疫联合小分子TKIs、双免疫联合治疗以及双特异性抗体联合TKIs等联合治疗模式风起云涌,不同方案各具特点,需要综合考虑研究数据、临床经验、患者情况等选择合适的人群,从而让患者最大获益。
近年来,多个一线治疗的Ⅱ、Ⅲ期研究均以索拉非尼为对照,索拉非尼治疗组可获得较为稳定的PFS,而OS开始呈延长趋势。这个现象可能与纳入的患者人群特征、药物毒性管理以及一线治疗进展后治疗的药物日渐增多有关。经索拉非尼一线治疗进展的患者,在选择晚期HCC二线系统治疗方案时有相对丰富的证据[3,4,5]。但随着免疫联合靶向治疗成为一线系统治疗的优选[6,7],之前索拉非尼进展后的二线治疗标准还能否成为当前的二线选择?目前仍缺乏联合治疗模式下的二线证据,甚至连仑伐替尼、免疫单药以及化疗等一线治疗进展后的Ⅲ期临床研究数据也乏善可陈。因此,国内外指南对晚期HCC接受一线免疫联合治疗进展后的后续治疗推荐尚未明确[23,24],亟待突破。
有研究者探索了仑伐替尼治疗HCC进展后的二线治疗候选药物。该回顾性结果显示,仑伐替尼治疗进展后,索拉非尼和瑞戈非尼后续治疗的mPFS分别为1.8个月和3.2个月[25]。此外,索拉非尼或奥沙利铂为基础的化疗治疗进展后,帕博利珠单抗二线治疗亚洲晚期HCC的KN394研究OS、PFS、ORR三终点均有明显差异(P值分别为0.018 0、0.003 2和< 0.000 1)。缓解时间(duration of response,DoR)为23.9个月。KN394研究是首个HCC二线免疫治疗的大型III期随机对照临床研究,其阳性结果有力地验证了帕博利珠单抗在HCC患者中的活性,尤其是在亚太及中国地区患者中[26]。由于纳入部分化疗患者,为化疗后的二线治疗提供了一些证据。但一线仑伐替尼、多纳非尼等TKIs治疗进展后,二线使用ICIs单药治疗晚期HCC需要临床研究进一步验证。
近期对于免疫治疗进展后二线治疗方案的探索研究也有报道。2021年美国临床肿瘤学会胃肠肿瘤研讨会(ASCO-GI)报告了"伊匹木单抗+武利尤单抗/帕博利珠单抗"治疗一线ICIs难治的晚期HCC患者。单中心、回顾性分析了25例既往ICIs治疗进展后接受该治疗的进展期HCC患者。结果显示,ORR为16%,mOS为10.9个月,TTP为2.96个月,值得注意的是CR率为12%。在原发性耐药和获得性耐药患者中ORR相似(16.7%与15.4%),但OS差异较大(4.44个月与11.4个月,P = 0.55),并且肝功能分级与OS显著相关。研究显示该组合具有一定的抗肿瘤活性及较好的生存获益[27]。另一项研究是晚期HCC患者在接受"T+A"组合一线治疗进展后使用TKIs单药治疗的国际多中心回顾性研究。分析49例"T+A"方案进展后二线使用TKI的患者,结果显示仑伐替尼在ORR上优于索拉非尼(15.8%与0,P = 0.062),DCR相当(63.2%与62.1%);仑伐替尼的mPFS显著优于索拉非尼(6.1个月与2.5个月,P = 0.004),mOS差异无统计学意义(16.6个月与11.2个月,P = 0.347)[28]。一项随机对照III期研究-IMbrave251研究(NCT 04770896)也正在探索"T+A"进展后使用"阿替利珠单抗+TKIs"治疗能否进一步给晚期HCC患者带来生存获益。目前,一线HCC的优选方案是免疫联合靶向治疗或双免疫组合治疗,但进展后二线治疗如何选择,是临床医生需要重点考虑以及迫切需要解决的问题。2021年Jin等[29]研究提示EGFR表达阳性的肝癌患者一线仑伐替尼治疗后,再联合应用EGFR抑制剂吉非替尼可以克服肿瘤耐药性,可有效抑制肿瘤进展,ORR高达33.3%。提示对耐药机制的研究或许是未来二线治疗研究的方向。
就国内发表的共识而言,如《肝癌转化治疗中国专家共识(2021版)》以及《肝细胞癌肝切除术后复发预防和治疗中国专家共识(2020版)》就指出系统治疗可更广泛的应用于围手术期HCC的治疗[30,31] ,包括转化治疗、新辅助和辅助治疗。
近年来,HCC转化研究方案集中在"TKIs±ICIs±局部"治疗,其带来的高有效率促进了对不可切除HCC(unresectable HCC,uHCC)转化治疗的探索。在2021年ASCO-GI上更新了一组PD-1抑制剂联合仑伐替尼在uHCC转化治疗上的数据[32],ORR为53.1%,DCR为69.4%,其中15例(30.6%)患者接受了根治性手术。生存结果显示12个月OS率为74.1%,12个月无复发生存期(recurrence free survival,RFS)率为61.1%。另一项回顾性研究结果显示,仑伐替尼、抗PD-1单抗和经动脉化疗(transcatheter arterial chemoembolization,TACE)或肝动脉灌注化疗(hepatic arterial infusion chemotherapy,HAIC)联合治疗的ORR和DCR分别为67.7%和86.5%,转化率为40.5%(15/37)[33]。此外,通过仑伐替尼联合PD-1单抗系统性控制肿瘤、肝动脉灌注化疗局部控制肿瘤实现肿瘤降期,再通过联合肝脏分隔和门静脉结扎的二步肝切除术增加剩余肝脏体积的"双转化"有在个案病例中显示出良好的疗效[34]。这提示可通过结合多种创新治疗手段,扩大转化的人群,同时还需更多循证依据选择患者最大化获益的治疗模式。现阶段对于肝癌的转化治疗仍然存在一些问题,例如目标人群的选择、转化方案的选择、判断是否可切除的标准等尚未统一,转化成功后手术的价值均需要在未来的III期研究中需加以证实。
对于可切除HCC的新辅助治疗同样取得了一定成效。一系列小样本研究提示双免疫抑制剂联合治疗或ICIs+TKIs术前新辅助治疗可有所获益:纳武利尤单抗单药或联合伊匹木单抗治疗,总人群病理缓解率达40%[35];特瑞普利单抗(JS001)单药或联合仑伐替尼、纳武利尤单抗联合卡博替尼以及卡瑞利珠单抗联合阿帕替尼使约1/3的患者获得病理学缓解[36,37,38]。这提示早期使用免疫治疗可能带来更好的疗效。但部分患者存在新辅助治疗失败导致失去手术机会的情况,因此,这种治疗模式的探索受到了一定的限制。
对于HCC术后的辅助治疗,前瞻性LANCE研究探索了TACE联合仑伐替尼治疗术后高危复发HCC患者的疗效以及安全性,中期结果显示,仑伐替尼联合TACE组的中位无病生存期(disease free survival,DFS)显著优于TACE组(17.0个月与9.0个月, P < 0.05)[39]。大规模、全球多中心的临床III期IMbrave050研究是首个证明根治性切除或消融后RFS改善的肝癌辅助治疗的III期临床研究,两组患者术后分别接受"T+A"治疗或主动监测,主要研究终点为独立审查机构(IRF)评估的RFS期。在中期分析中,"T+A"辅助治疗达到了主要终点,并且在具有HCC复发高风险的患者中,IRF评估的RFS与主动监测相比显示出具有统计学意义和临床意义的改善(HR = 0.72,95%CI:0.56~0.93,P < 0.05)[40]。另外,众多术后使用免疫单药、免疫联合小分子靶向药、免疫联合大分子药物辅助治疗的III期研究正在进行中(表2)。
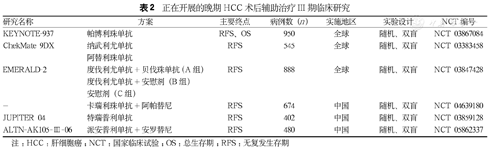
正在开展的晚期HCC术后辅助治疗III期临床研究
正在开展的晚期HCC术后辅助治疗III期临床研究
| 研究名称 | 方案 | 主要终点 | 病例数(n) | 实施地区 | 实验设计 | NCT编号 |
|---|---|---|---|---|---|---|
| KEYNOTE-937 | 帕博利珠单抗 | RFS、OS | 950 | 全球 | 随机、双盲 | NCT 03867084 |
| ChekMate 9DX | 纳武利尤单抗 | RFS | 545 | 全球 | 随机、双盲 | NCT 03383458 |
| 阿替利珠单抗 | ||||||
| EMERALD-2 | 度伐利尤单抗+贝伐珠单抗(A组) | RFS | 888 | 全球 | 随机、双盲 | NCT 03847428 |
| 度伐利尤单抗+安慰剂(B组) | ||||||
| 安慰剂(C组) | ||||||
| - | 卡瑞利珠单抗+阿帕替尼 | RFS | 674 | 中国 | 随机、双盲 | NCT 04639180 |
| JUPITER 04 | 特瑞普利单抗 | RFS | 402 | 中国 | 随机、双盲 | NCT 03859128 |
| ALTN-AK105-Ⅲ-06 | 派安普利单抗+安罗替尼 | RFS | 480 | 中国 | 随机、双盲 | NCT 05862337 |
注:HCC:肝细胞癌;NCT:国家临床试验;OS:总生存期;RFS:无复发生存期
局部治疗是HCC的重要治疗手段,具有较高的缓解率,但HCC的高复发和转移率一直是限制TACE、放疗等局部治疗手段获得长期疗效的关键因素。近年来,随着系统治疗的进展以及局部治疗与系统治疗的协同效应,使得这种联合模式在HCC治疗中逐步成为热点。通过与局部治疗的合理结合,为HCC患者提供了更多有效治疗方式的选择。真实世界中,HCC治疗已然进入免疫+靶向+局部治疗的"免疫3.0时代"。
对于中期HCC,TACE/HAIC联合TKIs或ICIs的治疗方案具有一定前瞻性。局部治疗后序贯系统治疗,以及系统治疗同时联合局部治疗已经在HCC治疗中显示出了亮眼的疗效和安全性。TACE或载药微球栓塞(DEB-TACE)后序贯帕博利珠单抗治疗BCLC-B期HCC的Ib期研究(PETAL研究)以及TACE联合仑伐替尼治疗uHCC患者的前瞻性Ⅱ期研究(TACTICS-L研究)均显示一定的潜力[41,42]。在一项评估TACE联用索拉非尼对比单用TACE治疗uHCC的疗效与安全性的TACTICS研究中,联合组可为uHCC患者带来显著的PFS获益,可将OS延长至3年以上[43],但TKI联合TACE在uHCC的确切疗效仍需理性看待。TACE与TKI如何联合,包括联合的顺序、时间间隔、治疗周期、TKI的最佳剂量以及按需TACE与精细TACE的标准等,TACE与不同TKI的适用人群、排除后续治疗对OS的影响以及选择有效的评价标准均值得进一步探索。中期HCC存在较大的异质性,应个体化选择合适的治疗方案。对于中期HCC的治疗,随着系统治疗的前移,以TACE为代表的局部治疗在联合靶向或免疫治疗后,患者能否获得更长的生存获益需要循证依据证实。
晚期HCC治疗已不再局限于靶向免疫药物的单药治疗,越来越多的研究证实系统治疗联合局部治疗能改善晚期HCC患者的生存。一项回顾性研究显示,TACE+仑伐替尼较单独TACE显著延长uHCC患者生存,2年OS率分别为79.8%和49.2%(P < 0.05)[44]。III期前瞻性LAUNCH研究显示,TACE+仑伐替尼一线治疗晚期HCC对比仑伐替尼,mPFS(10.6个月与6.4个月,P < 0.001)以及mOS(17.8个月与11.5个月, P < 0.001)均显著改善[39]。这些研究进一步验证了以仑伐替尼为基础的联合治疗可能是晚期HCC的一种有前景的治疗方法,可通过前瞻性随机对照研究来进一步验证。此外,仑伐替尼+特瑞普利单抗+HAIC一线治疗晚期HCC的前瞻性Ⅱ期LTHAIC研究的结果显示,6个月PFS率为80.6%,mPFS为10.5个月,ORR为63.9%,与回顾性研究一致[45,46]。
而更多联合治疗模式的研究设计是针对中期和晚期HCC患者。最近一项随机、双盲、安慰剂对照、多中心Ⅲ期EMERALD-1研究以既往未接受过TACE或系统治疗的HCC患者为研究对象,评估了在接受传统TACE或经动脉药物洗脱微球化疗栓塞术(DEB-TACE)联合"度伐利尤单抗±贝伐珠单抗"治疗后的疗效和安全性[47]。研究纳入了近60%的中期HCC患者(BCLC B期)以及15%左右的晚期HCC(BCLC C期)患者。研究共616例患者随机均分为3组:1组为TACE+度伐利尤单抗,最后一次TACE后给予度伐利尤单抗+安慰剂;2组为TACE+度伐利尤单抗,最后一次TACE后给予度伐利尤单抗+贝伐珠单抗;3组为TACE+安慰剂,最后一次TACE后给予安慰剂+安慰剂。研究结果显示,与单用TACE相比,度伐利尤单抗+TACE+贝伐珠单抗的PFS明显提高(15.0个月与8.2个月;HR = 0.77,P < 0.05),而度伐利尤单抗+TACE的mPFS相比单用TACE并无显著性提高(10.0个月与8.2个月;HR = 0.94,P = 0.638)。三联方案具有协同增效作用,在生存获益上更具优势,这也为临床治疗选择和未来探索带来启示。目前,针对中晚期HCC还有几项国际多中心随机对照的III期研究正在进行,如"可乐"+TACE(LEAP 012)、纳武利尤单抗+伊匹木单抗+TACE(CheckMate 74W)以及阿"T+A"+TACE(ML42612/TALENTACE)(表3)。期望这些结果的公布能为中晚期HCC的治疗带来新的选择。尽管如此,局部治疗联合系统治疗的模式仍需要不断探索和规范。
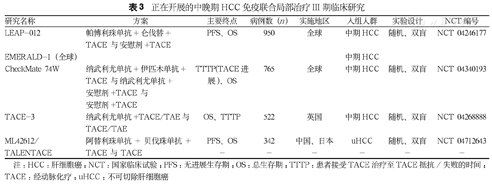
正在开展的中晚期HCC免疫联合局部治疗III期临床研究
正在开展的中晚期HCC免疫联合局部治疗III期临床研究
| 研究名称 | 方案 | 主要终点 | 病例数(n) | 实施地区 | 入组人群 | 实验设计 | NCT编号 |
|---|---|---|---|---|---|---|---|
| LEAP-012 | 帕博利珠单抗+仑伐替+TACE与 安慰剂+TACE | PFS、OS | 950 | 全球 | 中期HCC | 随机、双盲 | NCT 04246177 |
| EMERALD-1(全球) | 中期HCC | ||||||
| CheckMate 74W | 纳武利尤单抗+伊匹木单抗+TACE与 纳武利尤单抗+安慰剂+TACE与安慰剂+TACE | TTTP(TACE进展)、OS | 765 | 全球 | 中期HCC | 随机、双盲 | NCT 04340193 |
| TACE-3 | 纳武利尤单抗+TACE/TAE与TACE/TAE | OS、TTTP | 522 | 英国 | 中期HCC | 随机、双盲 | NCT 04268888 |
| ML42612/ | 阿替利珠单抗+贝伐珠单抗+ | PFS、OS | 342 | 中国、日本 | uHCC | 随机、双盲 | NCT 04712643 |
| TALENTACE | TACE 与 TACE | - | - | - | - | - | - |
注:HCC:肝细胞癌;NCT:国家临床试验;PFS:无进展生存期;OS:总生存期;TTTP:患者接受TACE治疗至TACE抵抗/失败的时间;TACE:经动脉化疗;uHCC:不可切除肝细胞癌
我国HCC发生率高、具有异质性、转移复发率高、预后差,这是严重影响我国国民身体健康。虽然免疫联合治疗为中晚期HCC系统治疗带来突破性进展,但临床仍有许多尚待解决的问题,如不同联合治疗方案如何选择、一线治疗进展后二线治疗方案的选择、局部治疗与系统治疗的联合次序、新型靶点的开发以及治疗优势人群的探索等,HCC治疗已迈入攻坚阶段。因此,进一步探寻TKIs和ICIs耐药或无效的机制、HCC分子特征和发生发展机制以及潜在的联合治疗靶点等,以最大限度提升HCC临床治疗效果是未来重要研究方向之一。应继续加强对HCC的异质性研究、基础肝病管理,重视药物不良反应管理,结合循证证据,多维度思考、多模式联合、多学科合作,融入HCC患者全程、全方位治疗;通过积极加强临床专家与基础医学专家的交流合作,结合人工智能、高通量多组学检测、单细胞及示踪技术以及精准的基因编辑等技术以实现精准化、个体化治疗,高效实现基础科研向临床转化,必将降低中晚期HCC的死亡率,助力实现"健康中国2030"规划纲要中的"到2030年,总体癌症5年生存率提高15%"的目标和任务。
袁振刚,叶胜龙.肝细胞癌系统治疗策略:现状和前景[J].中华肝脏病杂志, 2024, 32(6):565-571. DOI:10.3760/cma.j.cn501113-20240412-00200.
所有作者均声明不存在利益冲突
感谢王亚林医生在文献检索、资料整理等方面的帮助



























