
耐药皮肤癣菌感染是近期临床微生物领域与皮肤病领域关注的热点。我国已经出现耐药皮肤癣菌感染病例,预示存在人群传播的风险。中国中西医结合学会皮肤性病学分会真菌学组、中国耐药皮肤癣菌病诊治与防控工作组组织专家基于已有的循证医学证据和研究数据,对耐药皮肤癣菌的病原学、流行病学、菌株鉴定、体外药物敏感性试验以及耐药皮肤癣菌感染的诊断、治疗和防控提出推荐建议,制订了完整的诊治方案,以期为我国耐药皮肤癣菌感染的临床诊治与防控提供科学参考。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
近年来,耐药皮肤癣菌感染成为国际关注的热点,尤其是印度毛癣菌出现耐药或多重耐药甚至泛耐药,导致治疗困难,我国目前也已发现临床感染病例[1,2,3]。由于致病菌鉴定困难,临床容易漏检和漏诊,社会人群感染报道正在增多,亟需加强对耐药皮肤癣菌感染的规范化诊疗与防控,遏制耐药菌的发生和进一步传播[4,5]。为此,中国中西医结合学会皮肤性病学分会真菌学组、中国耐药皮肤癣菌病诊治与防控工作组组织专家针对耐药皮肤癣菌的病原学、流行病学、菌株鉴定、药物敏感性试验、诊断、治疗、预防和监测等内容提出推荐建议,并基于已有的循证医学证据,立足我国临床诊疗现状,共同制订本共识。
皮肤癣菌病是最常见的浅表真菌感染性疾病,影响全球20% ~ 25%的人群[6]。皮肤癣菌按菌落特征及大分生孢子的形态特征分为毛癣菌属(Trichophyton)、表皮癣菌属(Epidermophyton)、小孢子菌属(Microsporum)、奈尼兹皮菌属(Nannizzia)等,其中我国最常见的致病皮肤癣菌依次为红色毛癣菌(Trichophyton rubrum)、须癣毛癣菌/趾间毛癣菌复合群(Trichophyton mentagrophytes/interdigitale complex)及犬小孢子菌(Microsporum canis)等[7]。2017年以前,世界范围内已经出现对特比萘芬(terbinafine,TBF)耐药的红色毛癣菌[8]、犬小孢子菌[9]、断发毛癣菌(Trichophyton tonsurans)[10]以及须癣毛癣菌/趾间毛癣菌复合群[11]感染的报道,但数量较少[12]。2017年以后,印度报道了大量引起皮肤慢性泛发性感染、对特比萘芬耐药及多重耐药的皮肤癣菌,该菌最初经内转录间隔区序列(internal transcribed spacer,ITS)鉴定为须癣毛癣菌基因型Ⅷ(T.mentagrophytes Ⅷ)[13],2020年根据其表型与分子分型被归类为须癣毛癣菌/趾间毛癣菌复合群中的一个新种,由日本学者命名为印度毛癣菌(T. indotineae)[14]。最新研究支持印度毛癣菌属于须癣毛癣菌的一个变种,并建议称为须癣毛癣菌印度变种(T. mentagrophytes var. indotineae)[15],但学界尚未统一。目前,印度毛癣菌是导致皮肤癣菌耐药问题的最主要致病菌[16]。
推荐1 根据基因组学及分子学特征,须癣毛癣菌基因型Ⅷ作为新种仍存在争议,但鉴于印度毛癣菌的名称已被各界及文献广泛使用,以及其较特殊的临床致病特征,在本共识中我们倾向于使用印度毛癣菌这个名称[1,17]。
随着世界范围内皮肤癣菌流行病学的变化,红色毛癣菌、须癣毛癣菌/趾间毛癣菌复合群的感染率逐渐增加,成为全球皮肤癣菌感染的主要菌种[18]。在我国,红色毛癣菌仍是皮肤癣菌感染的首要病原菌[7]。在印度,须癣毛癣菌/趾间毛癣菌复合群已取代红色毛癣菌,占比高达40% ~ 97%,成为印度皮肤癣菌感染最常见的致病菌[19]。其中,须癣毛癣菌基因型Ⅷ(即印度毛癣菌)存在较高的耐药率,该菌正在向全球播散,以致耐药问题持续加剧。迄今,印度以外的亚洲、欧洲、美洲等20多个国家均出现印度毛癣菌感染的病例报道,包括亚洲的伊朗、伊拉克、利比亚、沙特阿拉伯、巴基斯坦、阿曼、叙利亚、斯里兰卡、也门、孟加拉国、泰国、尼泊尔、缅甸、柬埔寨、越南和日本等,欧洲的比利时、丹麦、芬兰、法国、德国、希腊和瑞士,以及美国、加拿大、澳大利亚和埃塞俄比亚等,遍及五大洲,提示印度毛癣菌已在世界范围内存在流行[16,20,21]。在已报道的国家中,输入性病例占据一定比例,主要考虑与跨国旅行和移民相关[22]。同时存在无相关旅居史的本土家庭聚集感染病例,提示印度毛癣菌在本土的人际传播已开始。目前,倾向将印度毛癣菌归类为亲人性皮肤癣菌,主要引起人与人之间的传播,而人畜间的传播状况尚不清楚,仅存在动物(牛和狗)感染的个案报道[23]。我国蒋燕萍等[24]从来华的印度籍体癣患者中分离出2株印度毛癣菌,其中1株存在特比萘芬耐药。刘维达团队等[3]2022年首次从中国本土体股癣患者中分离出多重耐药的印度毛癣菌。
推荐2 鉴于印度次大陆国家已经广泛出现印度毛癣菌感染,世界多国已出现输入与本土病例,并且中国本土感染病例也已出现,提示我国存在印度毛癣菌感染传播加剧的公共卫生风险[25],值得我国医务人员重视与警惕。
目前报道最多的耐药皮肤癣菌感染仍是由印度毛癣菌引起。印度毛癣菌主要引起股癣、体癣、面癣,较少引起甲癣和足癣,目前未见引起头癣的报道,常导致多部位、泛发性、难治性感染,临床主要表现为有活动性边缘的大片红斑伴脱屑,可呈叠瓦癣样外观,也可出现丘疹、脓疱、苔藓化等改变,常伴有严重瘙痒[19,26]。病程一般为3周至5年,平均8个月左右[27]。此外,半数以上患者曾因外用糖皮质激素类药物治疗,出现萎缩纹、色素减退等皮疹[28]。误用糖皮质激素类药物,不仅会使皮疹表现不典型,导致诊断困难,还能抑制皮肤的正常免疫功能,皮损难治愈和疾病易复发[29]。迄今,尚未见系统免疫受损人群对耐药皮肤癣菌更易感染的证据。其他耐药皮肤癣菌感染的报道少见,耐药红色毛癣菌可引起难治性甲癣、足癣和体癣等[30];而耐药犬小孢子菌主要分离自动物(猫),目前未见人类感染的病例报道[9]。耐药断发毛癣菌感染可存在于股癣[31]和头癣[32]患者中。我国已报道的印度毛癣菌感染病例主要表现为体股癣[25],同国外报道病例的临床表现类似,尚未见国内耐药红色毛癣菌、犬小孢子菌以及断发毛癣菌感染人的病例报道。
推荐3 对于存在难治性、复发性及泛发性体癣与股癣患者,应考虑耐药皮肤癣菌(尤其是印度毛癣菌)感染的可能[29];对于难治性足癣、甲癣等应考虑耐药红色毛癣菌感染的可能[30]。需及时完善病原学检查和体外药物敏感性试验,获取病原学及耐药证据。
病原菌镜检与分离培养应遵循皮肤癣菌镜检、分离与培养的基本原则[33]。
推荐4 真菌镜检:刮取皮损边缘鳞屑,应避开炎症较为剧烈的水疱、脓疱区域,刮取相对干燥的鳞屑或疱壁。标本置于载玻片上,加10% KOH溶液后覆盖玻片,放置数分钟或稍加热后显微镜下观察。阳性表现为有折光、细长、平滑、分枝分隔菌丝和/或关节孢子。也可采用荧光染色镜检,滴加真菌荧光染液后覆盖玻片,在荧光显微镜下观察,菌体(孢子或菌丝)呈蓝色或绿色荧光,可提高镜检阳性率。
推荐5 真菌培养:刮取皮损边缘鳞屑接种于含氯霉素和放线菌酮的沙堡弱葡萄糖琼脂培养基(SDA)可以减少培养过程中的细菌和其他腐生丝状真菌的污染,于25 ~ 28 ℃培养14 ~ 28 d。根据菌落形态、镜下结构及生理生化试验进行皮肤癣菌表型鉴定。
推荐6 必要时,皮肤镜及反射式共聚焦显微镜可用于辅助诊断,可能有助于发现感染线索[34];组织病理检查一般不作为常规检查,除非怀疑皮肤癣菌深部感染。
根据菌落形态、镜下结构及生理生化试验进行皮肤癣菌表型初步鉴定,采用ITS分子测序鉴定,基质辅助激光解析电离飞行时间质谱(MALDI-TOF MS)亦有助于皮肤癣菌种水平的快速鉴定。
推荐7 印度毛癣菌与须癣毛癣菌、趾间毛癣菌形态相似,印度毛癣菌在28 ℃、SDA培养基上培养2周,生长良好,培养物正面呈白色、扁平、绒毛样或粉末样外观,反面呈浅棕色至橘黄色外观,小培养示大量球形至梨形小分生孢子,偶见螺旋菌丝。印度毛癣菌吐温-80试验、毛发穿孔试验、角蛋白酶降解试验及尿素酶分解试验的阳性率均低于须癣毛癣菌和趾间毛癣菌[35],难以仅通过形态学和生理生化试验进行准确鉴定。对于鉴定为须癣毛癣菌/趾间毛癣菌复合群的菌株,建议完善分子鉴定[36]。耐药的红色毛癣菌、犬小孢子菌及断发毛癣菌形态学及生理生化鉴定同野生型菌株暂无差异性报道。
推荐8 菌株可采用ITS进行分子测序鉴定,测序后的序列可通过上传NCBI官网(网址:https://blast.ncbi.nlm.nih.gov/Blast.cgi)或者荷兰CBS-KNAW菌种保藏中心(https://wi.knaw.nl/Pairwise_alignment)进行比对。ITS序列可以参考印度毛癣菌标准菌株CBS146623(参考GenBank序列号NR_173767.1),红色毛癣菌参考标准菌株CBS 392.58(参考GenBank序列号NR_131330.1),犬小孢子菌参考标准菌株CBS 496.86(参考GenBank序列号NR_131265.1)及断发毛癣菌参考标准菌株CBS 496.48(参考GenBank序列号NR_144891.1)。如有条件,可通过基因测序构建系统进化树,准确率较高,常用引物包括ITS-1:5′-TCCGTAGGTGAACC TGCGG-3′,ITS-4:5′-TCCTCCGCTTATTGATATGC-3′等[35]。
推荐9 在具备条件的实验室,对形态学鉴定为须癣毛癣菌/趾间毛癣菌复合群的菌株可进行MALDI-TOF MS鉴定[37]。步骤简单,结果回报快,准确率高(96.97%),能实现与其他皮肤癣菌的鉴别[36]。
美国临床和实验室标准协会(clinical and laboratory standards institute,CLSI)以及欧洲抗微生物药物敏感试验委员会(European committee on antimicrobial susceptibility testing,EUCAST)已建立抗真菌药敏试验的标准方法[38,39]。EUCAST方法(EUCAST-E.Def 11.0)与CLSI方法(CLSI-M38M51S-Ed3)存在差异,但两种方法得到的最小抑菌浓度(Minimum inhibitory concentration,MIC)结果存在较好一致性。为指导治疗,建议有条件的实验室积极开展皮肤癣菌的抗真菌体外药敏试验。目前,适用于我国皮肤癣菌的体外药敏试验操作规范、流行病学界值和临床界值尚在制订中。参考EUCAST给出暂定的印度毛癣菌和红色毛癣菌的流行病学界值(ECOFF),印度毛癣菌野生型(WT)阿莫罗芬、特比萘芬、伊曲康唑和伏立康唑的MIC分别≤ 0.5 mg/L、0.125 mg/L、0.25mg/L和1 mg/L[40]。目前,我国已报道的2株耐药印度毛癣菌菌株的MIC分别为1株特比萘芬4 mg/L[24],另1株为特比萘芬> 32 mg/L和伊曲康唑1 mg/L[3]。
推荐10 对于存在难治性、复发性、泛发性皮肤癣菌病,建议进行体外药敏试验。
推荐11 有条件的实验室,建议对可疑耐药的皮肤癣菌分离株进行体外药敏试验;可疑耐药的须癣毛癣菌/趾间毛癣菌复合群等分离株还可选用含0.2 mg/L特比萘芬的葡萄糖琼脂培养基进行筛选培养[29]。
推荐12 耐药须癣毛癣菌/趾间毛癣菌复合群可能为印度毛癣菌,需采用分子或质谱方法进一步鉴定;一旦发现印度毛癣菌导致的皮肤感染,建议进行体外药敏试验。
印度数据提示,近75%的印度毛癣菌在体外常显示对特比萘芬高度耐药,少数菌株对伊曲康唑和伏立康唑耐药[29]。目前菌株耐药原因尚未明确阐释,倾向于认为与抗真菌药物不规范使用及局部使用抗真菌药-糖皮质激素复合制剂有关[2,41]。特比萘芬耐药性主要与其作用靶酶角鲨烯环氧化酶(Squalene epoxidase,SQLE)基因位点突变有关,引起氨基酸替换并导致蛋白构象变化,进而影响特比萘芬与该靶酶结合。Phe397Leu、Leu393Phe和Leu393Ser的氨基酸替换在耐药菌株中最常见,且与特比萘芬高耐药有关,多表现为MIC ≥ 1 mg/L[23];其次是Leu335Phe、Ser395Pro、Gln408Leu、His440Tyr和Ser443Pro等,表现为MIC 0.2 ~ 1 mg/L[29];Val441Leu和Lys276Asn等也有报道,但它们对SQLE构象的影响较小,其突变株的MIC低于0.2 mg/L,与野生型菌株相似[21]。已有证据提示,唑类耐药与CYP51A/B基因高表达有关[42]。我国已报道印度毛癣菌感染病例,显示同时存在SQLE基因突变(Phe397Leu)和CYP51A/B高表达[3]。另外,特比萘芬耐药的红色毛癣菌也出现SQLE基因突变并导致氨基酸替换,包括Leu393Phe、Leu393Ser、Phe397Leu、Phe397Ile、Phe397Val、Phe415Ile、Phe415Ser、Phe415Val以及His440Tyr等[13],断发毛癣菌为Leu393Phe等[10],而犬小孢子菌为ATP结合盒转运蛋白(ATP-binding cassette transporter,ABC)家族过表达[43]。红色毛癣菌亦存在唑类耐药报道,其主要和ABC以及主要协同转运蛋白超家族(major facilitator superfamily)过表达等有关[44]。
推荐13 有条件的实验室,对存在可疑耐药的皮肤癣菌进行耐药基因检测,有助于确认菌株存在耐药表型证据、发现新的耐药位点及获取耐药分子流行病学规律(已报道的耐药皮肤癣菌氨基酸替换及基因突变位点见表1)。
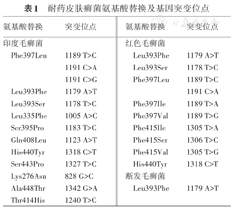
耐药皮肤癣菌氨基酸替换及基因突变位点
耐药皮肤癣菌氨基酸替换及基因突变位点
| 氨基酸替换 | 突变位点 | 氨基酸替换 | 突变位点 |
|---|---|---|---|
| 印度毛癣菌 | 红色毛癣菌 | ||
| Phe397Leu | 1189 T>C | Leu393Phe | 1179 A>T |
| 1191 C>A | Leu393Ser | 1178 T>C | |
| 1191 C>G | Phe397Leu | 1189 T>C | |
| Leu393Phe | 1179 A>T | 1191 C>A | |
| Leu393Ser | 1178 T>C | Phe397Ile | 1189 T>A |
| Leu335Phe | 1005 A>C | Phe397Val | 1189 T>G |
| Ser395Pro | 1183 T>C | Phe415Ile | 1305 T>A |
| Gln408Leu | 1123 A>T | Phe415Ser | 1306 T>C |
| His440Tyr | 1318 C>T | Phe415Val | 1305 T>G |
| Ser443Pro | 1327 T>C | His440Tyr | 1318 C>T |
| Lys276Asn | 828 G>C | 断发毛癣菌 | |
| Ala448Thr | 1342 G>A | Leu393Phe | 1179 A>T |
| Thr414His | 1240 T>C |
针对耐药皮肤癣菌感染,建议根据体外药敏结果与患者治疗反应等因素选择最优治疗方案。如果实验室无条件进行菌种鉴定与体外药敏试验,针对可疑耐药菌感染可经验性选择治疗药物。根据最新诊疗指南,经规范治疗(单独外用药、口服特比萘芬或伊曲康唑、口服联合外用药)2 ~ 4周仍未愈,或经多次规范治疗仍反复的体股癣等,需怀疑耐药皮肤癣菌感染[45]。多数印度毛癣菌感染者外用和口服特比萘芬的疗效欠佳,可经验性优先选择伊曲康唑等唑类药物治疗[46,47]。唑类耐药的印度毛癣菌目前也有少量报道[48]。目前国内尚无耐药皮肤癣菌引起甲癣的报道,国外有病例报道[13,49]。
基于已公开的循证医学数据,针对耐药(或可疑耐药)皮肤癣菌感染患者,治疗策略如下(具体用药方案参考见表2):①可疑特比萘芬耐药的皮肤癣菌感染患者,优先选择口服伊曲康唑200 mg/d治疗,4周无效(皮疹消退<50%或真菌学检查仍阳性)的患者,可延长至8周(或以上),延长治疗时间可能提高治愈率[46,47];②伊曲康唑口服剂量增加至200 mg每日2次,可能提高治愈率,但需更多的循证数据[3,22];③特比萘芬耐药菌株感染,增加特比萘芬的剂量(250 mg每日2次)或延长用药时间可能有效,但需更多的循证数据[27,50];④口服伊曲康唑和特比萘芬治疗效果均不佳,可结合体外药敏试验尝试选择新型抗真菌药物,如伏立康唑或雷夫康唑等[14,51];⑤一般认为红色毛癣菌、须癣毛癣菌/趾间毛癣菌复合群对氟康唑存在可预期耐药,口服氟康唑5 mg·kg-1·d-1治疗8周可能有效[47];⑥灰黄霉素10 ~ 20 mg·kg-1·d-1治疗2 ~ 6个月可能有效[52,53];⑦仅局部用药(如卢立康唑[54]、环吡酮胺[22]及伏立康唑[55])治愈的病例较少,一般建议联合系统抗真菌药[56];⑧口服抗真菌药治疗过程中应监测药物不良反应,注意药物相互作用,兼顾个体用药差异,超剂量使用应获取患者知情同意。
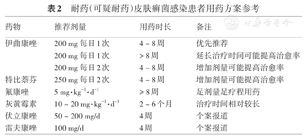
耐药(可疑耐药)皮肤癣菌感染患者用药方案参考
耐药(可疑耐药)皮肤癣菌感染患者用药方案参考
| 药物 | 推荐剂量 | 用药时长 | 备注 |
|---|---|---|---|
| 伊曲康唑 | 200 mg每日1次 | 4 ~ 8周 | 优先推荐 |
| 200 mg每日1次 | > 8周 | 延长治疗时间可能提高治愈率 | |
| 200 mg每日2次 | 4 ~ 8周 | 增加剂量可能提高治愈率 | |
| 特比萘芬 | 250 mg每日2次 | 4 ~ 8周 | 增加剂量可能提高治愈率 |
| 氟康唑 | 5 mg·kg-1·d-1 | ≥ 8周 | 足剂量足疗程用药 |
| 灰黄霉素 | 10 ~ 20 mg·kg-1·d-1 | 2 ~ 6个月 | 治疗时间相对较长 |
| 伏立康唑 | 50 ~ 200 mg/d | 4周 | 个案报道 |
| 雷夫康唑 | 100 mg/d | 4周 | 个案报道 |
推荐14 在无条件进行体外药敏试验的情况下,针对可疑特比萘芬耐药皮肤癣菌感染的患者,建议选择口服伊曲康唑200 ~ 400 mg/d,治疗4 ~ 8周,经治疗皮疹消退<50%或真菌学检查仍阳性的患者,可延长治疗时间。
推荐15 特殊人群的治疗[52,56]:妊娠及哺乳期用药应参考美国食品药品监督管理局(food and drug administration,FDA)的妊娠期药物安全分级标准,权衡利弊后可暂姑息外用药治疗,情况允许时再系统治疗。老年人除了感染部位及受累面积外,还需兼顾合并症和药物相互作用等因素。有严重基础病而不适合系统用药的患者,可暂局部保守治疗。对低龄儿童应按照药品说明书建议年龄范围用药,需监护人知情同意。印度毛癣菌导致甲癣与足癣时,需要积极规范治疗,以降低体股癣的发生率或复发率[57,58]。免疫缺陷人群的疗程应适当延长并个体化,同时积极纠正免疫缺陷状态。特殊人群系统用药、长时间用药及较高剂量用药,均需密切监测药物不良反应。
患者的疗效与预后需要根据临床症状改善情况、真菌学检查及随访观察确定是否治愈。
推荐16 原发皮损完全消退,真菌镜检和培养为阴性,并且停止治疗后,随访4周以内未再复发,可视为治愈[19]。
推荐17 治疗结束后数周(4周以上)再次出现症状,应按初治原则继续治疗,治愈判断标准同初次治疗[41]。
皮肤癣菌病是最常见的真菌感染性疾病,虽较少危及生命,但影响广大患者的生活质量。印度毛癣菌为代表的耐药皮肤癣菌的传播将导致难治性和复发性皮肤癣菌感染的比例升高,并且该菌存在特比萘芬或多药耐药,若广泛传播将有可能成为公共卫生问题。
推荐18 ①建议患者注意个人卫生,尽量避免共用公共浴室、按摩店等存在密切接触的物品(如公用座椅、按摩床、休息床上的铺巾);②避免和其他人混用衣物毛巾,内衣应定期洗晒煮烫等消毒处理;③家庭成员有类似感染时,应同时治疗;④因治疗疗程较长,需特别加强健康教育,以提高用药依从性;⑤加强科教宣传,避免滥用糖皮质激素和抗真菌药等非处方类外用药。
推荐19 临床诊疗人员须重视菌株分子鉴定,及时发现印度毛癣菌或其他耐药皮肤癣菌。对难治性、复发性皮肤癣菌感染患者或有印度次大陆旅居史患者,培养或质谱鉴定为须癣毛癣菌/趾间毛癣菌复合群,抗真菌药敏试验提示耐药(尤其是特比萘芬耐药)菌株感染的患者需高度警惕。
推荐20 有条件的医疗机构或单位需进行耐药皮肤癣菌感染的流行病学调查和监测。我国是人口大国,印度毛癣菌在我国已存在局域流行[25],应积极开展流调并构建全国皮肤癣菌耐药监测网络,以明确致病菌谱现况及解析耐药变化规律。
耐药皮肤癣菌可能导致难治性的皮肤癣菌感染,并波及广泛人群,医疗机构及皮肤科医务工作者都应该做好诊疗准备。考虑国内实际情况,本共识基于有限的文献和证据,初步进行耐药皮肤癣菌感染相关证据的归纳,并给予有限的临床诊疗推荐。未来,工作组将根据临床证据更新情况、国内感染状况变化等进行必要的更新,积极制订适用于我国皮肤癣菌的体外药敏实验操作规范、流行病学临界值和临床界值。基于已有的证据和经验,希望业界增强对耐药皮肤癣菌及其感染的了解、检测、鉴定、诊治、防控等能力,使其处于专业可控的状态。
需要指出,本共识是前瞻性的诊疗共识,旨在我国耐药皮肤癣菌(尤其是印度毛癣菌)感染状况加剧之前,做好预警和相关专业的技术储备,以期降低我国耐药皮肤癣菌感染的公共卫生风险,减少因防控、治疗不及时而导致的卫生资源消耗,服务我国广大皮肤癣菌感染患者或潜在的患者。
本共识制订组织者:刘维达(中国医学科学院皮肤病医院)
顾问:李若瑜(北京大学第一医院)、温海(上海长征医院)、顾军(同济大学附属第十人民医院)、冉玉平(四川大学华西医院)、席丽艳(中山大学孙逸仙纪念医院)、李福秋(吉林大学第二医院)、章强强(复旦大学附属华山医院)
参与编写的专家(按姓氏拼音为序):曹存巍(广西医科大学第一附属医院)、冯佩英(中山大学附属第三医院)、付萌(空军军医大学西京皮肤医院)、蒋燕萍(贵州医科大学附属医院)、李珊山(吉林大学第一医院)、李筱芳(中国医学科学院皮肤病医院)、梁官钊(中国医学科学院皮肤病医院)、刘红芳(南方医科大学皮肤病医院)、刘泽虎(杭州市第三人民医院)、吕雪莲(首都医科大学附属北京安贞医院)、帕丽达·阿布利孜(新疆医科大学第一附属医院)、潘炜华(上海长征医院)、桑红(东部战区总医院)、佘晓东(中国医学科学院皮肤病医院)、史冬梅(济宁市第一人民医院)、童中胜(武汉市第一医院)、王爱平(北京大学第一医院)、王玲(大连市皮肤病医院)、肖媛媛(首都医科大学附属北京儿童医院)、杨洁(海南省第五人民医院)、杨连娟(上海市皮肤病医院)、余进(北京大学第一医院)、占萍(江西中医药大学附属医院)、张思平(中国科学技术大学附属第一医院)、张宇(天津市中医药研究院附属医院)、朱红梅(上海长征医院)、朱敏(复旦大学附属华山医院)
执笔:李筱芳、梁官钊
工作秘书:孔雪(中国医学科学院皮肤病医院)、宋歌(首都医科大学附属北京世纪坛医院)
本共识内容仅代表专家组对耐药皮肤癣菌感染诊治与防控的指导意见。疾病的诊治需遵循个体化原则,本共识所提供的建议并非强制性意见。临床实践中与本共识不一致的做法并不等同于错误或不当
参与本共识制订的人员均声明无利益冲突



























