
皮肤结核是由结核分枝杆菌复合群引起的慢性感染性皮肤病,临床表现多样,诊断困难,延误诊断可能导致皮肤与软组织损毁,其诊断需要综合临床、病理、实验室检查等指标综合判断。皮肤结核治疗疗程长且需要多种抗生素联合治疗,早期规范的诊疗是保证良好预后的关键。本共识在参考国内外皮肤结核与结核相关文献、指南基础上编写,旨在规范皮肤结核诊疗流程,提高皮肤结核的治疗效果。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
皮肤结核(cutaneous tuberculosis)是由结核分枝杆菌复合群引起的慢性感染性皮肤病。由于皮损表现多样,无明显特异性,早期识别和诊断较为困难,病情持续进展可引起皮肤及皮下组织残毁,甚至继发肿瘤性皮肤病[1,2,3]。为规范皮肤结核诊疗流程,提高对皮肤结核的诊治能力,由中国"一带一路"皮肤病专病联盟分枝杆菌病研究联盟、中国麻风防治协会皮肤性病检验与诊断分会邀请相关领域专家,针对皮肤结核临床诊疗策略进行讨论,结合临床经验及国内外皮肤结核病研究进展制订本专家共识。
中国结核病新发病例负担位列全球第3位,病例数占全球总数的7.4%[4]。皮肤结核是一种较为少见的肺外结核,占所有肺外结核的1% ~ 2%[5]。在内脏结核患者中,仅3.51%合并皮肤结核[6]。皮肤结核的病原体多为人型结核分枝杆菌,偶尔由牛型结核分枝杆菌引起[7]。皮肤结核在全球多地均有报告,我国皮肤结核分离株谱系与肺结核菌株谱系分布基本一致,多属于Lineage 2.2(北京型),少数为Lineage 4[8,9]。分离株耐药率低,其中50%以上为单药耐药,以耐链霉素、异烟肼为主[8,9]。多数皮肤结核患者免疫力正常,但不同类型皮肤结核患者合并肺结核或其他内脏结核的概率有差异(见"皮肤结核诊断指标-临床表现")。
结核分枝杆菌是一种生长缓慢、兼性细胞内寄生的需氧杆菌,致病性强。其菌体结构复杂,包含胞壁脂质、脂蛋白、蛋白分泌系统等多种毒力相关因子,能够影响细胞功能和炎症反应,与分枝杆菌药物耐受性相关。结核分枝杆菌感染结局在不同感染对象或单个感染者中有一定异质性,是宿主免疫反应、细菌菌株和接触程度等因素共同作用的结果。在免疫力正常的宿主中,结核分枝杆菌感染细胞后发出趋化因子和细胞因子信号,吸引单核细胞、巨噬细胞、中性粒细胞和树突细胞在感染部位聚集。巨噬细胞是结核分枝杆菌复制的主要生态位,结核感染导致巨噬细胞抗原呈递受损,并通过多种机制对抗吞噬体环境,利用多种毒力因子诱导巨噬细胞坏死,促进结核分枝杆菌传播。随着细胞免疫的启动,局部的促炎反应导致募集更多的单核细胞和淋巴细胞迁移到感染部位,聚集在被感染的巨噬细胞周围,形成肉芽肿结构。结核分枝杆菌在肉芽肿内持续处于延迟或抑制复制的状态。如果结核分枝杆菌繁殖过多,肉芽肿将无法控制感染,结核分枝杆菌可能逃逸形成新的结核肉芽肿,最终扩散到其他器官。[10,11,12,13]
抗原特异性T细胞及细胞因子是适应性抗结核免疫的关键,其中Th1细胞与感染的巨噬细胞相互作用可以激活巨噬细胞抗菌活性,限制细菌胞内复制。然而,生长缓慢的结核分枝杆菌可通过抑制感染的巨噬细胞和中性粒细胞凋亡,抑制树突细胞成熟及其共刺激分子和细胞因子的产生等途径干扰抗原提呈,阻碍抗原加工来削弱CD4+ T细胞启动能力,也可通过分泌脂质直接干扰T细胞反应,从而延缓适应性免疫的发生。因此,适应性免疫可以抑制肉芽肿中细菌增殖,但通常不能根除感染[11,12,13]。
皮肤结核的临床表现多样,包括炎性丘疹、疣状斑块、化脓性结节、慢性溃疡等[7,14,15,16,17,18]。基于皮损中含菌量可将皮肤结核分为多菌型和少菌型两大类。多菌型指机体对结核分枝杆菌免疫力较弱,在皮肤组织或渗出液中较容易检测到结核分枝杆菌的临床类型,包括腔口周围皮肤结核、瘰疬性皮肤结核、结核性下疳、结核性树胶肿、粟粒性皮肤结核。少菌型指机体对结核分枝杆菌有较强免疫力,在病理切片中结核分枝杆菌稀疏或不可见,或皮损组织中较难分离出结核分枝杆菌的临床类型,包括寻常狼疮、疣状皮肤结核。
基于感染途径分类是一种更常用的分类方式,可将皮肤结核分为外源性和内源性两类。外源性皮肤结核指可通过外源性结核分枝杆菌接种导致皮肤感染的类型,包括结核性下疳(原发性皮肤结核综合征)、疣状皮肤结核和少部分寻常狼疮。内源性皮肤结核指结核性淋巴结炎、骨髓炎、附睾炎等结核感染通过邻近病灶播散、自体接种、淋巴或血液传播导致体内结核分枝杆菌感染皮肤的类型,包括粟粒性皮肤结核、结核性树胶肿、寻常狼疮、瘰疬性皮肤结核、腔口周围皮肤结核。
我国皮肤结核患者中寻常狼疮是最常见的临床分型,占50%以上[9,19],其次为疣状皮肤结核、腔口周围皮肤结核以及瘰疬性皮肤结核;结核性下疳、粟粒性皮肤结核、结核性树胶肿较罕见。在儿童患者中,瘰疬性皮肤结核和寻常狼疮是较常见的临床类型[20,21]。人类免疫缺陷病毒(human immunodeficiency virus,HIV)感染者中,瘰疬性皮肤结核和孤立性结核树胶肿最常见[22]。
此外,另有一组与结核病相关的反应性皮肤病名为结核疹(tuberculids)。根据临床及病理表现可分为硬红斑、丘疹坏死性结核疹、瘰疬性苔藓等类型,以硬红斑最常见,占50%以上,其次为丘疹坏死性结核疹[19]。关于结核疹的发病机制及其与结核分枝杆菌的关系仍存在争议,目前多数研究认为其由来自体内感染部位的分枝杆菌的血源性传播引发超敏反应所致,通常发生在具有高水平抗结核免疫力的个体中,患者可能具有内脏结核或淋巴结结核病史,其皮损组织中通常无法检出结核分枝杆菌,但结核免疫学检查可呈强阳性,且抗结核治疗疗效显著,病灶中分枝杆菌核酸扩增呈阳性[23,24,25]。
为我国最常见的皮肤结核临床类型,多发生于有良好免疫力且既往感染结核分枝杆菌的个体。皮损多发于面颈部,其次为四肢、臀部等,表现为单发或多发的丘疹结节性病变,质地柔软,可融合成浸润性红棕色斑块,表面或附有痂屑,玻片压诊时可呈苹果酱样色泽。病变缓慢进展,有自发愈合倾向,可能因反复出现溃疡和自愈逐渐形成萎缩性瘢痕。
多发生于对结核分枝杆菌较强免疫力的个体,通常由外源性病原体接种于皮肤破损处引起。皮损多单发,最常见于手部,其次为足部、臀部、小腿等处。初起为小而硬的无症状性丘疹或结节,外周轻微红晕,缓慢进展形成边缘不规则的暗红色疣状斑块。皮损可自中央痊愈,遗留白色萎缩性瘢痕,也可逐渐形成疣状、乳头状赘生物,质地坚实,局部可有少量脓性分泌物。中央网状瘢痕、疣状增生的边缘和外周红晕合称为"三廓征",为疣状皮肤结核的典型皮损。
又称溃疡性皮肤结核,通常发生于免疫力偏低且合并肺、肠道或泌尿生殖系统结核等进展期内脏结核的患者,多由内源性病灶中的病原体进入黏膜表面破损处自体接种引起,少数经血液或邻近器官扩散引起,导致其毗邻的黏膜及腔口部位感染。皮损多发于口腔、外生殖器、肛门等黏膜部位,表现为疼痛性溃疡和化脓性基底,边缘有明显的红斑,无自愈倾向。
多发生于既往感染结核分枝杆菌、具有一定免疫力的个体,由淋巴结核、骨关节结核等深部病灶连续扩散引起,以颈部淋巴结结核播散引起最常见。皮损多发于颈部、上胸部,初起为无症状性皮下肿胀或结节,逐渐化脓、破溃形成潜行性溃疡和底部线状排列的窦道和瘘管,伴有分泌物渗出,愈合后形成的条索状瘢痕具有一定特征性。
又称原发性皮肤结核综合征,多发生于既往未感染过结核分枝杆菌的儿童患者,通常由结核分枝杆菌外源性接种引起。病变最常见于面部、手部和下肢,在皮肤损伤后2 ~ 4周形成无痛、坚实的红褐色丘疹、结节,缓慢增大并发展成边缘清晰的非压痛性溃疡,4 ~ 8周后可出现局部淋巴结炎。
又称转移性结核脓肿,主要影响营养不良的儿童和免疫功能低下的成年人,由病原体血源性播散引起。皮损单发或多发,初起为坚实的皮下结节,后逐渐软化为境界欠清的波动性肿块,可破溃形成潜行性溃疡,并形成窦道和瘘管。
多发生于免疫力低下的儿童或成人,为结核分枝杆菌急性血源性播散引起的严重结核感染,患者多有发热、乏力、体重减轻等全身症状。皮损为泛发性粟粒大小的红斑、丘疹,中央可出现溃疡、坏死,形成结痂和脐凹,可在1 ~ 4周内消退,遗留色素沉着和瘢痕。
皮肤结核的主要组织病理学特征是上皮样细胞肉芽肿。肉芽肿的存在与否、在真皮中的位置和其构成因临床类型不同有所差异,主要取决于结核感染和机体免疫反应之间的平衡[14,18,26,27,28,29]。感染初期,各种类型皮肤结核表现为非特异性急性炎性反应,数周后出现聚集的上皮样组织细胞,其中含有数量不等的朗罕氏巨细胞和上皮样细胞、淋巴细胞肉芽肿性炎症,随病情进展病灶中央可能出现特征性的干酪样坏死,部分可出现钙化。Ziehl-Neelsen、Fite-Faraco等染色方法可用于检测抗酸阳性杆菌,但在皮肤结核皮损切片中的敏感性较低[30]。
寻常狼疮的病理表现较为多样,表皮变化不一,可出现角化过度、棘层肥厚或萎缩。真皮典型改变是由大量上皮样细胞团块和淋巴细胞构成的结核样肉芽肿,多数情况肉芽肿浸润于真皮上部,约四分之一的病例出现干酪样坏死[28]。随着病变的愈合,病灶逐渐吸收并纤维化。病变长期不愈可能继发鳞状细胞癌等皮肤肿瘤。
疣状皮肤结核通常有明显的角化过度、棘层增生、乳头瘤状增生或假上皮瘤样增生,真皮内大量中性粒细胞、淋巴细胞及巨细胞浸润,形成完整或者不典型的结核性肉芽肿,通常位于真皮中部。
瘰疬性皮肤结核常见坏死和中性粒细胞脓肿,在坏死或脓肿的外周均可见结核样肉芽肿,主要位于真皮下层,约三分之一的病例可见巨细胞,相对较易发现抗酸杆菌[28]。
腔口周围皮肤结核或粟粒性皮肤结核一般不形成完整或典型的结核样肉芽肿,病灶或伴有脓肿形成和坏死,含菌量通常较多。结核性下疳初期为急性中性粒细胞性炎症,病灶和受累淋巴结可发生坏死,有大量杆菌,早期通常不形成肉芽肿,3 ~ 6周后出现肉芽肿性浸润和干酪样坏死,同时结核杆菌逐渐消失。结核性树胶肿组织学表现为大片组织坏死,杆菌数量较多。
硬红斑组织学特征为局灶性或弥漫性的小叶性或小叶间隔性肉芽肿性血管炎,伴大血管或小血管中性粒细胞性血管炎。可见干酪样坏死区域,肉芽肿通常发育欠佳。丘疹坏死性结核疹早期病变可出现白细胞碎裂性血管炎或淋巴细胞性血管炎,伴有纤维蛋白样坏死、血管内血栓闭塞等血管受累,随后真皮开始出现楔形梗死样病变,周围上皮样细胞和巨噬细胞聚集形成发育不良的肉芽肿结构。瘰疬性苔藓为围绕毛囊和汗管分布的浅表性肉芽肿,由上皮样细胞、淋巴细胞聚集形成,偶见巨细胞,可累及数个真皮乳头,通常无干酪样坏死[23,24,25,31,32]。
在左前臂屈侧前1/3中央皮内注射5个单位纯化蛋白衍生物(purified protein derivative,PPD),48 ~ 72 h后测量注射部位出现的硬结大小,判断机体对结核抗原的迟发型超敏反应强弱,辅助结核感染的诊断[33,34]。受机体抗结核免疫力影响,不同类型皮肤结核对TST反应可能存在差异。在结核疹中,TST通常呈强阳性反应,对诊断有辅助作用[31,32,35,36]。该方法在未接种卡介苗的人群中特异性较高,因PPD中多种抗原也存在于非结核分枝杆菌和卡介苗中,已接种卡介苗、合并感染非结核分枝杆菌可能导致假阳性[18,37]。该方法在HIV感染者等免疫缺陷人群中检出率较低,假阴性反应可发生在6个月以内婴儿、感染8 ~ 10周内、肾衰竭患者或细胞免疫受损患者[37]。
通过检测结核分枝杆菌抗原刺激外周血T淋巴细胞产生的γ干扰素水平来判断机体结核感染状态,辅助结核感染的诊断。目前较为成熟的IGRA包括酶联免疫吸附试验和酶联免疫斑点技术。IGRA的检测抗原早期分泌性抗原靶(early secretary antigenic target)6、培养滤液蛋白(culture filtrate protein)10在卡介苗和绝大部分非结核分枝杆菌中缺失,故其结果不受卡介苗接种影响,常应用于潜伏结核筛查,在结核感染诊断中敏感性和特异性均高于结核菌素皮肤实验,在结核疹中可呈阳性[38,39]。但该试验无法区分活动性结核、潜伏或既往结核感染,无法完全将结核感染与部分非结核分枝杆菌(海分枝杆菌、堪萨斯分枝杆菌、苏尔加分枝杆菌、戈登分枝杆菌)感染区分开,有时可能导致假阳性结果,因此对阳性结果需要综合临床及其他检查结果分析[40,41,42]。假阴性结果可能与高龄、超重、患病时间长等因素相关[43],必要时可复查。
对皮损组织研磨液、引流液以及临床培养阳性菌落等进行直接涂片和抗酸染色,镜下的结核分枝杆菌为抗酸阳性的细长稍弯曲或直的、两端圆钝的杆菌,有时呈X、Y形或条索状[44]。抗酸染色镜检阳性仅提示分枝杆菌感染,尚需排除其他分枝杆菌和放线菌可能。由于皮肤结核标本菌载量普遍偏低,直接抗酸染色镜检检出率低[30,45]。
含有活性病原菌的皮损组织标本经研磨、接种于分枝杆菌专用培养基进行选择性培养,若培养阳性且菌落被鉴定(包括分子鉴定、生化鉴定或质谱鉴定)为结核分枝杆菌,可确诊皮肤结核,并可进一步检测菌株对药物的敏感性。常用的传统培养基包括Lownstein-Jensen斜面培养基、Middle brook 7H10固体培养基、Middle brook 7H9液体培养基等,多在接种后8周内观察到干燥、坚硬、黄白色的颗粒状菌落[44,45,46]。全自动液体培养系统通过监测培养基氧猝灭荧光变化来判断分枝杆菌生长情况,可自动孵育、报阳,并同时进行药敏检测,该方法平均报阳时间4 ~ 11 d,药敏试验6 d,相比传统培养基其检测速度较快,阳性检出率更高[47,48,49]。目前,分枝杆菌培养仍是世界卫生组织(WHO)推荐确诊活动性结核的金标准。该方法的缺点在于耗时长,对实验室生物安全级别要求高,且结果可能因标本状态、菌活力等因素影响呈假阴性。可同时使用多种培养方法以提高检测效率。
在临床标本中检测结核分枝杆菌特异性核酸,或使用分枝杆菌通用引物进行PCR扩增,可快速检测出临床标本中少量的结核分枝杆菌核酸,能显著提升多种类型肺外结核临床标本的结核分枝杆菌检出率,尤其是培养阴性的标本,同时缩短检测时间[53,54,55],此外还可用于耐药突变检测和流行病学研究。皮肤结核标本取材可为皮损组织研磨液、脓液、蜡块以及临床培养阳性的菌落。常用靶标序列包括16S rRNA、hsp 65(Rv0440)、rpoB(Rv0667)、IS6110基因序列等[56,57,58]。常用的核酸扩增检测方法包括DNA探针杂交、常规PCR、多重或巢氏PCR、环介导等温扩增、荧光PCR探针熔解曲线法等。因核酸检测实验影响因素较多,其结果存在一定假阳性或假阴性率,建议结合临床表现和其他各项检查结果来综合分析。
对于怀疑皮肤结核病的患者,推荐进行皮损组织取材,分枝杆菌核酸检测、分枝杆菌培养及抗酸染色涂片,以及结核免疫学检测(TST、IGRA);对于不能明确诊断的患者,可行多次取材重复分枝杆菌培养及核酸检测,提高阳性率。
诊断标准包括:①皮损组织/分泌物中分枝杆菌培养阳性,并经鉴定为结核分枝杆菌;②皮损组织/分泌物中结核分枝杆菌核酸检测阳性;③皮损组织病理表现为上皮样细胞肉芽肿且中央出现干酪样坏死;④结核免疫学指标(如IGRA、TST检测)阳性;⑤试验性抗结核治疗有效;⑥有其他脏器结核病史。诊断流程:临床皮损类似皮肤结核,若符合①或同时符合②③两条标准,可确诊为皮肤结核;若符合②③④⑤⑥中任一条,疑似皮肤结核。见图1。
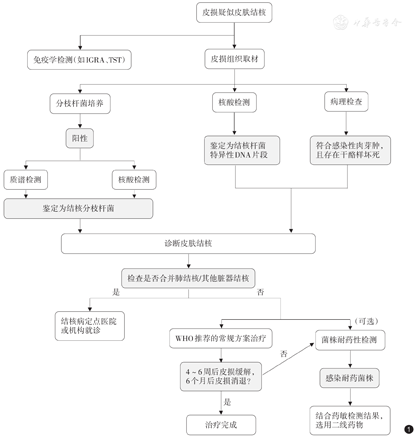

注:IGRA,外周血γ干扰素释放试验;TST,结核菌素皮肤试验;WHO:世界卫生组织;WHO推荐的常规治疗方案为2HRZE + 4HR(H:异烟肼,R:利福平,Z:吡嗪酰胺,E:乙胺丁醇;强化治疗2个月,维持治疗4个月)
在进行抗结核治疗前须全面评估患者的健康状况,包括有无合并肺结核及其他肺外结核情况、皮肤受累类型和范围、免疫水平、肝肾疾病史及药物过敏史等,建议在诊断皮肤结核的同时对所有皮肤结核患者进行胸部影像检查,考虑通过计算机断层成像、磁共振成像、超声、内镜检查等方式排除其他部位结核感染[26]。如患者有相关临床症状或检查结果提示合并肺结核或其他部位结核感染,考虑转诊至结核病定点医院或机构继续治疗[65]。
皮肤结核常规治疗方案遵循药物敏感性肺外结核治疗方案,强化治疗期服用不少于4种有效的抗结核药,连续服用2个月:异烟肼5 ~ 8 mg·kg-1·d-1,利福平8 ~ 10 mg·kg-1·d-1(≤ 600 mg/d),吡嗪酰胺20 ~ 30 mg·kg-1·d-1,乙胺丁醇15 ~ 25 mg·kg-1·d-1(≤ 1 000 mg/d);维持治疗期服用不少于2种抗结核药:异烟肼5 ~ 8 mg·kg-1·d-1,利福平8 ~ 10 mg·kg-1·d-1(≤ 600 mg/d),连续服用4个月[66,67,68,69]。多数皮肤结核病例对抗结核药物敏感,上述方案在绝大多数皮肤结核病例中治愈率高[70,71,72]。
对于3个月至16岁的儿童和青少年,可遵循儿童非严重类型结核病治疗方案,疗程4个月[67]。若处于异烟肼耐药高流行区,可选择在前2个月加用乙胺丁醇。推荐剂量如下:异烟肼10 ~ 15 mg·kg-1·d-1 (≤ 300 mg/d),利福平10 ~ 20 mg·kg-1·d-1(≤ 600 mg/d),吡嗪酰胺30 ~ 40 mg·kg-1·d-1(≤ 2 000 mg/d),乙胺丁醇15 mg·kg-1·d-1(≤ 750 mg/d)[67,69,73]。对于高龄患者,建议根据肾小球滤过率适当减少吡嗪酰胺、乙胺丁醇用量;因肝毒性或胃肠道不耐受发生率较高,不建议80岁以上人群使用吡嗪酰胺,此情况下治疗总持续时间应延长至9个月[66,74]。HIV感染者的抗结核治疗方案与单纯结核感染者一致,疗程可适当延长2 ~ 3个月,建议使用利福布丁替代利福平[67,69]。治疗期间需要进行疗效监测和药物不良反应监测。
药物治疗效果可通过临床反应评估,多数患者在初始治疗4 ~ 6周后可观察到皮损缓解[72,75]。若对药物治疗反应不佳,需警惕耐药性结核分枝杆菌感染,同时考虑对诊断进行重新评估。
抗结核药物不良反应在治疗全过程中均可能出现,服药前应向患者说明可能出现的不良反应。抗结核药物最常见的不良反应包括胃肠道反应、肝毒性以及皮肤过敏反应。其他常见的不良反应包括:利福平:体液(尿液、汗液等)变为橙色或橙红色,头痛、发热,血小板、中性粒细胞减少、溶血性贫血等,皮疹、瘙痒以及流感样症状;异烟肼:周围神经病变、共济失调和感觉异常等,可通过加用维生素B6缓解周围神经炎症状;乙胺丁醇:视神经炎,表现为视物模糊、视力减退、视野缩小等或红绿色盲,多为可逆性;吡嗪酰胺:无症状性高尿酸血症和痛风发作。
多重耐药株定义为至少同时对利福平和异烟肼耐药的结核分枝杆菌菌株,广泛耐药株定义为对利福平和异烟肼耐药的同时,对任何氟喹诺酮类药物和至少另外一种A类药物具有耐药性(左氧氟沙星、莫西沙星、贝达喹啉和利奈唑胺)。中国皮肤结核患者临床分离株耐药率低,且绝大多数皮肤结核病例按WHO标准治疗方案治疗疗效满意,故在治疗前可不必常规进行菌株耐药性检测[8,9,70,71,72]。若为抗结核治疗后复发的皮肤结核病例,或对常规抗结核治疗反应不佳,或合并其他脏器结核感染,可考虑进行药物敏感性试验。
基于培养的药物敏感性检测是结核分枝杆菌药物敏感性判断的金标准,常用检测方法包括微量稀释法等。目前临床普遍采用的药物敏感性检测方法是分子药物敏感性检测,较传统方法在检测效率、安全性方面有明显提升。
目前对于耐药性皮肤结核的治疗尚无相关研究,可参考耐药肺结核治疗方案,结合药物敏感性检测结果、药物的可及性、有效性和安全性,根据个体情况使用二线抗结核药物进行治疗。首选二线药物为A组药物,其他二线药物包括氯法齐明、环丝氨酸、吡嗪酰胺、乙胺丁醇、德拉马尼、丙硫异烟胺、阿米卡星、卷曲霉素、对氨基水杨酸、亚胺培南/西司他丁或美罗培南等。多重耐药结核病的治疗包括9 ~ 12个月的短程治疗方案和18 ~ 20个月的长程治疗方案(治疗开始时至少应有4种可能有效的抗结核药物)[76,77]。对于确诊的异烟肼耐药而利福平敏感的患者,建议用利福平、乙胺丁醇、吡嗪酰胺、左氧氟沙星治疗6个月[76]。儿童耐多药结核病的治疗可参考成人的治疗方案,但在选择药物时应充分权衡利弊,原则上不推荐氟喹诺酮类用于5岁以下或体重低于10 kg的儿童[69,73]。老年患者应按年龄分层酌情选择抗结核药物的种类和数量,慎用丙硫异烟胺、阿米卡星、卷曲霉素等有肝肾毒性的药物[69,74]。对于HIV感染者,应在抗结核治疗开始后8周内开始接受抗逆转录病毒治疗,推荐使用6(H)REZ(H:异烟肼,R:利福平,Z:吡嗪酰胺,E:乙胺丁醇,疗程6个月)-左氧氟沙星治疗方案[74]。
参加共识制订的专家名单:王飞(东南大学附属中大医院)、王洪生(中国医学科学院皮肤病医院)、石春蕊(兰州大学第一医院)、冉玉平(四川大学华西医院)、冯雨苗(苏州市立医院)、乔建军(浙江大学医学院附属第一医院)、刘彤云(昆明医科大学第一附属医院)、苏忠兰(南京医科大学第一附属医院)、李伟(广西壮族自治区皮肤病医院)、李若瑜(北京大学第一医院)、杨德刚(上海市皮肤病医院)、吴玮(广东医科大学附属医院)、宋营改(北京大学第一医院)、张建中(北京大学人民医院)、张桂英(中南大学湘雅二医院)、陈燕清(中山大学附属第五人民医院)、胡文龙(连云港市第一人民医院)、桑旭东(浙江省皮肤病医院)、梅又铭(中国医学科学院皮肤病医院)、曹存巍(广西医科大学第一附属医院)、熊竞舒(中国医学科学院皮肤病医院)
所有作者均声明无利益冲突



























