
出生缺陷防控对提高我国人口素质尤为重要。基于孕妇外周血胎儿游离DNA的无创产前筛查(NIPT)已广泛应用于临床,然而NIPT无法实现单基因病的筛查。新一代NIPT技术(NIPT 2.0)实现了胎儿染色体异常和单基因显性遗传病同步无创产前筛查,扩大了疾病范围并提高了检测准确性。本文回顾了NIPT国内外研究和临床应用现状,重点阐释了NIPT 2.0技术的临床应用价值、技术突破、临床研究进展及局限性,NIPT 2.0技术的临床推广应用将进一步提升出生缺陷的防控水平。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
基于孕妇外周血胎儿游离DNA的无创产前筛查(NIPT)作为一项产前筛查技术在临床得到了广泛的应用,并在染色体非整倍体产前筛查方面具有明显的优势。近年来随着技术的进步和突破,NIPT也迎来了新一轮的技术变革。新一代NIPT技术(简称“NIPT 2.0”),通过创新的试验设计和生物信息学分析方法,可以同步筛查胎儿染色体异常和单基因显性遗传病,扩大了NIPT的疾病范围,并提高了检测的准确性。NIPT 2.0的临床应用,对进一步完善我国产前筛查体系、助力新时期出生缺陷防控工作具有重要意义,也标志着我国在NIPT领域走在了世界的前列。
出生缺陷严重影响人口素质、危及患者的生存和生活质量,给患者及其家庭带来巨大痛苦和经济负担。《中华人民共和国国民经济和社会发展第十三个五年规划纲要》和《“健康中国2030”规划纲要》明确指出要“加强出生缺陷综合防治”。预防和减少出生缺陷,是提高出生人口素质、推进健康中国建设的重要举措。
根据《中国出生缺陷防治报告(2012)》估计,我国出生缺陷发生率在5.6%左右[1]。在国家重点研发计划的资助下,由首都医科大学附属北京妇产医院牵头全国45个研究中心建立了迄今为止全球范围内最大的出生人口队列(CBCS),研究结果显示我国2017—2020年的出生缺陷发生率仍高达2.5%[2]。
2017年以来,我国出生人口持续下滑;2022年出现了人口负增长[3],为60年来首次;2011—2020年,15~49岁育龄女性减少近6 000万[4, 5];不婚、晚婚、低结婚率和高离婚率日趋严重。在这样严峻的人口形势下,我国出生缺陷防控尽管已经取得了举世瞩目的伟大成就,但其总体情况出现新的变化,依然不容乐观。这就要求有新的技术手段来提供新的科技支撑,建立更加完善的出生缺陷防控体系,有效应对形势的变化。
1.NIPT在出生缺陷防控中发挥了重要作用:NIPT已经在全球范围内大规模地开展,每年接受NIPT的孕妇达到1 000万人次以上,多国已经把NIPT作为临床服务流程的一部分。国家卫生计生委于2016年组织全国产前诊断专家制定了《孕妇外周血胎儿游离DNA产前筛查与诊断技术规范》[6],技术规范充分考虑了我国产前筛查和诊断工作的国情,对于开展NIPT的基本要求、适用范围、临床服务流程、检测技术流程以及质量控制指标等内容进行详细的说明,为我国规范开展NIPT技术提供了指导意见,进一步促进我国NIPT技术的临床应用和推广。2019年国家卫生健康委临床检验中心产前筛查与诊断专家委员会发布的《孕妇外周血胎儿游离DNA产前筛查实验室技术专家共识》指出,相比于传统的孕妇外周血血清学筛查,NIPT具有检出率高及假阳性率低的优点[7]。2020年美国妇产科医师学会(ACOG)发布的胎儿染色体异常筛查指南明确指出,游离DNA检测是筛查胎儿常见染色体非整倍体最敏感、最特异的方法[8]。
国内外多项荟萃分析结果显示,NIPT对于21三体(T21)的检出率为99.5%,假阳性率为0.05%;18三体(T18)的检出率为97.7%,假阳性率为0.04%;13三体(T13)检出率为96.1%,假阳性率为0.06%[9, 10, 11, 12, 13]。
扩展性NIPT(NIPT-Plus)技术实现了染色体非整倍体和染色体微缺失微重复综合征(MMS)的同步筛查。国内一项对94 085例孕妇的研究结果显示NIPT-Plus对于已知致病性的MMS的复合阳性预测值(PPV)为40.8%,其中<10 Mb的非综合征拷贝数变异(CNV)的复合PPV为18.8%[14]。
NIPT和NIPT-Plus技术在染色体非整倍体和染色体MMS的产前筛查方面拥有较大优势,在我国得到了迅速而广泛的应用,2022年年筛查孕妇约400万人次,为我国以唐氏综合征为代表的染色体异常的出生缺陷防控做出了积极贡献。
2.单基因显性遗传病的无创产前筛查是当前产前筛查领域的重点:单基因病也是导致出生缺陷的重要因素。单基因遗传病在所有出生缺陷中占比为7.5%~12.0%[15, 16]。其中显性单基因病占全部单基因病约53%[17],而70%~80%显性单基因病由新发突变引起[18, 19]。父母高龄是单基因遗传病新发突变目前已明确的风险因素之一。Nature杂志上发表的一篇论著发现,任何子代都存在平均70.3个新发突变;子代新发突变与父母年龄成正相关,父亲每增加1岁,孩子增加1.51个新发突变;母亲每增加1岁,孩子增加0.37个新发突变[20]。随着我国平均婚育年龄持续增大和三孩政策放开,高龄妊娠导致的胎儿罹患遗传性疾病风险升高的形势将更为严峻。因此,有必要对由新发突变造成的显性单基因病进行产前筛查。
我国临床应用的NIPT技术都是基于低深度全基因组测序的原理,只能筛查染色体异常,无法同时检测胎儿的单基因病缺陷。单基因显性病主要是由一个或数个碱基突变导致,要想实现单基因显性遗传病的NIPT,需要目标区域的测序深度达到200 X以上(此时,若胎儿游离DNA浓度为4%,胎儿突变序列平均只有4条左右)。目前已知基因编码区序列占全基因组序列的2%,通过高深度全基因组测序检测单基因疾病成本过高、效用比低而且数据分析耗时长,综合检测性能难以达到产前筛查的要求,不具备临床适用性。由于缺乏相应的技术,我国对新发突变的单基因显性遗传病还没有形成较为完善的出生缺陷防控体系,这一点和染色体异常比较,存在巨大的差距,防控相对薄弱。将单基因病纳入NIPT的范围,是NIPT进一步发展的技术难点和临床应用方向。
3.单基因病无创产前筛查成为科学研究和临床应用新的热点:近年来,对于单基因病无创产前检测的临床应用取得了一些积极进展。2000年Amicucci等[21]首次在孕妇外周血总DNA中,检出胎儿父源性强直性肌营养不良蛋白激酶(DMPK)基因上的三核苷酸重复扩增序列,实现了常染色体显性遗传病的父源突变诊断。随后的研究采用不同的技术提高了父源突变检测的准确性,并完成了多个疾病的无创产前基因诊断。针对不同遗传病的不同致病位点需要设计专门的检测方案,这大大限制了其在临床的应用。
2012年英国国家医疗服务体系(NHS)批准了软骨发育不全和致死性骨发育不良等疾病的无创产前辅助诊断[22, 23],这是单基因病无创产前检测首次被用于临床。2018年,国内研究者也开始在常规染色体非整倍体NIPT检测的同时,使用微滴式数字PCR(ddPCR)技术进行软骨发育不全无创产前检测。首都医科大学附属北京妇产医院从2019年开展基于ddPCR的先天性软骨发育不全的NIPT,累计完成临床检测9 000例,确诊2例先天性软骨发育不全胎儿。从目前临床应用的结果显示,针对单个基因位点的无创产前检测社会效益和经济效率均较低,不适合大规模的临床应用推广。
2019年Nature Medicine上发表文章报道,贝勒遗传的研究团队开发了一种无创产前多基因检测技术,可一次检测30个基因、44种显性单基因病[24]。从美国、欧洲和亚洲超过131家医疗机构收取458例高危人群筛查样本(高龄父亲或者母亲,胎儿超声异常或有家族史),422例标本符合入组要求,32例标本的筛查结果呈阳性。所有阳性案例与产前超声影像或者出生后临床检测结果全部吻合。其中20例获得产前侵入性标本或产后标本,对其进行了分子诊断检测,其无创筛查结果与分子诊断结果全部一致[24]。2021年,Mohan等[25]报道了上述无创产前单基因病检测技术的临床应用数据,在对2 208名孕妇进行单基因病无创产前检测,发现125例(5.7%)为阳性。在125例阳性病例中,67例(53.6%)获得了随访信息。在经随访确认的病例中,未发现假阳性或假阴性结果。近年来,我国也有多家机构相继推出其单基因显性遗传病的NIPT产品,与NIPT 2.0相比较存在明显不足,将染色体病和单基因遗传病分开筛查会增加检测成本和孕妇的经济负担,而且推广难度较大。
1.染色体和单基因病同步无创产前筛查具有重要临床价值:大规模出生人口队列研究数据证实遗传因素是出生缺陷的重要因素,其中染色体病和单基因遗传病的发生率超过了30%。我国目前上市的NIPT和NIPT-Plus存在两个内在固有的缺陷,临床亟须新技术来满足如下需求:(1)都采用的是低深度全基因组测序技术,测序深度0.1X-0.4X。如前所述,如此低的测序深度,不能同步检测胎儿的单基因遗传病;(2)对部分染色体异常检测准确性不足,尤其是T13、45,X和小片段染色体MMS等疾病PPV偏低。我国多个大样本量的临床研究结果显示,NIPT-Plus或NIPT筛查T13的PPV为17.6%~54.5%,NIPT-Plus筛查45,X的PPV为17.5%~25.8%,筛查<10 Mb的CNV的复合PPV为18.8%~50.0%(表1)[14,26, 27, 28, 29]。
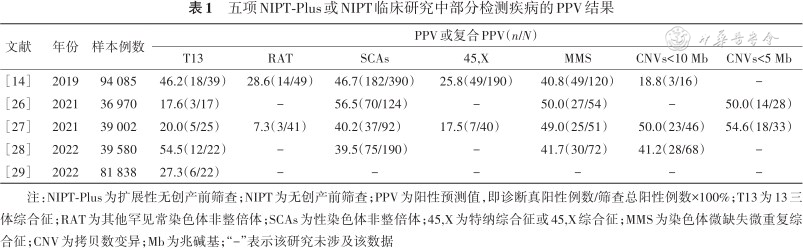
五项NIPT-Plus或NIPT临床研究中部分检测疾病的PPV结果
五项NIPT-Plus或NIPT临床研究中部分检测疾病的PPV结果
| 文献 | 年份 | 样本例数 | PPV或复合PPV(n/N) | ||||||
|---|---|---|---|---|---|---|---|---|---|
| T13 | RAT | SCAs | 45,X | MMS | CNVs<10 Mb | CNVs<5 Mb | |||
| [14] | 2019 | 94 085 | 46.2(18/39) | 28.6(14/49) | 46.7(182/390) | 25.8(49/190) | 40.8(49/120) | 18.8(3/16) | - |
| [26] | 2021 | 36 970 | 17.6(3/17) | - | 56.5(70/124) | - | 50.0(27/54) | - | 50.0(14/28) |
| [27] | 2021 | 39 002 | 20.0(5/25) | 7.3(3/41) | 40.2(37/92) | 17.5(7/40) | 49.0(25/51) | 50.0(23/46) | 54.6(18/33) |
| [28] | 2022 | 39 580 | 54.5(12/22) | - | 39.5(75/190) | - | 41.7(30/72) | 41.2(28/68) | - |
| [29] | 2022 | 81 838 | 27.3(6/22) | - | - | - | - | - | - |
注:NIPT-Plus为扩展性无创产前筛查;NIPT为无创产前筛查;PPV为阳性预测值,即诊断真阳性例数/筛查总阳性例数×100%;T13为13三体综合征;RAT为其他罕见常染色体非整倍体;SCAs为性染色体非整倍体;45,X为特纳综合征或45,X综合征;MMS为染色体微缺失微重复综合征;CNV为拷贝数变异;Mb为兆碱基;“-”表示该研究未涉及该数据
2.NIPT 2.0基础研究和临床应用取得重要技术突破:NIPT 2.0采集一管孕妇外周血,一次试验、同步检测尽可能多的胎儿遗传性疾病,实现胎儿单基因病和染色体病的同步NIPT,具有显著的临床价值,既可以弥补显性单基因病产前筛查方面的空白,又能够大幅降低对单个疾病的检测成本,提高对多种严重遗传疾病进行大规模人群的筛查效率和准确性,使孕妇获得更大的临床收益;NIPT 2.0的临床应用,能够进一步减少严重出生缺陷的胎儿的出生;或可有效指导孩子出生后的工作、生活和治疗,这对我国产前筛查体系的完善和出生缺陷防控工作具有重要意义。
NIPT 2.0技术通过原创性的探针设计、协同等位基因靶向富集(COATE)技术、湿实验流程优化、创新生信算法等,基于高深度靶向捕获测序,在全球首次实现了对染色体非整倍体、MMS和单基因显性遗传病的同步NIPT,实现了“三合一”检测,大幅度提高NIPT的疾病范围和检测准确性,为该项技术的临床应用推广奠定了基础。2022年,发明专利“染色体和单基因病同步产前筛查的设备、试剂盒和分析系统”获得知识产权局授权。
NIPT 2.0除了可筛查常见染色体非整倍体和MMS外,还可在孕12周起,对孕妇外周血胎儿游离DNA杂交捕获建库后高通量测序,同步筛查检测胎儿64个基因导致的92种显性单基因病。这些单基因病的综合发病率为1/400,约为唐氏综合征(T21)的两倍,占所有显性单基因病的1/2,占新发突变导致的显性单基因病的2/3。NIPT 2.0覆盖了临床常见的显性单基因病如软骨发育不全(侏儒症)、成骨不全症(瓷娃娃)、努南综合征、马方综合征、Costello综合征、结节性硬化、致死性骨发育不良、德朗热综合征(Cornelia de Lange综合征)、雷特综合征(Rett综合征)、CHARGE综合征、歌舞伎综合征、Stickler综合征、短指发育不良等92种疾病。这些显性单基因病患者症状严重,存在多器官和系统的畸变和功能异常,包括骨骼、神经、神经/皮肤、肾脏、免疫、内分泌、肌肉等,绝大多数没有有效的治愈手段。在孕期,这些疾病常常没有影像学异常指标或在孕中晚期方可发现结构异常。
3.临床研究表明NIPT 2.0高效、准确:染色体病和单基因病同步NIPT技术NIPT 2.0已开展了回顾性研究和多中心前瞻性临床研究。2022年,Xu等[30]发表的回顾性临床研究论文结果显示,对1 202例样本(其中阳性66例)检测,NIPT2.0综合灵敏度为100%(95%CI:94.9%~100.0%),综合特异度为99.3%(95%CI:98.6%~99.7%)。
由复旦大学附属妇产科医院牵头对高风险孕妇的多中心前瞻性临床研究已经在Nature Medicine上发表[31]。在入组的1 090例高风险妊娠中检出135例阳性病例,其检测敏感度达98.5%,特异度为99.3%。相比目前仅针对染色体异常的标准筛查,NIPT 2.0筛查将遗传变异诊断的检出率提高了60.7%;对入组的NIPT-Plus筛查结果为胎儿染色体疾病高风险的孕妇中,NIPT 2.0将PPV从40.7%(35/86)提高到85.4%(35/41)。筛查效率和检测准确性均有较大幅度的提高。
这些临床研究结果表明,由于NIPT 2.0同步筛查了发病率约1/400的单基因显性遗传病,因此,其筛查效率较NIPT-Plus提高了约1/3。此外,NIPT 2.0对染色体异常的检测准确性大幅提高,对于T21、T18、45,X之外的性染色体异常、染色体微缺失和单基因病,该研究都没有发现假阳性。对45,X和T13,其PPV值分别为88.2%和55.6%;四种性染色体非整倍体(45,X、XXX、XXY和XYY)的复合PPV值达到了99.3%;6例22q11.3小片段微缺失全部准确检出,没有假阳性和假阴性。这些指标较传统NIPT或NIPT-Plus都有了显著提升,可综合降低约2/3以上的假阳性,NIPT 2.0将有望大幅降低有创性产前诊断率,从而降低胎儿丢失的发生率。
4.NIPT 2.0技术进一步研究和临床推广应用:前期已完成的前瞻性临床研究还存在局限性,包括:入组的均是需要产前诊断的高风险孕妇人群;没有和传统NIPT进行同步检测并比较临床有效性;样本量还相对较少,对于检测的特异性的分析数据不足和观察性研究的性质等。因此需要大规模的人群队列研究进一步评价该项技术的临床应用效果。
据悉由全国20多家临床机构参与的“新一代无创产前筛查10万例多中心前瞻性临床队列”研究已于2023年6月启动,计划通过3年的入组、随访和分析,完成近10万例的孕妇前瞻性应用研究,全面评估NIPT 2.0技术的临床应用效果及价值,项目预计于2027年完成结题、数据分析和论文提交工作。在2023年6月30日启动会上,来自全国19个省市30家医院的专家讨论并形成NIPT 2.0临床应用策略的专家共识。在未来几年,项目将组织该领域系列专家共识的形成,并积极推动,希望最终将其纳入我国的临床指南。
除了进行全人群的大队列研究之外,NIPT 2.0还应该进一步适当扩大筛查疾病数量,逐步实现核酸提取、建库、杂交捕获和报告解读的自动化等,以进一步满足临床检测的需要。应以国家和省市课题为支撑,加强NIPT 2.0的学术推广、技术培训和科普教育工作。此外,应进一步通过技术创新,将常见高发后果严重的单基因隐性遗传病纳入NIPT范畴,进入NIPT 3.0的临床应用时代。
5.NIPT 2.0的技术局限性和卫生经济学问题:NIPT 2.0也是一种产前筛查技术,不能用于诊断,不能替代系统超声等产前检查。对筛查提示高风险者,应及时进行羊水穿刺后产前诊断,可以早期发现早期处理(部分疾病可在产前超声时发现并行产前诊断,但孕周较晚可能导致大月份引产或围产儿死亡)。应当注意,仍有多种因素可能导致NIPT 2.0筛查的假阳性和假阴性结果,如限制性胎盘嵌合、胎儿嵌合、孕妇自身遗传变异、胎儿cfDNA浓度过低;染色体嵌合、染色体多倍体、染色体平衡易位/倒位、环状染色体;基因组中高重复区域、高GC区域或假基因干扰的区域等。在检测前后的遗传咨询中应高度重视这些技术局限性。
由于增加了探针和杂交捕获等实验步骤,测序深度高数据量大,且对检测单基因变异需人工解读,对于单个样本检测,当前成本应高于NIPT-Plus,但其检测效率和准确性也有较大幅度的提高。因此,临床应用一段时间后,需进行卫生经济学评估。
人口发展是关系中华民族伟大复兴的大事。推动人口高质量发展需要不断提高人口素质。优生优育是提高人口素质的基础,党和国家高度重视相关工作,取得了巨大的成效。但应该看到,我国出生缺陷防控形势仍然十分严峻。在当前出生人口下降的新形势下,进一步全面加强出生缺陷防控工作显得更加迫切和重要。
经过十年的发展,相对于传统的血清学筛查方法,具有高灵敏度和特异性的NIPT技术,已经广泛地应用于临床染色体异常的筛查。但是,基于低深度全基因组测序技术的NIPT,只能筛查染色体异常,不能检测胎儿的单基因病缺陷。而单基因病发病率高达1%,新发突变的单基因病更是我国当前产前筛查体系的薄弱环节,还没有形成较为完善的防控体系。研究表明,高父龄高母龄是胎儿新发突变的高危因素。因此,随着我国三孩政策放开,高龄产子增多,胎儿罹患遗传性疾病风险升高的形势将更加严峻。
2021年12月14日,“国务院办公厅关于印发国家残疾预防行动计划(2021—2025年)的通知”中明确指出,广泛开展产前筛查,加强对常见胎儿染色体病、严重胎儿结构畸形、单基因遗传病等重大出生缺陷的产前筛查和诊断[32]。NIPT 2.0实现了对常见胎儿染色体病、严重胎儿结构畸形和单基因显性遗传病的同步筛查,极大地满足了产前筛查领域的这一临床急迫需求。回顾性临床研究和高风险孕妇的多中心前瞻性临床研究表明,NIPT 2.0可以同步、准确地检测胎儿染色体非整倍体、染色体CNV和单基因显性遗传病,大幅提高了产前筛查的效率和检测的准确性。NIPT 2.0的临床推广应用,必将对我国建设更加完善的出生缺陷防控体系提供重要的技术支撑,做出积极的贡献;有助于进一步巩固我国在相关领域的全球领先地位;具有重要的科学意义、临床价值和深远的现实意义。
闫有圣, 阴赪宏. 新一代无创产前筛查技术的临床应用价值与前景[J]. 中华医学杂志, 2024, 104(26): 2457-2461. DOI: 10.3760/cma.j.cn112137-20231213-01373.
所有作者声明不存在利益冲突



























