
探索以维奈克拉为基础的诱导方案对初诊儿童急性髓细胞白血病(AML)的疗效。
前瞻性纳入2019年11月至2023年12月于首都医科大学附属北京儿童医院和首都医科大学附属北京儿童医院保定医院新诊断的AML患儿,根据诱导方案将患者分为DAH组(柔红霉素联合阿糖胞苷、高三尖杉酯碱的传统诱导方案)和VAH组(维奈克拉联合阿糖胞苷、高三尖杉酯碱的诱导方案)。收集患儿的临床资料,比较2组间临床特征和诱导缓解率,通过多因素logistic回归模型分析诱导缓解率的影响因素。
共纳入135例患儿,DAH组96例,男54例,女42例,年龄[M(Q1,Q3)]为6.4(3.9,11.6)岁;VAH组39例,男26例,女13例,年龄8.0(6.2,13.2)岁。在初诊为低/中危患儿中,VAH组和DAH组的形态学完全缓解率分别为94.7%(18/19)和84.4%(38/45);微小残留病(MRD)转阴率分别为57.9%(11/19)和46.7%(21/45),差异均无统计学意义(均P>0.05)。在初诊为高危患儿中,VAH组的形态学完全缓解率高于DAH组[95.0%(19/20)比70.6%(36/51),P=0.027];MRD转阴率分别为45.0%(9/20)和33.3%(17/51),差异无统计学意义(P=0.359)。诱导方案(维奈克拉联合阿糖胞苷、高三尖杉酯碱)有利于形态学缓解(OR=0.126,95%CI:0.025~0.629);FLT3基因突变不利于形态学缓解(OR=5.832,95%CI:1.778~19.124)和MRD转阴(OR=4.166,95%CI:1.396~12.433)。
以维奈克拉为基础的诱导方案对初诊儿童AML疗效较传统化疗方案好。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
白血病是儿童最常见的恶性肿瘤,发病率约4.23/10万[1]。急性髓细胞白血病(acute myeloid leukemia,AML)约占儿童白血病的25%,总生存率为70%左右[2]。AML的传统化疗方案主要由阿糖胞苷和蒽环类药物组成[3]。近年来一些小分子抑制剂和生物制剂在AML治疗中的作用逐渐被挖掘出来[4, 5]。其中,维奈克拉是抗凋亡蛋白B细胞淋巴瘤-2(B-cell lymphoma-2,BCL-2)高选择性的强效抑制剂,可以特异性靶向结合BCL-2,使其凋亡途径重新激活[6]。众多临床试验证明,维奈克拉联合化疗或去甲基化药物的治疗在成人AML患者的应答率高达60%~70%,且治疗耐受性良好[7, 8, 9, 10, 11, 12, 13, 14, 15];也逐渐证实维奈克拉在儿童难治/复发(refractory/relapsed,R/R)AML中的良好反应率和耐受性[16, 17, 18]。高三尖杉酯碱是成人AML的一线治疗药物[19],中国儿童白血病组(the Chinese Childhood Leukemia Group,CCLG)AML2015方案研究也发现:基于高三尖杉酯碱的诱导方案可提高中国AML患儿的诱导缓解率和生存率[20]。研究表明,BCL-2抑制剂和高三尖杉酯碱在AML细胞系和异种移植AML模型中具有协同效应[21, 22]。因此,本研究将高三尖杉酯碱、阿糖胞苷和维奈克拉联合治疗儿童AML,重点分析在初诊AML患儿中用维奈克拉代替传统诱导方案中的柔红霉素后的治疗效果,探索儿童AML的优化治疗方案,提高患儿的诱导缓解和预后。
本研究为队列研究,前瞻性纳入2019年11月至2023年12月于首都医科大学附属北京儿童医院和首都医科大学附属北京儿童医院保定医院通过骨髓形态学-免疫学-细胞遗传学-分子生物学(morphology-immunology-cytogenetics-molecular biology,MICM)检查确诊的AML(除外急性早幼粒细胞白血病)患儿。入组患儿均参与CCLG-AML 2019方案多中心临床研究,本研究通过首都医科大学附属北京儿童医院医学伦理委员会批准(审批号:2019-k-343),所有患者监护人均签署本研究的知情同意书。
1.纳入标准:(1)入组年龄<18岁;(2)明确诊断为AML;(3)入组前未接受过其他针对原发病治疗;(4)采用高三尖杉酯碱、柔红霉素和阿糖胞苷的传统诱导方案诱导治疗,或使用维奈克拉代替传统方案中的柔红霉素进行诱导治疗。
2.排除标准:(1)急性早幼粒细胞白血病;(2)只做暂时性化疗、放疗或免疫治疗,未按照治疗方案进行系统治疗;(3)合并任何显著异常的疾病或精神疾病,影响患儿的生命安全及依从性,影响研究随访。
3.分组:根据诱导方案的不同,将患者分为2组:(1)DAH组:柔红霉素联合高三尖杉酯碱、阿糖胞苷的传统诱导方案组;(2)VAH组:维奈克拉联合高三尖杉酯碱、阿糖胞苷的新诱导方案组。
1.治疗方案:入组患者采用CCLG-AML 2019方案进行治疗,对于初诊的AML患儿,传统的诱导方案为柔红霉素联合阿糖胞苷、高三尖杉酯碱治疗,方案简称“DAH”。若患儿不耐受化疗、因伴有预后不良遗传学标志初评为高危或为放疗、化疗、疾病等继发AML,将使用维奈克拉(200 mg/m2)代替传统方案中的柔红霉素进行治疗,即维奈克拉联合阿糖胞苷、高三尖杉酯碱的诱导方案,方案简称“VAH”。研究后期,维奈克拉的诱导缓解优势逐渐显现出来,为了使更多患者获益,VAH方案的适应证不再局限于初评高危或不耐受化疗的AML患者。由于在诱导期的最初两周内患者突变基因结果未归且随后的2周内发生骨髓抑制,因此本研究的患者均未使用FLT3抑制剂。第1疗程诱导治疗方案详见表1。
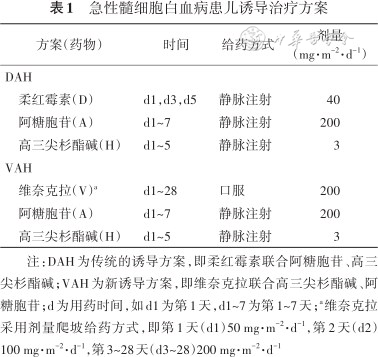
急性髓细胞白血病患儿诱导治疗方案
急性髓细胞白血病患儿诱导治疗方案
| 方案(药物) | 时间 | 给药方式 | 剂量(mg·m-2·d-1) |
|---|---|---|---|
| DAH | |||
| 柔红霉素(D) | d1,d3,d5 | 静脉注射 | 40 |
| 阿糖胞苷(A) | d1~7 | 静脉注射 | 200 |
| 高三尖杉酯碱(H) | d1~5 | 静脉注射 | 3 |
| VAH | |||
| 维奈克拉(V)a | d1~28 | 口服 | 200 |
| 阿糖胞苷(A) | d1~7 | 静脉注射 | 200 |
| 高三尖杉酯碱(H) | d1~5 | 静脉注射 | 3 |
注:DAH为传统的诱导方案,即柔红霉素联合阿糖胞苷、高三尖杉酯碱;VAH为新诱导方案,即维奈克拉联合高三尖杉酯碱、阿糖胞苷;d为用药时间,如d1为第1天,d1~7为第1~7天;a维奈克拉采用剂量爬坡给药方式,即第1天(d1)50 mg·m-2·d-1,第2天(d2)100 mg·m-2·d-1,第3~28天(d3~28)200 mg·m-2·d-1
2.初诊患儿高危的定义:根据患儿初诊时的MICM分型进行危险度初评,即:初诊时具有5号、7号染色体单体、5q-、7q-、12p/t(2;12)/ETV6-HOXD、除外t(9;11)的MLL重排、t(6;9)/DEK-NUP214或DEK-CAN、t(7;12)/HLXB9-ETV6、t(9;22)/BCR-ABL1、t(16;21)/TLS-ERG或FUS-ERG、复杂核型、c-kit突变(除外CBF-AML)、RUNX1突变、TP53突变、NUP98重排等预后不良遗传学标记、髓系肉瘤或为继发AML。
3.疗效评估:第1疗程治疗的第28天抽取骨髓进行诱导疗效评估,包括形态学评估和免疫学评估。(1)形态学评估:分为以下4种:①完全缓解(complete remission,CR):骨髓三系造血恢复,原始幼稚细胞比例<5%,且无髓外浸润;②CR伴血液学不完全恢复(complete remission with incomplete hematologic recovery,CRi):外周血中性粒细胞≤1.0×109/L和(或)血小板≤100×109/L,且原始幼稚细胞比例<5%;③部分缓解(partial remission,PR):原始幼稚细胞比例介于5%~20%;④不缓解:原始幼稚细胞比例>20%。(2)免疫学评估:流式细胞术检测骨髓中的微小残留病(minirnal residual disease,MRD)<0.1%定义为阴性。
采用SPSS 26.0软件进行统计学分析,符合正态分布的计量资料采用表示,两组间比较采用独立样本t检验;偏态分布的计量资料用M(Q1,Q3)表示,两组间比较采用Mann-Whitney U检验。计数资料采用例数(%)表示,组间比较采用χ²检验或者Fisher确切概率法。采用logistic回归模型分析诱导缓解率的影响因素,将单因素logistic回归模型分析中P<0.1的自变量纳入多因素logistic回归分析。双侧检验,检验水准α=0.05。
共纳入135例患儿,DAH组96例,男54例,女42例,年龄6.4(3.9,11.6)岁;VAH组39例,男26例,女13例,年龄8.0(6.2,13.2)岁。135例患儿中,最常见的形态类型为髓系(myloid,M)2和M5,分别有59和28例;融合基因或突变基因以AML1-ETO最为常见,其次是C-KIT突变、FLT3突变、MLL重排(除外MLL-AF9)、NRAS突变、WT1突变,分别有46、32、24、19、18和17例。2组患者的临床资料详见表2。VAH组患儿的年龄大于DAH组,FLT3突变患者比例高于DAH组(均P=0.043),2组患儿其他基线特征差异无统计学意义(均P>0.05)。
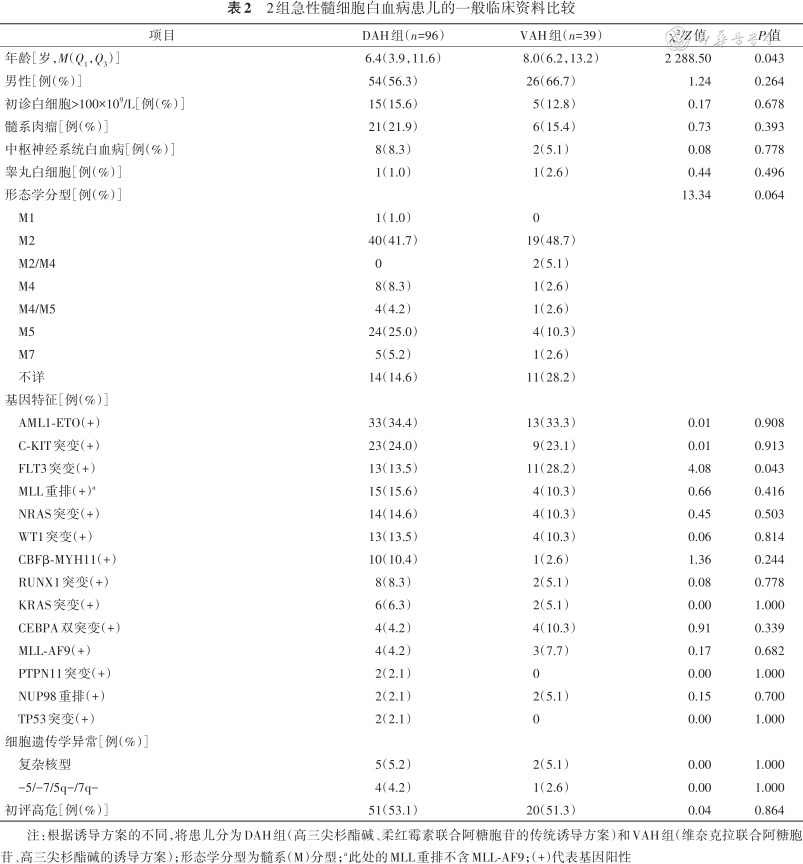
2组急性髓细胞白血病患儿的一般临床资料比较
2组急性髓细胞白血病患儿的一般临床资料比较
| 项目 | DAH组(n=96) | VAH组(n=39) | χ²/Z值 | P值 | |||
|---|---|---|---|---|---|---|---|
| 年龄[岁,M(Q1,Q3)] | 6.4(3.9,11.6) | 8.0(6.2,13.2) | 2 288.50 | 0.043 | |||
| 男性[例(%)] | 54(56.3) | 26(66.7) | 1.24 | 0.264 | |||
| 初诊白细胞>100×109/L[例(%)] | 15(15.6) | 5(12.8) | 0.17 | 0.678 | |||
| 髓系肉瘤[例(%)] | 21(21.9) | 6(15.4) | 0.73 | 0.393 | |||
| 中枢神经系统白血病[例(%)] | 8(8.3) | 2(5.1) | 0.08 | 0.778 | |||
| 睾丸白细胞[例(%)] | 1(1.0) | 1(2.6) | 0.44 | 0.496 | |||
| 形态学分型[例(%)] | 13.34 | 0.064 | |||||
| M1 | 1(1.0) | 0 | |||||
| M2 | 40(41.7) | 19(48.7) | |||||
| M2/M4 | 0 | 2(5.1) | |||||
| M4 | 8(8.3) | 1(2.6) | |||||
| M4/M5 | 4(4.2) | 1(2.6) | |||||
| M5 | 24(25.0) | 4(10.3) | |||||
| M7 | 5(5.2) | 1(2.6) | |||||
| 不详 | 14(14.6) | 11(28.2) | |||||
| 基因特征[例(%)] | |||||||
| AML1-ETO(+) | 33(34.4) | 13(33.3) | 0.01 | 0.908 | |||
| C-KIT突变(+) | 23(24.0) | 9(23.1) | 0.01 | 0.913 | |||
| FLT3突变(+) | 13(13.5) | 11(28.2) | 4.08 | 0.043 | |||
| MLL重排(+)a | 15(15.6) | 4(10.3) | 0.66 | 0.416 | |||
| NRAS突变(+) | 14(14.6) | 4(10.3) | 0.45 | 0.503 | |||
| WT1突变(+) | 13(13.5) | 4(10.3) | 0.06 | 0.814 | |||
| CBFβ-MYH11(+) | 10(10.4) | 1(2.6) | 1.36 | 0.244 | |||
| RUNX1突变(+) | 8(8.3) | 2(5.1) | 0.08 | 0.778 | |||
| KRAS突变(+) | 6(6.3) | 2(5.1) | 0.00 | 1.000 | |||
| CEBPA双突变(+) | 4(4.2) | 4(10.3) | 0.91 | 0.339 | |||
| MLL-AF9(+) | 4(4.2) | 3(7.7) | 0.17 | 0.682 | |||
| PTPN11突变(+) | 2(2.1) | 0 | 0.00 | 1.000 | |||
| NUP98重排(+) | 2(2.1) | 2(5.1) | 0.15 | 0.700 | |||
| TP53突变(+) | 2(2.1) | 0 | 0.00 | 1.000 | |||
| 细胞遗传学异常[例(%)] | |||||||
| 复杂核型 | 5(5.2) | 2(5.1) | 0.00 | 1.000 | |||
| -5/-7/5q-/7q- | 4(4.2) | 1(2.6) | 0.00 | 1.000 | |||
| 初评高危[例(%)] | 51(53.1) | 20(51.3) | 0.04 | 0.864 | |||
注:根据诱导方案的不同,将患儿分为DAH组(高三尖杉酯碱、柔红霉素联合阿糖胞苷的传统诱导方案)和VAH组(维奈克拉联合阿糖胞苷、高三尖杉酯碱的诱导方案);形态学分型为髓系(M)分型;a此处的MLL重排不含MLL-AF9;(+)代表基因阳性
1.所有患儿缓解率比较:第1疗程诱导治疗后,共111例(82.2%)患儿达到形态学CR/CRi,58例(43.0%)MRD转阴。VAH组和DAH组初评为高危AML的患儿比例差异无统计学意义(51.3%比53.1%,P=0.864);但VAH组患儿形态学总CR/CRi率(P=0.014)、总MRD转阴率(P=0.213)均高于DAH组(表3)。
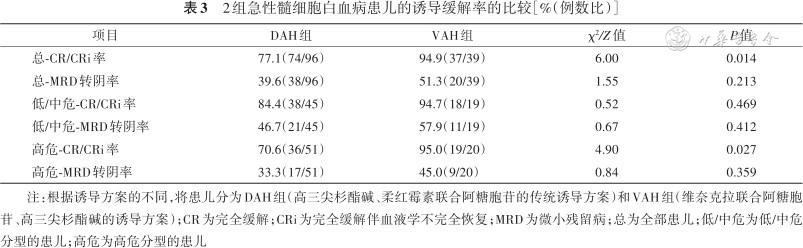
2组急性髓细胞白血病患儿的诱导缓解率的比较[%(例数比)]
2组急性髓细胞白血病患儿的诱导缓解率的比较[%(例数比)]
| 项目 | DAH组 | VAH组 | χ²/Z值 | P值 |
|---|---|---|---|---|
| 总-CR/CRi率 | 77.1(74/96) | 94.9(37/39) | 6.00 | 0.014 |
| 总-MRD转阴率 | 39.6(38/96) | 51.3(20/39) | 1.55 | 0.213 |
| 低/中危-CR/CRi率 | 84.4(38/45) | 94.7(18/19) | 0.52 | 0.469 |
| 低/中危-MRD转阴率 | 46.7(21/45) | 57.9(11/19) | 0.67 | 0.412 |
| 高危-CR/CRi率 | 70.6(36/51) | 95.0(19/20) | 4.90 | 0.027 |
| 高危-MRD转阴率 | 33.3(17/51) | 45.0(9/20) | 0.84 | 0.359 |
注:根据诱导方案的不同,将患儿分为DAH组(高三尖杉酯碱、柔红霉素联合阿糖胞苷的传统诱导方案)和VAH组(维奈克拉联合阿糖胞苷、高三尖杉酯碱的诱导方案);CR为完全缓解;CRi为完全缓解伴血液学不完全恢复;MRD为微小残留病;总为全部患儿;低/中危为低/中危分型的患儿;高危为高危分型的患儿
2.危险度分层后患儿缓解率比较:进一步比较不同危险度患者两组诱导方案治疗后的骨髓CR/CRi率和MRD转阴率。在初诊为低/中危的患儿中,DAH组和VAH组的CR/CRi率(P=0.469)和MRD转阴率(P=0.412)差异无统计学意义;在初诊为高危的患儿中,VAH组的CR/CRi率高于DAH组(P=0.027),但2组间MRD转阴率差异无统计学意义(P=0.359,表3)。
1.单因素分析:初诊白细胞计数、FLT3突变、诱导方案是形态学不缓解的影响因素(均P<0.05);FLT3突变是免疫残留不缓解的影响因素(P=0.021,表4)。
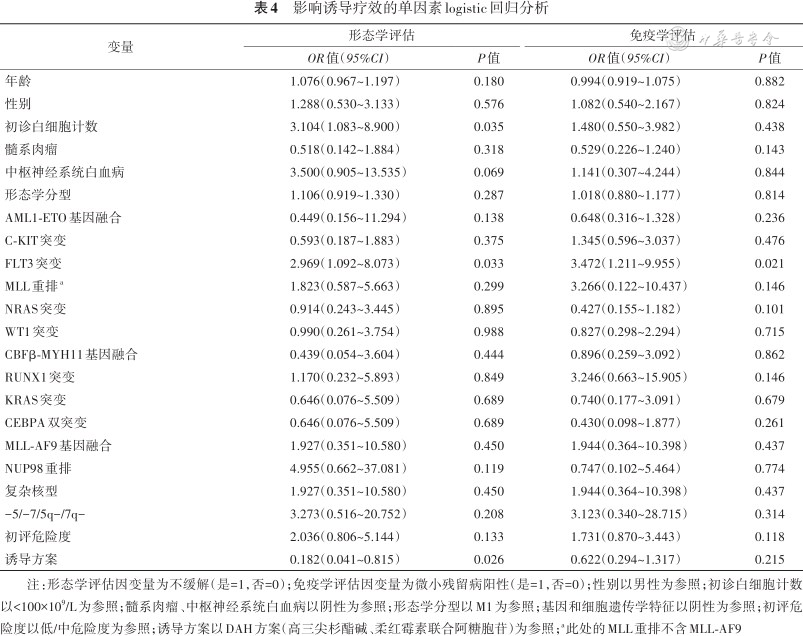
影响诱导疗效的单因素logistic回归分析
影响诱导疗效的单因素logistic回归分析
| 变量 | 形态学评估 | 免疫学评估 | ||
|---|---|---|---|---|
| OR值(95%CI) | P值 | OR值(95%CI) | P值 | |
| 年龄 | 1.076(0.967~1.197) | 0.180 | 0.994(0.919~1.075) | 0.882 |
| 性别 | 1.288(0.530~3.133) | 0.576 | 1.082(0.540~2.167) | 0.824 |
| 初诊白细胞计数 | 3.104(1.083~8.900) | 0.035 | 1.480(0.550~3.982) | 0.438 |
| 髓系肉瘤 | 0.518(0.142~1.884) | 0.318 | 0.529(0.226~1.240) | 0.143 |
| 中枢神经系统白血病 | 3.500(0.905~13.535) | 0.069 | 1.141(0.307~4.244) | 0.844 |
| 形态学分型 | 1.106(0.919~1.330) | 0.287 | 1.018(0.880~1.177) | 0.814 |
| AML1-ETO基因融合 | 0.449(0.156~11.294) | 0.138 | 0.648(0.316~1.328) | 0.236 |
| C-KIT突变 | 0.593(0.187~1.883) | 0.375 | 1.345(0.596~3.037) | 0.476 |
| FLT3突变 | 2.969(1.092~8.073) | 0.033 | 3.472(1.211~9.955) | 0.021 |
| MLL重排a | 1.823(0.587~5.663) | 0.299 | 3.266(0.122~10.437) | 0.146 |
| NRAS突变 | 0.914(0.243~3.445) | 0.895 | 0.427(0.155~1.182) | 0.101 |
| WT1突变 | 0.990(0.261~3.754) | 0.988 | 0.827(0.298~2.294) | 0.715 |
| CBFβ-MYH11基因融合 | 0.439(0.054~3.604) | 0.444 | 0.896(0.259~3.092) | 0.862 |
| RUNX1突变 | 1.170(0.232~5.893) | 0.849 | 3.246(0.663~15.905) | 0.146 |
| KRAS突变 | 0.646(0.076~5.509) | 0.689 | 0.740(0.177~3.091) | 0.679 |
| CEBPA双突变 | 0.646(0.076~5.509) | 0.689 | 0.430(0.098~1.877) | 0.261 |
| MLL-AF9基因融合 | 1.927(0.351~10.580) | 0.450 | 1.944(0.364~10.398) | 0.437 |
| NUP98重排 | 4.955(0.662~37.081) | 0.119 | 0.747(0.102~5.464) | 0.774 |
| 复杂核型 | 1.927(0.351~10.580) | 0.450 | 1.944(0.364~10.398) | 0.437 |
| -5/-7/5q-/7q- | 3.273(0.516~20.752) | 0.208 | 3.123(0.340~28.715) | 0.314 |
| 初评危险度 | 2.036(0.806~5.144) | 0.133 | 1.731(0.870~3.443) | 0.118 |
| 诱导方案 | 0.182(0.041~0.815) | 0.026 | 0.622(0.294~1.317) | 0.215 |
注:形态学评估因变量为不缓解(是=1,否=0);免疫学评估因变量为微小残留病阳性(是=1,否=0);性别以男性为参照;初诊白细胞计数以<100×109/L为参照;髓系肉瘤、中枢神经系统白血病以阴性为参照;形态学分型以M1为参照;基因和细胞遗传学特征以阴性为参照;初评危险度以低/中危险度为参照;诱导方案以DAH方案(高三尖杉酯碱、柔红霉素联合阿糖胞苷)为参照;a此处的MLL重排不含MLL-AF9
2.多因素分析:诱导方案(维奈克拉联合阿糖胞苷、高三尖杉酯碱)有利于形态学缓解(OR=0.126,95%CI:0.025~0.629,P=0.012);FLT3基因突变不利于形态学缓解(OR=5.832,95%CI:1.778~19.124,P=0.004)和MRD转阴(OR=4.166,95%CI:1.396~12.433,P=0.011)。
维奈克拉与低剂量阿糖胞苷和去甲基化药物联合方案的有效性和安全性已在成人R/R及初诊AML中得到广泛验证,CR率约为70%[8, 9,11, 12,23]。此外,维奈克拉在儿童R/R AML中也表现出良好的应用前景[17,24]。然而,与成人相比,维奈克拉在儿童AML中的应用相对较少,应用适应证多为R/R的AML[25],目前鲜有报道维奈克拉在儿童AML诱导期尤其是初诊时应用的有效性。本研究对135例新诊断的AML患儿进行了常规化疗联合或不联合维奈克拉的治疗,对比了初诊时应用维奈克拉替代传统蒽环类药物后患者的诱导缓解率。对于维奈克拉在AML患儿中的适应证,本研究不再局限于R/R的AML,并根据初诊时是否应用维奈克拉进行分组,进而进行诱导缓解率的前瞻性队列研究。
本研究中,VAH组和DAH组初评为高危AML患儿的比例差异无统计学意义,但初诊时应用以维奈克拉为基础的VAH诱导方案的患儿的形态学CR/CRi率(94.9%比77.1%,P=0.014)高于未应用维奈克拉组;且多因素logistic回归分析去除混杂变量的影响后,VAH诱导方案仍然是影响CR/CRi率的危险因素。常规情况下,高危组患者的形态学缓解率低于低中危组,本研究进一步比较初诊时不同危险度患儿经过不同诱导方案治疗后的骨髓缓解情况,发现VAH方案在低/中危组和高危组患者中的形态学缓解率相当(94.7%比95.0%),说明VAH方案提高了高危组的诱导缓解率,考虑维奈克拉的应用降低了初诊时不良遗传学特征对缓解率的负向影响。该结果证明了初诊时加用维奈克拉可以提高AML患儿的诱导缓解率,而尽早的诱导缓解和缓解深度将进一步改善患儿的生存预后[26, 27]。此外,蒽环类药物的心脏毒性一直是困扰临床医师的难题[28],维奈克拉作为柔红霉素的替代治疗,是对患者诱导缓解率和安全性的双重提升。
既往研究发现,儿童AML经过高三尖杉酯碱为基础的2疗程诱导治疗后的CR/CRi率为79.8%[20];本研究中,初诊时应用维奈克拉为基础的诱导治疗仅1疗程后的CR/CRi率为94.9%,高于既往研究。此外,既往报道维奈克拉的剂量多为360 mg·m-2·d-1,CR率约60%~77%[17,24,29, 30];本研究即使给予了较低剂量的维奈克拉(200 mg·m-2·d-1),初评为高危患儿的CR/CRi率也高于既往研究[17],这一结果揭示了维奈克拉在初诊AML患儿中提高缓解率方面的潜力,进一步验证了维奈克拉的尽早应用对儿童AML缓解率的重要影响。
研究前期,以维奈克拉为基础的诱导方案的应用主要集中在不能耐受强化疗和初评为高危的AML患儿中,随着维奈克拉的诱导缓解优势的出现,为了使更多患儿获益,一些初评为低/中危且可以耐受化疗的患儿也在初诊时应用了维奈克拉,但这只能在一定程度上缩小不同诱导方案患儿的基本特征的偏倚程度,因此应用VAH方案的患儿的FLT3突变比例更高(28.2%比13.5%,P=0.043),考虑是因为前期维奈克拉应用的适应证导致的组间偏倚。本研究患儿均未加用FLT3抑制剂,但多因素分析结果提示FLT3突变是影响维奈克拉诱导缓解率的危险因素。研究表明,FLT3突变是影响AML患者预后的不良遗传学标志,而早期识别FLT3突变及规律加用FLT3抑制剂能改善AML患者的预后[31];且维奈克拉与吉瑞替尼联合应用,可以提高AML的反应率[32]。因此,对于FLT3阳性的AML患者,早期应用维奈克拉并联用FLT3抑制剂治疗非常有必要。
本研究存在一定的不足:(1)本研究中的AML患儿病初的肿瘤负荷、感染、脏器损伤等并发症的基础差异较大,很难判断并发症是否为用药不良反应或原发病所致,故未针对不同方案的安全性进行对比;(2)白血病治疗周期长达数年,大部分患者随访时间内未完成系统AML方案的治疗,故未进行远期预后分析,有待长期随访进一步判断VAH方案对AML患儿的远期效益。
综上,本研究验证了维奈克拉联合高三尖杉酯碱、阿糖胞苷较传统方案治疗儿童初诊AML的有效性,特别是对初评为高危的患儿的诱导缓解更有优势,提示维奈克拉不仅可以作为R/R AML的挽救治疗,更应尽早应用于初诊的AML患儿,使之获益。
温晓佳, 卢煜, 黄鹏丽, 等. 以维奈克拉为基础的诱导方案对初诊儿童急性髓细胞白血病的疗效[J]. 中华医学杂志, 2024, 104(27): 2513-2520. DOI: 10.3760/cma.j.cn112137-20240108-00056.
所有作者声明不存在利益冲突



























