
探讨贝林妥欧单抗在儿童CD19阳性(CD19+)B细胞型急性淋巴细胞白血病(B-ALL)的安全性及疗效。回顾性纳入中国医学科学院血液病医院自2021年8月至2023年10月接受贝林妥欧单抗治疗的B-ALL患儿,根据疾病状态将患儿分为难治/复发(RR)组、微小残留病清除(MC)组及化疗不耐受(IC)组。收集患儿的临床资料,评估药物不良反应、治疗疗效及患儿的生存情况。共纳入35例患儿,男20例,女15例,年龄0.6~16.4(9.9±4.2)岁;其中RR组10例,MC组20例,IC组5例。共完成56周期输注,其中完成1、2、3、4周期输注的患儿分别有24、5、2、4例;第1~4周期输注的中位时间[M(Q1,Q3)]分别为14(14,28)d、28(28,28)d、28(28,28)d和28(26,28)d。关于不良反应,1~2级细胞因子释放综合征(CRS)的发生率为57.1%(32/56),其中1级CRS占84.4%(27/32);免疫效应细胞相关神经毒性综合征(ICANS)发生率(4级)1.8%(1/56)。RR组中6例患儿治疗有效,微小残留病(MRD)均转阴,治疗前MRD水平均<20%,其中3例患儿在贝林妥欧单抗停药14~42 d后MRD再次转阳;4例患儿治疗无效,治疗前MRD均>20%。MC组治疗前MRD阳性者均转阴。IC组治疗前后MRD均为阴性。RR组治疗有效的患儿中位随访时间为5.7(3.8,9.4)个月,1年生存率及无事件生存率分别为40.0%±21.9%和33.3%±19.2%。MC组及IC组患儿中位随访时间分别为6.7(5.2,12.5)个月和7.1(5.1,7.6)个月,无事件生存率均为100%。贝林妥欧单抗在部分RR、MRD清除和化疗不耐受情况下应用的安全性及疗效良好。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
B细胞型急性淋巴细胞白血病(B-cell acute lymphoblastic leukemia,B-ALL)是儿童血液肿瘤最常见的类型。一线治疗是由激素、蒽环类药物、门冬酰胺酶、新碱类药物、环磷酰胺、巯嘌呤、甲氨蝶呤等化疗药物组成为期2~3年的规律联合化疗方案,90%以上的患儿可获得长期生存;10%~20%的患儿复发,化疗后部分患儿可获得再次缓解,但比例降低,长期生存率仅约为50%。微小残留病(minimal residual disease,MRD)是复发的危险因素[1]。化疗不耐受或并发症导致化疗强度减弱或中断,也可增加复发的风险。有效清除MRD、降低化疗强度、甚至去化疗化是儿童B-ALL方案的优化方向。贝林妥欧单抗是靶向CD19和CD3的双特异性T细胞衔接分子(bispecific T-cell engagers,BiTE),介导CD3+T细胞对CD19+肿瘤细胞的定向识别和杀伤,在复发难治性B-ALL的治疗、MRD清除和化疗不耐受时的维持治疗中取得较好疗效[2, 3, 4, 5],联合TKI药物的去化疗方案提高了费城染色体阳性(philadelphia chromosome-positive,Ph+)B-ALL的缓解率[6]。然而,国内应用贝林妥欧单抗治疗儿童ALL的研究较少[7]。本研究回顾性分析接受贝林妥欧单抗治疗的B-ALL患儿的临床资料,旨在分析贝林妥欧单抗在儿童B-ALL患者中应用的安全性及疗效,以期改善此类患儿的预后。
1.对象:本研究为病例系列研究,回顾性纳入2021年8月至2023年10月中国医学科学院血液病医院儿童血液与肿瘤诊疗中心接受贝林妥欧单抗治疗的B-ALL患儿。本研究经中国医学科学院血液病医院伦理委员会审核批准(审批号:IIT2021009-EC-1),并取得研究对象及其监护人的知情同意。(1)纳入标准:①根据WHO形态学、免疫学、细胞遗传学和分子生物学(morphology,immunology,cytogenetics and molecular biology,MICM)分型确诊为B-ALL,流式免疫分型确定肿瘤细胞表面表达CD19;②接受贝林妥欧单抗治疗。(2)排除标准:临床资料不完整。(3)分组:根据贝林妥欧单抗首次应用前患儿的疾病状态分为3组:难治/复发(recurrent/relapse,RR)组、MRD清除(MRD clearance,MC)组和化疗不耐受(intolerance of chemotherapy,IC)组。
2.资料收集:详细收集患儿的人口学特征、实验室检查、影像学检查、治疗方案、治疗后临床表现、疾病评估及生存情况等资料。
3.贝林妥欧单抗输注方法:采用24 h匀速静脉滴注的方式。每周期推荐治疗时间为28 d,但由于不良反应、疗效、经济差异等原因,本研究中的患儿使用的时间范围是1~30 d。
4.疗效评估:采用流式细胞术检测(flow cytometry,FCM)MRD并作为疗效评估指标,细胞获取数目500 000个及以上,能检测到肿瘤细胞为MRD阳性;未检测到肿瘤细胞为MRD阴性[1];本研究将MRD由阳性转为阴性或降低1个数量级及以上为MRD反应(10的指数差一位即1个数量级),MRD降低不超过1个数量级或升高定义为MRD无反应。
5.随访及研究终点:本研究随访截至2023年11月15日。研究终点包括总生存、无事件生存(event‐free survival,EFS)、复发。(1)总生存时间:贝林妥欧单抗开始应用至死亡时间或末次随访时间;(2)EFS时间:自FCM MRD转阴至MRD转阳、疾病复发、死亡或末次随访的时间(FCM MRD阴性患儿自药物开始应用至MRD转阳、疾病复发、死亡或末次随访的时间)。
6.定义:(1)RR-ALL:复发性ALL指获得完全缓解(complete remission,CR)后外周血或骨髓再次出现原始细胞(比例>5%),或出现髓外浸润;难治性ALL指诱导治疗结束未获CR或血细胞未完全恢复的CR(CR with incomplete hematological recovery,CRi)。(2)MC:贝林妥欧单抗治疗前流式细胞学和(或)分子生物学MRD阳性。(3)IC:因感染或并发症等导致化疗中断,因门冬酰胺酶过敏、重症胰腺炎、血栓等导致门冬酰胺酶药物暴露不足。(4)细胞因子释放综合征(cytokine release syndrome,CRS):由于T细胞的激活激发体内免疫系统连锁反应,产生多种细胞因子,引起发热、低血压、血管渗透性增加、缺氧和器官毒性等。CRS分级参考美国移植和细胞治疗学会共识[8]。(5)免疫效应细胞相关神经毒性综合征(immune effector cell-associated neurotoxicity syndrome,ICANS):T细胞和(或)其他免疫效应细胞激活累及中枢神经系统,表现为头痛、谵妄、脑病、失语症、嗜睡、注意力不集中、激动、震颤、癫痫发作和脑水肿。ICANS分级参考美国移植和细胞治疗学会共识。其他不良反应分级参考CTCAE 5.0。
7.统计学方法:采用SPSS 26.0软件进行统计学分析。符合正态分布的计量资料采用范围表示;非正态分布计量资料采用M(Q1,Q3)表示。计数资料以例(%)表示。总生存率、无事件生存率采用Kaplan‐Meier法进行分析。
1.一般临床资料:共纳入35例患儿,男20例,女15例,年龄0.6~16.4(9.9±4.2)岁,入组患儿具体信息见表1。RR组包括2例难治性ALL,8例复发性ALL,中位复发时间为22.6(3.2,60.7)个月,自确诊复发至用药间隔时间为1.6(0.6,3.0)个月。MC组包括15例中危,5例高危,自确诊至用药间隔3.4(2.2,7.6)个月。IC组3例低危、2例中危,3例低危患儿分别因重症感染(1例)、重症胰腺炎(2例)导致诱导治疗中断或强度不足而在诱导治疗后接受1疗程贝林妥欧单抗治疗;2例中危患儿因门冬酰胺酶过敏(1例)、重症胰腺炎(1例)导致维持治疗强度不足以再诱导阶段加用1疗程贝林妥欧单抗,自确诊至用药间隔5.7(1.4,10.3)个月。
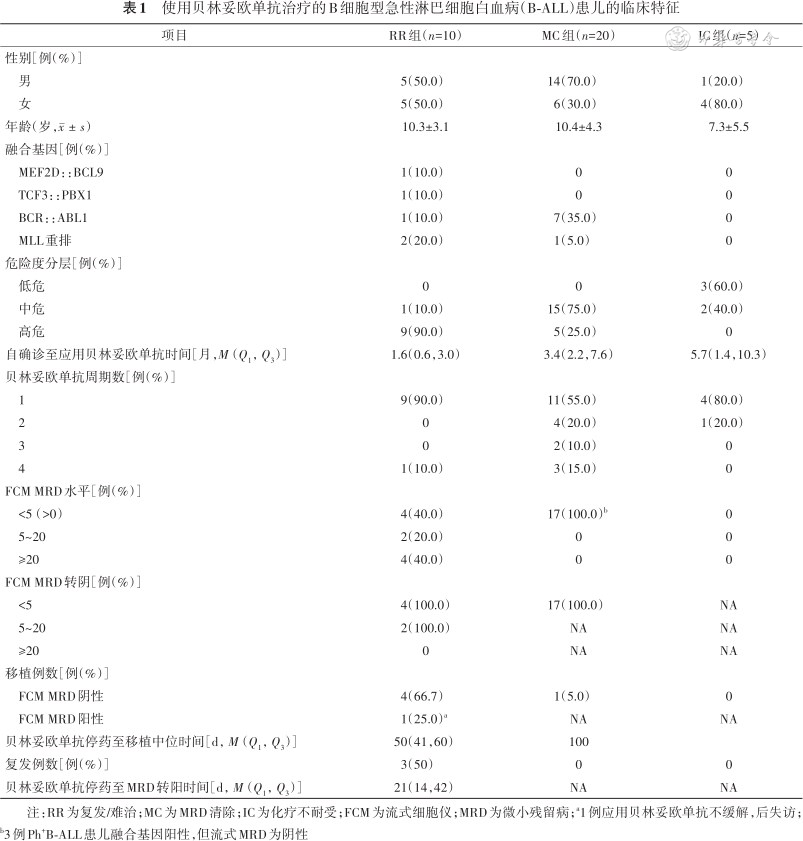
使用贝林妥欧单抗治疗的B细胞型急性淋巴细胞白血病(B-ALL)患儿的临床特征
使用贝林妥欧单抗治疗的B细胞型急性淋巴细胞白血病(B-ALL)患儿的临床特征
| 项目 | RR组(n=10) | MC组(n=20) | IC组(n=5) |
|---|---|---|---|
| 性别[例(%)] | |||
| 男 | 5(50.0) | 14(70.0) | 1(20.0) |
| 女 | 5(50.0) | 6(30.0) | 4(80.0) |
| 年龄(岁,) | 10.3±3.1 | 10.4±4.3 | 7.3±5.5 |
| 融合基因[例(%)] | |||
| MEF2D::BCL9 | 1(10.0) | 0 | 0 |
| TCF3::PBX1 | 1(10.0) | 0 | 0 |
| BCR::ABL1 | 1(10.0) | 7(35.0) | 0 |
| MLL重排 | 2(20.0) | 1(5.0) | 0 |
| 危险度分层[例(%)] | |||
| 低危 | 0 | 0 | 3(60.0) |
| 中危 | 1(10.0) | 15(75.0) | 2(40.0) |
| 高危 | 9(90.0) | 5(25.0) | 0 |
| 自确诊至应用贝林妥欧单抗时间[月,M(Q1,Q3)] | 1.6(0.6,3.0) | 3.4(2.2,7.6) | 5.7(1.4,10.3) |
| 贝林妥欧单抗周期数[例(%)] | |||
| 1 | 9(90.0) | 11(55.0) | 4(80.0) |
| 2 | 0 | 4(20.0) | 1(20.0) |
| 3 | 0 | 2(10.0) | 0 |
| 4 | 1(10.0) | 3(15.0) | 0 |
| FCM MRD水平[例(%)] | |||
| <5(>0) | 4(40.0) | 17(100.0)b | 0 |
| 5~20 | 2(20.0) | 0 | 0 |
| ≥20 | 4(40.0) | 0 | 0 |
| FCM MRD转阴[例(%)] | |||
| <5 | 4(100.0) | 17(100.0) | NA |
| 5~20 | 2(100.0) | NA | NA |
| ≥20 | 0 | NA | NA |
| 移植例数[例(%)] | |||
| FCM MRD阴性 | 4(66.7) | 1(5.0) | 0 |
| FCM MRD阳性 | 1(25.0)a | NA | NA |
| 贝林妥欧单抗停药至移植中位时间[d,M(Q1,Q3)] | 50(41,60) | 100 | |
| 复发例数[例(%)] | 3(50) | 0 | 0 |
| 贝林妥欧单抗停药至MRD转阳时间[d,M(Q1,Q3)] | 21(14,42) | NA | NA |
注:RR为复发/难治;MC为MRD清除;IC为化疗不耐受;FCM为流式细胞仪;MRD为微小残留病;a1例应用贝林妥欧单抗不缓解,后失访;b3例Ph+B-ALL患儿融合基因阳性,但流式MRD为阴性
2.贝林妥欧单抗的输注情况和不良反应:35例患儿输注周期数为1~4个,共完成56周期输注,输注情况见表2。中止输注有以下原因:第1周期中1例患儿(MC组)在第3天出现ICANS终止输注;1例患儿(MC组)第2天出现CRS 2级反应,要求中止输注,1周后再次应用时未发生CRS;第2周期中1例患儿(IC组)在第16天因感染中止;第4周期中1例患儿(MC组)在第21天因头痛要求中止。不良反应发生情况:CRS发生率为57.1%(32/56,1~2级),1级CRS占84.4%(27/32),2级CRS占15.6%(5/32);80%(4/5)的2级CRS发生于FCM MRD水平在1%~20%的患者中。中性粒细胞缺乏发生率为3.6%(4级);肝酶升高发生率为3.6%(1~2级);ICANS发生率为1.8%(4级),输注前FCM MRD仅0.03%(MC组);感染性发热发生率为17.8%。除ICANS外,余患儿可不中断治疗,或待反应或感染控制后继续输注。
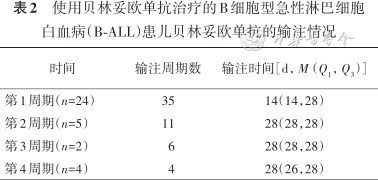
使用贝林妥欧单抗治疗的B细胞型急性淋巴细胞白血病(B-ALL)患儿贝林妥欧单抗的输注情况
使用贝林妥欧单抗治疗的B细胞型急性淋巴细胞白血病(B-ALL)患儿贝林妥欧单抗的输注情况
| 时间 | 输注周期数 | 输注时间[d,M(Q1,Q3)] |
|---|---|---|
| 第1周期(n=24) | 35 | 14(14,28) |
| 第2周期(n=5) | 11 | 28(28,28) |
| 第3周期(n=2) | 6 | 28(28,28) |
| 第4周期(n=4) | 4 | 28(26,28) |
3.FCM MRD应答情况:RR组中骨髓形态达CR 1例,CRi 5例,MRD FCM转阴6例(60%),FCM MRD低于5%的4例患儿及介于5%~20%的2例患儿1周期治疗后FCM MRD均转阴(表1)。其中1例患儿第4周期结束仅42 d复查MRD即转阳,1例患儿(伴MEF2D::BCL9)在结束治疗21 d后转阳,1例患儿(伴TCF3::PBX1)在结束治疗14 d后融合基因转阳,治疗后120 d(移植后70 d)全面复发。FCM MRD高于20%的4例患儿均未获得MRD应答。20例MC患儿中,17例FCM MRD阳性患儿治疗后FCM MRD转阴,包括因ICANS仅输注2 d的患儿。3例伴BCR::ABL1的患儿治疗前FCM MRD阴性而BCR::ABL1定量为阳性,治疗后FCM MRD仍为阴性。IC组治疗前FCM MRD均为阴性,治疗后FCM MRD仍为阴性。
4.生存分析:(1)RR组:RR组FCM MRD转阴的6例病例中,4例桥接造血干细胞移植(hematopoietic stem cell transplantation,HSCT),2例在移植前复发,1例转入其他治疗,1例因原发病死亡。目前中位随访时间为5.7(3.8,9.4)个月,1年生存率及无事件生存率分别为40.0%±21.9%和33.3%±19.2%(图1A~B)。(2)MC及IC组:MC及IC组患儿大部分继续按原化疗方案治疗,5例患儿继续应用贝林妥欧单抗巩固治疗;目前分别随访6.7(5.2,12.5)个月和7.1(5.1,7.6)个月,无事件生存率均100%(图1C~1D)。
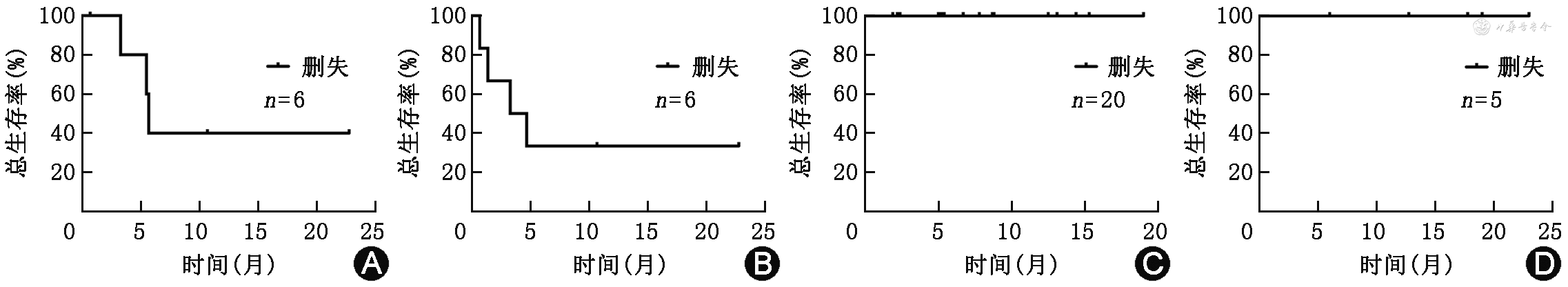

注:RR为复发/难治;MC为微小残留病(MRD)清除;IC为化疗不耐受
贝林妥欧单抗在国外应用10余年,积累了大量临床数据,在中国仅应用2年余,治疗儿童B-ALL的经验有限。本研究纳入了35例使用贝林妥欧单抗治疗的B-ALL患儿,治疗类型包括RR-ALL、MRD清除及化疗不耐受期的维持治疗和化疗剂量不足的补充治疗,为国内贝林妥欧单抗在儿童B-ALL中的应用提供了参考经验。
本研究共纳入10例RR B-ALL患儿,2例难治性,7例高危复发,1例中危复发,疾病恶性度较高。FCM MRD转阴的6例患儿用药前肿瘤负荷较低(FCM MRD<20%),4例无应答病例用药前肿瘤负荷均较高(>20%),与文献报道基本一致[9]。部分患儿MRD阴性状态维持极短时间,3例患儿在停药14~42 d再次转阳,提示贝林妥欧单抗仅可作为RR-ALL患儿降低肿瘤负荷的手段,建议尽快进行HSCT。安全性方面,本研究患儿无3级及以上不良反应发生,耐受性较好。
B-ALL的化疗毒性可导致化疗中断或死亡。保证疗效同时降低化疗毒性是B-ALL一线治疗的努力方向。贝林妥欧单抗具有较高的安全性,有望加入一线治疗[10]。2023年11月发表的1项回顾性对照试验纳入了105例接受贝林妥欧单抗一线治疗的儿童及年轻成人(年龄1~24岁),耐受性较好,与UKALL 2003化疗方案相比,EFS和总生存率均改善[3]。另有4项回顾性研究分别报道了11、23、8、17例初诊ALL患者应用贝林妥欧单抗清除MRD或在化疗不耐受及感染情况下维持治疗的案例[11, 12, 13, 14]。2项进行中的前瞻性研究(NCT03914625和NCT03643276),探索在初治ALL患儿伴有不良预后因素时,如诱导方案后MRD阳性或伴有不良遗传学特征,加入1~2个疗程贝林妥欧单抗是否获益。本研究纳入了20例CR伴MRD阳性患儿和5例化疗不耐受患儿,贝林妥欧单抗治疗后FCM MRD均转阴或在治疗期间及治疗后维持阴性。但由于本研究的随访时间尚短,可能尚未到达复发时间,因此不能判断患儿的复发风险。
本研究也存在不足:病例数较少、入组标准及治疗方案欠统一、随访时间短,仍有必要开展前瞻性研究来探索贝林妥欧单抗的最佳使用时机、用药周期及长期预后。
综上,贝林妥欧单抗在RR-ALL、MC和IC等情况下应用的安全性良好,但即使在肿瘤负荷极低情况下,仍有发生ICANS的风险。在RR-ALL中贝林妥欧单抗有助于HSCT前达到深度缓解;在一线应用中可有效清除MRD,或在化疗中断期或不耐受期作为安全有效的替代治疗。
李晓兰, 赵贝贝, 万扬, 等. 贝林妥欧单抗治疗儿童B细胞型急性淋巴细胞白血病的安全性及疗效[J]. 中华医学杂志, 2024, 104(27): 2563-2567. DOI: 10.3760/cma.j.cn112137-20240224-00392.
所有作者声明不存在利益冲突



























