美国癌症联合委员会(AJCC)肿瘤分期系统是临床应用最广泛的肿瘤分期依据。2023年10月,AJCC发布了第九版胃神经内分泌瘤分期系统,并于2024年1月开始应用实施。第九版胃神经内分泌瘤分期系统主要在组织病理分型、诊断和分期方法、临床及病理分期、预后分级、肿瘤及非肿瘤因素预后特征等方面进行了更新。分期系统的更新及推行对胃神经内分泌瘤的准确诊断、分期和精准治疗提供了更详细的参考依据,便于临床医师进行临床实践。本文结合相关循证医学证据对胃神经内分泌瘤新版分期的重要更新进行阐述解读。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
神经内分泌肿瘤(neuroendocrine neoplasm,NEN)是一类起源于肽能神经元和神经内分泌细胞,具有神经内分泌标志物、能够产生生物活性胺和(或)多肽激素的肿瘤[1, 2]。NEN可发生于全身各处,以发生在胃肠胰和肺部最为常见。2017年国际癌症研究机构(International Agency for Research on Cancer,IARC)组织专家团队形成共识,按照分化程度将分化良好的NEN分类为神经内分泌瘤(neuroendocrine tumor,NET),将分化差的NEN分类为神经内分泌癌(neuroendocrine carcinoma,NEC)[3]。NET具有独特的疾病特征和预后特点,发病率逐渐升高[4, 5]。国家癌症中心分析了我国246个肿瘤登记中心数据显示,胃NEN年龄标准化的发病率为0.21/10万人,占当年所有新发NEN病例的19.7%,仅次于胰腺和肺[6]。从2000—2007年,胃NEN年龄标准化的发生率以10.3%的年增长率位居增幅第三,仅次于直肠和肺[6]。胃NET发病率的快速增长,一方面说明了临床医师及病理学家对其关注度增加,另一方面也得益于诊疗技术和设备的不断发展和普及。随着对胃NET的持续关注和深入研究,胃NET的分期诊断和治疗决策也在不断更新。
2023年10月,美国癌症联合委员会(American Joint Committee on Cancer,AJCC)更新发布了第九版胃NET的分期系统(以下称“第九版分期系统”),并且已于2024年1月1日开始正式推行。第九版胃NET分期系统适用于分化良好的胃NET(G1、G2、G3),而对于NEC、混合型腺-神经内分泌癌(mixed adenocarcinoma-NEC)和混合型腺-神经内分泌瘤(mixed adenocarcinoma-NET)均遵照AJCC胃腺癌TNM系统进行分期。此外,新版分期的内容在第八版的基础上做了很大的更新和变化,包括病理类型的更新、临床分型的调整、分期系统的细化和注释内容的详解等;强调了肿瘤因素和非肿瘤因素,从“癌症分期手册”(Cancer Staging Manual)转变为“癌症分期系统”(Cancer Staging System),以更好地服务于NET的分期诊断和精准治疗。本文结合第九版AJCC癌症分期系统中胃NET的更新要点以及相关循证依据,对新版指南进行详细解读。
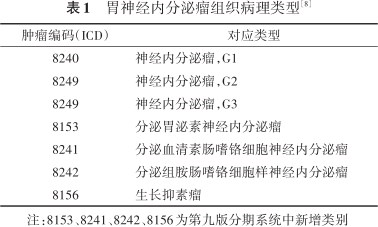
NEN可以发生在不同器官,既往针对不同器官所划分的NEN组织分型差异很大,不利于病理学家和临床医生交流和管理。胃NET第九版分期系统的组织病理类型依据第五版世界卫生组织病理学分类分级标准进行了更新[7]。除了继续保留依据分化程度、核分裂像和Ki-67指数进行 G1、G2和G3的分类外,第九版分期系统还依据细胞起源,将能够分泌激素的功能性NET列举更新到胃NET的组织病理学分类中,包括分泌胃泌素(G-cell)NET、分泌血清素肠嗜铬细胞(EC-cell)NET、分泌组胺肠嗜铬细胞样(ECL-cell)NET以及未指定分类的生长抑素瘤(也称D细胞NET)。但是大部分的胃NET并没有分泌相关的症状,且属于分泌组胺嗜铬细胞样NET[8]。见表1。
相比于第八版分期,第九版分期系统新增加了PPI相关的胃NET临床亚型。已有研究表明,1型和2型胃NET发生的主要原因是长期高胃泌素血症过度刺激ECL细胞,导致其过度增殖,从而诱发胃NET[9, 10]。质子泵抑制(proton pump inhibitor,PPI)药物作为抑酸药物广泛地应用于临床,是胃酸分泌异常及相关疾病的一线药物[11]。研究表明,长期使用PPI药物(超过1年)会导致受试者出现高胃泌素血症,且多数受试者的空腹血清胃泌素水平增加3~5倍[12]。长期使用PPI药物反馈性诱导的高胃泌素血症是否也与胃NET的发生有关?美国一项研究发现,服用PPI药物超过10年并且用药剂量较高的患者罹患胃NET的风险加大[13]。也有研究报道,PPI相关型胃NET具有区别于1型或2型胃NET临床亚型的独特临床特征,可能是一种新的临床病理分型[14]。基于上述相关研究结果,胃NET第九版分期系统中,将PPI相关的胃NET作为独立的临床亚型列举分析其主要临床病理特征,见表2。在肿瘤登记数据收集时,新版分期系统将PPI用药史也纳入登记采集范围。
| 临床分型 | 人口统计学 | 发生率 | 高胃泌素血症 | 泌酸 | 相关疾病 | 好发部位 | 内镜发现 | |||
|---|---|---|---|---|---|---|---|---|---|---|
| 1型 | 女>男;50~60岁高发 | 65% | 有 | 低或无 | 萎缩性胃炎 | 胃体或胃底 | 单发或多数多发;扁平或息肉样; 直径小;背景黏膜萎缩 | |||
| 2型 | 女=男;平均发病年龄 50岁 | 2% | 有 | 高 | MEN-1/ZES | 胃体或胃底 | 通常多发;息肉样;直径小 | |||
| 3型 | 男>女;平均发病年龄: 55岁 | 13% | 无 | 正常 | 无 | 胃窦或胃体或 胃底 | 单发;块状或息肉样;经常可见 溃疡形成;直径大 | |||
| PPI相关型 | 女≈男;大部分发生在 50~70岁 | 20% | 有 | 不清楚 | 长期应用PPI 药物 | 胃体或胃底 | 单发或多发;息肉样;直径小; 背景无萎缩黏膜出现 | |||
| 临床分型 | 胃黏膜背景 | 病理分级 | 侵犯深度 | 转移 | 5年生存率 | |||||
| 1型 | 可见慢性萎缩性胃炎;壁细胞缺乏;肠化生; ECL细胞增生 | 大多数G1或G2<10% | 黏膜内多见 | 几乎不 | ~100% | |||||
| 2型 | 可见壁细胞和ECL细胞增生 | 大多数G1 | 黏膜内多见 | <30% | 60%~90% | |||||
| 3型 | 正常 | 大多数G2,少部分G1/3 | 深度侵犯 | 50%~100% | <50% | |||||
| PPI相关型 | 可见壁细胞、ECL细胞和神经内分泌细胞增生 | G1或G2 | 黏膜内/黏膜下 | 几乎不 | ~100% | |||||
注:NET:神经内分泌瘤;PPI:质子泵抑制剂;MEN-1:多发性内分泌腺瘤病1型;ZES:佐林格-埃利森综合征;ECL:嗜铬细胞样
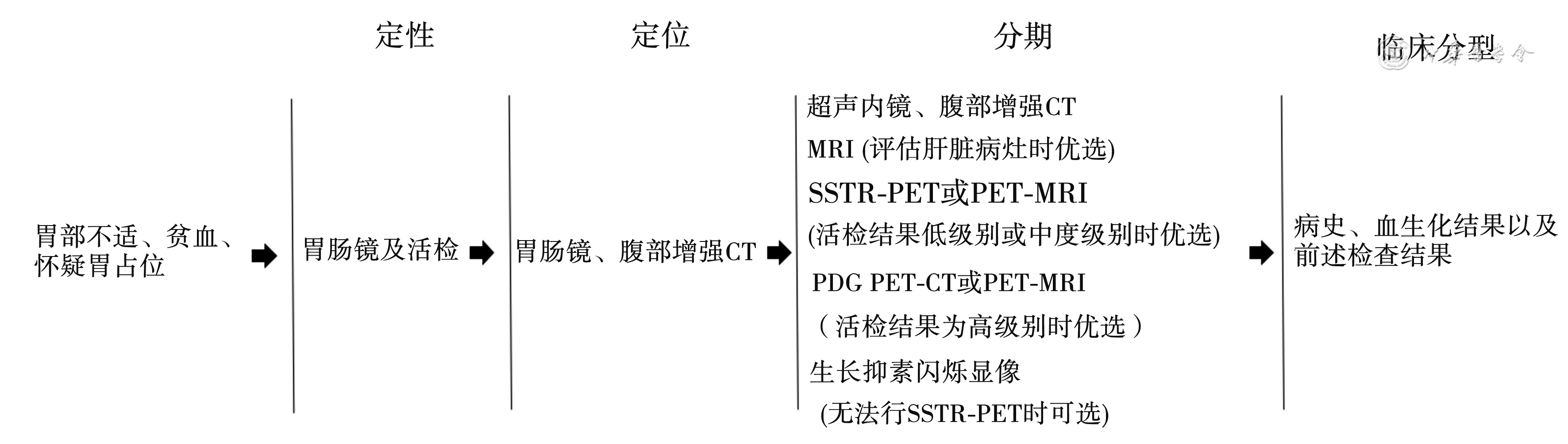
胃NET无典型的临床表现,依靠影像学和组织病理学明确诊断[8,15]。新版分期系统中详述了胃NET的诊断和分期检查方式,尤其在影像学检查方面,新版分期推荐通过超声内镜(endoscopic ultrasonography,EUS)、腹盆腔CT、腹部MRI、SSTR-PET或(18F-FDG)PET-CT进行胃NET诊断和协助分期。EUS常用于胃NET的诊断,尤其对于1型和PPI相关型胃NET微小肿瘤,EUS在诊断和术前评估方面具有良好的敏感性[8,16, 17]。同时,腹盆CT常用于原发灶和肝外转移的评价,而腹部MRI 发现肝内转移的特异性更高,两者联合评估胃NET转移病灶的敏感性接近80%[8,17]。
除了上述解剖影像学检查外,新版指南将功能影像学检查纳入胃NET的诊断和分期中。生长抑素受体(somatostatin-receptor,SSTR)广泛分布于人体神经内分泌组织,其在NEN中广泛表达,将放射性核素标记的生长抑素类似物引入体内,与肿瘤的SSTR特异结合而使肿瘤成像,生长抑素受体类似物显像(somatostatin-receptor scintigraphy,SSRS)被认为是GEP-NEN诊断和分期的金标准[18, 19, 20]。其中,SSTR-PET对于转移性胃NET的检出率最高,同时具有常规解剖影像学检查不具备的优势:高敏感性、高亲和性、高空间分辨率以及可以进行示踪剂摄取定量。既往使用放射性同位素药物indium-111 pentetreotide作为示踪剂使用,但由于其显影扫描分辨率差且存在放射暴露,新版分期系统不再推荐使用。目前,临床常用的SSTR靶向药物包括Gallium-68 DOTA-Tyr3-octreotatate(68Ga-DOTATATE)、Gallium-68 DOTA NaI3-octreotide(68Ga-DOTANOC)和gallium-68 DOTA-TyI3-octreotide(68Ga-DOTATOC),统称为68Ga-DOTA相关肽,这些放射药物在SSTR阳性表达肿瘤的成像中检出率差异微小,它们的差异仅在于对受体亚型的亲和力不同[21]。此外,由于放射性物质摄取程度随肿瘤分化程度而变化,约70%低级别(分化好)NET表达SSTR,在68Ga-DOTATATE PET-CT扫描中呈阳性,但18F FDG PET-CT摄取较低,而高级别(分化差)NET则与之相反,因此,选择使用68Ga-DOTATATE PET-CT和(或)18F-FDG PET-CT对于明确胃NET的诊断和分期具有重要的临床意义[21, 22]。不同诊断检查方式的总结见表3。当怀疑为胃NET时,可参考图1流程进行术前定性、定位、分期以及临床亚型分类。

胃神经内分泌瘤诊断检查方式与对临床分期的价值
胃神经内分泌瘤诊断检查方式与对临床分期的价值
| 诊断检查方式 | 描述说明 | 对TNM分期价值 |
|---|---|---|
| 临床检查 | ||
| EGD | 对肿瘤特征、大小、数目、周围黏膜情况进行描述;测定胃pH值 | 无 |
| 活检 | 病理诊断 | 无 |
| 影像学检查 | ||
| EUS | 肿瘤大小、侵犯深度、淋巴结转移情况 | T1~4 N1 |
| CT | 胸、腹、盆腔CT——明确原发肿瘤累积范围、淋巴结转移及远处转移情况 | T3~4 N1 M1a~c |
| MRI | 腹盆腔MRI——明确原发肿瘤累积范围、淋巴结转移及远处转移情况;有助于判断 肝转移病灶 | T3~4 N1 M1a~c |
| SSTR-PET或PET/MRI | 颅底到大腿中部——明确原发肿瘤累积范围、淋巴结转移及远处转移情况;尤其适用 于低-中级别肿瘤 | T3~4 N1 M1a~c |
| 生长抑素闪烁显像 | SPECT/CT全身扫描——明确原发肿瘤累积范围、淋巴结转移及远处转移情况;仅适用 于无法进行SSTR-PET时使用 | T3~4 N1 M1a~c |
| FDG-PET/CT或PET/MRI | 颅底到大腿中部——明确原发肿瘤累积范围、淋巴结转移及远处转移情况;尤其适用 于高级别肿瘤 | T3~4 N1 M1a~c |
| 实验室检查 | ||
| 生化检查 | 提供肿瘤分型信息;临床有指示时使用 | 无 |
| 基因检测 | 可能是MEN-1时检测 | 无 |
注:EGD:食管胃十二指肠镜;EUS:超声内镜;CT:计算机断层扫描;MRI:磁共振成像;SSTR:生长抑素受体;PET:正电子发射断层成像;SPECT:单光子发射型计算机断层成像;FDG:脱氧葡萄糖
患者的治疗方案需要依据胃NET的类型、肿瘤分期和病理分级等因素共同决定,其中肿瘤分期是重中之重。为了合理地将肿瘤分期,需要明确患者处在什么疾病阶段,即分期窗口(staging window)。相关研究表明,尽管多数直径≤1 cm的胃NET表现为惰性进展,但仍有约有29.5%的患者在观察随访中出现进展,而需要手术治疗。因此,临床上多数胃NET确诊后需要外科干预[23]。鉴于内镜下治疗的安全性和有效性已经得到证实,对于直径≤1 cm且无胃周可疑淋巴结及远处转移的胃NET,也可以选择内镜治疗[24, 25]。第九版胃NET分期系统在病理分期中也更新并强调了,内镜切除的标本同样可作为手术标本,获取T分期等肿瘤信息并用于分期[26]。第九版胃NET分期系统按照是否行内镜或外科治疗以及是否行术前新辅助治疗,来确定分期窗口,进而完成分期分类。不同分期窗口进行分期评估形成了不同的TNM分期分类,如初始治疗前的临床分期(clinical TNM classification,cTNM)、手术切除后的病理分期(pathological TNM classification,pTNM)、新辅助治疗后的临床分期(post-therapy clinical TNM classification,ycTNM)、新辅助治疗手术后的病理分期(post-therapy pathological TNM classification,ypTNM)、复发分期(recurrence/retreatment TNM classification,rTNM)以及尸检分期(autopsy TNM classification,aTNM)。从第九版胃NET分期系统的分类原则可以看出,胃NET分期总体上趋向于按照AJCC胃腺癌TNM分期规则进行分类。但是临床上大多数胃NET为早期肿瘤,初诊时即需要进行新辅助治疗的进展期胃NET比较少,因此,胃NET的分期更加侧重于内镜或外科干预前后的cTNM分期和pTNM分期。
第九版分期系统对胃NET的预后分期进行了修订,结构更加清晰,见表4。临床实践中,胃NET很少出现胃周淋巴结转移且预后良好,大部分患者行内镜治疗,未获取胃周淋巴结数据。因此,这部分患者的分期多数为T1NxM0[27, 28, 29]。但是第八版分期手册中并未提及T1NxM0胃NET的预后分期分类。美国国家癌症中心统计数据研究表明,T1NxM0和T1N0M0分期胃NET患者的远期预后差异无统计学意义[23,30]。鉴于此,第九版分期系统将T1NxM0胃NET的预后分期分类为Ⅰ期,完善了胃NET内镜治疗后的预后分期分类。但是新版胃NET分期系统并未提及原位癌(Tis)预后分期,以及也并未按照cTNM分期、pTNM分期和ypTNM分期分别推荐并制定预后分期。

胃神经内分泌瘤的预后分期
胃神经内分泌瘤的预后分期
| Nx | N0 | N1 | |
|---|---|---|---|
| T1 | Ⅰa | Ⅰ | Ⅲ |
| T2 | - | Ⅱ | Ⅲ |
| T3 | - | Ⅱ | Ⅲ |
| T4 | - | Ⅲ | Ⅲ |
| M1(任何T) | Ⅳ | Ⅳ | Ⅳ |
注:a新增T1NxM0预后分期为Ⅰ期;“-”示无内容
既往认为,嗜铬素蛋白A(CgA)是影响胃NET预后的肿瘤因素,外周血CgA的高低可以反映肿瘤负荷,监测治疗反应,且与不良预后相关。但进一步研究发现,萎缩性胃炎和肾衰竭等疾病以及PPI药物也会导致CgA升高,缺乏特异性和敏感性[17,31]。因此,第九版分期系统不再将CgA作为胃NET的预后肿瘤因素。临床上不同分型的胃NET,预后不同。长期随访数据表明,1型胃NET具有良好的长期预后,而3型胃NET的预后较差[32, 33, 34]。新版分期将胃NET的临床分型作为影响预后的肿瘤因素。本中心一项纳入501例胃NET的回顾性研究表明,年龄、性别、吸烟史和饮酒史等非肿瘤因素是影响患者预后的危险因素,且确诊时年龄≥60岁为影响预后的非肿瘤独立危险因素[35]。另一项荟萃分析表明,癌症家族史是NET的发生相关性最强的风险因素,其次是高BMI水平和糖尿病,吸烟和饮酒史也是潜在危险因素[36]。新版胃NET分期系统中将年龄、癌症家族史、吸烟、饮酒、BMI和糖尿病列为胃NET相关的非肿瘤危险因素。
综上,第九版胃NET分期系统进一步将分期关键要素及分期原则标准化,从而建立统一的科学评价体系,便于病情评估、预后判断、治疗决策、效果评价以及科学研究的开展和交流。同时我们也需看到新版本的局限性:(1)尽管提出了cTNM、ycTNM等分期概念,但未提供与pTNM分期有区别的具体分期方法。(2)胰胃素(pancreastatin)是在第八版分期中新增的潜在预后相关因素,其含量不受PPI药物等因素影响。但由于缺少相关数据支持,胰胃素并未在第九版分期系统中进一步推荐为常规使用。(3)提供了美国国家癌症中心2010—2016年诊断为胃NET的生存曲线图,但生存曲线图中Ⅰ期和Ⅱ期病例并未完全分开,表明Ⅰ期和Ⅱ期分期标准仍有细化改善空间。(4)在第八版分期中提到了个体化风险预后预测模型,但九版分期系统中并未提供[37]。
上述的局限性均与胃NET的发病率相对较低、循证数据不足相关。因此,笔者认为,胃NET相关研究更需要多个医疗中心的协作才能积累充足的病例。有了充足的病例积累,才能进一步改善优化cTNM、ycTNM等分期系统,才能建立准确地融合了分子分型的个体化预后预测模型系统。
吴迪, 常正尧, 谢天宇, 等. 美国癌症联合委员会第九版胃神经内分泌瘤分期系统更新要点及解读[J]. 中华胃肠外科杂志, 2024, 27(7): 734-739. DOI: 10.3760/cma.j.cn441530-20240313-00097.
所有作者均声明不存在利益冲突