
探讨嗜铬细胞瘤/副神经节瘤(PPGLs)患者临床特征与肿瘤病理特征的关系。
病例系列研究。回顾性纳入2019年1月至2022年12月就诊于北京协和医院且术后病理诊断为单发原发灶PPGLs的患者。以Ki-67增殖指数3%为界值分为Ki-67<3%组及Ki-67≥3%组。分析PPGLs患者临床特征与肿瘤病理特征的关系。
共纳入399例PPGLs患者,男177例,女222例,年龄[M(Q1,Q3)]为45.0(35.5,53.0)岁。其中226例起源于肾上腺(56.6%),104例起源于腹膜后(26.1%)。20.9%(27/129)的PPGLs患者携带有PPGLs易感基因胚系突变,以SDHB突变最为多见(10.1%,13/129)。302例PPGLs行Ki-67染色,Ki-67增殖指数[M(Q1,Q3)]为2.0%(1.0%,3.0%)。Ki-67<3%组194例,Ki-67≥3%组108例。与Ki-67<3%组相比,Ki-67≥3%组患者发病年龄更小(P=0.029)。与没有携带SDHB或Cluster 1A相关基因突变、131I-间碘苄胍(131I-MIBG)显像阳性或O-6-甲基鸟嘌呤-DNA甲基转移酶(MGMT)免疫组化染色阴性的PPGLs患者相比,携带有SDHB突变或Cluster 1A相关基因突变、131I-MIBG显像阴性或MGMT免疫组化染色阳性的PPGLs患者的Ki-67指数更高(均P<0.05)。与肾上腺嗜铬细胞瘤相比,腹膜后副神经节瘤携带SDHB突变的比例更大、甲氧基去甲肾上腺素(NMN)分泌型比例更高(均P<0.05)。与肾上腺嗜铬细胞瘤相比,头颈部副神经节瘤肿瘤最大径更小[3.0(1.9,3.8)cm比4.7(3.4,6.4)cm, P<0.001],Ki-67≥3%的比例更高(61.3%比33.8%,P=0.007)。
发病年龄早、携带SDHB或Cluster 1A相关基因胚系突变、131I-MIBG显像阴性或MGMT免疫组化染色阳性的PPGLs患者Ki-67指数更高。头颈部来源肿瘤通常较小,但增殖能力并不弱。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
嗜铬细胞瘤/副神经节瘤(pheochromocytomas and paragangliomas,PPGLs)是起源于肾上腺髓质或交感副交感神经节的罕见神经内分泌肿瘤。肿瘤合成和分泌过量儿茶酚胺(catecholamines,CAs),患者表现为血压升高、头痛、心悸、大汗等症状。PPGLs可依据患者临床表现、血浆或尿中升高的CAs及其代谢产物、肿瘤影像学和放射性核素摄取特点进行诊断,但确诊仍需依靠组织病理学结果[1]。此外,基于免疫组化(immunohistochemistry,IHC)技术的分子病理染色结果有助于肿瘤的鉴别诊断及患者预后的评估。然而,有关PPGLs病理与临床特征关系的研究较少,且纳入的病例有限,因此本研究拟通过总结大样本PPGLs患者的临床和病理特征,分析两者间关系,为临床诊治提供帮助。
病例系列研究。回顾性分析2019年1月至2022年12月就诊于北京协和医院的PPGLs患者的病例资料。纳入标准:(1)术后病理证实为PPGLs的患者;(2)PPGLs为单发原发病灶。排除标准:(1)PPGLs为多发病灶的患者;(2)发生转移的PPGLs患者。本研究已获得北京协和医院伦理委员会批准(批号:K3118),患者均签署知情同意书。
1. 收集患者的基本信息:(1)一般信息:性别、发病年龄、临床表现、病程中最高血压、肿瘤起源部位、肿瘤最大径等;(2)实验室检查:血浆甲氧基肾上腺素(metanephrine,MN)、甲氧基去甲肾上腺素(normetanephrine,NMN)、3-甲氧基酪胺(3-methoxytyramine,3-MT)、24 h尿去甲肾上腺素(norepinephrine,NE)、肾上腺素、多巴胺(dopamine,DA)、神经元特异性烯醇化酶(neuron specific enolase,NSE)水平等;(3)功能影像学检查结果:奥曲肽显像及131I-间碘苄胍(131I-meta-iodobenzylguanidine,131I-MIBG)肾上腺髓质显像;(4)病理诊断结果。
2. 基因检测及肿瘤分泌类型判定:通过一代测序、二代测序(next generation sequencing,NGS)明确部分患者携带的胚系突变情况。通过患者血浆CAs代谢产物水平判断肿瘤的分泌类型:如患者血浆MN升高,则肿瘤判定为MN型;仅NMN升高,则判定为NMN型;如两者均正常,则为无分泌型。
3. IHC染色:利用IHC染色检测肿瘤组织嗜铬蛋白A(chromogranin A,CgA)、突触素(synaptophysin,Syn)、Ki-67增殖指数、琥珀酸脱氢酶复合体铁硫亚基B(succinate dehydrogenase complex iron sulfur subunit B,SDHB)、S100钙结合蛋白(S100 calcium binding protein,S-100)、α地中海贫血/智力迟钝综合征基因(Alpha-thalassemia/memal retardation syndrome,ATRX)、O-6-甲基鸟嘌呤-DNA甲基转移酶(O-6-methylguanine-DNA methyltransferase,MGMT)和P53蛋白表达。PPGLs的病理诊断、IHC染色及结果判读均由北京协和医院病理科完成。
4. 分组方法:本研究以Ki-67增殖指数3%为界值分为Ki-67<3%组及Ki-67≥3%组。
采用R软件(4.1.3版)进行统计学分析。采用Shapiro-Wilk(S-W)检验分析计量资料分布情况,所有计量资料均为非正态分布,以M(Q1,Q3)表示,两组间比较采用Wilcoxon秩和检验。分类资料以例(%)表示,组间比较采用χ2检验或Fisher确切概率法检验。采用双侧检验,检验水平取α=0.05。
1. 临床特征:共纳入399例PPGLs患者,男177例,女222例,年龄为45.0(35.5,53.0)岁。肿瘤最常见的起源部位为肾上腺(56.6%,226/399),其次是腹膜后(26.1%,104/399),肿瘤最大直径为4.4(3.0,6.0)cm,奥曲肽显像和131I-MIBG显像阳性率分别为54.8%(153/279)和83.7%(211/252),见表1。共284例患者依据血浆CAs代谢产物水平评估肿瘤分泌类型,结果NMN分泌型114例(40.1%,114/284),MN分泌型116例(40.8%,116/284),无分泌型54例(19.0%,54/284),见表2。
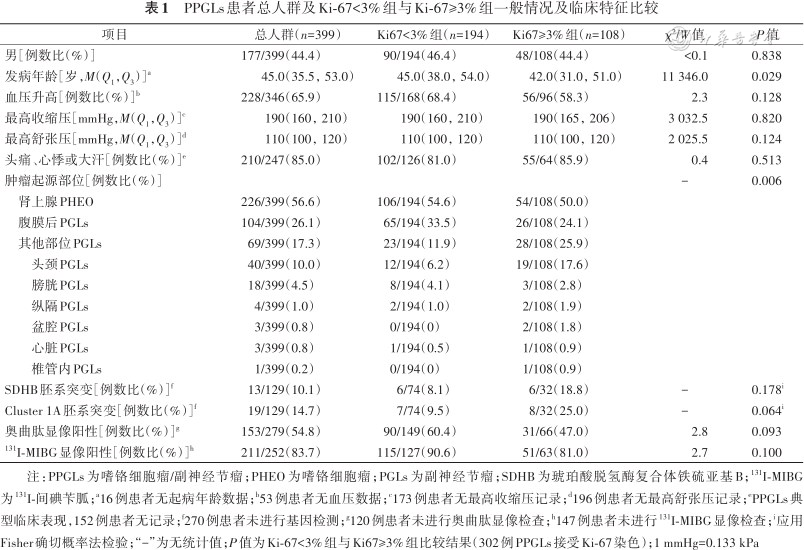
PPGLs患者总人群及Ki-67<3%组与Ki-67≥3%组一般情况及临床特征比较
PPGLs患者总人群及Ki-67<3%组与Ki-67≥3%组一般情况及临床特征比较
| 项目 | 总人群(n=399) | Ki67<3%组(n=194) | Ki67≥3%组(n=108) | χ²/W值 | P值 |
|---|---|---|---|---|---|
| 男[例数比(%)] | 177/399(44.4) | 90/194(46.4) | 48/108(44.4) | <0.1 | 0.838 |
| 发病年龄[岁,M(Q1,Q3)]a | 45.0(35.5,53.0) | 45.0(38.0,54.0) | 42.0(31.0,51.0) | 11 346.0 | 0.029 |
| 血压升高[例数比(%)]b | 228/346(65.9) | 115/168(68.4) | 56/96(58.3) | 2.3 | 0.128 |
| 最高收缩压[mmHg,M(Q1,Q3)]c | 190(160,210) | 190(160,210) | 190(165,206) | 3 032.5 | 0.820 |
| 最高舒张压[mmHg,M(Q1,Q3)]d | 110(100,120) | 110(100,120) | 110(100,120) | 2 025.5 | 0.124 |
| 头痛、心悸或大汗[例数比(%)]e | 210/247(85.0) | 102/126(81.0) | 55/64(85.9) | 0.4 | 0.513 |
| 肿瘤起源部位[例数比(%)] | - | 0.006 | |||
| 肾上腺PHEO | 226/399(56.6) | 106/194(54.6) | 54/108(50.0) | ||
| 腹膜后PGLs | 104/399(26.1) | 65/194(33.5) | 26/108(24.1) | ||
| 其他部位PGLs | 69/399(17.3) | 23/194(11.9) | 28/108(25.9) | ||
| 头颈PGLs | 40/399(10.0) | 12/194(6.2) | 19/108(17.6) | ||
| 膀胱PGLs | 18/399(4.5) | 8/194(4.1) | 3/108(2.8) | ||
| 纵隔PGLs | 4/399(1.0) | 2/194(1.0) | 2/108(1.9) | ||
| 盆腔PGLs | 3/399(0.8) | 0/194(0) | 2/108(1.8) | ||
| 心脏PGLs | 3/399(0.8) | 1/194(0.5) | 1/108(0.9) | ||
| 椎管内PGLs | 1/399(0.2) | 0/194(0) | 1/108(0.9) | ||
| SDHB胚系突变[例数比(%)]f | 13/129(10.1) | 6/74(8.1) | 6/32(18.8) | - | 0.178i |
| Cluster 1A胚系突变[例数比(%)]f | 19/129(14.7) | 7/74(9.5) | 8/32(25.0) | - | 0.064i |
| 奥曲肽显像阳性[例数比(%)]g | 153/279(54.8) | 90/149(60.4) | 31/66(47.0) | 2.8 | 0.093 |
| 131I-MIBG显像阳性[例数比(%)]h | 211/252(83.7) | 115/127(90.6) | 51/63(81.0) | 2.7 | 0.100 |
注:PPGLs为嗜铬细胞瘤/副神经节瘤;PHEO为嗜铬细胞瘤;PGLs为副神经节瘤;SDHB为琥珀酸脱氢酶复合体铁硫亚基B;131I-MIBG为131I-间碘苄胍;a16例患者无起病年龄数据;b53例患者无血压数据;c173例患者无最高收缩压记录;d196例患者无最高舒张压记录;ePPGLs典型临床表现,152例患者无记录;f270例患者未进行基因检测;g120例患者未进行奥曲肽显像检查;h147例患者未进行131I-MIBG显像检查;i应用Fisher确切概率法检验;“-”为无统计值;P值为Ki-67<3%组与Ki67≥3%组比较结果(302例PPGLs接受Ki-67染色);1 mmHg=0.133 kPa
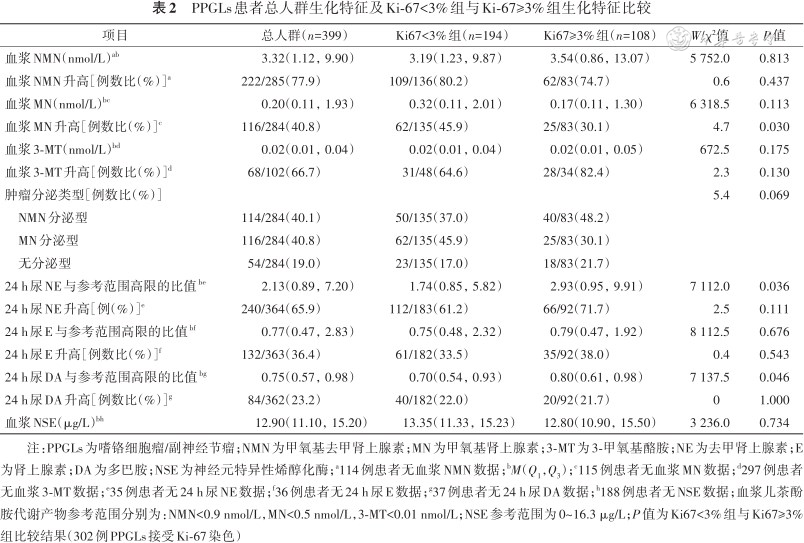
PPGLs患者总人群生化特征及Ki-67<3%组与Ki-67≥3%组生化特征比较
PPGLs患者总人群生化特征及Ki-67<3%组与Ki-67≥3%组生化特征比较
| 项目 | 总人群(n=399) | Ki67<3%组(n=194) | Ki67≥3%组(n=108) | W/χ²值 | P值 |
|---|---|---|---|---|---|
| 血浆NMN(nmol/L)ab | 3.32(1.12,9.90) | 3.19(1.23,9.87) | 3.54(0.86,13.07) | 5 752.0 | 0.813 |
| 血浆NMN升高[例数比(%)]a | 222/285(77.9) | 109/136(80.2) | 62/83(74.7) | 0.6 | 0.437 |
| 血浆MN(nmol/L)bc | 0.20(0.11,1.93) | 0.32(0.11,2.01) | 0.17(0.11,1.30) | 6 318.5 | 0.113 |
| 血浆MN升高[例数比(%)]c | 116/284(40.8) | 62/135(45.9) | 25/83(30.1) | 4.7 | 0.030 |
| 血浆3-MT(nmol/L)bd | 0.02(0.01,0.04) | 0.02(0.01,0.04) | 0.02(0.01,0.05) | 672.5 | 0.175 |
| 血浆3-MT升高[例数比(%)]d | 68/102(66.7) | 31/48(64.6) | 28/34(82.4) | 2.3 | 0.130 |
| 肿瘤分泌类型[例数比(%)] | 5.4 | 0.069 | |||
| NMN分泌型 | 114/284(40.1) | 50/135(37.0) | 40/83(48.2) | ||
| MN分泌型 | 116/284(40.8) | 62/135(45.9) | 25/83(30.1) | ||
| 无分泌型 | 54/284(19.0) | 23/135(17.0) | 18/83(21.7) | ||
| 24 h尿NE与参考范围高限的比值be | 2.13(0.89,7.20) | 1.74(0.85,5.82) | 2.93(0.95,9.91) | 7 112.0 | 0.036 |
| 24 h尿NE升高[例(%)]e | 240/364(65.9) | 112/183(61.2) | 66/92(71.7) | 2.5 | 0.111 |
| 24 h尿E与参考范围高限的比值bf | 0.77(0.47,2.83) | 0.75(0.48,2.32) | 0.79(0.47,1.92) | 8 112.5 | 0.676 |
| 24 h尿E升高[例数比(%)]f | 132/363(36.4) | 61/182(33.5) | 35/92(38.0) | 0.4 | 0.543 |
| 24 h尿DA与参考范围高限的比值bg | 0.75(0.57,0.98) | 0.70(0.54,0.93) | 0.80(0.61,0.98) | 7 137.5 | 0.046 |
| 24 h尿DA升高[例数比(%)]g | 84/362(23.2) | 40/182(22.0) | 20/92(21.7) | 0 | 1.000 |
| 血浆NSE(μg/L)bh | 12.90(11.10,15.20) | 13.35(11.33,15.23) | 12.80(10.90,15.50) | 3 236.0 | 0.734 |
注:PPGLs为嗜铬细胞瘤/副神经节瘤;NMN为甲氧基去甲肾上腺素;MN为甲氧基肾上腺素;3-MT为3-甲氧基酪胺;NE为去甲肾上腺素;E为肾上腺素;DA为多巴胺;NSE为神经元特异性烯醇化酶;a114例患者无血浆NMN数据;bM(Q1,Q3);c115例患者无血浆MN数据;d297例患者无血浆3-MT数据;e35例患者无24 h尿NE数据;f36例患者无24 h尿E数据;g37例患者无24 h尿DA数据;h188例患者无NSE数据;血浆儿茶酚胺代谢产物参考范围分别为:NMN<0.9 nmol/L,MN<0.5 nmol/L,3-MT<0.01 nmol/L;NSE参考范围为0~16.3 μg/L;P值为Ki67<3%组与Ki67≥3%组比较结果(302例PPGLs接受Ki-67染色)
2. 基因特征:共129例患者接受基因检测,其中27例携带有PPGLs易感基因胚系突变,以SDHB突变(10.1%,13/129)最为多见,其次是RET(3.1%,4/129)、SDHA(3.1%,4/129)、VHL(1.6%,2/129)、SDHD(0.8%,1/129)、FH(0.8%,1/129)、NF1(0.8%,1/129)和TMEM127(0.8%,1/129)。
3. IHC染色方面:98.5%(199/202)的PPGLs表现为Syn阳性,肿瘤组织均为CgA染色阳性(302/302)。302例PPGLs行Ki-67染色,Ki-67增殖指数为2.0%(1.0%,3.0%)。280例行S-100染色,93.2%(261/280)表现为阳性。此外,分别有46例、16例和12例肿瘤组织进行了MGMT、ATRX和P53染色,阳性率分别为19.6%、87.5%和8.3%,见表3。

PPGLs患者的病理特征(n=399)
PPGLs患者的病理特征(n=399)
| 病理特征 | 结果 |
|---|---|
| 肿瘤最大直径[cm,M(Q1,Q3)]a | 4.4(3.0,6.0) |
| Ki-67指数[%,M(Q1,Q3)]b | 2.0(1.0,3.0) |
| Syn(+)[例数比(%)]c | 199/202(98.5) |
| CgA(+)[例数比(%)]d | 302/302(100.0) |
| S-100(+)[例数比(%)]e | 261/280(93.2) |
| P53(+)[例数比(%)]f | 1/12(8.3) |
| SDHB(+)[例数比(%)]g | 123/129(95.4) |
| ATRX(+)[例数比(%)]h | 14/16(87.5) |
| MGMT(+)[例数比(%)]i | 9/46(19.6) |
注:PPGLs为嗜铬细胞瘤/副神经节瘤;Syn为突触素;CgA为嗜铬蛋白A;S-100为S100钙结合蛋白;SDHB为琥珀酸脱氢酶复合体铁硫亚基B;ATRX为α地中海贫血/智力迟钝综合征基因;MGMT为O-6-甲基鸟嘌呤-DNA甲基转移酶;a2例患者无肿瘤大小数据;b97例肿瘤未进行Ki-67染色;c197例肿瘤未进行Syn染色;d97例肿瘤未进行CgA染色;e119例肿瘤未进行S-100染色;f387例肿瘤未进行P53染色;g270例肿瘤未进行SDHB染色;h383例肿瘤未进行ATRX染色;i353例肿瘤未进行MGMT染色
1. Ki-67<3%组与Ki-67≥3%组PPGL患者临床及生化特征比较:302例PPGLs接受Ki-67染色,Ki-67<3%组194例,Ki-67≥3%组108例。与Ki-67<3%组相比,Ki-67≥3%组患者发病年龄更小(W=11 346.0,P=0.029)。Ki-67≥3%组肿瘤奥曲肽显像和131I-MIBG显像阳性率均低于Ki-67<3%组,但差异无统计学意义(均P>0.05)。Ki-67≥3%组患者血浆MN升高比例(χ²=4.7,P=0.030)、24 h尿NE与参考范围高限的比值(W=7 112.0,P=0.036)及24 h尿DA与参考范围高限的比值(W=7 137.5,P=0.046)更高。两组临床表现、血浆NSE水平差异均无统计学意义(均P>0.05),见表1, 2, 3。
2. 不同临床病理特征肿瘤的Ki-67指数升高程度:通过比较不同临床和病理特征的PPGLs Ki-67增殖指数的差异,发现相比于没有携带SDHB或Cluster 1A相关基因突变,131I-MIBG显像阳性或MGMT IHC染色阴性的PPGLs,携带有SDHB基因突变[2.0%(1.0%,3.0%)比2.5%(2.0%,5.3%),W=373.5,P=0.048]或Cluster 1A相关基因突变[2.0%(1.0%,3.0%)比3.0%(2.0%,7.0%),W=383.0,P=0.004],131I-MIBG显像阴性[2.0%(1.0%,3.0%)比2.5%(1.3%,5.0%),W=1459.0,P=0.028]或MGMT IHC染色阳性[2.0%(1.0%,2.0%)比3.0%(2.8%,8.0%),W=58.0,P=0.002]的肿瘤Ki-67指数更高。
3. 肾上腺嗜铬细胞瘤(pheochromocytomas,PEHOs)和腹膜后副神经节瘤(paragangliomas,PGLs)中Ki-67增殖指数与临床及其他病理特征间的关系:肾上腺PEHOs和腹膜后PGLs占所有PPGLs的82.7%(330/399),因此分别在226例肾上腺PHEOs和104例腹膜后PGLs中分析了Ki-67染色结果与临床及其他病理特征之间的关系。在肾上腺PHEOs中,与Ki-67<3%组相比Ki-67≥3%组肿瘤奥曲肽显像阳性率更低(36.6%比60.7%,χ2=5.5,P=0.019)。在腹膜后PGLs中,Ki-67≥3%组肿瘤发病年龄更早(39.0岁比48.0岁,W=1 088.0,P=0.003),131I-MIBG显像阳性率更低(73.7%比95.5%,P=0.022),NMN分泌型比例更高(68.2%比45.7%,P=0.047)。两组间在其他临床及病理特征方面差异均无统计学意义(均P>0.05)。
1. PPGLs起源部位:除肾上腺及腹膜后外,其他肿瘤起源部位包括头颈(10.0%,40/399)、膀胱(4.5%,18/399)、纵隔(1.0%,4/399)、盆腔(0.8%,3/399)、心脏(0.8%,3/399)以及椎管内(0.2%,1/399),见表1。
2. 腹膜后PGLs和肾上腺PEHOs的临床及病理特征比较:腹膜后PGLs最大径与肾上腺PHEOs相似[4.7(3.5,6.3)cm比4.7(3.4,6.4)cm,W=11 989.0,P=0.670],且两组肿瘤Ki-67增殖指数差异无统计学意义[2.0%(1.0%,3.0%)比2.0%(1.0%,3.0%),W=7 181.0,P=0.853]。与肾上腺PHEOs相比,腹膜后PGLs携带SDHB突变的比例更大(15.8%比1.6%,P=0.007)及NMN分泌型比例更高(54.7%比33.3%,χ2=17.9,P<0.001)。
3. 头颈部PGLs和肾上腺PHEOs的临床及病理特征比较:肿瘤多为无分泌型(75.0%),患者多无高血压(76.3%)。12例接受奥曲肽显像的肿瘤均表现为阳性,7例接受131I-MIBG显像的肿瘤仅3例表现为阳性。与肾上腺PHEOs相比,头颈部PGLs径更小[3.0(1.9,3.8)cm比4.7(3.4,6.4)cm,W=2 197.0,P<0.001],但Ki-67≥3%的比例更高(61.3%比33.8%,W=3 312.5,P=0.007)。
4. 膀胱PGLs的临床及病理特征:肿瘤最大径为2.0(1.6,3.0)cm,所有患者均有PPGLs相关临床症状。肿瘤奥曲肽和131I-MIBG显像阳性率均较低,分别为10.0%和30.0%。膀胱PGLs的Ki-67增殖指数为1.0%(0.8%,2.5%)。
PPGLs通常分泌过量CAs,患者可表现为血尿CAs及其代谢产物的升高,并出现高血压、交感神经过度兴奋等症状。尽管术前临床、生化及功能学显像特征可以帮助诊断PPGLs,但术后病理仍是其诊断的金标准。
不同起源部位的PPGLs通常表现出不同的生物学行为。本研究发现头颈部来源的PGLs更小,这可能与其特殊的解剖部位相关。颅底PGLs生长空间狭小,肿瘤常累及周围神经及血管,引发患者出现相应症状,易被早期发现,而颈部PGLs发生位置表浅,多表现为颈部无痛性肿块[2]。国内一项研究比较了22例头颈部与57例腹部PGLs的临床特征,结果发现头颈部PGLs中,最大径>4 cm的肿瘤比例更少(9.5%比86.8%,P<0.001),但Ki-67≥3%的肿瘤比例更多(57.1%比41.8%,P=0.231)[3]。另一项研究通过比较17例头颈部与175例非头颈部PGLs的临床特征同样发现前者最大直径明显小于后者(P<0.001)。笔者团队在更大样本中的研究结果与上述研究结果一致[4]。
Ki-67增殖指数作为评价细胞增殖活性的常用指标,与PPGLs患者预后密切相关。既往研究表明Ki-67≥3%的PPGLs术后更容易出现复发转移[5],因此本研究也以3%为界值,比较了Ki-67<3%与Ki-67≥3%的PPGLs临床及病理特征的差异。结果发现Ki-67≥3%的肿瘤患者发病年龄更早,NMN分泌型比例更高,且功能学显像阳性率有更低的趋势,可能提示增殖能力越强的PPGLs其分化更差,导致肿瘤细胞表面单胺转运体及生长抑素受体的表达密度更低,对于131I-MIBG的摄取及生长抑素的结合更少。近期一项纳入了202例PPGLs的研究分析了肿瘤表面生长抑素受体2(somatostatin receptor 2,SSTR2)表达与患者临床特征之间的关系,结果表明相比于SSTR2染色阴性的PPGLs,SSTR2染色阳性的PPGLs中Ki-67<3%的肿瘤占比更大(72.3%比66.3%),但差异无统计学意义[6]。
此外,本研究发现相比于MGMT IHC染色阳性的PPGLs,MGMT IHC染色阴性的肿瘤Ki-67增殖指数更小。MGMT是一种DNA修复酶,能够逆转替莫唑胺等烷化剂引起的DNA损伤,影响替莫唑胺治疗的疗效。在胶质瘤中,既往研究发现部分患者MGMT编码基因启动子区域存在高甲基化,导致该酶表达受抑制,进而表现出对替莫唑胺治疗更好的反应性以及更佳的预后[7, 8],而在转移性PPGLs中也有类似报道[9, 10]。一篇综述系统性地回顾了既往报道的23例接受替莫唑胺治疗的转移性PPGLs情况。共有12例肿瘤实现了影像学或生化部分缓解,其中5例接受了MGMT启动子区域甲基化状态检测,结果均为高甲基化;6例进行了MGMT IHC染色,结果5例表现为阴性,1例表现为阳性[11]。这表明MGMT启动子高甲基化状态同样可用于预测转移性PPGLs对替莫唑胺的反应。本研究结果表明MGMT染色阴性与Ki-67增殖指数低相关,提示增殖能力较弱的PPGLs可能对替莫唑胺治疗反应更佳。近期一项前瞻性研究在62例转移性PPGLs中评估了替莫唑胺治疗疗效,结果发现在MGMT甲基化<7%的转移性PPGLs中,Ki-67<5%的肿瘤对替莫唑胺治疗的反应要好于Ki-67≥5%的肿瘤(66.7%比33.3%)[12]。这与本研究的推论相一致,然而未来仍需多中心临床研究证实这一推论。
综上,不同部位来源的PPGLs临床及病理特征存在差异。其中头颈部来源的PGLs通常较小,但增殖能力并不弱,明确诊断后需要及早干预,术后需要密切随访。此外,起病年龄早,携带SDHB或Cluster 1A相关基因胚系突变,131I-MIBG阴性或MGMT染色阳性的PPGLs肿瘤Ki-67指数高,提示其增殖能力强,术后需密切随访,警惕肿瘤复发或转移。
周玥, 张文倩, 陈映含, 等. 嗜铬细胞瘤/副神经节瘤患者临床特征与肿瘤病理特征的关系[J]. 中华医学杂志, 2024, 104(28): 2613-2618. DOI: 10.3760/cma.j.cn112137-20231218-01404.
所有作者声明不存在利益冲突



























