
胆管癌由于其高度恶性和较差的预后,诊断和治疗都相当困难,这使得提高胆管癌患者的早期诊断率、规范治疗流程以及改善患者预后成为当前亟需解决的难题。2022年,英国胃肠病学会肝脏分会召集了多学科专家,根据最新的循证医学证据,对旧版胆管癌诊疗指南进行了全面更新。新版指南提出了50条推荐意见,并进行了详细阐释。此次更新涵盖了胆管癌诊疗的各个环节,包括危险因素分析、流行病学、病理学、影像学诊断、内窥镜检查、手术治疗和综合治疗等方面。《英国胃肠病学会:胆管癌指南》2023版在胆管癌诊断及治疗方面提出了许多建设性意见,强调了多学科联合诊治的重要地位,并指出了学科的发展方向,本文对其做系统解读。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
胆管癌(cholangiocarcinoma,CCA)是一种来源于胆管上皮细胞的高度恶性肿瘤,其5年平均生存率为5%~10%。随着对CCA认识的深入以及治疗理念的不断更新,国外早已制订CCA相关指南并不断更新,包括将肝内胆管癌(intrahepatic cholangiocarcinoma,ICCA)从肝癌中分离出来,同时将肝外胆管癌(extrahepatic cholangiocarcinoma,ECCA)分为肝门部胆管癌(perihilar cholangiocarcinoma,PCCA)和远端胆管癌(distal cholangiocarcinoma,DCCA),并分别制定了以上3种CCA各自的TNM分期标准[1]。近日,由英国胃肠病学会(British Society of Gastroenterology)委托编写的英国胃肠病学会《胆管癌诊断和治疗指南》(以下简称《指南》)[2]于杂志Gut上发表,这是继该《指南》自2002年首次发布后的第二次更新。2023版《指南》共31页,共引用参考文献295篇,相较于前两版指南,新版指南内容更加丰富,可信度更高。除此之外,本版《指南》严格遵循GRADE证据分级系统,对研究证据质量和推荐强度分别作了详细说明,并依据循证医学证据增加了新的内容。本文结合国内外最新研究进展,以及本中心临床经验,对该版《指南》进行简要解读。
CCA病因目前尚未完全明确,已知危险因素包括Caroli病、原发性硬化性胆管炎(primary sclerosing cholangitis,PSC)、胆总管囊肿及结石、肝硬化、肝吸虫、胆石症、慢性胰腺炎、慢性乙型及丙型病毒性肝炎、炎症性肠病、饮酒、非酒精性脂肪肝、血色病、Ⅱ型糖尿病、吸烟、肥胖、高血压及环境因素等。相关研究认为全球CCA患病率的变异性是宿主特异性遗传背景与相关风险因素地理分布之间复杂相互作用的结果。全球CCA患病率最高的地区是泰国东北部及周边地区,主要风险因素是慢性肝吸虫感染;在西方国家,已知主要风险因素是PSC[3, 4, 5]。作为较常见的消化道恶性肿瘤,CCA在所有消化道恶性肿瘤中发病率高达3%[6],且发病率呈逐年上升趋势。《指南》特别强调了目前CCA大多数已知的主要风险因素与胆道上皮慢性炎症和胆汁淤积有关。当然,CCA与宿主基因变异也有密切关系,有研究发现细胞周期调节因子PLK1及其底物在ICCA中的表达增加[7]。
CCA作为高度恶性的肿瘤,其诊断较为复杂,诊断需要依靠病史、症状及辅助检查,金标准仍为病理诊断。CCA辅助检查包括影像学检查、血清学检查、病理学检查,必要时可完善免疫组化和分子病理检测以便指导后续治疗。影像学检查主要包括CT、增强CT、MRI、增强MRI、超声、内镜检查、PET-CT。《指南》建议对于所有类型的CCA均应进行胸部、腹部和盆腔的对比增强多相CT,以便对原发肿瘤进行准确分期,同时评估肿瘤与局部血管关系。对于PCCA和ICCA,《指南》认为增强MRI和MRCP能更好地提供胆道受累程度的信息,并确定卫星病灶或肝内转移灶。中国医学科学院北京协和医学院进行的一项回顾性研究发现通过MRI放射组学和形态学特征可以预测肝内肿块型CCA患者的微血管浸润并可用于肿瘤分级[8]。
对于病理诊断,《指南》认为应为患者进行超声胃镜(EUS)或CT引导的穿刺活检,如果无法完善EUS则可经ERCP行细胞学刷检。同时,《指南》建议对于肝内原发性肿瘤或有肝内转移灶的患者,优先进行超声或CT引导下的穿刺活检。而对于可手术伴有远端恶性胆管梗阻(distal malignant tract obstruction,DMTO)的患者,《指南》认为EUS和ERCP引导下的穿刺活检可以更好地造福患者。《指南》提出PET-CT对于原发病灶的诊断并无明显优势,但对于怀疑肿瘤转移患者PET-CT检查不失为一种不错的方法。
《指南》特别强调了多学科诊疗模式(multidisciplinary team,MDT)在CCA诊断中的重要性,其中有6条强烈推荐建议、1条中等推荐建议涉及MDT;MDT应该在具备外科、介入放射学、内镜科、肝胆科、肿瘤学和病理学等相关专业知识的中心进行,讨论时应明确CCA的解剖学分型,梗阻性黄疸患者要明确梗阻的原因。《指南》建议在患者影像学检查、血液学检验等完成后应在MDT后对患者进行详细的评估。MDT完成后应对肝内原发肿瘤或转移病灶行超声或CT引导下穿刺活检,以便获取病理学诊断。对于EUS引导下胆道引流,《指南》提出应在MDT讨论后采用。国内于2023年发布了《中国胆道肿瘤多学科综合治疗专家共识》,强调了MDT在胆道肿瘤诊治中的重要作用,并对MDT团队组成及流程进行规范[9]。笔者结合《指南》及《中国胆道肿瘤多学科综合治疗专家共识》对MDT流程进行说明(图1)。
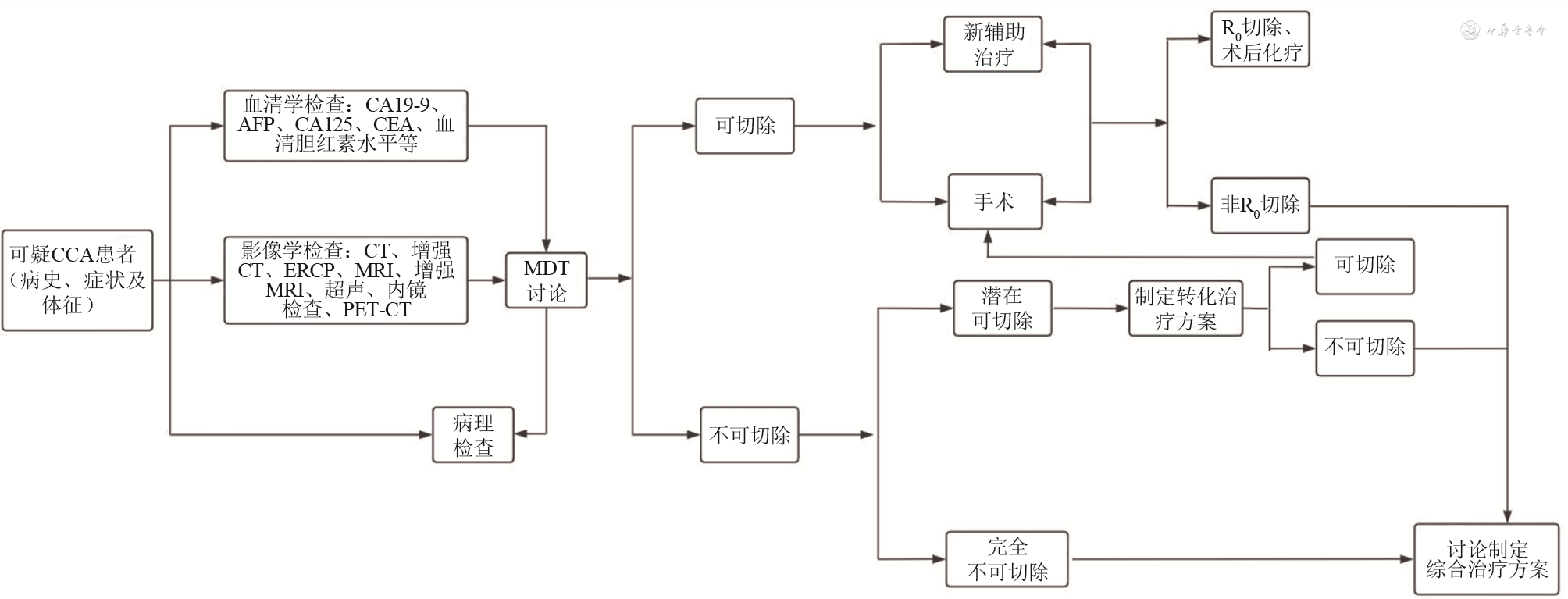

同时,《指南》提出第二代测序(next-generation sequencing,NGS)在未来可能会使CCA患者获益,但仍需更多的临床数据进行验证。相关研究也认为通过NGS进行分析在CCA诊断中具有巨大应用的前景[10]。除上述辅助诊断方式外,有研究发现肠道微生物与CCA的发生发展密切相关,认为双歧杆菌/克雷伯杆菌可用于区分健康个体和CA19-9阴性CCA患者[11]。国外有学者也提出一种可用于评估肿瘤转移的实时荧光成像技术,该技术使用一种可被癌症特异性酶识别的探针,该探针在被激活后立即发出荧光实时显示ECCA的扩散情况[12]。相信随着医学新技术的不断涌现,未来CCA的诊断方式会更加多样,早期诊断率会显著提高。然而,鉴于医疗资源的分配不均,上述所提及的部分检查手段在我国部分地区难以实施。CCA辅助检查手段多样,《指南》中对CCA多种诊断方式进行了详述,并对部分诊断方式使用场景进行了阐述。笔者认为医疗机构应坚持“以患者为中心”,结合实际情况,采用替代检查检验方式,适当扩增医疗资源,对疑难病例应积极响应“分级诊疗”制度进行转诊等。
1. ICCA:ICCA大体分型包括肿块形成型、管周浸润型、管内生长型和混合生长型4类[13]。病理分型包括高分化、中分化及低分化腺癌及一些少见亚型如腺鳞癌、鳞癌、黏液癌、印戒细胞癌等[14]。关于CCA病理组织学的相关内容《指南》也进行了相应阐述,主要提到了“大胆管”和“小胆管”型ICCA的分型,并比较了两者在免疫组化和分子特征等方面的差异。自第7版《AJCC肿瘤分期手册》ICCA TNM分期被单独列出之后,第8版TNM分期又进行了重大更新:T1分期第八版分期以肿瘤直径5 cm为界,将单发且无血管侵犯的ICCA分为T1a和T1b期,并把Ⅰ期分为Ⅰa期和Ⅰb期;T2分期T2a和T2b合并为T2期;T4分期将第7版中胆管周围浸润调整为直接侵及肝外结构;系统分期新增ⅢB期分类,将第7版中原ⅣA期分类内容纳入ⅢB期,取消ⅣA期分类并将ⅣB期调整为Ⅳ期。
2. PCCA:目前PCCA常用分型方式有如下3种:(1)Bismuth-Corlette分型;(2)MSKCC T分期系统;(3)AJCC的TNM分期系统。由于MSKCC T分期系统在临床应用较少在此不进行赘述。第8版PCCA TNM较第7版也有较明显更新,主要变化体现在T分期和N分期的变化上:T分期新版分期系统扩大了Tis的定义使高度上皮内瘤变被列入Tis,并提出重度不典型增生与原位癌具有相同意义,将Bismuth Ⅳ型从T4分期中移除;N分期N1定义为1~3枚区域淋巴结转移,N2定义为≥4枚区域淋巴结转移;T4N0M0对应分期从ⅣA调整为ⅢB;TxN1M0对应分期从ⅢB调整为ⅢC;系统分期TxN2M0对应分期为ⅣA[15]。
3. DCCA:DCCA大体分型包括硬化型、结节型、息肉型及弥漫浸润型。组织学类型最常见的为胆管腺癌及其他少见类型包括黏液癌、鳞状细胞癌、腺鳞癌、小细胞未分化癌、乳头状癌等。DCCA的TNM分期也发生了较大变化:T分期定义修正为肿瘤浸润胆管壁,深度<5 mm;T2期则为肿瘤浸润胆管壁,深度5~12 mm;T3期肿瘤浸润胆管壁,深度>12 mm;T4期修改为肿瘤侵犯腹腔静脉、肠系膜上动脉和(或)肝动脉;N分期:Nx:区域淋巴结不能评价;N0:无区域淋巴结转移;N1:1~3个区域淋巴结转移;N2:4个以上区域淋巴结转移;系统分期:将7版ⅠA期调整为8版Ⅰ期;原ⅠB期调整为ⅡB期;原ⅡB期T1N1M0调整为ⅡA期;T1~3N1M0调整为ⅢA期;原Ⅲ期调整为ⅡB期。
AJCC分期系统的更新对于肿瘤患者的诊断和治疗具有重要意义。新的分期系统能够更准确地评估肿瘤的严重程度,帮助临床医师制定更有效的治疗方案。同时,更新后的分期系统也能够提高医师和患者对于肿瘤预后的了解,为患者提供更精准的医疗建议。但我们也应看到其不足的一面,现有肿瘤分期系统对肿瘤生长和扩散的全面理解不足,以及对患者预后和治疗反应的准确预测能力不足。此外,现有的分期系统可能无法满足不同类型肿瘤的特殊需求,需要更精确和个性化的分期方法来指导临床治疗。
CCA治疗方式包括手术治疗、放疗、化疗、靶向治疗、免疫治疗、介入治疗、消融治疗、光动力治疗等。其中,R0切除仍是CCA唯一可治愈的治疗方式(除少数可行肝移植的患者及可进行消融的ICCA患者外)。
CCA非手术治疗包括新辅助治疗、放疗、化疗、靶向治疗、免疫治疗、介入治疗、消融治疗、光动力治疗。《指南》对新辅助治疗的态度较为保守,不推荐对可切除的CCA患者常规使用新辅助治疗。国内相关研究也认为目前CCA新辅助治疗方案的安全性研究仍然不足,需要更多的患者和更长的随访时间来验证这些治疗方案的整体肿瘤学获益[16]。对于切缘阳性或淋巴结转移的CCA患者,《指南》提出放化疗会使患者受益,同时推荐接受CCA手术切除的患者应进行24周的辅助化疗(推荐药物为卡培他滨)。对于不可切除CCA患者,《指南》推荐将顺铂-吉西他滨化疗(CisGem)作为一线治疗。
近年来,随着NGS的迅速发展,CCA相关基因图谱不断完善,Pemigatinib和Infigratinib等靶向药物相继问世。目前已知CCA中存在的分子靶向基因包括:IDH1、IDH2、FGFR2、HER2、BRAF、BRCA1/2、PALB2等,其中一些突变存在于特定解剖亚型,比如FGFR2和IDH1主要位于ICCA,而另一些突变类型,如BRAF被发现于所有类型CCA患者中。由于这些突变与其他常见的恶性驱动因素(尤其是RAS突变)互斥,提高了从靶向治疗中获益的机会。国外研究发现CCA靶向治疗抵抗与靶基因(FGFR2、IDH1)内的突变有关,目前作用于多靶点的第二代靶向药物正在开发中[17, 18]。最近的研究表明Futibatinib有望成为CCA靶向治疗的新药物[19]。国内相关指南推荐对于局部晚期、转移性或不可切除ICCA,携带FGFR2基因融合或重排患者可使用Pemigatinib;携带IDH1基因突变的不可切除ICCA推荐使用Ivosidenib;携带BRAF基因突变的不可切除胆道恶性肿瘤推荐Dabrafenib联合Trametinib[20]。尽管靶向治疗展现出了巨大潜力,但也面临着一些挑战,如药物耐药性可能导致治疗效果下降和靶向治疗的高昂成本等问题。为了应对这些挑战,我们需要加强研究和持续创新,以提升靶向治疗的效果和覆盖范围。
对于免疫治疗是否会使CCA患者受益这一问题,《指南》中未明确表态,同时认为仍需大量临床研究来明确免疫治疗对CCA患者的作用。国内一项回顾性研究发现根治性CCA术后辅助化疗联合免疫治疗组的总生存期(OS)、无复发生存期(FRS)均优于单纯术后辅助化疗组[21]。美国的一项研究也发现,对于CisGem化疗不敏感的CCA患者使用FOLFIRI-贝伐珠单抗化疗方案对患者有一定益处[22]。目前,国内相关指南推荐Pembrolizumab单药治疗作为错配修复缺陷(dMMR)、微卫星高度不稳定(MSI-H)及不可切除或进展期胆道恶性肿瘤的一线治疗方案;同时提出免疫治疗联合化疗、靶向治疗及双免疫治疗等方案,在未来可能为CCA患者带来新的希望[20]。免疫疗法为CCA患者带来治疗希望的同时,也伴随着诸多挑战,如免疫耐受性、治疗效果和安全性等方面的问题。目前亟需解决的问题是筛选出精准、可靠的生物标志物[20]及提高免疫疗法的疗效,减少不良反应,并找到更有效的治疗方法。
对于是否行术前胆道引流,《指南》认为对于合并胆管炎患者、接受术前抗肿瘤治疗的患者及因高胆红素血症引起的营养不良、肝功能不全或肾功能不全的患者以及接受门静脉栓塞的患者应行术前胆道引流。对于恶性梗阻性黄疸患者,《指南》建议当血清胆红素高于250 μmol/L时应考虑术前胆道引流,当患者血清胆红素不高于250 μmol/L时,如果患者有因高胆红素血症引起的相关症状时也可考虑行术前胆道引流。国外有研究认为术前胆道引流可能会增加手术部位的感染风险[23]。术前胆道引流方式包括ERCP、EUS引导引流及经皮经肝胆管造影(percutaneous transhepatic cholangiography,PTC)等。患有远端CCA不可手术的DMTO患者,《指南》建议应行EUS联合ERCP或单行ERCP以明确病理诊断并减轻黄疸。相较于塑料支架,《指南》认为DMTO患者放置全覆盖式自膨胀金属支架更能获益。对于减黄方式的选择,推荐首选ERCP下放置胆管支架,次选EUS引导的胆道引流,当上述两种方式均失败时考虑行经皮肝穿刺引流(PTCD)。
近年来针对CCA的消融治疗及光动力治疗方兴未艾,《指南》也提出消融治疗及光动力治疗可作为CCA患者的治疗选择,但不推荐将此两种治疗方式作为标准治疗方式。相关研究表明,对于肿瘤位于肝脏中央、直径<3 cm的病变,热消融治疗是一种较为安全的替代疗法[24]。光动力治疗作为一种新兴技术,在不可切除CCA的治疗中起到了越来越重要的作用。此外,国外一项随机对照试验比较了光动力治疗联合内镜支架置入与单纯内镜支架置入对不可手术CCA患者预后的影响,结果证实光动力治疗联合内镜支架置入比单纯内镜支架置入更能明显改善患者预后及生活质量[25]。除上述治疗方式外《指南》提出,对于因肿瘤过大无法进行热消融的病变,可采用经动脉治疗,如经动脉化疗栓塞、选择性内放射治疗和肝动脉灌注化疗。
目前CCA患者的首选治疗方法仍是外科手术,但因CCA早期诊断困难,恶性程度较高且易复发转移,对外科医师选择合适的手术时机及术式具有极大的挑战。《指南》建议CCA患者的管理应在综合医院内进行,手术时机选择及手术方式等应由专业的MDT团队制订。同时提出,对于不能明确排除恶性肿瘤的患者可采取积极的手术治疗,因为手术可以解除患者部分症状并且能为诊断提供帮助。对于腹腔镜分期(staging laparoscopy,SL)的应用,《指南》中未提出明确建议。
1. ICCA外科治疗:对于可切除ICCA患者完整的R0切除且术后残余肝体积(functional liver remnant,FLR)不低于30%被认为是首选的治疗方式。对于ICCA患者是否应行术前胆道引流,《指南》指出当术前评估FLR>50%时术前可不行胆道引流,反之则术前应行胆道引流以改善FLR。对于因慢性肝病而无法行根治性手术的ICCA患者,是否可行肝移植《指南》未提出明确意见。
2. PCCA外科治疗:手术切除仍然是唯一的治愈方式,但因肿瘤在解剖位置上靠近肝门静脉,因此手术难度及风险较大。近年来,肝移植在CCA治疗中的作用被再次重视。《指南》提出,对存在慢性肝病(最常见的为PSC)、肿瘤体积<3 cm且没有肝外转移的PCCA患者行肝移植可获得长期无病生存。《指南》强调了腹腔镜探查术可能为患者带来显著的生存益处,可能因其能用于明确原发肿瘤的局部可切除性,包括血管侵犯、胆管延伸和淋巴结扩散,但《指南》也提出腹腔镜探查术应在SL排除腹膜内广泛转移之后使用。
3. DCCA外科治疗:与ICCA和PCCA不同,前两者常需联合部分肝脏切除,而DCCA常用术式为胰十二指肠切除术。因胰十二指肠切除术对术者技术要求极高,《指南》强调CCA患者的诊治应在大型综合医院进行。
CCA因其恶性程度较高,预后较差,2023版《指南》中提出了许多具有建设性的建议,主要体现在以下方面:(1)对于CCA的诊治,《指南》强烈推荐要在大型综合医院进行,并建议由相关科室专家组成专业的MDT团队,对可疑CCA患者进行MDT讨论并制订个性化诊疗计划;(2)对于梗阻性黄疸患者,《指南》明确了当血清胆红素高于250 μmol/L时应考虑术前胆道引流,并对引流方式进行了先后排序式推荐;(3)指出病理诊断仍为CCA确诊依据,提出了NGS技术在CCA未来诊治中将会起到巨大作用;(4)明确各型CCA治疗方式,提出靶向治疗及光动力治疗展现出新的活力,有望为不可切除CCA患者带来新的希望;(5)对有症状且伴远处转移的CCA患者建议行姑息性治疗,伴肿瘤寡转移患者可行立体定向放射治疗;(6)增加FLR和胆道引流均是可能需要的术前准备,可能更有利于提高手术安全性;(7)接受姑息治疗的PCCA/DCCA患者,射频消融及光动力疗法不应作为标准方案等。
《指南》结合近年来CCA最新研究成果,不断更新,为CCA患者的诊治提供了重要参考。然而,我们也应该清楚地认识到《指南》仍然存在不足之处。例如,对于射频消融、动脉化疗栓塞、光动力治疗等局部治疗以及NGS的阐述过于简略;对于外科治疗新进展等方面的关注不足,而国内和日本在相关方面的描述更加详尽[26, 27]。因为东西方的遗传背景和地理因素不同,CCA病因具有一定差异。《指南》中的一些建议并不完全适用于中国CCA患者,对于《指南》中的推荐建议应结合我国实际情况,取其精华。
综上所述,《指南》作为一部具有重要影响力的临床规范,尽管存在一些不完善之处,部分推荐意见可能不适用国内患者,但整体上有助于我们全面了解CCA的诊疗情况,值得借鉴。除此之外,《指南》所展现出的研究思路是我们所缺乏的,相较于欧美,我国病例样本更加丰富,但国内相关研究仍落后于欧美国家。期待国内相关领域学者能够团结协作,充分利用临床资源,创造出具有世界影响力的高水平临床规范。
李家军, 白睿, 孙备.《英国胃肠病学会:胆管癌指南》2023版解读[J]. 中华普通外科杂志, 2024, 39(7): 564-568. DOI: 10.3760/cma.j.cn 113855-20231230-00461.
所有作者均声明不存在利益冲突



























