
阿尔茨海默病(Alzheimer′ s disease,AD)是一种神经退行性疾病,给患者、家庭及社会带来沉重负担。最近研究显示基于淀粉样蛋白(Amyloid-beta,Aβ)级联瀑布假说开发的多款Aβ靶向疾病修饰治疗药物可以有效延缓AD认知功能下降,为AD治疗提供了新的治疗选择。淀粉样蛋白相关成像异常(Amyloid related imaging abnormalities,ARIA)是Aβ靶向疾病修饰治疗过程中出现的重要不良事件,制约着该类药物的应用。本文对近年来临床试验中ARIA研究进展进行总结,综述ARIA相关的表现、识别、管理及转归,并对未来可能的研究方向进行展望。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
阿尔茨海默病(Alzheimer′s disease,AD)是一种起病隐匿的神经退行性疾病,以记忆下降等认知功能受损为特征、最终严重影响患者日常生活功能[1]。AD的病因尚未完全明确,既往研究表明神经细胞外β-淀粉样蛋白(Amyloid β,Aβ)沉积和细胞内过度磷酸化的Tau蛋白形成的神经原纤维缠结是AD的典型病理生理学特征[2, 3]。AD在出现典型症状之前20余年,脑组织就可能发生一系列的病理改变,在此过程中出现的轻度认知障碍(mild cognitive impairment,MCI),即AD源性MCI,是最早有临床症状的阶段[2]。我国当前60岁及以上人群中约有1 000万AD患者[4],约有4 000万AD源性MCI患者[5, 6]。AD的患病率与年龄高度相关,随着人口老龄化加剧,我国AD疾病负担将进一步加重。既往AD的治疗多以对症治疗为主[7],不能有效延缓或改变病程进展。近年来,研究证实基于Aβ级联假说开发的部分Aβ靶向的单克隆抗体药物阿杜那单抗(Aducanumab)、仑卡奈单抗(Lecanemab)和多奈单抗(Donanemab)可以有效清除脑内Aβ沉积,延缓早期AD(包括AD源性MCI及轻度AD)患者认知功能下降,以期改变病程进展[8, 9, 10, 11, 12, 13]。2024年1月,国家药监局官网显示,仑卡奈单抗在我国获批上市,用于治疗早期AD(https://www.nmpa.gov.cn/zhuanti/cxylqx/cxypxx/20240109192251169.html)。这是迄今为止第一款在我国获批上市的Aβ靶向药物。
新的AD治疗药物将为医生和患者带来新的治疗选择,同时,也带来了新的安全性风险。以脑水肿、脑出血为特征的淀粉样蛋白相关脑成像异常(amyloid-related imaging abnormalities,ARIA)是Aβ靶向药物治疗AD过程中出现的常见不良事件[14, 15, 16]。随着国内相似靶点药物开发项目的开展及未来其他的Aβ靶向治疗药物上市,更好地了解ARIA将有助于AD的治疗与管理。基于此,我们在PubMed、Web of Science等数据库中采用“Alzheimer′s Disease”“Amyloid-Related Imaging Abnormalities”“anti-amyloid theraputics”作为关键词,年份不限,检索相关文献,就临床试验中ARIA相关的表现、识别、管理与转归等进行综述,以期能够帮助Aβ靶向治疗药物更安全地用于AD患者的治疗。
ARIA是指Aβ单克隆抗体靶向治疗AD过程中出现的一系列MRI脑成像异常[17]。根据颅脑MRI检查发现的影像学表现不同,可将ARIA分为以脑水肿/渗出为特征的淀粉样蛋白相关影像学异常-水肿/渗出(ARIA-edema/effusions,ARIA-E)和以脑微出血/含铁血黄素沉积为特征的淀粉样蛋白相关影像学异常-含铁血红素沉积(ARIA-hemosiderin deposition,ARIA-H)2类。ARIA是Aβ靶向治疗AD药物开发中的重要安全性评价指标,研究者不但可以根据治疗过程中出现的ARIA及其严重程度来调整剂量或终止治疗,也可通过预测受试者发生ARIA风险高低来决定在某项研究中是否纳入或排除某些受试者以更好地保护受试者[18]。随着阿杜那单抗等Aβ靶向药物的获批,监管机构也建议在临床治疗过程中采取密切措施以监测和管理出现的ARIA不良事件。
ARIA发生的病理生理机制尚不完全明确,已有研究认为这可能是由Aβ靶向药物与脑内沉积的Aβ斑块结合并引起其清除从而导致脑内血管通透性增加及Aβ抗体直接与沉积在脑血管上的Aβ斑块直接相互作用引起脑血管完整性受损等多种因素共同作用引起[17,19]。
多数ARIA无临床症状,通过脑MRI检查发现。少数ARIA可出现头痛、头晕、意识模糊、视觉障碍、恶心、癫痫发作等临床症状。需要特别注意的是在临床试验中已有Aβ靶向治疗导致的ARIA相关死亡的案例报道[20]。因而,全面地了解Aβ靶向治疗AD过程中的ARIA特点,将有助于开展AD新药临床试验与应用。
在过去的20余年中,虽然多个Aβ靶向的单克隆抗体被证实可以有效降低AD患者脑内Aβ斑块水平,但截至目前,仅有阿杜那单抗、仑卡奈单抗和多奈单抗达到了临床终点,能够延缓AD患者认知功能下降。但阿杜那单抗2个关键Ⅲ期临床研究呈现出不一致的临床结局,虽然美国食品和药品监督管理局(Food and Drug Administration,FDA)在2021 年 6 月加速批准了阿杜那单抗,但要求其进一步提供研究数据以评估其疗效[21, 22],2024年1月,药物研发公司宣布放弃了对阿杜那单抗的继续研究和商业化,但声明说这一决定与任何安全性或有效性问题无关。值得注意的是,阿杜那单抗、仑卡奈单抗和多奈单抗关键临床研究中均出现了显著的ARIA不良事件。根据Ⅲ期公开临床研究数据整理的阿杜那单抗、仑卡奈单抗和多奈单抗临床试验一般资料及淀粉样蛋白相关异常不良事件对比见表1。
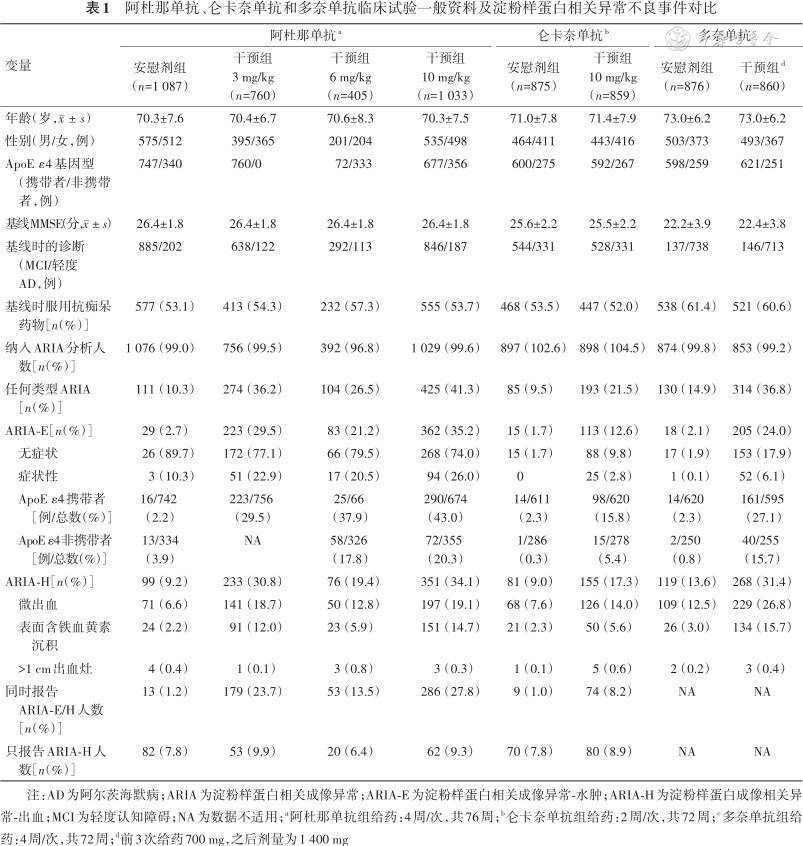
阿杜那单抗、仑卡奈单抗和多奈单抗临床试验一般资料及淀粉样蛋白相关异常不良事件对比
阿杜那单抗、仑卡奈单抗和多奈单抗临床试验一般资料及淀粉样蛋白相关异常不良事件对比
| 变量 | 阿杜那单抗a | 仑卡奈单抗b | 多奈单抗c | |||||
|---|---|---|---|---|---|---|---|---|
安慰剂组 (n=1 087) | 干预组 3 mg/kg (n=760) | 干预组 6 mg/kg (n=405) | 干预组 10 mg/kg (n=1 033) | 安慰剂组 (n=875) | 干预组 10 mg/kg (n=859) | 安慰剂组 (n=876) | 干预组d (n=860) | |
| 年龄(岁,) | 70.3±7.6 | 70.4±6.7 | 70.6±8.3 | 70.3±7.5 | 71.0±7.8 | 71.4±7.9 | 73.0±6.2 | 73.0±6.2 |
| 性别(男/女,例) | 575/512 | 395/365 | 201/204 | 535/498 | 464/411 | 443/416 | 503/373 | 493/367 |
| ApoE ε4基因型(携带者/非携带者,例) | 747/340 | 760/0 | 72/333 | 677/356 | 600/275 | 592/267 | 598/259 | 621/251 |
| 基线MMSE(分,) | 26.4±1.8 | 26.4±1.8 | 26.4±1.8 | 26.4±1.8 | 25.6±2.2 | 25.5±2.2 | 22.2±3.9 | 22.4±3.8 |
| 基线时的诊断(MCI/轻度AD,例) | 885/202 | 638/122 | 292/113 | 846/187 | 544/331 | 528/331 | 137/738 | 146/713 |
| 基线时服用抗痴呆药物[n(%)] | 577(53.1) | 413(54.3) | 232(57.3) | 555(53.7) | 468(53.5) | 447(52.0) | 538(61.4) | 521(60.6) |
| 纳入ARIA分析人数[n(%)] | 1 076(99.0) | 756(99.5) | 392(96.8) | 1 029(99.6) | 897(102.6) | 898(104.5) | 874(99.8) | 853(99.2) |
| 任何类型ARIA[n(%)] | 111(10.3) | 274(36.2) | 104(26.5) | 425(41.3) | 85(9.5) | 193(21.5) | 130(14.9) | 314(36.8) |
| ARIA-E[n(%)] | 29(2.7) | 223(29.5) | 83(21.2) | 362(35.2) | 15(1.7) | 113(12.6) | 18(2.1) | 205(24.0) |
| 无症状 | 26(89.7) | 172(77.1) | 66(79.5) | 268(74.0) | 15(1.7) | 88(9.8) | 17(1.9) | 153(17.9) |
| 症状性 | 3(10.3) | 51(22.9) | 17(20.5) | 94(26.0) | 0 | 25(2.8) | 1(0.1) | 52(6.1) |
| ApoE ε4携带者[例/总数(%)] | 16/742(2.2) | 223/756(29.5) | 25/66(37.9) | 290/674(43.0) | 14/611(2.3) | 98/620(15.8) | 14/620(2.3) | 161/595(27.1) |
| ApoE ε4非携带者[例/总数(%)] | 13/334(3.9) | NA | 58/326(17.8) | 72/355(20.3) | 1/286(0.3) | 15/278(5.4) | 2/250(0.8) | 40/255(15.7) |
| ARIA-H[n(%)] | 99(9.2) | 233(30.8) | 76(19.4) | 351(34.1) | 81(9.0) | 155(17.3) | 119(13.6) | 268(31.4) |
| 微出血 | 71(6.6) | 141(18.7) | 50(12.8) | 197(19.1) | 68(7.6) | 126(14.0) | 109(12.5) | 229(26.8) |
| 表面含铁血黄素沉积 | 24(2.2) | 91(12.0) | 23(5.9) | 151(14.7) | 21(2.3) | 50(5.6) | 26(3.0) | 134(15.7) |
| >1 cm出血灶 | 4(0.4) | 1(0.1) | 3(0.8) | 3(0.3) | 1(0.1) | 5(0.6) | 2(0.2) | 3(0.4) |
| 同时报告ARIA-E/H人数[n(%)] | 13(1.2) | 179(23.7) | 53(13.5) | 286(27.8) | 9(1.0) | 74(8.2) | NA | NA |
| 只报告ARIA-H人数[n(%)] | 82(7.8) | 53(9.9) | 20(6.4) | 62(9.3) | 70(7.8) | 80(8.9) | NA | NA |
注:AD为阿尔茨海默病;ARIA为淀粉样蛋白相关成像异常;ARIA-E为淀粉样蛋白相关成像异常-水肿;ARIA-H为淀粉样蛋白成像相关异常-出血;MCI为轻度认知障碍;NA为数据不适用;a阿杜那单抗组给药:4周/次,共76周;b仑卡奈单抗组给药:2周/次,共72周;c多奈单抗组给药:4周/次,共72周;d前3次给药700 mg,之后剂量为1 400 mg
1.阿杜那单抗:阿杜那单抗开展了2项Ⅲ期临床研究EMERGE(n=1 643)和ENGAGE(n=1 653),给药剂量分别为3、6和10 mg/kg,每月1次给药,治疗期为78周,后因中期数据分析未发现认知改善而提前终止试验研究[10],后补充数据分析后发现高剂量组有统计学差异,再次向FDA申请后获批上市。
对EMERGE和ENGAGE研究进行合并分析显示[16],2组基线随机分配均衡,以安慰剂组为例:受试者平均年龄为(70.3±7.6)岁,男女比例大致相当(52.9% 比47.1%),68.7%为ApoE ε4基因携带者,基线MMSE平均得分约为(26.4±1.8)分,MCI所占比例为81.4%,轻度AD占比为18.6%,约半数(53.1%)服用抗痴呆药物。在双盲治疗期间,阿杜那单抗不同给药剂量治疗ARIA发生率均明显高于安慰剂组,并且随着剂量增加,ARIA发生率有增高趋势,10 mg/kg组ARIA发生率高达41.3%,而安慰剂组仅为10.3%。其中,ARIA-E和 ARIA-H发生率治疗组也均高于安慰剂组。孤立性ARIA-H(仅出现ARIA-H而未出现ARIA-E)的发生率在阿杜那单抗组和安慰剂组数值接近。阿杜那单抗组报告了7例(0.3%)>1 cm的脑出血,而安慰剂组受试者中报告4例(0.4%)。ARIA的常见症状是头痛、意识模糊、头晕和恶心。阿杜那单抗组报告的ARIA-E事件大多为轻度至中度,大多(74%)无症状,且多(72.7%)发生在启动治疗的前8次治疗内。大多数观察到了影像学消退,其中10 mg/kg组82.8%患者在检测到ARIA异常后的16周内消退。共计23例(1.0%)受试者报告严重ARIA不良事件;没有报告ARIA相关的死亡事件。
2.仑卡奈单抗:仑卡奈单抗完成了1项为期18个月的Ⅲ期临床研究CLARITY研究(n=1 795),干预组和安慰剂组分配均衡,以安慰剂组为例,研究受试者平均年龄为(71.0±7.8)岁,男女比例大致相当(53.0%比47.0%),68.6%为ApoE ε4基因携带者,基线MMSE平均得分(25.6±2.2)分,MCI所占比例为62.2%,轻度AD占比为37.8%,约半数(53.5%)服用抗痴呆药物。仑卡奈单抗给药剂量为10 mg/kg,每2周1次[8]。
CLARITY研究发现,仑卡奈单抗组ARIA发生率高于安慰剂组,分别为21.5%和9.5%[8]。其中,仑卡奈单抗组ARIA-E 和ARIA-H 发生率均明显高于安慰剂组。仑卡奈单抗组报告的ARIA-E事件大多为轻度至中度(91%),大多(78%)无症状,且多(71%)发生在启动治疗的前6次治疗内,并于检测到ARIA异常后的4个月内消退(81%)。仑卡奈单抗组共有2.8%的受试者报告了症状性ARIA-E;多数报告的症状是头痛、视觉障碍和意识混乱。孤立性ARIA-H的发生率在仑卡奈单抗组和安慰剂组大致相当。仑卡奈单抗组受试者中报告了5例(0.6%)>1 cm的脑出血,而安慰剂组受试者中报告了1例(0.1%)。与ARIA-E同时发生的ARIA-H往往发生较早(启动治疗的前6个月内)。接受仑卡奈单抗治疗的7例受试者(0.8%)报告了严重ARIA-E不良事件,而安慰剂组严重ARIA-E不良事件为0。
尽管CLARITY研究在双盲治疗期没有报告仑卡奈单抗治疗相关的死亡事件,但Nature Communications报告了1例参加该研究的79岁、女性受试者在开放延伸期治疗过程中因广泛脑水肿、出血伴癫痫并因此死亡的案例,该受试者在死亡前接受了6周的开放延伸期仑卡奈单抗给药治疗,尚不清楚该受试者在双盲延伸期接受何种治疗,该受试者的详细的数据及其因果关系需等待进一步披露[23]。
3.多奈单抗:多奈单抗完成了一项为期76周的Ⅲ期临床研究TRAILBLAZER-ALZ 2(n=1 736),2组分配均衡,以安慰剂组为例,研究受试者年龄为(73.0±6.2)岁,女性略多于男性(57.4%比42.6%),71.2%为ApoE ε4基因携带者,基线MMSE得分为(22.2±3.9)分,MCI所占比例为15.7%,轻度AD占比为84.3%,61.4%服用抗痴呆药物。双盲治疗期多奈单抗给药为前3次给药700 mg,随后增加至1 400 mg,每月1次[9]。
TRAILBLAZER-ALZ 2研究发现多奈单抗治疗组ARIA发生率高于安慰剂组,2组分别为36.8%和14.9%。其中,多奈单抗组ARIA-E和 ARIA-H的发生率均高于安慰剂组。孤立性ARIA-H发生率在2组发生率大致相当。多奈单抗组报告了3例(0.4%)>1 cm的脑出血,而安慰剂组报告了2例(0.2%)。大多数ARIA-E不良事件的严重程度为轻度至中度(多奈单抗组93.1%,安慰剂组94.4%)。大多数病例(57.9%)首次报告ARIA-E发生在接受3次多奈单抗输注后。多奈单抗组和安慰剂组分别有98.0%和64.7%受试者在首次出现ARIA-E后自行消退,其中多奈单抗组和安慰剂组的ARIA-E平均消退时间分别为72.4 d和63.5 d。多奈单抗组有6.1%的受试者报告了与ARIA-E相关的症状,通常报告的症状为头痛、意识模糊。其中45例受试者(86.5%)得到症状缓解。接受多奈单抗治疗的13例受试者(1.5%)报告了严重ARIA-E不良事件。多奈单抗治疗组和安慰剂组报告的治疗相关的死亡不良事件分别是3例(0.4%)和1例(0.1%);多奈单抗治疗组3例死亡事件发生在出现ARIA事件之后,其中2例为ApoE ε4基因携带者,3名受试者均未接受抗凝或抗血小板药物治疗,1例受试者是在重度ARIA-E伴重度ARIA-H不良事件消退后继续接受治疗,1例受试者基线时存在含铁血黄素沉积;安慰剂组1例受试者因动脉硬化性疾病死亡。
给药剂量与ARIA发生呈正相关,剂量越高ARIA发生率越高。阿杜那单抗EMGER和ENGAGE研究探索了不同剂量给药的安全性,结果发现随着剂量的升高,ARIA发生率随之升高[10],EMERGE研究中安慰剂组、低剂量组及高剂量组ARIA-E发生率分别为2%、26%和35%,ENGAGE研究中对应ARIA-E分别为3%、26%和36%[16]。仑卡奈单抗一项Ⅱ期研究中发现给药18个月后安慰剂组,2.5 mg/kg组、5 mg/kg组和10 mg/kg组的ARIA-E的发生率分别为0.8%、1.9%、3.3%和9.9%[7]。
阿杜那单抗和多奈单抗研究中均采用滴定给药以减轻ARIA不良事件,仑卡奈单抗则没有采用滴定给药方式。虽然通常认为滴定给药可以减轻ARIA不良事件的影响,但滴定给药时,ARIA仍在给药早期出现[10,12,24];仑卡奈单抗研究中ARIA发生率较阿杜那单抗和多奈单抗低,但不同研究间ARIA发生率不能直接比较,且ARIA的出现与药物作用机制等多种因素有关,目前不同研究间ARIA发生率与滴定给药是否相关尚需更多研究提供证据。
ApoEε4等位基因是仅次于给药剂量的第二大ARIA潜在危险因素[23]。阿杜那单抗研究数据表明,治疗组ARIA-E的发生率在ApoEε4等位基因携带者和非携带者中的发生率分别为43.0%和20.3%,纯合子基因型发生率为65%,高于杂合子基因型的35%的发生率。而安慰剂组对应发生率分别为2.2%和3.9%;ARIA-H在ApoEε4等位基因携带者和非携带者中的发生率分别为27.5%和6.6%,而安慰剂组对应发生率分别为6.7%和2.5%[16]。仑卡奈单抗和多奈单抗研究发现了相似的趋势[8, 9]。因此,在开始Aβ靶向治疗前进行ApoEε4基因型检测有助于评估患者发生ARIA的风险,在开始治疗后适当增加ApoEε4基因携带患者的脑影像学检查频次有助于监测患者的ARIA风险。
AD患者常处于老年阶段且合并多种躯体疾病,如心血管疾病,常会接受抗凝药物或抗血小板药物治疗[25],因而需密切关注其对ARIA的影响。阿杜那单抗EMERGE和ENGAGE研究中允许受试者预防性使用日剂量≤325 mg的阿司匹林,但禁止使用其他抗凝药或抗血小板药。仑卡奈单抗CLARITY研究中允许使用稳定剂量的抗凝药,在临床治疗有需要时可以使用溶栓药物,但使用溶栓药物时应当暂停试验药物[8]。多奈单抗TRAILBLAZER-ALZ 2研究中允许受试者接受稳定剂量的抗凝药或抗血小板药物治疗[9]。上述3项关键研究关于合并抗凝药物或抗血小板用药与ARIA的发生之间的关联性尚未做详细说明,但抗凝药物或抗血小板药物使用通常会增加脑出血风险[25, 26],在患者接受Aβ靶向药物治疗前应谨慎评估获益与风险,并在治疗过程中密切监测出血风险。
ARIA在Aβ靶向治疗的早期出现且多数无临床症状,因此接受Aβ靶向治疗的患者定期进行脑MRI检查有助于及早发现ARIA[14]。
MRI对于Aβ靶向治疗的监测具有重要意义[27],是发现ARIA不良事件的主要方法,但目前国际上尚没有统一的指南对此进行规范[17]。考虑到中国MRI 1.5 T或3.0 T扫描设备资源分布不均衡,中国AD临床前期联盟认为MRI扫描序列不应过于严格限制,推荐采用颅脑MRI扫描序列如下:(1)采用FLAIR序列识别ARIA-E;(2)采用T2*GRE或SWI序列识别ARIA-H;(3)采用DWI序列评估脑水肿的类型及严重程度;(4)采用常规T1序列来展示脑解剖结构并作为增强扫描的对比序列;同时建议扫描场强3.0 T,层厚≤5.0 mm,回波时间≥20 ms[28]。
1. ARIA-E:ARIA-E的特征是蛋白液渗出增加导致的脑血管源性水肿和脑膜/脑沟渗出,ARIA-E严重程度与病灶发生部位和病灶的严重程度相关,ARIA积液和渗出均是一过性。ARIA-水肿在MRI FLAIR序列成像上呈高信号,可以同时波及脑灰质和脑白质;ARIA-积液呈局限在软脑膜/脑沟的高信号。
2. ARIA-H:ARIA-H的特征性表现是大脑微出血和(或)含铁血黄素沉积,大出血较罕见,但也已有相关案例报告。微出血在影像学上通常呈微小、圆形或椭圆形、低密度出血灶,通常指直径≤10 mm,但不同研究采用的评价标准可能存在差异。T2序列在发现ARIA-H上比FLAIR和快速自旋回波 T2序列更为敏感。
对ARIA进行严重程度分级有助于进行ARIA不良事件的研究与管理,仑卡奈单抗研究中根据ARIA在影像学中的表现将其分为轻度、中度和重度3级(表2),根据FLAIR成像中的病灶数量、大小和信号强弱进行ARIA-E的分级,根据新发病灶的数据进行ARIA-H的分级[24]。
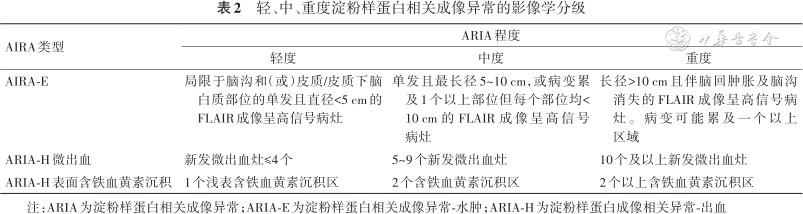
轻、中、重度淀粉样蛋白相关成像异常的影像学分级
轻、中、重度淀粉样蛋白相关成像异常的影像学分级
| AIRA类型 | ARIA程度 | ||
|---|---|---|---|
| 轻度 | 中度 | 重度 | |
| AIRA-E | 局限于脑沟和(或)皮质/皮质下脑白质部位的单发且直径<5 cm的FLAIR成像呈高信号病灶 | 单发且最长径5~10 cm,或病变累及1个以上部位但每个部位均<10 cm的FLAIR成像呈高信号病灶 | 长径>10 cm且伴脑回肿胀及脑沟消失的FLAIR成像呈高信号病灶。病变可能累及一个以上区域 |
| ARIA-H微出血 | 新发微出血灶≤4个 | 5~9个新发微出血灶 | 10个及以上新发微出血灶 |
| ARIA-H表面含铁血黄素沉积 | 1个浅表含铁血黄素沉积区 | 2个含铁血黄素沉积区 | 2个以上含铁血黄素沉积区 |
注:ARIA为淀粉样蛋白相关成像异常;ARIA-E为淀粉样蛋白相关成像异常-水肿;ARIA-H为淀粉样蛋白成像相关异常-出血
早期发现并有效管理ARIA是确保患者安全的重要途径,临床医生和放射科医生需要共同参与到这一过程中,从而及时识别患者的临床症状和MRI检查中脑AIRA-E或ARIA-H的异常,并根据患者的ARIA严重程度进行临床治疗方案的调整[15,17, 18,21]。
根据FDA批准的治疗建议,在患者开始Aβ靶向治疗前,应当进行颅脑PET Aβ生物标志物检测明确诊断、APOEε4基因检测评估ARIA风险并进行基线脑MRI检查。在治疗过程中,当患者出现轻度无症状性ARIA-E或ARIA-H时,可以继续治疗,同时密切监测患者症状,并按月进行MRI检查直到ARIA-E消失或者ARIA-H趋于稳定。当患者出现中度或重度ARIA异常或者出现症状性ARIA时,应当暂停给药,密切观察并及时处理患者的临床症状,并按月定期进行MRI检查直到ARIA-E消失或ARIA-H趋于稳定。当ARIA症状消退或者ARIA-E影像学异常消失后,可以在与患者及家属进行沟通后考虑重新启动给药治疗。重新启动治疗后,ARIA可能会再次出现。是否需要终止给药应该综合考虑患者的脑ARIA影像学严重程度、临床症状及程度、APOE基因型、合并疾病及合并用药等因素并进行决策。
综上所述,Aβ靶向疗法支持了AD的Aβ假说并开启了AD治疗的新阶段[29, 30],为AD患者和医生带来了新的治疗选择,但也产生了安全性风险ARIA。已有研究数据表明给药剂量和APOE ε4基因型与ARIA发生密切相关,ARIA多在开始治疗的早期出现,尽管大多数患者ARIA无症状,但ARIA仍是制约Aβ靶向治疗药物安全应用的重要因素;治疗前的Aβ生物标志物检测、APOE ε4基因型检测及治疗中的MRI检查等精准医学手段,可以用于患者的安全管理。此外也需要影像科医生熟悉ARIA影像学特点并密切与临床医生合作进行ARIA的识别、评估与管理,这也对影像学科参与AD治疗提出了新的要求。
同时,目前对Aβ靶向的治疗引起ARIA了解仍然较为有限,如Aβ靶向的抗体药物的作用靶点选择(如靶向结合可溶性Aβ聚体或不溶性Aβ斑块)与ARIA的相关性如何?Aβ斑块清除能力(清除速度与清除程度)怎样影响ARIA的发生发展?并且,当前研究数据多来自于设计良好且选择AD源性MCI或轻度AD阶段患者进行的临床试验,在临床实践中复杂的合并用药与共患疾病对患者的ARIA安全性的影响尚不明确,也缺乏在AD疾病的更早期或较后期的Aβ靶向治疗的疗效与ARIA安全性特征数据。此外,目前尚缺乏中国患者人群的单独ARIA安全性数据报告,中国人群与已知的ARIA安全性特点是否一致尚需更多研究。随着新的Aβ靶向药物的应用和更多研究数据的完成,将会进一步促进对ARIA的深入认识和AD治疗手段的不断完善。
本研究存在不足之处:(1)本文仅对目前获得Ⅲ期临床终点的临床试验报道的ARIA进行了总结,未对其他未取得临床终点或正在研发的研究结果进行分析,可能导致结论不够完整或出现偏移;(2)笔者团队采用综述的研究方法,无法提供定量的统计结果,期待未来更多研究进一步补充证据。
张雪, 张海峰. 阿尔茨海默病淀粉样蛋白靶向治疗药物Ⅲ期临床试验中淀粉样蛋白成像异常研究进展[J]. 中华精神科杂志, 2024, 57(8): 536-542. DOI: 10.3760/cma.j.cn113661-20231023-00152.
所有作者声明无利益冲突






























