
妊娠相关肺栓塞(PE)是静脉血栓栓塞症(VTE)的一种,严重威胁孕产妇生命安全,在临床上日益得到重视。妊娠期和产褥期由于生理和解剖的特点,VTE发生率显著高于非孕期,应对所有孕妇在妊娠期和分娩后采用合适的风险评估工具进行VTE风险评估,并根据不同风险级别采取对应的血栓预防措施,包括物理方法和药物方法。对临床疑诊妊娠相关PE的患者,可根据是否具有深静脉血栓的临床表现选择血管加压超声或胸部X线检查做初步检查,最终确诊依赖CT肺动脉造影或V/Q显像,对于休克的患者,超声心动图可快速用于PE的诊断和鉴别诊断。一旦诊断妊娠相关PE,其治疗根据患者血流动力学是否稳定选择再灌注治疗或抗凝治疗,体外膜氧合(ECMO)在危重患者中也可作为有益探索。妊娠期防治PE的推荐总体循证级别不高,仍需进一步临床实践探索来促进孕产妇的安全。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
静脉血栓栓塞症(venous thromboembolism,VTE)为深静脉血栓(deep vein thrombosis,DVT)和肺栓塞(pulmonary embolism,PE)的统称,严重威胁孕产妇生命安全。在全球范围内,VTE在孕产妇死因中的占比呈逐渐升高趋势[1, 2],日益受到关注。在国内,妊娠相关VTE发病率从2006年至2012年增长了50%[2]。2021年,中华医学会妇产科学分会产科学组发布了《妊娠期及产褥期静脉血栓栓塞症预防和诊治专家共识》[3],以期对该疾病的诊治做出进一步规范。在妊娠相关VTE中,虽然PE占比仅为20%~25%,但其导致的并发症率及死亡率更突出[4]。由于妊娠期生理性改变的影响,妊娠相关PE的发生率显著高于非孕期,临床表现更不具有特异性,因此如何合理预防、准确诊断和及时治疗妊娠相关PE一直是近年产科研究的重点。
妊娠期及产褥期发生的生理性和解剖性变化,例如凝血系统的生理性高凝状态、增大的子宫对盆腔静脉的压迫、孕激素导致的血流速度减慢、分娩、手术或并发症导致的血管损伤和凝血系统激活等,可导致孕产妇VTE风险较非孕期增加4~10倍[5, 6]。妊娠相关VTE事件的每日风险在产后短期内最高,尤其是产后第1周[4],但即便在产后7~12周,发生VTE的风险与产后1年时相比仍增加2.2倍[5]。
妊娠相关PE的发生率为0.2‰~0.4‰[3]。在全球范围内,妊娠相关PE在孕产妇死亡病因中占比3%;在医疗资源丰富的地区,如欧洲和北美,该死因占比高达10%~15%,且呈逐渐增高趋势[7]。妊娠相关PE中最严重的类型为大面积PE,由于广泛的肺动脉堵塞,可导致血流动力学不稳定,住院死亡率高达7%[8]。
妊娠相关PE的高致病性和致死性,促使了人们对疾病预防的高度重视。英国的数据显示,在广泛推行英国皇家妇产科学院(Royal College of Obstetricians and Gynaecologists,RCOG)孕产妇VTE预防指南后,孕产妇PE死亡率从1.56/10万降低至0.70/10万[9]。因此,尽管目前尚无充分证据指导妊娠相关VTE的预防策略实施细则,但国内外相关指南共识[1,3, 4,6,9]均普遍认可:探索合适的风险评估工具来评估妊娠相关VTE的发生风险;并根据不同风险级别采取对应的预防措施。
所有的孕妇都应该接受VTE风险的评估[3, 4,9, 10]。推荐在以下时间点进行VTE风险的动态评估:首次产前检查时、出现新的妊娠合并症或并发症时、住院期间和分娩后[3]。
在评估VTE风险时,需要着重考虑主要的高危因素,如VTE病史、易栓症病史,并结合其他的高危因素,如剖宫产(尤其合并产后出血或感染)、妊娠合并症/并发症(如肥胖、高血压、自身免疫病、心脏病、多胎妊娠、子痫前期等),个性化评估风险,并制定本地化的VTE评估策略,在临床实践中不断完善之[4]。
采用何种风险评估策略目前还存在很大的争议,临床上常见采纳使用的评估系统包括:RCOG(2015)[9]、澳大利亚昆士兰卫生组织(2020)[6]、美国妇产科医师协会(American College of Obstetricians and Gynecologists,ACOG)(2018)[4]、中华医学会妇产科学分会产科学组(2021)[3]等制定的孕产妇VTE防治指南或共识、妊娠改良Caprini血栓风险评估量表[11]、妊娠改良Padua血栓风险评估量表[10]等,但目前没有哪项评分系统的妊娠期效度得到临床研究数据的支持。有研究比较了上述3种不同的风险评估系统(RCOG、改良Caprini和改良Padua),但最终发现这3种评估系统并不能有效发现VTE,且会导致预防性用药的泛滥,其中改良Caprini评估量表(设定风险阈值≥2分)药物使用率高达94%[11]。2022年一项回顾性研究比较了RCOG指南(2015年)和ACOG指南(2018年)的风险评估系统对产科住院患者的VTE风险评估效果,结果显示,如果采用RCOG标准,53%的产后患者需使用预防性抗凝;而采用ACOG标准并将风险阈值再提高1分,产后仅11%患者需要药物预防,且可捕获所有的住院后VTE事件[12]。2023年的一项研究比较了11种产褥期VTE风险评估工具,认为各评估工具的预测效率差别极大,综合考虑灵敏度和特异度,瑞典方案可能具有更优的临床使用价值[13]。不少学者认为,现有的不少指南,包括美国胸科医师学会(American College of Chest Physicians,ACCP)、英国、加拿大、澳大利亚和新西兰指南等,在药物预防性抗凝方面的证据级别均较低,所得出的推荐值得进一步商榷[14, 15]。考虑到广泛使用肝素类药物对孕产妇带来的伤害也不容小觑,低分子肝素的使用可明显增加手术出血、伤口血肿和输血的风险[15]。因此,在制定使用药物预防VTE的决策前应充分评估获益和风险。
健康宣教和物理预防是预防妊娠相关VTE的首选[3]。健康宣教主要包括预防脱水、合理膳食、孕期适当运动、产后早期活动等,适用于所有孕产妇,在首次产检时就应当进行该项宣教[3]。物理预防包括足背屈运动、防血栓梯度加压弹力袜、间歇充气加压装置(intermittent pneumatic compression devices,IPCD)或足底静脉泵等,对活动受限的患者应采用物理预防直至自由活动[3, 4]。研究显示,IPCD与抗凝治疗在降低VTE风险方面效果相当;与抗凝治疗相比,IPCD使用可降低大出血风险;在抗凝治疗同时叠加IPCD可进一步降低VTE风险[16, 17]。鉴于物理预防措施的安全性和有效性数据,美国母胎医学学会和妇产科医师学会均推荐:剖宫产孕妇在术后恢复自由活动前应持续使用物理预防措施[4,18]。
VTE风险评估判定为高风险的人群,可根据风险评级选用适当的药物预防措施。药物选择方面,低分子肝素(low molecular weight heparin,LMWH)为孕期用药的首选。它与普通肝素(unfractionated heparin,UFH)均不通过胎盘,但LMWH可靠性更高,不良反应更少(如骨质疏松、肝素相关血小板减少、出血等),使用更方便[4]。华法林为维生素K拮抗剂,一般仅限于心脏机械瓣置换术后的孕妇,产后哺乳期可安全使用。
应根据患者的高危因素分级,选择合适的抗凝治疗剂量及疗程。抗凝的禁忌证包括:出血性疾病、活动性产科出血、出血高风险(如血小板中重度降低、前置胎盘、重度高血压未控等)。对疑难复杂患者,应由产科和血液内科等多学科团队会诊共同决定预防策略。
PE的典型临床表现包括气短(34.7%)、心动过速(30.4%)、胸痛(13%)、下肢疼痛肿胀(9.6%)等[7]。严重的PE患者可出现心脏骤停、休克或持续性低血压,同时可伴有终末器官的低灌注表现[19]。胎儿作为孕妇的特殊器官,如出现胎心异常也可能是终末器官灌注不足的一个表现。
妊娠相关PE患者的临床表现往往不具有特异性,且与妊娠期呼吸及心血管系统的生理性改变有表现重合之处,因此,目前尚没有妊娠相关PE的临床诊断标准。国际上现有的PE临床可能性评分(如Wells评分、Geneva评分量表)在妊娠期的适用性并未得到验证,仅做临床参考[7,20]。有研究将Geneva评分量表根据妊娠女性特点进行了项目调整(包括年龄、心率、合并症等),将这种妊娠改良的Geneva评分量表在小样本孕妇中验证效度尚可[21],但该标准尚未得到广泛的认可。目前在诊断妊娠相关PE时,往往需要综合考虑辅助检查结果。
1. D-二聚体检测:该项检查在非孕人群中诊断PE的灵敏度可达73%~100%。病例对照研究结果显示,D-二聚体水平与妊娠期PE发生呈正相关[22]。但考虑到D-二聚体在妊娠期存在生理性升高,目前妊娠期正常值参考范围尚不明确,采用D-二聚体筛查妊娠期PE的假阳性率过高[23];另外,有报道提示存在D-二聚体水平正常的妊娠相关PE,因此该值阴性并不能完全除外PE[5,7]。D-二聚体在用于妊娠相关PE的诊断时必须结合其他的临床参数。例如,有研究提示将妊娠改良的Geneva临床标准结合D-二聚体测定,可对低危患者进行PE排除性诊断,减少后续影像学检查的需求[24]。
2. 血管加压超声检查(compression ultrasonography,CUS):对DVT的诊断准确性较高,鉴于与非孕期相比,妊娠相关DVT的近心端血栓发生率更高,CUS用于诊断DVT的假阴性率可能更高[4],对CUS检查不明确但疑诊PE的患者,及早进行肺血管检查比进一步排查DVT更重要[5]。
3. 胸部X线检查:由于辐射剂量低,简便易行,通常为孕期疑诊PE时首选的放射性检查,同时还可用于其他肺部疾病的排除性诊断,但由于PE的胸部X线片表现不特异,不能准确诊断PE[5]。
4. CT肺动脉造影(computed tomography pulmonary angiography,CTPA)和核素肺通气/灌注(V/Q)显像:这两种影像学检查均可用于妊娠相关PE的确诊。CTPA的优点在于检查时间短,操作方便,可同时提供胸部其他疾病的鉴别诊断,在国内使用较为普遍。但与V/Q显像相比,缺点主要在于:诊断率稍低;乳房的辐射暴露稍高;存在碘造影剂相关风险,在碘过敏和肾功能不全患者中使用受限。尽管造影剂中的碘可通过胎盘,但尚未有致畸风险及对胎儿不良影响的报道[3]。V/Q显像在孕期使用的优点在于对母体的辐射暴露减少;诊断率更高,对胸部X线片正常、无慢性肺部疾病患者的诊断率可高达97%[5]。与CTPA相比,缺点在于:不能提供除PE外其他肺部疾病的鉴别诊断,检查耗时相对长。临床上可根据患者的特点及医院资源,合理选择这两种影像学检查,并做好相应的知情告知。
5. 超声心动图:对于休克的患者,超声心动图可快速用于休克的鉴别诊断,显示出PE的特征性表现,如右心增大、肺动脉扩张等,有时可直接观察到肺血管内血栓,从而确诊PE[5,25]。
6. 动脉血气分析:血气分析时发现低氧血症,可能有助于提示PE诊断[1]。但对临床可疑妊娠相关PE的患者,如果以动脉血气分析进行筛查诊断,各项指标效率均较差,因此,并不推荐采用该指标诊断PE[26]。
为避免妊娠相关PE的诊断延误,减少漏诊并尽可能减少孕产妇的辐射暴露,不少研究探讨了妊娠相关PE的诊断流程[27]。图1是参考了美国胸科学会/胸部放射学会[24]及ACOG[4]的推荐制定的妊娠相关PE的参考诊断流程。该流程适用于血流动力学稳定的疑诊妊娠相关PE患者。为减少诊断相关的辐射暴露,根据患者临床症状,优先考虑CUS或辐射剂量较低的胸部X线检查进行分流。对胸部X线检查异常患者,考虑CTPA可提供胸部其他疾病鉴别诊断,优先考虑CTPA;对胸部X线检查正常患者,考虑降低母胎暴露剂量和提升诊断率,优先考虑V/Q显像。
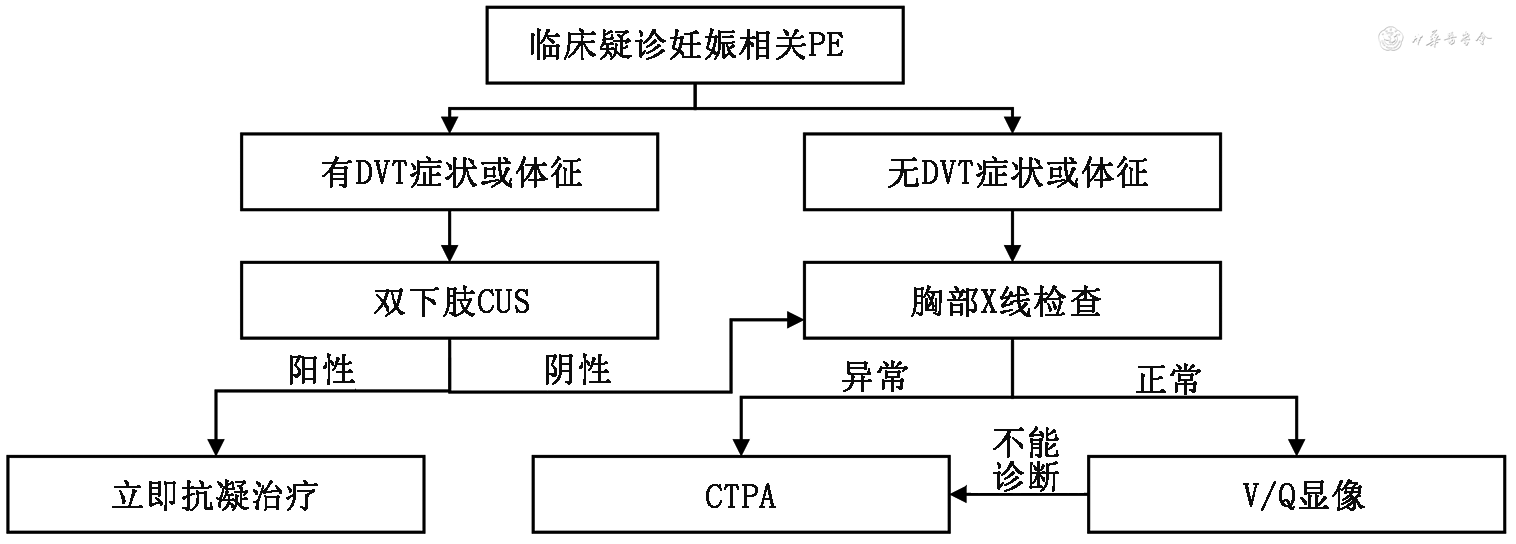

注:PE为肺栓塞;DVT为深静脉血栓;CUS为血管加压超声检查;CTPA为CT肺动脉造影;V/Q显像为核素肺通气/灌注显像
对血流动力学不稳定的PE疑诊患者,如果临床条件允许,建议完善CTPA以确诊或排除PE;如条件不允许,建议床旁超声心动图检查寻找PE的特征性表现[25]。
在实际使用中,医疗机构也可根据自身的医疗资源,制定本地化的诊断流程。
妊娠相关PE治疗与非妊娠期PE的治疗相似,应根据患者的临床表现进行危险分层,基于危险分层选择相应的治疗策略。
根据2019年欧洲心脏病学会(European Society of Cardiology,ESC)急性肺栓塞诊治指南,出现心脏骤停、梗阻性休克或持续性低血压等血流动力学不稳定现象的PE患者被判定为高危PE[17]。再灌注治疗是高危PE患者的首选治疗,包括药物溶栓或手术取栓[17]。
药物溶栓是首选的再灌注治疗方案,常用的溶栓药物为组织型纤溶酶原激活剂(recombinant tissue plasminogen activator,rt-PA)。在非孕期高危PE人群中的数据显示,溶栓治疗较抗凝治疗可显著降低PE死亡率(OR=0.15,95%CI:0.03~0.78)[28],但同时也带来了出血风险的增加,溶栓治疗的重大出血风险是抗凝治疗的3倍,大出血和颅内出血的绝对风险分别增加6%和1.4%[8],因此对于血流动力学稳定的中危或低危PE患者应避免常规溶栓。与非孕期相比,妊娠期溶栓治疗更为复杂,需顾虑胎儿安全和产科出血的风险。所幸溶栓药物的分子量均较大,胎盘通过率极低,人类数据中并未发现溶栓药物的致畸性,也并未发现药物进入母乳的证据[8]。2017年的一项系统回顾研究了83例溶栓治疗的PE孕妇,总体孕产妇生存率达94%,主要并发症包括大出血(产前发生率18%,产后58%)、胎儿死亡(12%)和早产(35%)[29]。因此,在妊娠相关PE中溶栓治疗并非禁忌,相关学会推荐建议妊娠相关高危PE选用溶栓治疗[4,9,19]。
针对急性PE的经皮导管介入治疗包括介入溶栓和介入取栓,也可两种治疗联合应用。2019年ESC急性肺栓塞诊治指南推荐用于存在溶栓禁忌或溶栓失败的高危型PE患者[19]。研究显示,介入治疗可减少重大出血发生率[30]。但该技术在孕期使用数据极少,能否采用需综合考虑患者的出血风险、技术的可获得性及操作伴随的辐射暴露对母儿的影响[8]。
对血流动力学稳定的PE患者,首选治疗为抗凝治疗[5]。药物选择方面也是优选LMWH,根据孕妇体重调整剂量,予以治疗剂量抗凝,用药过程中一般无需监测抗-Ⅹa水平[4]。
围分娩期抗凝治疗需进行相应调整。对LMWH抗凝的孕妇,在计划引产或剖宫产前,需停治疗性抗凝24 h或预防性抗凝12 h,且椎管内穿刺操作前应复查凝血功能[4]。产后恢复LMWH抗凝的时机,需要考虑的因素包括:(1)分娩情况:如阴道分娩后4~6 h或剖宫产分娩后6~12 h,根据产后出血情况判断是否恢复LMWH治疗[3,5];(2)抗凝剂量:椎管内穿刺或放置导管后至少24 h才可重新开始治疗量LMWH抗凝,至少12 h才可重新开始预防量LMWH抗凝[4];(3)导管留置状态:导管移除后至少等待4 h再开始LWMH注射[4]。在暂停使用抗凝期间,推荐使用IPCD等物理措施[4]。
产后抗凝时长至少需维持至产后6周,且需满足抗凝总疗程3个月。
1. 体外膜氧合(extracorporeal membrane oxygenation,ECMO):ECMO虽然并非再灌注治疗,但可以暂时恢复患者的血流动力学和循环状态。鉴于高危PE的血流动力学特点,通常采用静脉-动脉ECMO(VA-ECMO)模式。ECMO用于妊娠相关高危PE的证据极少,多为回顾性研究。有研究回顾了21例ECMO治疗的妊娠相关PE患者的资料[8],其中4例患者联合了抗凝治疗,其余17例联合了再灌注治疗,最终孕产妇存活率为76%,胎儿存活率为63%。联合再灌注治疗的患者中,重大出血发生率高达55%,包括2例致死性颅内出血,而联合抗凝治疗的孕妇均未发生重大出血[8]。使用ECMO过程中,还需要注意到ECMO技术自身的相关风险,如出血、感染、血栓形成等。尽管ECMO在妊娠相关PE中的使用证据极低,但对有条件的医疗机构,可考虑用于难治性心脏骤停患者再灌注治疗前的过渡期管理,或联合抗凝治疗用于再灌注治疗有禁忌(如出血风险极高的产后早期阶段)或不能获得的患者[8,31]。
2. 下腔静脉滤网(inferior vena cava filter,IVCF):IVCF的放置可能导致滤网血栓形成、静脉穿孔、后续取滤网失败等并发症风险[8],妊娠期放置的数据有限,一般仅限于有抗凝绝对禁忌的急性妊娠相关DVT,或在预期分娩前2~4周发生广泛的髂股静脉血栓的孕妇[7]。
随着我国生育现状的变迁,高龄、辅助生殖妊娠、营养代谢异常、复杂合并症患者妊娠等各种高危妊娠占比逐渐升高,不可避免地带来妊娠相关PE发生率的升高。相关高质量证据的缺乏使我们在面对这一疾病的诊疗时存在困惑。面对这一矛盾,更应该遵循循证医学原则,不冒进不懈怠,积极探索合适的预防、诊断和治疗模式,并在临床实践中不断对之进行总结完善,尽最大的努力保障孕产妇的生命安全和生活质量。
汤萍萍, 高劲松. 妊娠相关肺栓塞的预防和诊治[J]. 中华医学杂志, 2024, 104(30): 2785-2790. DOI: 10.3760/cma.j.cn112137-20240229-00446.
所有作者声明不存在利益冲突



























