
分析度普利尤单抗对中重度特应性皮炎(AD)的疗效与安全性。
回顾性分析2020年8月至2022年11月在中南大学湘雅医院皮肤科接受度普利尤单抗治疗的中重度AD患者的临床资料,共259例。分别在治疗前、治疗后第2、4、16、24周采用湿疹面积和严重程度指数评分(EASI)、特应性皮炎评分(SCORAD)、瘙痒峰值数字评分(NRS)、以患者为导向的湿疹测量评分(POEM)和皮肤病学生活质量指数(DLQI)评估患者疗效,同时记录治疗期间发生的不良反应。比较治疗前后不同时间点的评分变化和实验室指标变化。
259例患者的年龄为(35.4±25.9)岁,AD病程[M(Q1,Q3)]为4.00(2.00,9.00)年,男性占64.1%(166例)。度普利尤单抗治疗第2、4、16、24周的EASI、SCORAD、POEM、DLQI和NRS评分与治疗前相比均下降(均P<0.001)。第16周时EASI50、EASI75和EASI90构成分别为91.0%(101/111)、71.2%(79/111)和40.5%(45/111),第24周时构成分别为95.0%(76/80)、80.0%(64/80)和45.0%(36/80)。第24周的基础总IgE水平(P=0.005)和嗜酸性粒细胞(EOS)计数(P<0.001)与治疗前相比降低。54(20.9%)例患者出现不良事件,主要表现为面颈部顽固性红斑(5.0%,13例)和结膜炎(1.9%,5例)。
度普利尤单抗可有效改善中重度AD的皮疹面积、皮疹严重程度和瘙痒程度等,提高患者生活质量,并且不良反应发生率较低。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
特应性皮炎(atopic dermatitis,AD)是临床常见的慢性炎症性皮肤病,其特征是反复出现湿疹性皮疹和瘙痒[1]。近年来,AD的发病率在我国呈上升趋势。2013—2014年在中国12个城市进行的调查显示1~7岁儿童AD患病率为12.94%[2],1~12月龄婴儿AD患病率达30.48%[3]。AD的发生发展与多种因素相关,遗传、环境、免疫紊乱、神经源性炎症、皮肤屏障功能障碍、微生物菌群失调都可能参与AD的发病机制[4, 5, 6]。
AD主要由2型炎症反应驱动[4]。辅助型T细胞(helper T cell,Th)2和固有淋巴样细胞分泌的2型细胞因子白细胞介素(interleukin,IL)-4和IL-13在AD的2型炎症发病机制中发挥关键作用[7, 8]。度普利尤单抗是一种针对IL-4Rα的全人源IgG4单克隆抗体,通过靶向共同受体IL-4Rα,阻断IL-4和IL-13信号,抑制2型炎症反应,从而发挥治疗效应[9]。2020年6月,我国批准度普利尤单抗用于治疗外用处方药控制不佳或不建议使用外用处方药的成人中重度AD。2022年3月批准用于6岁及以上儿童和成人中重度AD。临床试验和真实世界研究表明,度普利尤单抗在成人、青少年和儿童AD中均显示出较好的临床疗效,是中度至重度AD的有效且较为安全的治疗方法[10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20]。目前针对我国中重度AD患者的真实世界研究较少[21, 22, 23],因此本研究在本团队前期真实世界研究[22]的基础上进一步扩大样本人群,以获得更多中国患者的治疗效果和不良反应真实世界的数据,指导临床医师合理用药。
本研究为病例系列研究。选取2020年8月至2022年11月在中南大学湘雅医院皮肤科接受度普利尤单抗治疗的中重度AD患者为研究对象。纳入标准:(1)符合AD诊断标准[24];(2)对常规治疗(包括外用糖皮质激素、系统治疗药物等)反应抵抗或不耐受其不良反应或不愿意继续接受常规治疗;(3)均为中度或重度AD:根据AD评分(SCORing atopic dermatitis,SCORAD)划分中重度患者,即26~50分为中度,51~103分为重度[25];(4)愿意参与本研究并接受随访。排除标准[26]:(1)结核、HIV等感染的活动期;(2)对度普利尤单抗所含任何成分过敏者;(3)怀孕、哺乳期患者。本研究通过中南大学湘雅医院伦理委员会批准(批号:202212806),且患者本人或监护人均已签署知情同意书。最终,共259例中重度AD患者接受至少1次以上度普利尤单抗注射治疗,并且符合入排标准纳入本研究。
1. 数据收集:采用湘雅医学大数据系统录入皮肤科AD专病门诊《AD病例报告表》和湘雅医院电子病历信息系统(hospital information system,HIS)的一般资料及临床资料,包括:年龄、性别、病程、体重、体质指数(body mass index,BMI)、现病史、临床表现、过敏史、家族史、合并症、既往治疗、合并治疗等(表1)。此外,检测治疗前后血清总IgE(正常值<200 U/ml)、外周血嗜酸性粒细胞(eosinophil,EOS)计数(正常值0.02~0.52×109/L)、乳酸脱氢酶(lactate dehydrogenase,LDH)(正常值120~250 U/L)的水平。
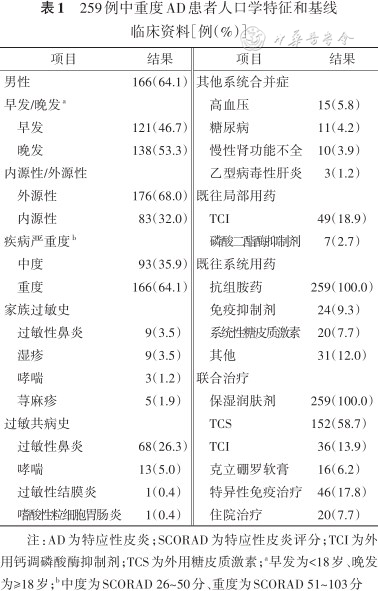
259例中重度AD患者人口学特征和基线临床资料[例(%)]
259例中重度AD患者人口学特征和基线临床资料[例(%)]
| 项目 | 结果 | 项目 | 结果 |
|---|---|---|---|
| 男性 | 166(64.1) | 其他系统合并症 | |
| 早发/晚发a | 高血压 | 15(5.8) | |
| 早发 | 121(46.7) | 糖尿病 | 11(4.2) |
| 晚发 | 138(53.3) | 慢性肾功能不全 | 10(3.9) |
| 内源性/外源性 | 乙型病毒性肝炎 | 3(1.2) | |
| 外源性 | 176(68.0) | 既往局部用药 | |
| 内源性 | 83(32.0) | TCI | 49(18.9) |
| 疾病严重度b | 磷酸二酯酶抑制剂 | 7(2.7) | |
| 中度 | 93(35.9) | 既往系统用药 | |
| 重度 | 166(64.1) | 抗组胺药 | 259(100.0) |
| 家族过敏史 | 免疫抑制剂 | 24(9.3) | |
| 过敏性鼻炎 | 9(3.5) | 系统性糖皮质激素 | 20(7.7) |
| 湿疹 | 9(3.5) | 其他 | 31(12.0) |
| 哮喘 | 3(1.2) | 联合治疗 | |
| 荨麻疹 | 5(1.9) | 保湿润肤剂 | 259(100.0) |
| 过敏共病史 | TCS | 152(58.7) | |
| 过敏性鼻炎 | 68(26.3) | TCI | 36(13.9) |
| 哮喘 | 13(5.0) | 克立硼罗软膏 | 16(6.2) |
| 过敏性结膜炎 | 1(0.4) | 特异性免疫治疗 | 46(17.8) |
| 嗜酸性粒细胞胃肠炎 | 1(0.4) | 住院治疗 | 20(7.7) |
注:AD为特应性皮炎;SCORAD为特应性皮炎评分;TCI为外用钙调磷酸酶抑制剂;TCS为外用糖皮质激素;a早发为<18岁、晚发为≥18岁;b中度为SCORAD 26~50分、重度为SCORAD 51~103分
2. 治疗方案:成人首次皮下注射600 mg度普利尤单抗,此后每隔2周皮下注射300 mg,直至16周,此后视具体情况延长注射间隔时间。6~17岁儿童/青少年:体重30~60 kg者,首次400 mg,此后每2周200 mg;体重15~30 kg者,首次600 mg,此后每4周300 mg。6岁以下儿童:首剂200或300 mg,每4周200或300 mg维持治疗[22]。所有患者在接受度普利尤治疗的同时联合接受保湿润肤、外用药等治疗(表1)。
3. 有效性指标变化及不良反应事件报告:在治疗前和注射度普利尤单抗后第2、4、16、24周采用湿疹面积和严重程度指数评分(eczema area and severity index,EASI)、SCORAD、瘙痒峰值数字评分(numerical rating scale,NRS)[27]、以患者为导向的湿疹测量评分(patient oriented eczema measure,POEM)和皮肤病学生活质量指数(dermatology quality of life index,DLQI)[28, 29]对患者进行疗效及生活质量评估。主要疗效指标:EASI评分下降≥50%(EASI50)、75%(EASI75)、90%(EASI90)的患者比例;次要疗效指标:峰值瘙痒NRS改善≥4或DLQI改善≥4的患者比例[22]。治疗过程中记录患者的不良反应报告。
采用SPSS 26.0统计软件进行数据分析。符合正态分布的计量资料采用表示,中重度AD患者两组间计量资料的比较采用独立样本t检验,采用单因素重复测量方差分析临床评分在治疗前后差异,两两比较采用Bonferroni 校正;不符合正态分布的计量资料以M(Q1,Q3)表示,采用广义估计方程分析度普利尤单抗治疗前后不同时间节点的实验室检测指标变化,采用Bonferroni法校正检验水准,α′=0.05/6=0.008;计数资料采用频数(%)表示,采用χ²检验,χ²检验的多重比较采用Bonferroni法校正检验水准,度普利尤单抗治疗后不同时间点疗效指标构成两两比较调整检验水准α′=0.05/6=0.008,16周不同用药次数两两比较调整检验水准α′=0.05/3=0.017;除多重校正外,其他所有检验均为双侧检验,检验水准α=0.05。
259例患者的年龄为(35.4±25.9)岁,AD病程为4.00(2.00,9.00)年,BMI为(20.75±4.29)kg/m²;其中,男性比例(64.1%,166例)高于女性(35.9%,93例),外源性患者比例(68.0%,176例)高于内源性患者(32.0%,83例),家族过敏史和过敏共病史中以过敏性鼻炎(3.5%,9例)最常见。见表1。中度AD患者为92例,重度AD患者为167例,重度AD患者在治疗期间联合使用外用糖皮质激素的比例(62.3%,104例)高于中度AD患者(47.8%,44例)(χ²=5.06,P=0.025),其他临床特征差异均无统计学意义(均P>0.05)。
1. 度普利尤单抗治疗后各项评分变化:治疗后第2、4、16、24周EASI、SCORAD、POEM、DLQI和NRS评分与治疗前相比均降低(均P<0.01)。治疗后第2、16周的EASI评分与前一时间点相比均降低(P<0.008)(表2)。达到主要和次要疗效指标的比例见表3,其中,中度和重度AD患者在各时间点的各疗效指标构成差异无统计学意义(P>0.05)。
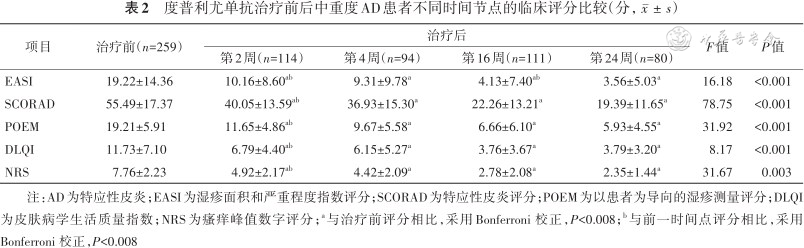
度普利尤单抗治疗前后中重度AD患者不同时间节点的临床评分比较(分,)
度普利尤单抗治疗前后中重度AD患者不同时间节点的临床评分比较(分,)
| 项目 | 治疗前(n=259) | 治疗后 | F值 | P值 | |||
|---|---|---|---|---|---|---|---|
| 第2周(n=114) | 第4周(n=94) | 第16周(n=111) | 第24周(n=80) | ||||
| EASI | 19.22±14.36 | 10.16±8.60ab | 9.31±9.78a | 4.13±7.40ab | 3.56±5.03a | 16.18 | <0.001 |
| SCORAD | 55.49±17.37 | 40.05±13.59ab | 36.93±15.30a | 22.26±13.21a | 19.39±11.65a | 78.75 | <0.001 |
| POEM | 19.21±5.91 | 11.65±4.86ab | 9.67±5.58a | 6.66±6.10a | 5.93±4.55a | 31.92 | <0.001 |
| DLQI | 11.73±7.10 | 6.79±4.40ab | 6.15±5.27a | 3.76±3.67a | 3.79±3.20a | 8.17 | <0.001 |
| NRS | 7.76±2.23 | 4.92±2.17ab | 4.42±2.09a | 2.78±2.08a | 2.35±1.44a | 31.67 | 0.003 |
注:AD为特应性皮炎;EASI为湿疹面积和严重程度指数评分;SCORAD为特应性皮炎评分;POEM为以患者为导向的湿疹测量评分;DLQI为皮肤病学生活质量指数;NRS为瘙痒峰值数字评分;a与治疗前评分相比,采用Bonferroni 校正,P<0.008;b与前一时间点评分相比,采用Bonferroni 校正,P<0.008
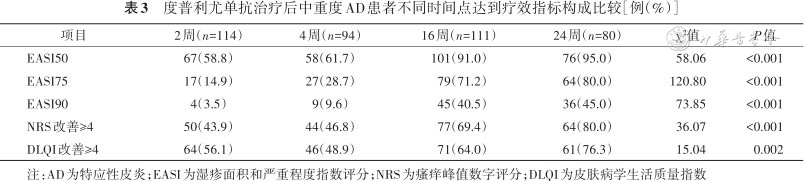
度普利尤单抗治疗后中重度AD患者不同时间点达到疗效指标构成比较[例(%)]
度普利尤单抗治疗后中重度AD患者不同时间点达到疗效指标构成比较[例(%)]
| 项目 | 2周(n=114) | 4周(n=94) | 16周(n=111) | 24周(n=80) | χ²值 | P值 |
|---|---|---|---|---|---|---|
| EASI50 | 67(58.8) | 58(61.7) | 101(91.0) | 76(95.0) | 58.06 | <0.001 |
| EASI75 | 17(14.9) | 27(28.7) | 79(71.2) | 64(80.0) | 120.80 | <0.001 |
| EASI90 | 4(3.5) | 9(9.6) | 45(40.5) | 36(45.0) | 73.85 | <0.001 |
| NRS改善≥4 | 50(43.9) | 44(46.8) | 77(69.4) | 64(80.0) | 36.07 | <0.001 |
| DLQI改善≥4 | 64(56.1) | 46(48.9) | 71(64.0) | 61(76.3) | 15.04 | 0.002 |
注:AD为特应性皮炎;EASI为湿疹面积和严重程度指数评分;NRS为瘙痒峰值数字评分;DLQI为皮肤病学生活质量指数
2. 用药次数对疗效的影响:随访期间,因时间及经济成本原因,部分患者未严格依从2周间隔时间治疗。治疗16周时,只接受3~4次治疗患者的EASI50比例低于接受5~6次治疗(P=0.014)的患者,但其他疗效指标比例差异无统计学意义(均P>0.017)。治疗24周时不同用药次数的疗效指标比例差异无统计学意义(均P>0.05)(表4)。
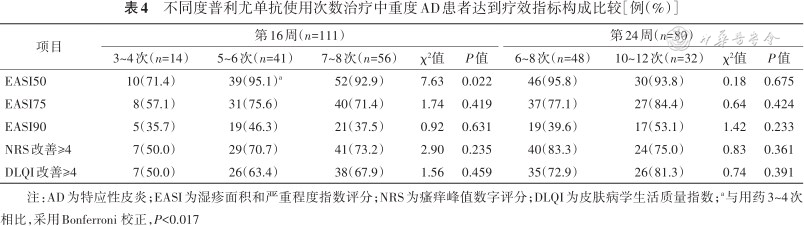
不同度普利尤单抗使用次数治疗中重度AD患者达到疗效指标构成比较[例(%)]
不同度普利尤单抗使用次数治疗中重度AD患者达到疗效指标构成比较[例(%)]
| 项目 | 第16周(n=111) | 第24周(n=80) | |||||||
|---|---|---|---|---|---|---|---|---|---|
| 3~4次(n=14) | 5~6次(n=41) | 7~8次(n=56) | χ²值 | P值 | 6~8次(n=48) | 10~12次(n=32) | χ²值 | P值 | |
| EASI50 | 10(71.4) | 39(95.1)a | 52(92.9) | 7.63 | 0.022 | 46(95.8) | 30(93.8) | 0.18 | 0.675 |
| EASI75 | 8(57.1) | 31(75.6) | 40(71.4) | 1.74 | 0.419 | 37(77.1) | 27(84.4) | 0.64 | 0.424 |
| EASI90 | 5(35.7) | 19(46.3) | 21(37.5) | 0.92 | 0.631 | 19(39.6) | 17(53.1) | 1.42 | 0.233 |
| NRS改善≥4 | 7(50.0) | 29(70.7) | 41(73.2) | 2.90 | 0.235 | 40(83.3) | 24(75.0) | 0.83 | 0.361 |
| DLQI改善≥4 | 7(50.0) | 26(63.4) | 38(67.9) | 1.56 | 0.459 | 35(72.9) | 26(81.3) | 0.74 | 0.391 |
注:AD为特应性皮炎;EASI为湿疹面积和严重程度指数评分;NRS为瘙痒峰值数字评分;DLQI为皮肤病学生活质量指数;a与用药3~4次相比,采用Bonferroni 校正,P<0.017
3. 度普利尤单抗治疗后相关实验室指标的变化:度普利尤单抗治疗后,血清总IgE水平、EOS和血清LDH水平均存在波动(表5),第24周的总IgE水平与治疗前相比显著降低(P=0.005);第16周(P=0.005)和第24周(P<0.001)的EOS计数与治疗前相比降低。LDH水平在治疗前后差异无统计学意义。
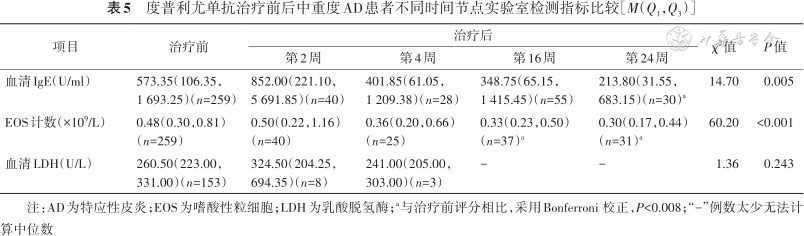
度普利尤单抗治疗前后中重度AD患者不同时间节点实验室检测指标比较[M(Q1,Q3)]
度普利尤单抗治疗前后中重度AD患者不同时间节点实验室检测指标比较[M(Q1,Q3)]
| 项目 | 治疗前 | 治疗后 | χ2值 | P值 | |||
|---|---|---|---|---|---|---|---|
| 第2周 | 第4周 | 第16周 | 第24周 | ||||
| 血清IgE(U/ml) | 573.35(106.35,1 693.25)(n=259) | 852.00(221.10,5 691.85)(n=40) | 401.85(61.05,1 209.38)(n=28) | 348.75(65.15,1 415.45)(n=55) | 213.80(31.55,683.15)(n=30)a | 14.70 | 0.005 |
| EOS计数(×109/L) | 0.48(0.30,0.81)(n=259) | 0.50(0.22,1.16)(n=40) | 0.36(0.20,0.66)(n=25) | 0.33(0.23,0.50)(n=37)a | 0.30(0.17,0.44)(n=31)a | 60.20 | <0.001 |
| 血清LDH(U/L) | 260.50(223.00,331.00)(n=153) | 324.50(204.25,694.35)(n=8) | 241.00(205.00,303.00)(n=3) | - | - | 1.36 | 0.243 |
注:AD为特应性皮炎;EOS为嗜酸性粒细胞;LDH为乳酸脱氢酶;a与治疗前评分相比,采用Bonferroni 校正,P<0.008;“-”例数太少无法计算中位数
本研究在半年随访期间一共报告了54例(20.9%)不良事件。其中37例(14.3%)为较显著的不良事件:10例(3.9%)患者因皮损及瘙痒加重而中断度普利尤单抗治疗。13例(5.0%)发生面颈部顽固性红斑。5例(1.9%)发生结膜炎,其中2例为顽固性结膜炎。3例(1.2%)患者在规律注射8~10周后出现银屑病样皮炎,表现为鳞屑性红斑块,境界清楚,病理符合银屑病改变。3例(1.2%)发生药物性皮炎,停止注射后住院治疗缓解。2例(0.8%)发生双手指间关节及双侧足踝关节疼痛,停止度普利尤单抗治疗后自行缓解。1例(0.4%)出现口腔单纯疱疹,后续治疗期间未复发。中度和重度AD患者的不良事件发生率差异无统计学意义(P>0.05)。
本研究中,度普利尤单抗治疗后各项临床客观评分(EASI、SCORAD)和主观评分(POEM、DLQI和NRS)均降低,与既往临床试验结果类似[11, 12, 13,30]。本研究中治疗后第16周时的EASI50、EASI75和EASI90的比例分别为91.0%、71.2%和40.5%,第24周时构成比分别为95.0%、80.0%和45.0%,提示其疗效随治疗持续时间的延长而逐步提高。本团队前期关于度普利尤单抗治疗116例中重度AD的真实世界数据显示,第16周EASI50、EASI75和EASI90的比例为100.00%、84.62%和30.77%[22]。其他团队研究结果显示,在16周时EASI50、EASI75和EASI90比例范围分别为87.20%~99.30%、60.60%~81.50%和32.40%~50.80%[17, 18, 19,31],与本研究统计结果接近。
观察EOS计数的变化趋势发现,第4周EOS计数与治疗前相比略有升高,而第16和24周时EOS降低。在临床试验的事后分析中发现了相同的趋势:SOLO-1和SOLO-2试验中EOS中位数在第4周略上升并在第8周下降到基线,CHRONOS试验中平均EOS在第8周上升并在第12周下降至接近或低于基线[32]。这一现象潜在的机制是,IL-4和IL-13激活B细胞向IgE类转移,并在T细胞和EOS向变态反应性炎症组织的迁移中发挥作用,而度普利尤单抗抑制了EOS向组织的运输,导致血液中EOS的一过性增加[8]。
在本研究中,16周内只接受3~4次治疗患者的EASI50构成低于接受5~6次治疗的患者,但其他疗效指标构成差异无统计学意义。24周内不同用药次数的疗效指标构成差异同样无统计学意义。一项法国的队列研究中,在达到临床改善的患者中,度普利尤单抗治疗间隔时间较长患者有2/3可达到疗效的稳定控制[33]。在出现不良反应的患者中,延长间隔时间可能有助于降低其强度。这些发现提示由于AD存在异质性,采用度普利尤单抗治疗时可根据患者具体情况制定个体化治疗方案。本研究中有患者在注射度普利尤单抗后发生银屑病样皮损,国内也有类似报道[34],IL-4负向调节Th1和Th17细胞并在AD中过度表达,这两类细胞因子在银屑病患者中都会增加[35]。有学者推测度普利尤单抗在靶向阻断IL-4信号转导,抑制Th2途径时,IL-4对Th1和Th17细胞的抑制消失,从而产生银屑病样皮损[36]。据国内外报道,度普利尤单抗治疗最常见的不良反应为结膜炎,在临床试验中结膜炎的发生率为5.00%~28.00%[12,30,37, 38],在真实世界数据中结膜炎的发病率为2.59%~62.00%[14,21, 22,39, 40]。本研究的患者群体中结膜炎报告率相对较低,可能与人种差异、及时采取相应防治措施、轻度患者未报告有关。
本研究存在一定的局限性:首先,本研究虽有较大样本量,但仍为单中心研究,需进一步纳入其他地区样本,以减少观察偏倚;其次,由于部分患者依从性不佳,导致并非所有治疗节点的临床资料收集完整。
综上所述,度普利尤单抗在降低中重度AD的疾病严重程度、瘙痒和改善生活质量方面具有较好的有效性和安全性。并且在使用过程中应根据病情逐渐调整药物使用剂量和间隔,同时配合使用其他外用药物[41],以达到长期控制、减少疾病复发的目的。
王佳怡, 周冰静, 曹巧芝, 等. 度普利尤单抗对中重度特应性皮炎的疗效与安全性分析[J]. 中华医学杂志, 2024, 104(30): 2810-2816. DOI: 10.3760/cma.j.cn112137-20240114-00104.
所有作者声明不存在利益冲突



























