
肿瘤微环境对结直肠癌患者的预后和治疗作用至关重要,肿瘤血管对结直肠癌的影响也日益受到重视。近年研究发现,新生肿瘤血管与正常血管结构功能均具有较大差异,这种新生血管的内皮细胞形态异常,周细胞松散附着或缺失以及基底膜的异常增厚或完全缺失,出现迂曲、囊性扩张等异常血管结构,从而抑制药物递送,而血管正常化后可恢复血管功能,目前将周细胞覆盖率、内皮细胞及基底膜渗漏作为评估血管正常化的评价指标。新近研究发现结直肠癌组织中血管的内皮细胞、周细胞及基底膜对肿瘤具有双向调控作用,本文综述血管相关结构对结直肠癌的具体影响,以及周细胞覆盖率和血管通透性作为评价肿瘤血管正常化的理论依据,总结了血管正常化的相关检测指标及对患者相关治疗的积极影响,使患者因血管正常化受益的同时尽可能地减少其不良影响。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
经全国继续医学教育委员会批准,本刊开设继教专栏,2024年从第1期至第10期共刊发10篇继教文章,文后附5道单选题,读者阅读后可扫描标签二维码答题,每篇可免费获得Ⅱ类继教学分0.5分,全年最多可获5分。
肿瘤微环境是指肿瘤中存在的非癌细胞和成分,包括它们产生和释放的分子。肿瘤细胞与肿瘤微环境之间的相互作用在肿瘤的发生发展、转移和治疗反应中起着关键作用[1]。尤其是在结直肠癌组织中,将肿瘤微环境作为肿瘤治疗靶点的相关研究得到了越来越多的关注。肿瘤的脉管系统是微环境中的重要组成部分,正常的血管结构相较于扭曲畸形的肿瘤血管在行使氧气及药物等的递送功能上存在较大差异。新近研究发现,结直肠癌组织中血管的内皮细胞、周细胞及基底膜对肿瘤具有双向调控作用,本文综述血管相关结构对结直肠癌组织的具体影响,以及周细胞覆盖率和血管通透性作为评价肿瘤血管正常化的理论依据,总结了血管正常化的相关检测指标及对患者相关治疗的积极影响,使患者因血管正常化受益的同时尽可能地减少其不良影响。
1.正常血管及肿瘤血管的结构差异:正常组织的促血管生成信号和抗血管生成信号相互平衡,使血管系统具有有序和规则的分支结构。通过观察其超微结构可见内皮细胞形态细长,相邻内皮细胞略有重叠,连接部分封闭。周细胞是稳定和包裹毛细血管的间充质细胞。在正常生理条件下形态扁平紧贴内皮细胞,稳定内皮细胞连接、限制血管渗透性,并通过分泌内皮生长因子和基质金属蛋白酶(MMP)抑制剂来调节内皮细胞。反之内皮细胞分泌血小板衍生生长因子(PDGF)亚单位B,以促进周细胞募集到肿瘤血管系统[2]。除此以外,可见血管基底膜清晰完整,将内皮细胞与周细胞包裹。研究发现,肿瘤组织为了获得生长所需的营养物质并转移到远处器官会上调促血管生成信号,使间质中生长出新的血管。这种新生血管的内皮细胞可向管腔内突起,使得狭窄和曲折的血管腔更加复杂;其外表面的棒状和指状突起使基底膜变形或穿透基底膜。周细胞呈圆形或不规则形,与相邻的内皮细胞分离,它们通常有自己的基底膜。这会导致基底膜异常增厚或完全缺失,出现迂曲、囊性扩张等异常血管结构,从而出现血管渗漏等病理改变。而肿瘤缺乏周细胞-内皮细胞相互作用,无法抑制血管出芽,导致肿瘤组织中血管持续出现上述异常形态。
2.肿瘤血管正常化的发生:肿瘤血管正常化发生于患者使用血管生成抑制剂后,旨在缓解肿瘤血管生成对患者的不良影响。肿瘤血管的异常结构共同导致间质流体静压升高、缺氧和酸中毒的肿瘤微环境。间质流体静压升高干扰了治疗剂向肿瘤组织的递送。缺氧使肿瘤细胞对放化疗药物产生抗性;除此以外,缺氧可诱导遗传不稳定性,并选择具有转移潜力更强的恶性细胞。肿瘤的异常脉管系统和由此产生的异常微环境共同驱动肿瘤生长和转移,并对癌症治疗药物的递送和疗效产生了巨大的障碍[3]。为了应对肿瘤血管结构和功能异常,临床使用血管生成抑制剂修复肿瘤相关的脉管系统。但该类药物对肿瘤血管的作用并不完全相同,只有原始的未成熟血管可被消除,其余血管虽未被消除但其异常结构和功能可被“正常化”。这些“正常化”的血管与正常结直肠组织的血管结构相似,具有管径均匀、被周细胞包裹、较少的侧枝和丝状伪足以及对静脉注射的示踪剂渗透性较低的特点[4],使肿瘤微环境恢复正常,进一步促进更多的肿瘤细胞获取有效浓度的药物和氧气。因此血管正常化对患者的良好预后起到重要作用,现有研究对其相关机制及评价体系尚未完善,目前广泛运用的评价指标包括周细胞覆盖率、内皮细胞及基底膜通透性等。新近研究发现,通过增加周细胞覆盖率与减少血管渗漏使血管正常化的同时可造成不良后果,周细胞与血管通透性对肿瘤微环境相关作用的具体机制有待进一步探究(图1)。
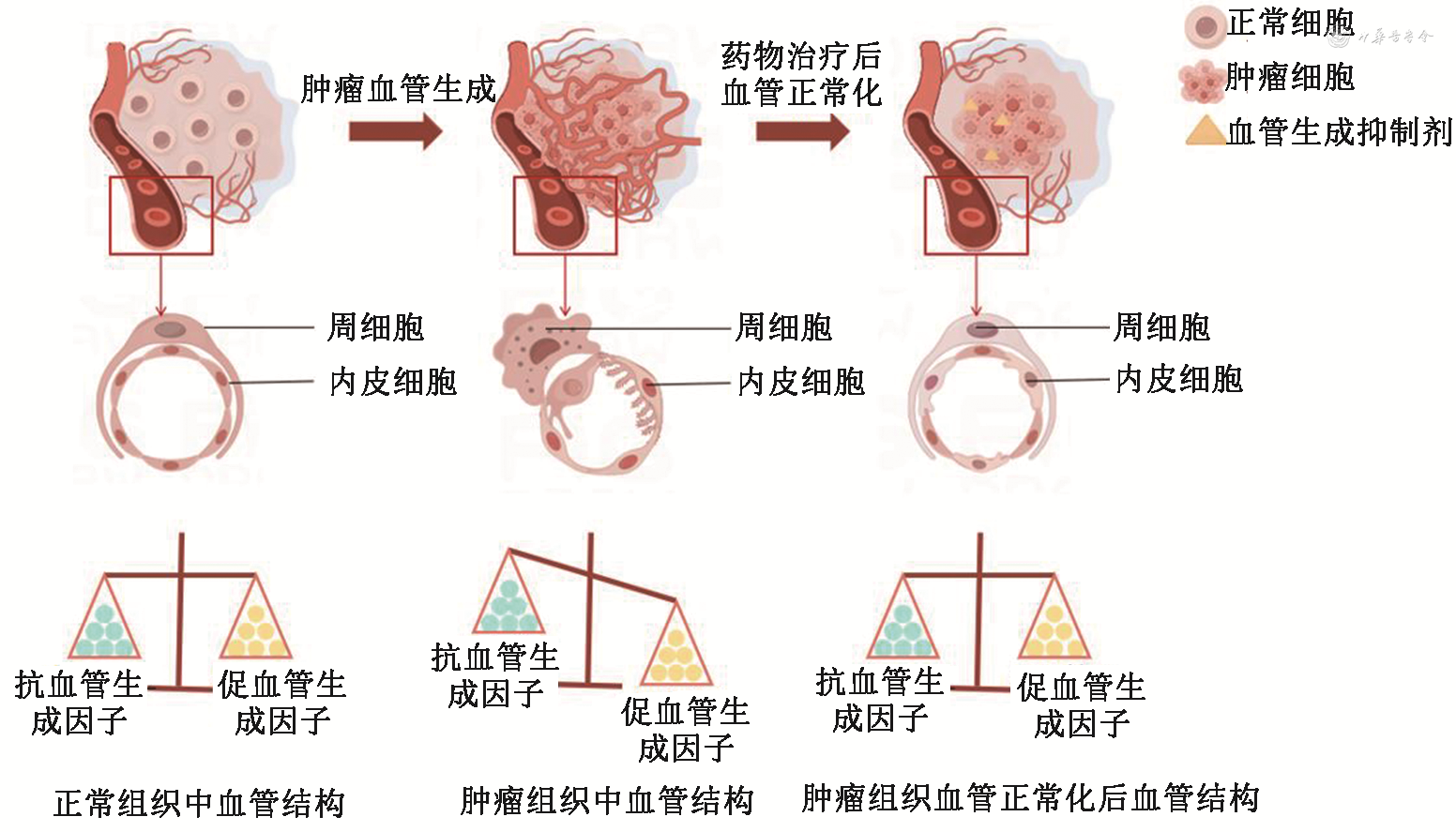

1.周细胞覆盖率增加提示血管正常化改善患者预后:正常形态的周细胞可延伸突起并紧紧包裹微血管系统,从而维持其结构并防止内皮屏障的过度渗漏或细胞迁移。Nairon等[5]通过探究在结直肠癌细胞制作的条件培养基中生长的周细胞形态学及其相应的生物学行为的变化,发现结直肠癌分泌的细胞因子使周细胞肌球蛋白轻链磷酸化降低从而出现球形表型,球形周细胞表面延伸减少,使其对血管的覆盖率降低。进一步研究证实,高侵袭性肿瘤细胞制成的条件培养基对周细胞表型变化的作用相较侵袭性较低的肿瘤细胞制成的培养基而言诱导作用更加显著。周细胞覆盖率在结直肠癌与正常组织的血管中存在显著差异,可通过周细胞覆盖率直观反映血管结构是否正常。当该指标降低提示血管结构异常,若在结直肠癌中检测到降低的周细胞覆盖率提高则提示肿瘤血管正常化。现有研究发现原发性肿瘤的周细胞覆盖率减少与肿瘤脉管系统的塌陷以及肿瘤转移有关,进一步证实周细胞介导的血管稳定和支持作用对肿瘤血管生成系统与肿瘤细胞的播散产生影响。Deryugina和Quigley[2]提出周细胞覆盖不连续的血管为肿瘤的转移提供结构基础:不仅为原发肿瘤细胞穿透血管壁提供足够的管腔空间,还允许较高的血流流速将内渗进血管管腔的肿瘤细胞从原发灶运送到邻近或远隔器官。周细胞覆盖增加使肿瘤血管结构正常化减少上述生物学行为的发生,削弱肿瘤的转移能力。因此,可根据周细胞覆盖率评估血管的形态结构,进一步预测肿瘤发生发展及转移的风险。基于此,越来越多研究将周细胞覆盖率增加作为血管成熟及正常化的标志。周细胞覆盖率的增加除了可以减少结直肠癌的转移,还可通过上调结直肠癌组织中免疫细胞浸润改善患者预后。Chu等[6]研究发现,CD8+ T细胞浸润密度高的患者的总生存时间显著长于浸润密度低的患者,同时发现CD8+ T细胞浸润密度与结直肠癌组织中周细胞覆盖面积呈显著正相关。研究人员推测这是由于周细胞覆盖面积增加使肿瘤血管结构更完整,从而允许更多免疫细胞的浸润。其他研究也得出了相似结论,Yan等[7]证实CXCL10的高表达促进结直肠癌组织CD8+ T细胞浸润,这与过表达的CXCL10通过泛素化介导的蛋白酶体依赖性机制抑制VCAN表达相关。VCAN通过表皮生长因子受体(EGFR)调节血管重塑减少周细胞覆盖,阻止CD8+ T细胞浸润到结直肠癌中。CXCL10与VCAN交互通过增加周细胞覆盖使肿瘤血管正常化,从而促进免疫细胞浸润。
2.某些周细胞亚群促进结直肠癌转移及结直肠癌组织的血管生成:正常周细胞是血管重要组成部分,但在异常肿瘤微环境中,一些肿瘤细胞被募集或分化为周细胞,这些周细胞具有促进结直肠癌细胞移动和侵袭的能力,被定义为恶性周细胞。它们在肿瘤血管中是普遍存在的,尽管结直肠癌组织血管中周细胞的附着可能比正常组织更松散,但它们对肿瘤血管生成和肿瘤转移具有重要意义[8]。因此,恶性周细胞对结直肠癌转移的促进作用可能存在除周细胞覆盖率减少外的其他机制。Navarro等[9]发现周细胞可表达高水平的转化生长因子(TGF)β1,而激活自分泌通路,与胰岛素样生长因子结合蛋白3(IGFBP3)相互作用影响结直肠癌细胞迁移和侵袭,最终通过周细胞和结直肠癌细胞相互作用触发恶性循环。结直肠癌细胞刺激周细胞分泌细胞因子,增加结直肠癌细胞的侵袭性。除此以外,周细胞还可从肿瘤血管脱离,成为肌成纤维细胞的重要来源,而肌成纤维细胞作为免疫微环境中的关键参与者,进一步促进了恶性循环,加剧了肿瘤的生长和侵袭。因此,在通过周细胞覆盖率等指标检测肿瘤血管正常化的过程中,区分覆盖于肿瘤血管的周细胞是否为恶性周细胞至关重要。
结直肠癌转移中肝转移的机制研究较为成熟。Li等[10]利用scRNA-PCR鉴定了13个肿瘤周细胞亚群,将TCF21高表达的肿瘤周细胞亚群命名为“基质-周细胞”,研究发现该亚群的整合素α5缺失使FAK/PI3K/AKT/DNMT1轴被抑制,减少TCF21启动子甲基化并增加TCF21在肿瘤周细胞中的表达。肿瘤周细胞中的TCF21增加血管周围细胞外基质硬度、胶原重排和基底膜降解,形成便于肿瘤细胞向周围转移的微环境以诱发结直肠癌肝转移。TCF21缺失可减轻血管周围细胞外基质重塑和结直肠癌肝转移,而高浓度TCF21的肿瘤周细胞和结直肠癌细胞共注射可显著促进结直肠癌肝转移[10]。另一项研究通过蛋白质组学分析表明,瞬时受体电位阳离子通道亚家族M成员8(TRPM8)的伴侣蛋白,即TRP通道相关因子2(TCAF2),在结直肠癌肝转移患者的肿瘤周细胞中过表达。TCAF2抑制TRPM8的表达和离子通道活性,通过激活Wnt5a/STAT3信号通路促进结直肠癌细胞转移[11]。促进血管正常化的周细胞亚群对结直肠癌预后有积极作用,由肿瘤细胞分化的周细胞亚群会加速结直肠癌的进展。但由于目前检测方法的局限性,仅能检测出周细胞覆盖率,区分周细胞亚群的准确性仍有待提高。在未来研究中,如果可以提高对周细胞亚群的识别能力,将对结直肠癌的侵袭性及患者的预后与治疗产生重要影响。
肿瘤血管生成涉及一系列多步骤事件,起源于肿瘤细胞表达和分泌各种促血管生成分子和炎性细胞因子,随后内皮细胞被促血管生成分子活化形成管腔,最终局部被周细胞覆盖产生血管。新生成的肿瘤血管不仅为肿瘤细胞提供营养和氧气并去除代谢废物,而且还为转移性肿瘤细胞提供进入循环系统的入口。Illemann等[12]发现周细胞表达基质金属蛋白酶组织抑制剂1,可阻断MMP-2/9,从而抑制其介导的抗血管生成片段的表达,间接促进血管生成,并与肿瘤组织中其他表达基质金属蛋白酶组织抑制剂1的基质细胞共同作用促进结直肠癌的肝转移。Besler等[13]报道了周细胞和血管平滑肌细胞分泌血管内皮生长因子(VEGF)的同时,还加工一种细胞表面蛋白即聚糖硫酸软骨素蛋白聚糖4,它们均是血管生成中非常重要的步骤,但具体机制尚待进一步探究。现有研究证实周细胞促进生成结构异常的肿瘤血管,可导致肿瘤的发生发展,如前文所述,这种血管在成熟或正常化后才能形成正常结构执行药物递送等功能。因此,周细胞在促进血管生成后如何进一步调控基因与蛋白的表达使血管结构正常化成为了未来研究需要解决的问题。
1.内皮细胞和基底膜形态异常影响结直肠癌血管结构与功能:Zhang等[14]通过对单细胞测序和批量RNA测序数据的综合分析,发现尖状内皮细胞是肿瘤和正常组织间内皮细胞的主要差异亚群,尖状内皮细胞主要存在于各种肿瘤组织中,而在正常组织中几乎不存在。这种内皮细胞是一种被激活的内皮细胞亚群,其高比例与不良临床结局相关,这可能与尖状内皮细胞可以通过与其他类型细胞之间的相互作用促进肿瘤血管生成,同时提高对抗血管生成治疗的抗性[15],并且可以影响肿瘤免疫微环境从而抑制抗肿瘤免疫反应相关。进一步研究表明,尖状内皮细胞可能通过巨噬细胞迁移抑制因子(MIF)-CD74轴招募肿瘤相关巨噬细胞或直接抑制T细胞活化,从而抑制抗肿瘤免疫反应。此外,MIF还通过抵消CD8+ T细胞介导的免疫刺激而促进肿瘤免疫逃逸。由于内皮细胞对肿瘤微环境的影响,越来越多实验希望通过靶向内皮细胞来改善患者预后,但现有研究发现,肿瘤血管系统具有保留并重塑其血管的能力。Coutelle等[16]证实靶向VEGF后内皮细胞消退发生有效的血管正常化,但留下空的基底膜袖。这些长寿命的基底膜袖允许肿瘤血管在治疗停止后快速再生,并促进对VEGF靶向药物的耐药性。进一步研究发现,该现象与血管重塑部位的内皮细胞形成及分泌血管生成素2相关。它一方面可以中断血管生成素1介导的血管正常化,导致周细胞覆盖受损、血管不稳定和血管通透性增加,从而促进血管出芽;同时还通过接合整合素ɑvβ5受体直接诱导血管出芽。该研究成果为解释相关药物无法持续使血管正常化提供了新的思路。未来可进一步探究如何消除基底膜袖等异常结构并阻断内皮细胞中相关通路,使肿瘤血管在正常化之后可维持正常形态并执行相应的功能,从而减少药物抵抗。
2.内皮细胞和基底膜的通透性降低提示肿瘤血管正常化:过往研究发现,结直肠癌组织血管正常化使肿瘤血管通透性降低可提高患者自身免疫力并改善预后[17],随着相关实验不断深入,该观点得到了支持。一方面血管内皮渗透性增加可促进癌细胞内渗,介导结直肠癌的远处转移。Dou等[18]报道结直肠癌细胞来源的外泌体miR-27b-3p可通过调节结直肠癌中的血管通透性,促进循环肿瘤细胞介导的转移。此外,血管通透性的增加可能与中性粒细胞细胞外陷阱相关,相关研究发现中性粒细胞细胞外陷阱可能通过改变血管通透性、诱导细胞骨架重排和细胞定向迁移,以及唤醒休眠癌细胞显著促进肿瘤肝转移和肺转移[19]。
近年来,通透性对结直肠癌影响的相关研究逐渐完善,新近实验发现,肿瘤血管通透性的增加有时对结直肠癌患者的预后和治疗具有积极作用。由于肿瘤浸润淋巴细胞(TIL)必须进入肿瘤微环境才可以发挥其介导的癌症控制和免疫治疗反应等作用,内皮细胞与基底膜及细胞外基质对TIL渗出有限制作用,因此血管的通透性对肿瘤免疫至关重要。研究发现肿瘤血管系统的内皮出芽和肿瘤微环境变化会导致内皮细胞与基底膜出现形态异常,SOD3通过激活WNT信号转导途径使内皮细胞与基底膜重塑,诱导血管正常化,从而促进肿瘤中T细胞浸润[20]。血管通透性的增加不仅可以促进免疫细胞的浸润,还有助于药物递送。研究发现电穿孔可以通过增加内皮细胞单层的渗透性,改善肿瘤细胞外间隙的扩散,以及破坏癌细胞质膜功能来辅助染料稳定的索拉非尼纳米颗粒(SFB-IR 783)的递送[21]。目前已有相关研究将内皮细胞与基底膜的通透性作为肿瘤血管正常化的参考指标,但具体的检测方法及渗透性对患者预后的确切影响仍处在研究阶段。因此,如何将血管渗透性调节在适宜范围,使其一方面促进免疫细胞浸润,另一方面防止肿瘤细胞外渗增加结直肠癌远处转移风险,是未来实验需要解决的另一问题。
1.周细胞标志物指示血管正常化。血管周细胞作为调节因子影响结直肠癌转移和免疫细胞活性的观点被广泛认可。Mezheyeuski等[22]运用数字定量的方法分析血管特征和周细胞,并使用2种周细胞标志物PDGFRβ和α平滑肌肌动蛋白(α-SMA)进行免疫荧光染色。随后根据不同的染色情况定义3种周细胞亚群,即PDGFRβ单阳性细胞、α-SMA单阳性细胞和双阳性细胞。最终证实PDGFRβ高表达的结直肠癌患者生存期明显延长。该结果提示未来可将PDGFRβ作为识别与肿瘤血管正常化相关周细胞亚群的生物标志物,表达PDGFRβ的周细胞可被确定为预测转移性结直肠癌生存期的独立标志物。周细胞状态还可影响内皮细胞中的信号转导和抗血管生成药物(包括VEGF靶向药物)的敏感性。目前,通过测量周细胞中α-SMA的表达强度衡量周细胞覆盖率提示血管正常化水平已广泛运用于科研中。未来可进一步探究能否将血管密度、直径和周细胞的PDGFRβ状态等因素作为评估血管正常化与患者预后的参考指标。
2.内皮细胞标志物。内皮细胞是血管重要结构,肿瘤中其结构功能发生异常可使一些分子表达异常,与正常血管形成显著差异。Gallo等[23]发现NOVA2对肿瘤血管具有提示意义,生理条件下NOVA2调节内皮细胞的极性和成熟,在肿瘤血管系统的内皮细胞中表达上调。研究证实NOVA2可作为新的肿瘤特异性生物标志物预测肿瘤组织缺氧,进一步提示血管功能,由于肿瘤血管正常化可恢复血管功能,可根据其表达差异区分肿瘤血管是否发生正常化。Nogués等[24]发现,在侵袭性更强的肿瘤血管内皮细胞中CD105高表达,通过与TGFβ1、TGFβ3和BMP9结合调节恶性肿瘤。CD105具有膜性和可溶性2种形式,膜性CD105与侵袭性的强弱有关,而可溶性CD105水平可用于监测转移。Oshi等[25]使用转录组的xCell算法探究结直肠癌中肿瘤内微血管内皮细胞的临床相关性。研究发现微血管内皮细胞高表达血管稳定性相关基因,反映成熟的血管,对肿瘤血管正常化有间接提示作用。具有丰富微血管内皮细胞的结直肠癌组织与M2巨噬细胞、树突状细胞和较少的γ-δ T细胞浸润相关,并提示化疗的高反应率,从而可预测结直肠癌患者的生存率。
目前,临床上主要运用多种VEGF受体抑制剂诱导肿瘤血管正常化,提高结直肠癌患者化疗与免疫治疗疗效[26]。新近研究发现一种高选择性VEGF受体2抑制剂阿帕替尼,通过修剪扭曲的血管分支和减少内皮细胞之间的间距改善肿瘤血管形态,继而减少血管渗漏,同时增加血管内皮细胞上的周细胞覆盖,使肿瘤血管更加成熟和完整。阿帕替尼可能通过使肿瘤血管正常化,在一定时间窗内改善肿瘤血管的有效灌注,可有助于制订阿帕替尼临床使用的联合用药方案[27]。目前仍有许多促进肿瘤血管正常化的药物处于试验阶段。Zhu等[28]发现结直肠癌细胞的一种支架性致癌蛋白PELP1异常升高,并与结直肠癌中微血管密度的增加高度相关。靶向PELP1减少STAT3/VEGFA介导的血管生成,并促进血管正常化而增强化疗反应。除此以外,中药也可促进血管正常化,Cheng等[29]证实参麦注射液可以改变促血管生成因子和抗血管生成因子的稳态,促进肿瘤血管的正常化,从而增强化疗药物的释放和抗肿瘤作用。
随着关于免疫微环境对肿瘤作用的相关研究逐渐深入,肿瘤血管的生成与正常化受到了广泛关注。血管的组成成分如内皮细胞、周细胞等对肿瘤的发生发展及药物递送都存在着重要意义,它们一方面在肿瘤组织中受到肿瘤微环境中多种机制的调控而表现出异常形态从而发挥促肿瘤的功能,另一方面保留生理状态下的功能使肿瘤血管正常化。因此,未来需要更多实验探究各细胞对肿瘤进展及肿瘤血管正常化的具体影响。本文聚焦结直肠癌组织中肿瘤血管正常化对结直肠癌患者的诊断与治疗的相关研究,未来肿瘤血管正常化治疗或将成为临床抗肿瘤治疗的新策略。
杨舒喆, 白中元, 崔巍, 等. 结直肠癌组织中肿瘤血管正常化的研究进展[J]. 中华病理学杂志, 2024, 53(8): 887-892. DOI: 10.3760/cma.j.cn112151-20231227-00442.
所有作者声明无利益冲突
1.正常组织中周细胞功能不包括()
A.稳定和包裹毛细血管
B.分泌内皮生长因子
C.分泌基质金属蛋白酶抑制剂
D.分泌血小板衍生生长因子
2.肿瘤血管正常化可以()
A.间质流体静压升高
B.增加癌症治疗药物的递送
C.缺氧
D.酸中毒
3.周细胞覆盖率增加的作用不包括()
A.减少结直肠癌的转移
B.促进免疫细胞浸润
C.为原发肿瘤细胞穿透血管壁提供足够的管腔空间
D.提示肿瘤血管正常化
4.TCF21高表达的肿瘤周细胞亚群的生物学行为不包括()
A.增加血管周围细胞外基质硬度
B.抑制结直肠癌肝转移
C.减轻血管周围细胞外基质重塑
D.促进血管内皮基底膜降解
5.尖状内皮细胞的作用不包括()
A.促进T细胞活化
B.促进肿瘤血管生成
C.提高抗血管生成治疗的抗性
D.招募肿瘤相关巨噬细胞



























