
探讨橙皮苷诱导慢性髓性白血病细胞系K562细胞发生铁死亡的作用及分子机制。
通过CCK-8、EDU-594、Transwell法检测橙皮苷对K562细胞活力、增殖和迁移的影响。采用流式细胞术检测K562细胞的凋亡率。采用C11-BODIPY和FerroOrange检测细胞中脂质过氧化和Fe2+水平。通过Western blot法检测细胞中铁死亡相关蛋白溶质载体家族7成员11(SLC7A11)、谷胱甘肽过氧化物酶4(GPX4)表达水平。采用SLC7A11过表达质粒转染细胞后,同样检测脂质过氧化及Fe2+水平。
橙皮苷可呈剂量依赖性降低K562细胞活力,IC50值为0.544 μmol/L,选取0.4、0.8 μmol/L的橙皮苷行后续实验。EDU-594、Transwell法和流式细胞术检测显示,0.4、0.8 μmol/L橙皮苷作用24 h后K562细胞增殖和迁移率明显降低,细胞凋亡率明显提高,与对照组比较差异均有统计学意义(P值均<0.05)。同时Western blot法检测显示,抗凋亡蛋白Bcl-2表达下调,促凋亡蛋白Bax及Caspase-3表达升高。与对照组比较,橙皮苷可以提高细胞内脂质过氧化和Fe2+水平(P值均<0.05)。铁死亡抑制剂(Fer-1)与橙皮苷联合给药可以逆转橙皮苷对K562细胞的作用。0.8 μmol/L橙皮苷作用组铁死亡相关基因SLC7A11、GPX4 mRNA及蛋白水平明显降低(P值均<0.05)。SLC7A11过表达可以抑制橙皮苷作用,减轻铁死亡。
橙皮苷可通过调控SLC7A11/GPX4轴,促进K562细胞铁死亡。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
慢性髓性白血病(CML)是一种起源于造血干细胞的恶性增殖性疾病,以Ph染色体和BCR::ABL融合基因为特征[1]。酪氨酸激酶抑制剂(TKI)如伊马替尼被用作一线治疗药物[2]。然而,TKI的原发性和继发性耐药降低了抗白血病的治疗效果。此外许多患者还经历TKI不耐受。铁死亡是一种铁依赖和细胞内氧化积累为特征的程序性细胞死亡[3]。铁死亡失调与肿瘤的发生密切相关,越来越多证据表明铁死亡是抑制肿瘤的重要靶点。近年来发现中药作为天然化合物具有明确的抗肿瘤特性,逐渐成为研究的热点。
橙皮苷(Hesperadin)别名陈皮苷、橘皮苷,是一种广泛存在于柑橘中的天然酚类化合物[4]。最初它被认为是一种抗肿瘤药物,在体外通过抑制AuroraB激酶诱导多种肿瘤细胞的增殖阻滞和凋亡,具有促凋亡、抗氧化、抗炎等功能[5]。然而在CML中作用及机制研究甚少。本研究主要探讨橙皮苷诱导CML细胞发生铁死亡的作用及分子机制。
人CML细胞系K562细胞购自武汉普诺赛生命科技有限公司。
橙皮苷、铁死亡抑制剂(Ferrostatin-1,Fer-1)均为美国MCE公司产品。胎牛血清、RPMI 1640培养基为美国GIBCO公司产品。C11-BODIPY为美国Thermo Fisher公司产品。FerroOrange为日本同仁化学研究所产品。SLCTA11、GPX4抗体购自武汉三鹰生物技术有限公司。Annexin Ⅴ-FITC/PI细胞凋亡检测试剂盒购自赛文创新生物科技有限公司。CCK-8检测试剂盒为日本同仁化学研究所产品,Transwell小室为美国Corning公司产品。EDU试剂盒购自碧云天生物技术有限公司。
将CML细胞系K562细胞培养于RPMI 1640培养基(含10%胎牛血清、1%链霉素和1%青霉素)中,并置于含5%CO2、37 ℃的培养箱中孵育。
将对数生长期的K562细胞按照2×104/孔的密度接种于96孔培养板中。分别设置空白对照组和不同浓度的橙皮苷组(0.2、0.4、0.6、0.8、1 μmol/L),每组设3个复孔。在24 h以后加入CCK-8试剂(10 μl),在5%CO2、37 ℃培养箱中孵育2~4 h,使用酶标仪读取450 nm处的吸光度值。
使用不同浓度的橙皮苷干预K562细胞24 h后,将37 ℃预热的2× EDU工作液(20 μmol/L)等体积加入6孔板中,继续孵育2 h,EDU标记完成后加入固定液,室温固定10~15 min。随后加入通透液,室温孵育15 min。经本试剂盒处理后,增殖的细胞在荧光显微镜下呈现出明亮的红色荧光。
取K562细胞调整至2 × 104 /ml,加入Transwell小室,24孔板下室加入完全培养基和不同浓度的橙皮苷。经药物干预24 h以后,弃去培养基,用甲醛固定30 min,用PBS清洗3次后,加入0.1%的结晶紫染色30 min。最后用棉签擦去上层未迁移的细胞,在显微镜下观察并拍照。
橙皮苷浓度分别为0、0.4、0.8 μmol/L,干预K562细胞24 h后离心收集;使用PBS洗涤3次,加入500 μl的1× Annexin Ⅴ缓冲液悬浮细胞。然后加入5 μl Annexin Ⅴ-FITC混匀后,再加入5 μl Propidium Iodide混匀;室温避光反应5~15 min;在1 h内使用流式细胞仪检测。
橙皮苷干预K562细胞24 h后,加入2 μmol/L的C11-BODIPY(581/591),放在37 ℃培养箱孵育30 min。用PBS清洗3遍,使用共聚焦显微镜测量荧光强度。
将K562细胞接种于荧光培养皿中,在37 ℃、5%CO2培养箱中孵育24 h后,弃去上清液,用无血清培养基洗涤细胞3次。加入浓度为1 μmol/L的FerroOrange工作液,在5%CO2、37 ℃培养箱中培养30 min。培养后无需清洗直接在荧光显微镜下进行观察。
200×g离心5 min收集细胞,加入增强型RIPA裂解液裂解细胞。提取细胞总蛋白进行SDS-PAGE凝胶电泳,电转到PVDF膜上。使用含有5%的脱脂奶粉室温封闭2 h。使用TBST清洗后加入一抗,4度摇床过夜。随后用TBST清洗3次,每次10 min。加入对应属性的二抗,室温孵育1 h,再次使用TBST清洗3次,最后使用成像系统检测蛋白表达情况。
将K562细胞密度调整至5×105/ml,接种于6孔板中孵育24 h,转染时细胞密度在70%~80%;转染细胞分为2组:空质粒转染(SLC7A11-NC)组和过表达质粒转染(SLC7A11-OE)组;每组设3个复孔,使用Lipofectamine2000作为转染试剂,转染试剂与质粒比例为1∶1混合后;室温孵育10~15 min后加入6孔板中,转染4~6 h换完全培养基,转染72 h后显微镜观察转染效率,收集细胞做后续实验。
TRIzol法提取细胞总RNA,使用逆转录试剂盒将RNA逆转录为cDNA,以NAPDH为内参,使用荧光染料法进行荧光定量PCR,整个感应体系分为扩增和溶解曲线两部分。使用2-ΔΔCt表示基因表达水平。引物序列见表1。
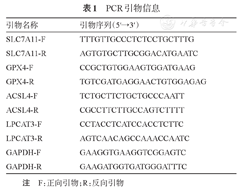
PCR引物信息
PCR引物信息
| 引物名称 | 引物序列(5′→3′) |
|---|---|
| SLC7A11-F | TTTGTTGCCCTCTCCTGCTTTG |
| SLC7A11-R | AGTGTGCTTGCGGACATGAATC |
| GPX4-F | CCGCTGTGGAAGTGGATGAAG |
| GPX4-R | TGTCGATGAGGAACTGTGGAGAG |
| ACSL4-F | TCTGCTTCTGCTGCCCAATT |
| ACSL4-R | CGCCTTCTTGCCAGTCTTTT |
| LPCAT3-F | CCTACCTCATCCACCTCTTC |
| LPCAT3-R | AGTCAACAGCCAAACCAATC |
| GAPDH-F | GAAGGTGAAGGTCGGAGTC |
| GAPDH-R | GAAGATGGTGATGGGATTTC |
注 F:正向引物;R:反向引物
使用SPSS 24.0软件进行统计分析,数据以均数±标准差表示,所有数据都来自3次独立实验。采用单因素方差分析及t检验进行组间比较。P<0.05为差异具有统计学意义。
我们首先通过CCK-8检测橙皮苷对K562细胞活力的影响,结果显示:0、0.2、0.4、0.6、0.8、1.0 μmol/L橙皮苷干预组的K562细胞活力分别为(100±0.02)%、(85.50±0.06)%、(60.81±0.01)%、(55.43±0.03)%、(34.20±0.03)%、(22.95±0.02)%。橙皮苷的IC50值为0.544 μmol/L。随着橙皮苷浓度的升高,K562细胞活力显著降低。选取0.4 μmol/L(低浓度)、0.8 μmol/L (高浓度)的橙皮苷行后续实验。随后,我们进行了EDU-594细胞增殖和Transwell实验,结果显示:橙皮苷可以抑制细胞增殖(图1A和图1B)和迁移(图1C和图1D),且呈浓度依赖性。
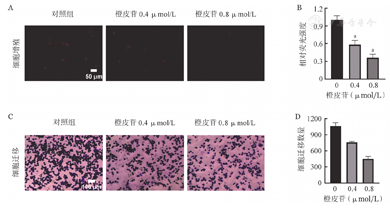

注 与对照组比较,aP<0. 05
使用不同浓度橙皮苷干预细胞24 h,从图2A和图2B可见低浓度和高浓度组K562细胞凋亡率分别为16.0%、37.4%。进一步采用Western blot法检测凋亡相关蛋白的变化,发现在橙皮苷作用下,抗凋亡蛋白Bcl-2表达下调,促凋亡蛋白Bax及Cleaved-Caspase-3的表达升高(图2C~F)。并且与低浓度相比,高浓度的作用更显著,与图2A流式细胞术检测结果一致。表明橙皮苷可以诱导人CML细胞系K562细胞凋亡。
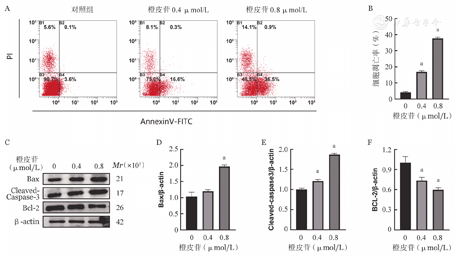

注 与对照组比较,aP<0.05
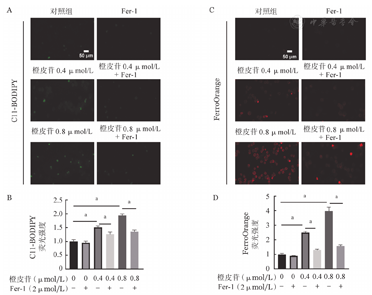
为了研究橙皮苷是否可以诱导CML细胞铁死亡,我们首先检测了K562细胞内的脂质过氧化(C-11BODIPY)水平。结果显示:与对照组相比,橙皮苷可以显著增加K562细胞内脂质过氧化,且呈剂量依赖性(图3A、图3B)。我们进一步使用特异性Fe2+探针FerroOrange对细胞内不稳定铁进行了检测,同样发现橙皮苷处理细胞后FerroOrange红色荧光升高,表明Fe2+在K562细胞中积累(图3C、图3D)。以上结果表明,橙皮苷可促进K562细胞铁死亡。
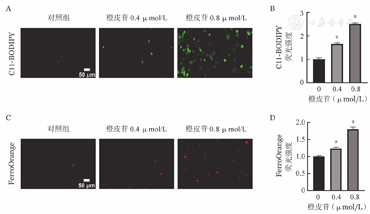

注 与对照组比较,aP<0.05
为进一步证实铁死亡是否参与橙皮苷介导的抗癌活性,我们引入铁死亡抑制剂Fer-1逆转橙皮苷对K562细胞的抑制作用。CCK-8实验显示:Fer-1+0.4 μmol/L橙皮苷组细胞活力为(81.46±0.06)%,高于0.4 μmol/L橙皮苷组的(57.90±0.05)%,Fer-1+0.8 μmol/L橙皮苷组细胞活力为(52.46±0.07)%,高于0.8 μmol/L橙皮苷组的(35.91±0.04)%(图4A)。EDU-594(图4B、图4C)和Transwell(图4D、图4E)实验结果显示:与单独橙皮苷组相比,联合铁死亡抑制剂组K562细胞的增殖和迁移率升高。
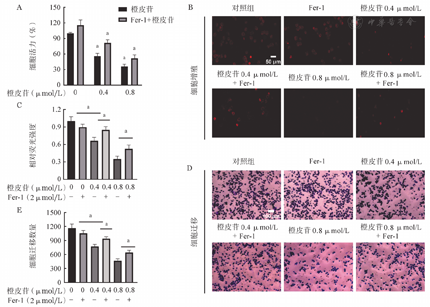

注 与对照组比较,aP<0.05
流式细胞术检测结果显示:0.4 μmol/L橙皮苷组细胞凋亡率为17.6%,0.4 μmol/L橙皮苷+Fer-1组细胞凋亡率为9.1%;0.8 μmol/L橙皮苷组细胞凋亡率为41.1%,0.8 μmol/L橙皮苷+Fer-1组细胞凋亡率为29.5%。与单独橙皮苷组相比,联合组细胞凋亡率降低。Fer-1逆转了K562细胞中橙皮苷诱导的细胞死亡。
C11-BODIPY实验结果显示:相比于对照组,橙皮苷组的脂质过氧化水平明显升高,橙皮苷+Fer-1联合组脂质过氧化水平降低(图5A、图5B)。同样FerroOrange检测结果显示:橙皮苷在联合使用铁死亡抑制剂Fer-1后,红色荧光强度明显降低(图5C、图5D)。这些数据表明,橙皮苷能够诱导K562细胞发生脂质过氧化以及Fe2+积累,而铁死亡抑制剂Fer-1可以阻止这一现象。

注 两组比较,aP<0.05
为进一步探究橙皮苷调控K562细胞铁死亡的机制,我们选取橙皮苷0.8 μmol/ L进行了后续实验。SLC7A11、GPX4、ACSL4、LPCAT3和FTH1被认为是铁死亡发生的关键调控蛋白[6],实时荧光定量PCR结果显示:与对照组相比,橙皮苷组SLC7A11、GPX4 mRNA水平显著降低,ACSL4、LPCAT3和FTH1无明显变化(图6A)。Western blot结果显示:与对照组相比,橙皮苷组SLC7A11和GPX4蛋白的表达显著降低(图6B~D)。进一步我们在K562细胞中过表达了SLC7A11(图6E、图6F),并观察其对橙皮苷作用的影响,结果表明:与对照组相比,橙皮苷组SLC7A11、GPX4蛋白水平下降。脂质过氧化及Fe2+水平升高。与SLC7A11-NC+橙皮苷组相比,SLC7A11-OE+橙皮苷组SLC7A11、GPX4蛋白水平升高(图6G~I),脂质过氧化(图6J、图6K)及Fe2+(图6L、图6M)水平降低。以上结果提示SLC7A11/ GPX4信号介导了橙皮苷诱导的K562细胞铁死亡。
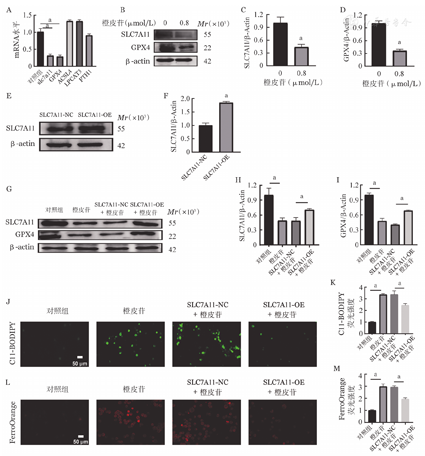

注 两组比较,aP<0.05
伊马替尼作为第一代BCR::ABL酪氨酸激酶抑制剂,广泛用于CML的一线治疗,但是部分患者对伊马替尼耐药[7]已成为临床治疗的主要问题。在本研究中我们发现,铁死亡在橙皮苷诱导的K562细胞死亡方式中占有主要地位。铁死亡是一种新形式的程序性细胞死亡,不同于细胞凋亡、坏死和自噬等形式。其特征是脂质过氧化物和铁离子的积累[8]。铁是驱动细胞内脂质过氧化和铁死亡的重要物质[9]。发生铁死亡时,细胞内的胱氨酸摄取和谷胱甘肽(GSH)的合成减少,最终导致细胞死亡[10]。在过去的十年中,铁死亡被发现与多种肿瘤的发生发展和治疗相关,并作为肿瘤的抑制机制发挥作用。因此,靶向铁死亡为癌症治疗提供了一个很有前途的策略[11]。
本研究结果显示橙皮苷的活性是通过促进铁死亡发挥作用。越来越多的证据表明橙皮苷具有抗肿瘤作用。它能抑制细胞增殖、迁移以及诱导细胞周期阻滞和凋亡。凋亡和铁死亡是两种类型的程序性细胞死亡,但是彼此密切相关,铁死亡可以促进细胞对凋亡的敏感性[12]。铁死亡和凋亡途径是潜在的癌症治疗策略,据报道许多药物通过组合途径发挥抗癌活性[13,14,15]。在本研究中,橙皮苷通过SLC7A11/GPX4通路促进细胞发生铁死亡,并且可能通过铁死亡和细胞凋亡的混合途径发挥抗癌活性。在其他疾病中,橙皮苷通过IL-6/STAT3信号通路,抑制肺成纤维细胞衰老,阻碍肺纤维化的进展[16]。橙皮苷通过TGF-β1/Smad信号通路抑制细胞增殖,可以改善良性前列腺增生[17]。橙皮苷通过NRF2/NF-κB轴减轻髓核细胞中氧化应激诱导铁死亡,避免椎间盘退化[18]。在肺癌细胞中橙皮苷可以通过靶向miR-132/ZEB2信号通路促进细胞凋亡,抑制增殖[19]。橙皮苷还可以通过抑制SDF-1/CXCR-4通路抑制非小细胞肺癌的迁移和侵袭[20]。在膀胱癌中,通过PI3K/AKT/FOXO3a通路促进细胞凋亡和周期阻滞[21]。本研究以0.2、0.4、0.6、0.8、1.0 μmol/L橙皮苷处理K562细胞,均可降低K562细胞活力;采用0.4、0.8 μmol/L橙皮苷处理K562细胞,可降低其细胞增殖和迁移率。流式细胞术发现橙皮苷可以明显诱导K562细胞凋亡。Western blot法检测显示,橙皮苷可下调K562细胞内BCL-2的表达,并上调Cleaved-caspase 3和Bax的表达水平,这一结果表明橙皮苷可增加促凋亡蛋白,同时下调抑凋亡蛋白的表达,诱发K562细胞凋亡,减弱其增殖活性。因此,橙皮苷可发挥显著的抗癌功效;剂量越高,功效越强。我们推测橙皮苷在治疗CML中,是一种很有前途的药物。
SLC7A11是一种多通道跨膜蛋白,可调节XC-系统(含有SLC7A11和SLC3A2亚单位的跨膜蛋白复合物)中的胱氨酸/谷氨酸逆向转运蛋白活性[22]。越来越多的证据证明,SLC7A11可以抑制铁死亡,促进肿瘤的进展。例如在肿瘤抑制过程中,p53通过抑制SLC7A11的表达使细胞对铁死亡敏感[23]。心脏铁蛋白的缺失通过SLC7A11介导的铁死亡促进心肌病的形成[24]。SLC7A11抑制时,肿瘤抑制因子BRCA1相关蛋白1 (BAP1)会引发铁死亡,从而减缓肿瘤进展[25]。RNA结合蛋白(RBP)对SLC7A11翻译后调节,促进肺癌中的铁死亡[26]。HBV X蛋白(HBV X protein,HBx)通过组蛋白甲基转移酶(EZH2)抑制SLC7A11,促进急性肝衰竭发生铁死亡[27]。此外在胃癌[28]、肺癌[29]等肿瘤细胞中SLC7A11是高表达的,在抑制SLC7A11后可诱发细胞死亡。黄芩苷通过NRF2/SLC7A11/GPX4调节轴诱导骨肉瘤发生铁死亡[30]。辣椒素通过体外调节SLC7A11/GPX4信号轴诱导NSCLC细胞铁死亡[31]。Ruscogenin通过NRF2/SLC7A11/GPX4信号通路抑制软骨细胞铁死亡,减轻骨关节炎中的软骨破坏[32]。青蒿琥酯通过SLC7A11/GPX4介导的铁死亡抑制胰岛素瘤细胞的生长[33]。二甲双胍通过抑制乳腺癌中SLC7A11诱导铁死亡[34]。因而推测橙皮苷可能通过抑制SLC7A11/GPX4轴,促进K562细胞铁死亡。本研究结果显示,以0.4、0.8 μmol/L橙皮苷处理K562细胞,可升高细胞内脂质过氧化和铁水平。而加入铁死亡抑制剂Fer-1后各项指标水平得到逆转,0.8 μmol/ L橙皮苷作用K562细胞24 h后,有效降低细胞内SLC7A11和GPX4蛋白的表达。这表明橙皮苷可以促进铁死亡。评估SLC7A11在K562细胞中的功能,进一步使用SLC7A11-OE转染K562细胞,对SLC7A11进行过表达。Westen blot检测显示,与单独使用橙皮苷组相比,SLC7A11-OE+橙皮苷组可降低细胞内脂质过氧化和铁离子水平。以上结果证明:过表达SLC7A11后,可以减弱橙皮苷对K562细胞的杀伤作用。
综上所述,本研究证实了橙皮苷可以抑制K562细胞增殖,通过下调SLC7A11/GPX4通路蛋白表达,引发K562细胞内脂质过氧化和铁累积,诱导细胞铁死亡,这可能是橙皮苷抗CML细胞的作用机制之一。橙皮苷下调SLC7A11/GPX4信号通路的具体分子机制还待深入研究。
所有作者声明无利益冲突



























