
血液透析目前仍然为终末期肾病患者的主要肾脏替代治疗方案,当浅静脉耗竭,或因其他原因无法建立自体动静脉内瘘时,应选择动静脉移植物内瘘作为患者的永久透析通路。本文对动静脉移植物内瘘的构建及技术要点进行阐述,涵盖术前评估、手术方案设计、移植物血管选择、术前准备及手术操作等诸多技术环节,关系到手术结局、并发症和远期通畅率。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
血液透析目前仍然为终末期肾病患者的主要肾脏替代治疗方案,自体动静脉内瘘(AVF)由于其并发症少、远期通畅率高成为长期血液透析患者的首选透析通路[1]。当浅静脉耗竭,或因其他原因无法建立AVF时,应选择动静脉移植物内瘘(AVG)作为患者的永久透析通路[2]。随着透析龄的增加以及老年透析患者人数的增加,AVG的需求量也将逐年增加[3]。本文主要就常见的上肢AVG建立及手术技术要点进行阐述。
1. 适应证:上肢浅静脉纤细或耗竭,无法建立AVF;上肢AVF无法成熟或促成熟失败;原有AVF/AVG失功且存在合适的流入道动脉及流出道静脉;患者预期寿命有限且自体内瘘建立过程复杂(如上臂转位AVF)。
2. 禁忌证:绝对禁忌证包括流出道静脉闭塞、手术侧肢体未经治疗的严重外周动脉疾病[3]。相对禁忌证包括经同侧中心静脉放置带导线的心脏节律装置(起搏器/除颤器)、中心静脉(同侧)及上腔静脉狭窄、活动性感染(拟定手术部位感染或全身感染)、既往同侧腋窝淋巴结清扫术、充血性心力衰竭、严重凝血障碍、外伤后大面积瘢痕[4]、意识障碍不能配合麻醉及手术者。
与AVF相同,为保证AVG成功率,减少并发症发生,建立AVG前患者评估过程不可或缺[2]。术前评估涵盖既往病史及手术史、物理检查、影像学检查并确定通路建立时间。物理检查包括动脉评估和静脉评估,评估应由术者亲自完成。
1. 既往手术史:既往史中尤其要注意中心静脉及外周静脉穿刺置管史、糖尿病病史、起搏器植入史、充血性心力衰竭、外周血管疾病、凝血系统异常史、合并肿瘤或其他影响患者预期寿命的疾病、心脏瓣膜病以及上肢、颈部、胸部外伤或手术史。
2. 动脉系统评估:检查双上肢血压,双上肢肱、桡、尺动脉搏动是否对称,弹性是否良好。动脉钙化时搏动有可能减弱。Allen试验评估掌动脉弓完整性。需要警惕的是部分患者可能存在肱动脉变异,桡动脉或尺动脉自肱动脉近心端甚至腋动脉或锁骨下动脉发出,导致肘部动脉内径过细,增加手术失败风险。根据笔者所在中心研究结果(未发表),患者中肱动脉高分叉变异发生率约为11.9%。此类变异肘部及腕部动脉触诊搏动可能正常,易被漏诊,建议术前常规超声检查明确之。部分老年患者存在锁骨下动脉狭窄,易引起术后AVG血栓形成或透析相关远端肢体缺血;若肱动脉搏动减弱,双上肢收缩压差>20 mmHg(1 mmHg=0.133 kPa),应高度怀疑此病并进一步进行CT血管造影(CTA)或数字减影血管造影(DSA)以明确病变部位及严重程度。如AVG必须在同侧建立,则应在术前首先纠正流入道动脉狭窄。若患者拟建立下肢AVG,术前需要进行踝臂指数(ABI)测定,ABI>0.9方可实施手术,避免术后发生透析通路相关肢体远端缺血。
3. 静脉系统评估:首先应显露患者面部、颈部、双肩及胸部,仔细观察有无置管或手术瘢痕,有无浅静脉扩张、曲张,单侧面部、颈部及肢体有无水肿,女性患者有无单侧乳房肿胀。若出现上述情况,结合既往相关病史,应怀疑中心静脉狭窄或闭塞可能,需要进一步进行静脉造影检查。由于AVG建立后血流量迅速增加,若存在中心静脉闭塞且周围静脉未形成良好侧支循环,手术侧肢体可迅速发生严重肿胀,甚至出现皮肤张力性水泡和人工血管血栓形成。
外周流出道静脉需在绑扎止血带下观察并触诊浅静脉的连续性和可扩张性(绑扎止血带前、后浅静脉直径变化)。流出道静脉直径最好在3 mm以上,若选用管壁较厚的血管移植物(如即穿型人工血管),则静脉直径最好在3.5~4.0 mm或以上。
4. 影像学评估:当肢体绑扎止血带后浅静脉仍不可见或无法触及,或物理检查时出现上述动、静脉评估异常,应考虑对血管进行彩色多普勒超声检查。动脉超声评估包括动脉管腔直径、管壁钙化、管腔狭窄、动脉变异、动脉充血试验等。静脉超声评估包括静脉连续性、静脉内径、可扩张性、距皮肤距离、瓣膜位置等。深、浅静脉均应进行检查。检查应细致全面,自肢体远端至锁骨下静脉。部分患者浅静脉可能存在节段性狭窄甚至闭塞应予以注意。手术医师应全程参与评估,强烈建议由术者亲自进行。若怀疑锁骨下动脉狭窄或中心静脉狭窄,或患者有中心静脉插管史、同侧起搏器植入史,应考虑CTA、CT静脉造影(CTV)、DSA或静脉造影明确病变部位并予以相应治疗。
5. 手术时机的选择:AVG的成熟时间较AVF短,且其主要并发症为静脉端吻合口狭窄,狭窄的发生与AVG建立时间长短有关,与AVG是否使用无关,故AVG不应过早建立。通常情况下,使用标准人工血管可在开始透析前3~6周建立,对于早期穿刺型(即穿型)人工血管,可推迟至接受透析治疗前数小时至数天[5]。
AVG包括三部分:动脉端吻合口、瘘体(可穿刺部位)及静脉端吻合口。良好的流入道动脉和流出道静脉是成功建立AVG以及维持通畅率的关键因素。术前建议根据物理检查,并结合超声评估确定动脉端和静脉端吻合口位置。
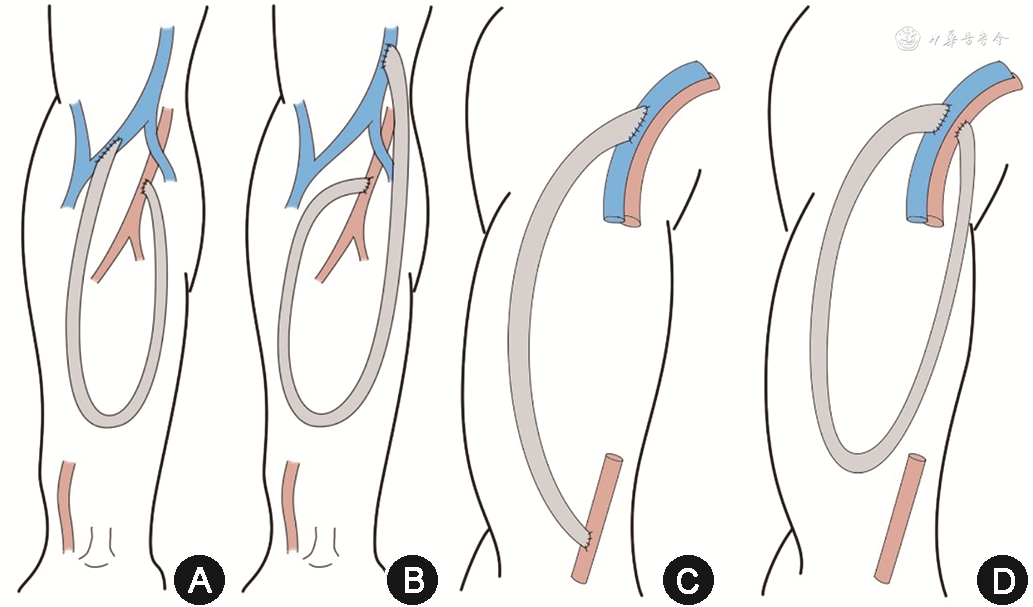
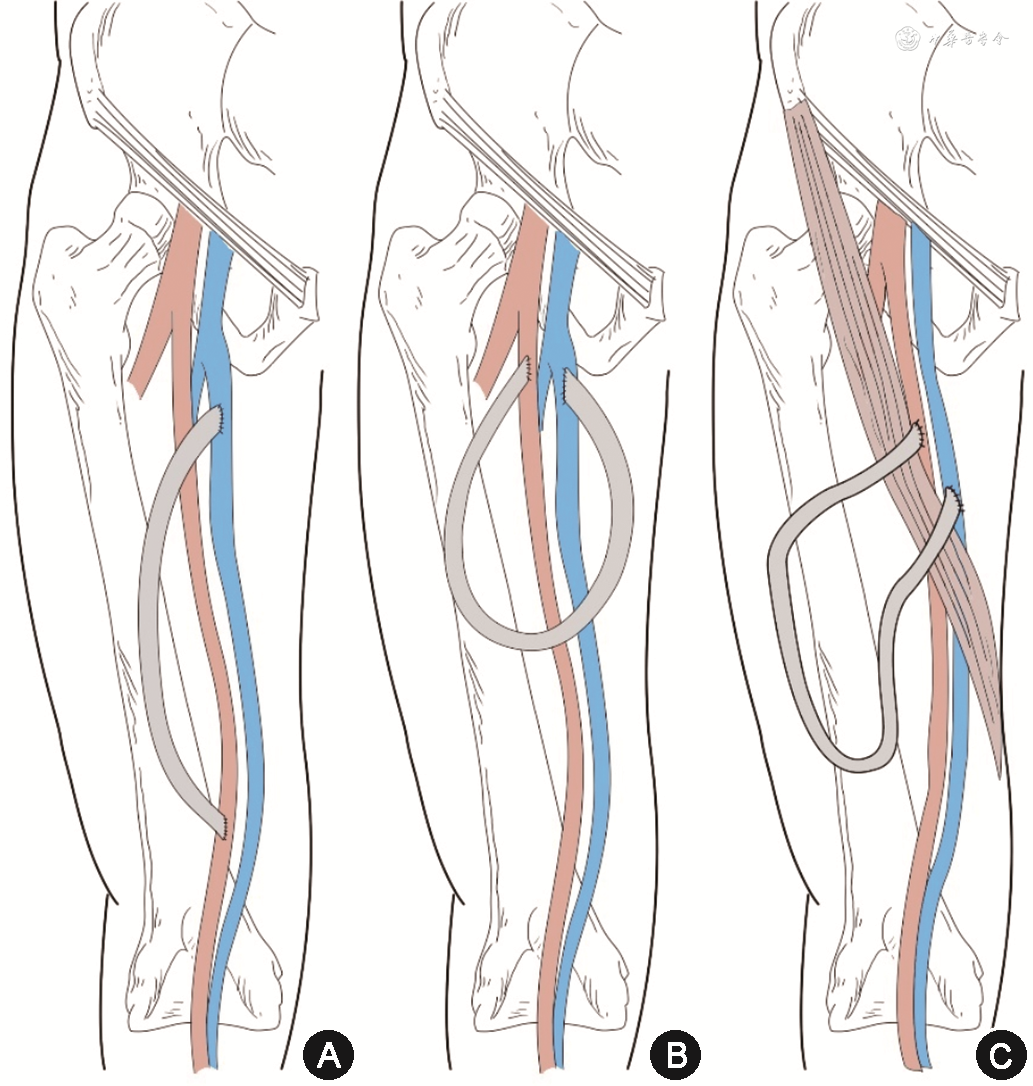
AVG 设计类型:常用的AVG为前臂“U”形襻式人工血管内瘘以及上臂弧形人工血管内瘘。首选前臂“U”形襻式内瘘,可有效利用人工血管长度,增加穿刺面积,并尽可能保留近端血管以便后续建立内瘘使用。前臂AVG流入道动脉常选择肘部肱动脉,流出道静脉选择依次为肘正中静脉、头静脉(肘横纹下,肘横纹上)、贵要静脉(肘横纹下,肘横纹上)及肱静脉(图1 A~B)。肘正中静脉作为流出道由于拥有头静脉和贵要静脉两条流出道,术后发生头静脉弓狭窄的风险较小。根据本中心研究结果,上述静脉流出道远期通畅率并无明显差异[6]。当上肢浅静脉耗竭时,利用肘部深静脉作为流出道不失为另一种选择[7],且可以保护上臂血管资源,减少中心静脉插管的使用[8]。但由于深静脉(肱静脉)并非上肢主要回流静脉,部分患者直径较细,术前需进行超声检查,确认作为流出道的肱静脉直径在3.5 mm以上。此外,深静脉管壁薄,易损伤或扭曲,吻合口时需要细心操作[9]。美国国家肾脏基金会肾脏病预后质量倡议(KDOQI)2019提出“患者优先”原则与“终末期肾脏病生存计划”,在首次建立AVG时,需评估建立二期AVF(secondary AVF)的可能性[2]。二期AVF指首次AVG失功后,优先利用成熟流出道静脉建立近端AVF,无需等待成熟期,可立即投入使用。如果前臂AVG建立在肘横纹远端,当前臂AVF废弃时可利用已动脉化的肘正中静脉、上臂头静脉或转位贵要静脉建立上臂二期AVF。穿静脉自肘正中静脉发出并汇入肱静脉,当AVG静脉端吻合口位于肘正中静脉发出穿静脉的远心端时,则二期AVF可利用穿静脉建立[10]。若首次AVG静脉流出道建立在肘横纹近心端,后期上臂浅静脉多因缺乏足够长度无法用于建立二期AVF。前臂桡动脉-肘部浅静脉直行AVG由于通畅率不及襻式AVG,且穿刺面积有限,不作为首选。若患者为既往前臂AVF废弃,前臂动脉已经代偿性增粗且肘部有已扩张流出道静脉时可以考虑前臂直行AVG。当前臂浅静脉耗竭后,可考虑建立上臂肱动脉-腋静脉弧形AVG或襻式AVG(图1 C~D)[11]。无法建立上肢AVG时方考虑下肢AVG以及特殊部位AVG(如锁骨下动脉-锁骨下静脉AVG、锁骨下静脉-颈内静脉AVG、锁骨下动脉-锁骨下动脉移植物透析通路、肱动脉-肱动脉移植物透析通路等)。下肢AVG流入道动脉和流出道静脉常选择股总动、静脉(图2A~B)。股外侧AVG(midthigh loop AVG)位于缝匠肌外侧,距离腹股沟区较远,相对清洁,其流入道动脉和流出道静脉分别为股浅动、静脉(图2C)[11]。该型内瘘可以保留完好的腹股沟区血管资源,AVG失功后,可以利用同侧股总动、静脉再建立第2条AVG,为患者在同一肢体增加了一次永久通路的建立机会。


自20世纪60年代后期膨体聚四氟乙烯(ePTFE)移植物血管应用于血液透析通路以来,其临床应用并未发生重大改变,ePTFE仍为目前使用最广泛的人工血管动静脉内瘘材料[12]。人工血管内径通常选用6 mm。为提高AVG的远期通畅率,多年来不断尝试对ePTFE血管进行各种改良,包括锥形设计、外部或管壁内支撑环、薄壁、内表面修饰(肝素绑定、碳涂层),但对远期通畅率影响不大[13, 14]。静脉端袖状吻合口预成形人工血管理论上可减小静脉吻合口壁剪切力(WSS)梯度,近期有荟萃分析显示该设计可显著改善AVG远期通畅率[15],但该研究引用的文献证据等级为低或极低。一项基于真实世界的研究指出,与标准口径人工血管相比,锥形设计人工血管并未显示出在初级通畅率、血液透析通路相关窃血综合征发生率和再干预率方面更具有优势[16]。临床医师可根据具体情况选择相应类型的人工血管。对于中心静脉插管困难的患者可选择即穿型人工血管[1]。跨越肘关节的AVG建议选用带支撑环的人工血管。
人工血管感染是AVG最严重的并发症,可导致通路永久失功甚至威胁患者生命。术后30 d内的人工血管感染约半数(47%)与手术切口有关[17]。术区皮肤需要彻底清洁,包括消毒前术侧肢体的清洗。透析患者特别是携带中心静脉导管的患者皮肤卫生状况往往不佳,需要特别引起注意。切皮前半小时静脉给予预防性抗生素。消毒前可用记号笔标记人工血管预定走行位置(或在消毒铺无菌巾后用无菌记号笔标记)。消毒后用无菌手术膜覆盖整个术野。
前臂及上臂AVG可采用局部浸润麻醉。预期手术时间较长、手术复杂、下肢AVG或特殊部位/类型AVG应采用区域阻滞麻醉或全身麻醉。局部浸润麻醉时应逐层浸润,确保麻醉效果良好。
1. 切口选择:以前臂AVG为例,通常在肘横纹远端约1 cm处做平行于肘横纹的横切口或“S”型切口,便于同时显露动、静脉。如静脉流出道为肘上静脉,则多需在肘上另做切口。首先游离浅静脉,确定静脉端吻合位置,随后向深部切开肱二头肌腱膜,显露肱动脉。动脉游离2~3 cm,静脉游离约3 cm。前臂“U”形襻式AVG需在前臂近腕部另做一横行或纵行小切口,并向近心端游离约1.5 cm皮下潜腔供人工血管埋入。切忌将人工血管直接置于切口正下方,需保证人工血管和皮肤切口间有足够的皮下组织缝合包埋人工血管。“U”形襻动脉臂和静脉臂应有充足的长度以便于绳梯穿刺,每侧长度约15 cm即可。过长亦会导致流阻增加。
2. 皮下隧道建立:虽然可以使用长弯止血钳、长组织剪以及卵圆钳等器械建立皮下隧道,但对组织损伤大,隧道与人工血管贴合不好,加重术后组织水肿。建议使用隧道器建立皮下隧道。市面上常见两类隧道器,一类是杆式(如Kelly-Wick 隧道器),另一类为鞘式。前者为带有可交换不同直径隧道器头的弧形金属杆,后者为一弧形中空金属管并允许人工血管从其内部穿过。使用杆式隧道器建立隧道时应选择大于人工血管内径2 mm的隧道器头(如6 mm人工血管选择8 mm隧道器头),若为即穿型人工血管应大于人工血管内径3 mm,避免隧道过细,埋入人工血管时因牵拉阻力过大导致管壁结构损伤。建立隧道时穿刺段皮下组织厚度控制在2~4 mm,过深不易穿刺,过浅易压迫皮肤导致其缺血坏死,尤其对于即穿型人工血管更为重要。建立隧道时术者需用另一手同步触摸隧道器尖端走行的深度和方向,及时做出调整。非穿刺段(如吻合口及“U”形襻定点)应保证有足够的皮下组织覆盖人工血管。“U”形襻弧度应足够大,避免转弯处折角干扰血流。若AVG需跨越肘关节,隧道应自肘关节侧方建立,勿使人工血管自肘窝前方穿过,防止患者屈肘时人工血管打折压闭引发血栓。
3. 人工血管埋入:使用杆式隧道器时,需注意人工血管标志线,避免在隧道内扭曲成角,采用鞘式隧道器可避免人工血管在隧道内扭曲。使用4~6 mm锥形人工血管时,应注意将人工血管静脉端(6 mm端)自动脉侧隧道引入,再从静脉侧隧道拉出,令人工血管4 mm动脉端恰好位于待吻合动脉处,并将多余的静脉端血管剪裁。使用袖状预成形静脉端的人工血管则过程相反,需要将人工血管动脉端引入隧道,静脉端血管恰好位于流出道静脉待吻合部位,防止破坏袖状静脉端吻合口。部分品牌ePTFE血管具有弹性(例如GORE-TEX® Stretch人工血管),若使用鞘式隧道器引入,需要将其适当牵拉延长后再撤出鞘式隧道器,避免日后由于动脉血流冲击导致AVG延长迂曲影响穿刺。当使用杆式隧道器由于引入时周围组织摩擦力的原因人工血管埋入隧道时已延长,无需再次牵拉。前臂襻式AVG需注意将“U”形襻顶点的人工血管置于预先制备的皮下潜腔内。
4. 静脉端吻合要点:建立AVG应首先吻合静脉端,注意静脉端勿位于肘横纹正下方,避免弯肘时压闭吻合口。人工血管静脉端吻合口需适当修剪成斜面,长度1.0~2.0 cm,与流出道静脉建立端-侧吻合。静脉切开后可使用肝素盐水液力扩张或血管扩张器扩张。缝线使用6-0/7-0聚丙烯单丝不可吸收缝线或ePTFE材质缝线连续缝合,后者可减少针孔漏血的发生。人工血管与流出道静脉间的汇入角度应呈约30°的锐角,以降低病理性剪切应力,有助于提高移植物通畅率[18]。若使用静脉端袖状预成形的人工血管,则需要根据流出道静脉直径沿适当的剪裁线(标记于人工血管袖状口上)进行裁剪。随意裁剪将失去使用袖状人工血管的意义。
5. 动脉吻合要点:动脉吻合口仅需少许修剪,以45°~60°度角与流入道动脉建立端-侧吻合。接近直角的吻合口可能增加日后取栓手术难度(取栓导管难以通过)。使用锥形人工血管注意勿过度修剪其4 mm动脉端。吻合口大小4~6 mm。选用6-0或7-0不可吸收血管缝线进行连续缝合。动脉端吻合口往往较深,采用“降落伞”式缝合更加方便。人工血管动脉端应避免反复牵拉,防止管壁结构损伤导致该部位人工血管血清渗出(“冒汗”现象)。严重的血清渗出可导致术后切口血清肿的发生。
6. 肝素的使用:通常AVG手术时间在1 h内,血管阻断时间不长,无需全身肝素化。吻合时使用肝素盐水冲洗吻合口即可。勿使用肝素盐水加压冲洗人工血管,避免增加术后血清肿风险。根据笔者经验,在静脉端吻合结束后,自动脉端缓慢注入肝素生理盐水至充满人工血管后短暂开放静脉端,若见肝素盐水自动脉端涌出,证明静脉端吻合口通畅,同时起到抗凝、排气作用。
7. 切口关闭:所有切口均需仔细止血,确保吻合口无渗血时方可关闭切口。建议常规使用电凝止血,减少丝线的使用,减少线结异物反应和感染风险。使用3-0合成可吸收缝线分层缝合,不推荐使用生物可吸收缝线或丝线缝合以减小炎症反应。首先缝合皮下组织,覆盖人工血管,再缝合皮肤。勿将人工血管直接置于切口下方。若吻合口附近人工血管出现“冒汗”现象,建议切口内放置封闭式负压引流管并另戳口引出,减少术后发生血清肿风险。勿放置普通橡皮片或Penrose等开放引流以防止逆行感染。
8. 手术后管理:术后无需继续使用抗生素。手术后应每日检查通路震颤情况、伤口及引流(如有),及时更换敷料。引流应在72 h内拔除。手术后约2周开始肿胀消退,约3~4周即可尝试穿刺使用。即穿型人工血管术后24 h内即可使用,但应严格注意相应操作规程,防止穿刺部位出血及感染。若术后4周肿胀仍不消退,需警惕是否存在流出道静脉或中心静脉狭窄,可使用血管造影或CTV明确诊断,血管造影在诊断的同时可以对狭窄部位进行治疗。
血液透析为终末期肾病患者的主要肾脏替代治疗方案,当浅静脉耗竭,或因其他原因无法建立AVF时,AVG可作为患者永久透析通路的另一选择。AVG构建需要经过术前评估、手术方案设计、移植物血管选择,关注术前准备及手术操作等诸多技术环节,方能得到良好的手术结局,减少并发症,提高远期通畅率。
郁正亚, 谭正力. 动静脉移植物内瘘的构建及技术要点探讨[J]. 中华医学杂志, 2024, 104(32): 2975-2979. DOI: 10.3760/cma.j.cn112137-20240305-00496.
所有作者声明不存在利益冲突



























