
评价血液透析患者下肢动静脉移植物内瘘(AVG)的长期应用效果。
回顾性分析2015年8月至2023年7月上海中医药大学附属龙华医院血管外科下肢AVG患者的临床资料,分析其通畅率和并发症发生情况。
共纳入83例患者,男25例,女58例,年龄(58.9±13.3)岁,AVG手术成功率为100%(83/83),无围手术期并发症。随访时间[M(Q1,Q3)]38.4(22.6,55.3)个月,随访率92.8%(77/83)。术后穿刺点感染9例(11.7%),穿刺点假性动脉瘤5例(6.5%),血清肿2例(2.6%),下肢缺血3例(3.9%),狭窄48例(62.3%),其中24例(31.2%)继发血栓形成。Kaplan-Meier生存分析结果显示,术后6个月及1、2、3、5年初级通畅率分别为78.9%、61.2%、39.0%、27.0%、16.3%,初级辅助通畅率分别为93.5%、82.5%、74.9%、68.0%、53.0%,次级通畅率分别为 96.1%、94.7%、93.1%、91.3%、75.3%。
对于上肢血管资源耗竭的血液透析患者,下肢AVG是安全、有效的血管通路之一。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
随着血液透析患者透析龄的延长,血液透析导管的广泛应用,上肢中心静脉资源耗竭的患者不断增多。下肢血管通路成为重要的替代方案,包括自体动静脉内瘘、动静脉移植物内瘘(arteriovenous graft,AVG)及下肢血液透析导管,其中建立下肢AVG是重要的手术方式[1, 2, 3]。与上肢AVG相比,早期报道显示下肢AVG有更高的感染率较低的远期通畅率以及更高的肢体缺血发生率[1,4, 5]。得益于腔内技术和器械的进步,术前评估的完善及术后宣教的加强,近年研究报道显示下肢AVG的通畅率及并发症发生率并不劣于上肢AVG[6, 7]。本文回顾性分析上海中医药大学附属龙华医院血管外科于2015年8月至2023年7月建立的下肢AVG的随访结果及诊治经验,报道如下。
随访研究。回顾性纳入2015年8月至2023年7月于上海中医药大学附属龙华医院血管外科建立下肢AVG的患者。纳入标准:(1)上肢血管条件无法建立自体动静脉内瘘,经外周静脉穿刺造影提示双上肢中心静脉病变不能于上肢建立有效而长期的血管通路,或原有血管通路肢体因中心静脉肿胀拟行内瘘关闭手术;(2)下肢造影提示下肢股静脉、髂静脉、下腔静脉基本通畅;(3)无外周动脉疾病,术前手术侧肢体足背动脉或胫后动脉搏动好,踝肱指数(ankle brachial index,ABI)≥0.85;(4)超声提示拟人工血管吻合部位动静脉直径≥4 mm。排除标准:(1)下肢静脉血栓、无法纠正的髂静脉闭塞;(2)左心室射血分数<30%;(3)全身感染,或拟术区皮肤感染。本研究通过上海中医药大学附属龙华医院伦理委员会批准(批件号:2019LCSY048),所有患者均签署知情同意书。
在区域神经阻滞麻醉下,大腿轻度外旋外展位。于大腿中上段或腹股沟处做切口,充分游离出目标动脉(股总动脉或股浅动脉)、静脉(股总静脉或股浅静脉或大隐静脉),大腿外侧拟置放人工血管襻底处1 cm小切口,经隧道器置入人工血管成“U”形血管襻,人工血管皮下深度1~3 mm,可触及。两端分别与动脉、静脉行端侧吻合,动脉吻合口直径约6 mm,静脉吻合口直径12~15 mm,使用Prolene 6-0缝线连续全层外翻缝合。彻底止血后缝合皮下及皮肤组织。术中及术后不常规使用肝素抗凝。术前30 min使用抗生素预防感染。
除临床常规回访外,术后每6个月进行电话随访,评估血液透析是否顺利,有无静脉压升高、穿刺点止血时间延长,人工血管走行区有无红肿发热,术侧足趾有无寒冷、麻木、疼痛等症状。随访截止时间为人工血管弃用、失访或患者死亡。收集患者的一般资料及合并症情况,手术技术成功率、通畅时间、围手术期及术后并发症,包括狭窄、血栓形成、感染、血肿、血清肿、假性动脉瘤、肢体缺血等及其相应处理措施。
参考欧洲血液透析通路指南[8],初级通畅时间定义为:通路建立到因通路功能不良或血栓导致首次重新干预的时间间隔;初级辅助通畅时间定义为:在干预的情况下,通路建立至首次通路闭塞的时间间隔。次级通畅定义为:在一次或多次干预情况下,从建立通路到其废弃的时间间隔。
采用SPSS 21.0和GraphPad Prism 10.1.2软件进行数据分析。符合正态分布的计量资料以表示,非正态分布的计量资料以M(Q1,Q3)表示,计数资料以例数和百分比(%)表示。使用MedCalc 22.030软件绘制Kaplan-Meier生存曲线并计算初级通畅率、初级辅助通畅率及次级通畅率。
共纳入下肢AVG血液透析患者83例,男25例,女58例,年龄29~87(58.9±13.3)岁,左下肢51例,右下肢32例。因上肢外周血管条件欠佳新建下肢AVG 1例,余82例均造影提示上肢中心静脉病变而建立下肢AVG,其中19例已出现上肢及头面部肿胀症状。原发病主要为肾小球肾炎(48例,57.8%),其余依次为糖尿病肾病(10例,12.0%)、高血压肾病(9例,10.8%)、多囊肾(6例,7.2%)等。颈静脉血液透析导管置管史81例(97.6%),建立下肢AVG侧股静脉血液透析导管置管史22例(26.5%)。腹股沟区域AVG 5例,大腿中段AVG 78例。即穿型人工血管30例,非即穿型人工血管53例。
83例均手术成功,技术成功率100%。围手术期病死率为0,无围手术期感染、伤口延迟愈合,无单神经病变及严重下肢动脉缺血。5例远端足背动脉搏动较术前减弱,给予静脉应用贝前列腺素钠,无缺血症状,出院后未再使用扩血管药物。30例即穿型AVG中27例于术后第1天穿刺使用,余3例术后第3、5、13天启用,每周规律血液透析2~3次。
83例患者失访6例,均为非即穿型人工血管,随访率92.8%(77/83)。随访时间38.4(22.6,55.3)个月。随访3年以上42例(54.5%),5年以上13例(16.9%)。随访的47例非即穿型人工血管中44例术后(34.5±9.7)d开始穿刺使用,1例于术后28个月开始穿刺使用,期间继续使用右颈静脉带涤纶套带隧道导管,2例自觉肿胀手代偿,继续使用上肢自体动静脉内瘘,下肢AVG至今通畅未启用。随访期间死亡22例(28.6%),其中1例为即穿型AVG建立后92 d穿刺点感染,患者放弃治疗死亡,余死亡原因均与下肢AVG无明显关系(脑出血5例,肺部感染7例,车祸1例,心肌梗死1例,心力衰竭1例,原因未明猝死6例),死亡前下肢AVG均通畅。
1. AVG狭窄和血栓发生情况:随访期间下肢AVG狭窄48例(62.3%),均存在静脉吻合口狭窄,合并人工血管穿刺点狭窄19例,髂静脉狭窄14例。人工血管穿刺点狭窄均行经皮球囊扩张成形术(percutaneous transluminal angioplasty,PTA),5例后期因整根人工血管钙化(图1)难以扩张及穿刺不便,于术后50~94个月弃用原AVG,于近心端(3例)(图2)或对侧(2例)下肢新建AVG。静脉吻合口狭窄闭塞病变4例行开放手术,2例间置人工血管至近心端股静脉,2例由原大隐静脉吻合口转位间置人工血管至股浅静脉。其余44例均行PTA治疗,其中22例于静脉吻合口处植入覆膜支架。髂静脉狭窄闭塞病变14例,2例病变与术前无明显改变且无症状未干预,1例髂静脉受压侧支开放经对侧髂静脉回流通畅未干预,11例于术后6~54个月植入裸支架,随访期间无支架内再狭窄,支架通畅时间(19±15)个月。合并血栓24例(31.2%),其中4例分别于术后2、3、6、19个月AVG血栓形成,因穿刺不便及交通不便自行弃用未处理,20例行切开取栓,其中1例取栓后造影通畅,余19例造影见狭窄,行介入治疗后通畅继续使用。平均干预次数0.73次/人年。
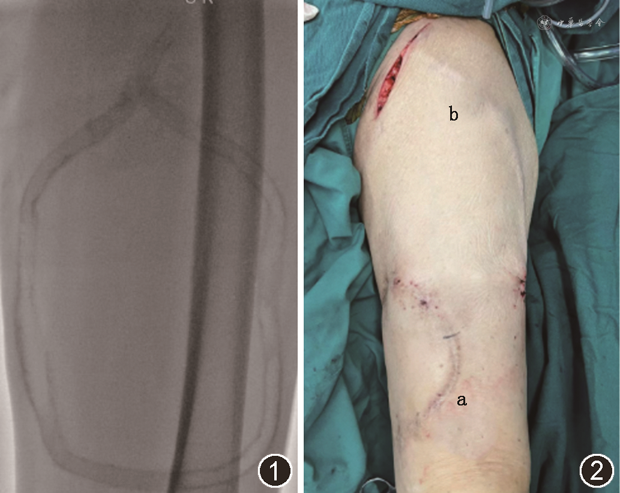

2. 感染与假性动脉瘤、血清肿发生情况:下肢AVG感染9例(11.7%),无围手术期感染事件,均为穿刺点感染。1例即穿型AVG于术后92 d感染,患者放弃治疗,其余于术后4~62(29±22)个月发生感染。2例当地切除人工血管,6例接受感染段人工血管切除+人工血管间置手术后继续使用。穿刺点假性动脉瘤5例(6.5%),3例行手术切除假性动脉瘤+人工血管间置,2例未干预,日常禁止穿刺假性动脉瘤处。血清肿2例(2.6%),1例术后5个月行血清肿手术切除+人工血管间置,1例术后3个月切开引流后弹力绷带加压治疗后好转。
3. 下肢缺血发生情况:下肢缺血3例(3.9%),围手术期均无缺血表现,为后期血液透析过程中疼痛及静息痛,2例AVG动脉吻合口以远股浅动脉短段重度狭窄,1例髂总动脉开口重度狭窄,其中2例动脉严重钙化,1例基础疾病为红斑狼疮。3例分别于AVG建立后11、53、62个月行介入手术治疗后好转并相应药物治疗。
4. Kaplan-Meier生存分析结果:下肢AVG术后6个月及1、2、3、5年初级通畅率分别为78.9%、61.2%、39.0%、27.0%、16.3%,初级辅助通畅率为93.5%、82.5%、74.9%、68.0%、53.0%,次级通畅率为96.1%、94.7%、93.1%、91.3%、75.3%(图3)。
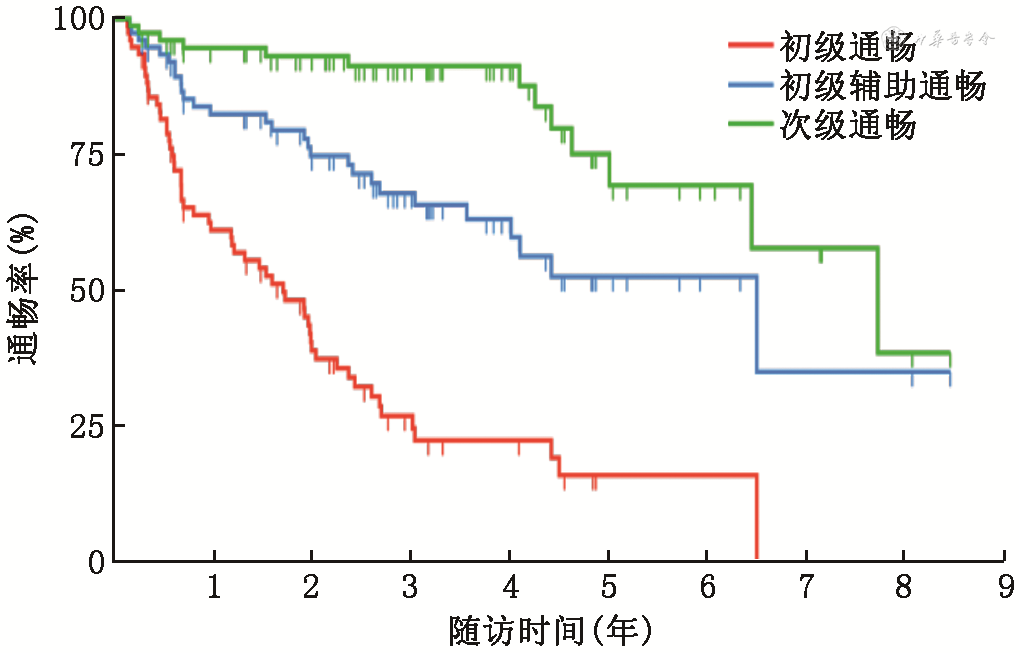

注:n=77;竖线表示删失
随着医疗技术的不断进步,维持性血液透析患者的生存期总体延长及血液透析导管的广泛使用,导致上肢中心静脉病变无法建立上肢血液透析通路的患者不断增多,下肢血管通路成为重要的替代方案之一[1, 2, 3]。下肢血管通路包括自体动静脉内瘘、AVG及下肢血液透析导管。大隐静脉管径相对较细,通畅率尚不理想;股浅静脉转位动静脉内瘘有较高的通畅率,优于下肢AVG;股静脉透析导管应尽量避免作为下肢长期血管通路[8]。但是下肢自体动静脉内瘘取材有限,选取股浅静脉创伤较大,同时部分患者股浅静脉的长度无法满足两段绳梯穿刺的要求[9],因此临床中下肢AVG仍是重要的手段,具有成熟期短以及血栓形成后易取栓和重建等优点。
对于建立下肢AVG的患者而言,其后续血液透析通路的选择机会是有限的。本研究中81例(97.6%)患者是由于颈静脉血液透析导管导致的上肢中心静脉病变而建立下肢AVG,因此应尽量避免或减少血液透析置管来降低中心静脉病变的发生率,以保护血管资源,为患者提供更多通路的选择机会。
狭窄及继发血栓形成是AVG失功的最主要原因。早期下肢AVG的通畅率并不理想,2006年Englesbe等[10]报道30例下肢AVG的1、2、3年次级通畅率分别为 41%、26%和21%,且并发症发生率较高。随着PTA技术、高压球囊、覆膜支架的广泛应用,手术成功率及通畅率得到明显提高。目前研究证据显示下肢AVG的次级通畅率与上肢AVG相似,甚至优于上肢AVG,其1、2、5年的次级通畅率可达到41%~100%、18%~94%、38%~51%[11, 12, 13, 14]。本研究中,下肢AVG术后6个月及1、2、3、5年次级通畅率分别为96.1%、94.7%、93.1%、91.3%、75.3%,使用时间最长的一例下肢AVG使用了103个月。随访过程中发现,有14例术前造影评估基本通畅的髂静脉出现狭窄或闭塞病变,一部分是因为手术侧有插管病史,插管的损伤在高血流的冲击下刺激内膜增生,刺激狭窄加重[15],另一原因是存在髂静脉受压综合征的解剖压迫导致[16]。裸支架在这些髂静脉狭窄病变的应用取得良好效果,无一例出现再狭窄。
感染是AVG废弃的另一重要原因。既往研究报道显示下肢AVG的感染率较高,达17%~46%[17]。有研究发现感染革兰阴性菌的概率较上肢AVG更大,建议经验性用药抗感染治疗时联合抗革兰阴性菌药物[4]。本研究无围手术期感染,得益于良好的术前准备及术中严格的无菌操作,包括术前评估全身无感染病灶、术前皮肤清洁、预防性使用广谱抗生素、术中严格无菌操作、尽量减少人工血管暴露在空气中的时间、尽量避免人工血管直接在切口下、缝合皮下层、术后弹力绷带包扎至拆线。总计9例感染(11.7%),均为后期穿刺点感染,感染率较上肢AVG并无明显劣势,可能与本组患者大部分采用大腿中部位置,远离腹股沟和泌尿系统区域,避开腹股沟淋巴结组织,降低了感染的风险。良好的患者清洁指导宣教,以及对血液透析护士进行严格的无菌操作及内瘘穿刺培训也有助于降低感染率。下肢AVG远期穿刺点感染,如果感染局限,可通过感染段局部切除并人工血管间置以保留原AVG的使用,本研究中来本院干预的6例患者均通过此方法控制感染,AVG得以继续使用。只有当感染累及AVG全段时需要行AVG全切手术。
下肢AVG患者不仅感染率高于上肢,而且由于下肢动脉粥样硬化、终末期肾病所致钙磷代谢异常及合并糖尿病等因素,其下肢血管通路窃血风险也增加[18, 19]。肢体远端缺血发生率高于上肢,其发生率为1%~16%[5,20]。这些血液透析患者一旦发生下肢动脉重症缺血,预后往往不佳,死亡和截肢风险高[21]。因此,下肢AVG建立前需对下肢动脉进行详细评估,ABI应≥0.85,考虑钙化病变可能导致ABI检测数值虚高,笔者建议术前需保证手术侧足背或胫后动脉至少一支动脉搏动有力以降低术后肢体缺血的风险。即使如此,本组患者在随访期间仍有3例由于钙化加重导致肢体远端缺血。此外还需强调血液透析患者钙磷代谢的管理,从而延长通路的使用时间。本组有5例患者因全程人工血管钙化影响穿刺而弃用。
笔者推荐下肢AVG的建立部位首选大腿中部而非腹股沟[22],选择此部位不仅有助于降低感染率,更重要的是为未来修复AVG或建立新的AVG预留了空间,尤其是累及吻合口的局部感染或血清肿,在大腿部位仍有空间间置一段人工血管,而如果腹股沟区域的AVG跨越吻合口的修复则要进入后腹膜的髂血管区域,手术创伤更大。本组4例患者因下肢穿刺不便及交通不便,当地医护人员缺乏血栓等并发症的处理技术,最终导致下肢AVG被弃用。为便于穿刺,保护好患者的隐私,下肢AVG构型设计应尽量将人工血管置于外侧走行[7]。
本研究存在一定局限性:单中心回顾性研究,随访方式为电话随访及临床驱动的回访,对并发症的发现有延迟可能,导致初级、初级辅助通畅率高于前瞻性研究数据。但研究结果可提示,对于上肢血管资源耗竭患者,下肢AVG是安全、有效的血管通路之一。
米兰化, 鲍雪东, 施娅雪, 等. 下肢动静脉移植物内瘘的长期随访结果[J]. 中华医学杂志, 2024, 104(32): 3032-3036. DOI: 10.3760/cma.j.cn112137-20240331-00733.
所有作者声明不存在利益冲突



























